修回日期: 2025-06-24
接受日期: 2025-07-17
在线出版日期: 2025-08-28
本文聚焦于表浅性非壶腹部十二指肠上皮性肿瘤(superficial nonampullary duodenal epithelial tumors, SNADETs)内镜诊治领域的最新进展, 旨在阐述如何通过优化精准风险分层与发展微创治疗策略来提升诊疗水平、改善患者预后. 综合分析表明, SNADETs发病率约为0.02%-0.50%, 其检出率随内镜技术进步而上升; 内镜检查是当前诊断的核心手段, 而多样化的内镜下治疗技术虽各有其适应证及优缺点, 已成为重要治疗选择. 尽管取得进展, 十二指肠独特的解剖特性仍带来显著挑战. 未来应着力于发展人工智能辅助诊断、研发新型内镜闭合装置, 并亟需建立统一诊断标准与基于风险的分层治疗指南, 同时开展多中心研究比较不同术式疗效, 以优化整体诊疗路径, 最终提高患者生存率与生活质量.
核心提要: 表浅性非壶腹部十二指肠上皮性肿瘤发病率0.02%-0.50%, 内镜检出率提升. 内镜为核心诊疗手段, 治疗方式多样但各有优劣. 虽存解剖挑战, 未来需聚焦人工智能诊断、新型闭合技术研发. 亟需建立统一标准与分层指南, 开展多中心研究优化治疗, 提升生存率及生活质量.
引文著录: 张雨, 崔曼莉, 张明鑫, 孙超. 表浅性非壶腹部十二指肠上皮性肿瘤的内镜诊治: 现状及未来. 世界华人消化杂志 2025; 33(8): 609-618
Revised: June 24, 2025
Accepted: July 17, 2025
Published online: August 28, 2025
This commentary addresses the evolving landscape of endoscopic diagnosis and treatment for superficial nonampullary duodenal epithelial tumors (SNADETs), highlighting recent advances aimed at refining risk stratification and minimally invasive therapeutic strategies to improve patient outcomes. Current understanding, synthesized from clinical features, diagnostic challenges, and diverse endoscopic techniques, reveals that SNADETs (incidence 0.02%-0.50%) are increasingly detected. While endoscopy remains the cornerstone diagnostic modality, and various endoscopic resection methods offer viable treatment options, each with specific indications and limitations, the unique anatomical vulnerability of the duodenum continues to pose significant challenges. Future progress hinges on developing artificial intelligence-assisted diagnostics and novel closure devices, establishing standardized diagnostic criteria and risk-stratified treatment guidelines, and conducting multicenter trials to compare therapeutic efficacy, ultimately optimizing management pathways to enhance survival and quality of life.
- Citation: Zhang Y, Cui ML, Zhang MX, Sun C. Endoscopic diagnosis and treatment of superficial nonampullary duodenal epithelial neoplasms: Current status and future perspectives. Shijie Huaren Xiaohua Zazhi 2025; 33(8): 609-618
- URL: https://www.wjgnet.com/1009-3079/full/v33/i8/609.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v33.i8.609
表浅性非壶腹部十二指肠上皮性肿瘤(superficial nonampullary duodenal epithelial tumors, SNADETs)是一类起源于十二指肠非壶腹部黏膜层的病变, 包括腺瘤和局限于黏膜下层的腺癌. 尸检研究数据显示[1], 原发性十二指肠肿瘤呈现低发生率(0.02%-0.50%), 其中恶性十二指肠病变仅占全部消化道恶性肿瘤的0.5%. 由于无特征性临床症状及体征, 导致早期诊断困难, 误诊率高[2]. 但近年来, 随着消化道内镜检查率的上升和内镜诊断技术的提高, 病例数呈显著增长趋势[3]. 因十二指肠解剖结构的特殊性(如壁薄、血供丰富, 黏膜下分布Brunner腺), SNADETs的早期诊断与干预, 对于改善患者预后至关重要[4]. 因此越来越多新的内镜切除技术被应用于十二指肠肿瘤的治疗, 不仅显著提升了治疗效果, 也减少了手术风险[5]. 目前, SNADETs的内镜诊断和治疗策略仍有提升改进空间, 本文旨在系统阐述其最新诊疗方法的进展.
十二指肠肿瘤早期多无特异性临床症状, 且常规上消化道内镜检查的检出率较低, 多数病例为偶然发现[6]. 内镜检查凭借其直视化、动态化优势, 可精准评估病灶的部位、大小、形态特征, 并同步完成靶向活检, 已成为SNADETs诊断的标准与核心手段. 准确的术前诊断对于选择合适的治疗方案、避免不必要的侵入性治疗至关重要[7]. 典型十二指肠腺瘤内镜下多表现为黏膜隆起性病变, 表面可伴结节或糜烂; 而进展期腺癌常呈现边界不清的溃疡或浸润性生长模式. 近年来, 染色内镜(如靛胭脂、亚甲蓝)与放大内镜的联合应用, 显著提升了黏膜微结构(如腺管开口形态)及病变边界的可视化水平, 有效降低了不完全切除风险. 值得注意的是, 在评估SNADETs的术前诊断方法时, Goda等[8]通过一项多中心回顾性研究发现, 内镜诊断对高级别上皮内瘤变或浅表腺癌的敏感性(77%)和准确性(75%)显著高于随机活检(敏感性58%, 准确性68%).
白光内镜(white light endos-copy, WLE)对平坦型(如Paris 0-Ⅱb型)及微小病变的检出率存在局限性. 靛胭脂或亚甲蓝染色内镜通过增强黏膜表面结构对比度, 可更清晰地界定病变范围及边界, 成为WLE的重要补充.
在WLE中, 巴黎分型(Paris classification)用于系统描述SNADETs的形态特征, 包括带蒂型(0-Ⅰp)、扁平型(0-Ⅰs)、浅表隆起型(0-Ⅱa)、浅表平坦型(0-Ⅱb)、浅表凹陷型(0-Ⅱc)及溃疡型(0-Ⅲ), 为内镜下形态学评估提供了标准化框架[9]. 在维也纳分类(Vienna classification, VCL)中, 基于组织学风险分层, 将病变分为非浸润性高级别肿瘤(C4, 含高级别腺瘤/异型增生、原位癌)与浸润性癌(C5, 含黏膜内癌至更深层浸润癌), 指导治疗决策[10].
在NADETs的术前诊断中, Kakushima等[11]开发了一种基于内镜特征的评分系统, 通过病变颜色、宏观类型、结节性及直径综合评估, 总评分≥3分可有效区分高级别病变(VCL4或更高)与低级别腺瘤(VCL3), 其敏感性、特异性和准确率分别为88%、79%和86%. 关键内镜特征包括红色病变、凹陷型或混合型宏观形态、结节性异质性/无结节(表1).
| 分组 | 评分 | 诊断意义 |
| 颜色 | ||
| 红色 | 2分 | 强烈提示VCL4或更高(红色病变与癌变风险显著相关) |
| 等色(与周围黏膜一致) | 1分 | 中等风险, 需结合其他特征判断 |
| 白色 | 0分 | 低风险, 多见于低级别腺瘤VCL3 |
| 宏观类型 | ||
| 凹陷型(Ⅱc)或混合型(Ⅱa+Ⅱc) | 2分 | 凹陷或混合型病变与癌变高度相关 |
| 非凹陷型(Ⅰs, Ⅰp, Ⅱa) | 0分 | 低风险, 多见于良性腺瘤 |
| 结节性 | ||
| 异质性或无结节 | 2分 | 异质性结节或表面无结节提示恶性可能 |
| 均质性结节 | 0分 | 均一结节多与低级别腺瘤相关 |
| 病变直径 | ||
| ≥10 mm | 1分 | 直径增大与癌变风险升高相关 |
| <10 mm | 0分 | 较小病变风险较低, 但仍需结合其他特征 |
WLE操作简便, 无需依赖放大功能即可实施, 因此具有广泛的临床适用性. 与随机活检相比, 内镜全景成像可避免因取材偏差导致的假阴性结果(尤其当活检标本量不足或来自低级别瘤变区域时), 并优先靶向高风险区域进行活检, 提升诊断准确性.
1.2.1 窄带成像与蓝激光成像: 近年来, 窄带成像(narrow band imaging, NBI)与蓝激光成像(blue laser imaging, BLI)作为图像增强内镜的核心技术, 已广泛应用于消化道病变的检测与特征分析. 放大内镜通过可变焦光学镜头或电子图像处理技术, 将观察区域放大80-150倍, 实现黏膜微血管及细胞结构的可视化, 部分设备整合染色技术(如靛胭脂、亚甲蓝)或NBI能够进一步增强成像对比度[12].
NBI其原理是借助滤光器对内镜光源进行处理, 筛选出窄带光谱. 该技术无需染色即可显著提升黏膜对比度, 能清晰呈现消化道黏膜表面细微的腺管结构与微血管形态, 使普通胃镜难以察觉的病变无所遁形[13]; BLI则通过激光光源优化图像分辨率, 操作简便且无需染色剂辅助[14]. 进行NBI检查时, 需保证充足光线和清晰视野, 避免出血和胆汁干扰[15].
有充分证据支持无放大NBI区分肿瘤性和非肿瘤性息肉的准确率在89.0%至90.0%之间, 而放大NBI的准确率高达94.1%至96.1%[16]. Chen等[17]在2008年的研究中比较了智能分光比色技术(flexible spectral imaging color enhancement, FICE)和NBI在体内息肉组织学诊断中的功效, 发现NBI的阴性预测值高于FICE, 差异具有统计学上意义(P<0.001), 意味着NBI对于正确识别阴性病例(即排除病理性息肉)方面更为可靠. 在非糜烂性反流病诊断方面, NBI联合放大内镜(narrow band imaging-magnifying endoscopy, NBI-ME)可检测到常规WLE难以发现的微小黏膜破损(微糜烂)和异常微血管[乳头内毛细血管袢(intrapapillary capillary loops, IPCLs)][18]. 这对于SNADETs的诊断具有重要参考价值, 提示NBI-ME在检测肿瘤相关微血管和黏膜改变方面可能有类似优势.
超声内镜(endoscopic ultrasonography, EUS)通过整合内镜与高频超声探头, 实现腔内形态学观察与实时超声扫描的双重功能. 其微型超声探头(频率通常为7.5-20 MHz)可清晰显示消化道管壁的分层结构特征(黏膜层、黏膜肌层、黏膜下层、固有肌层及浆膜层)及邻近脏器(如胰腺、胆管)的解剖细节, 显著提升诊断的层次化与空间定位能力[19].
有报道显示[20], EUS在上消化道肿瘤诊断方面表现出色, 其阳性率可达92%, 基于此, 美国胃肠内镜学会指南建议, 对于非壶腹部腺瘤且病变直径大于2 cm, 以及壶腹部病变直径大于1 cm的情况, 应在术前采用超声内镜进行诊断. EUS能精准评估肿瘤浸润深度(T分期), 区分黏膜内癌(T1a)和黏膜下层浸润癌(T1b), 对治疗方案的选择有决定性意义. 但与此同时, 超声内镜在判断十二指肠肿瘤浸润深度上准确性劣于传统内镜, 诊断时存在高估黏膜下浸润深度的问题, 可归咎于十二指肠内结构回声相似、内镜操作不便、管腔注水困难和黏膜下层菲薄等[21]. 另一方面, EUS可有效避免肠气与胃内积气对超声成像的干扰, 不仅通过内镜直视下观察消化道黏膜表面, 还利用超声波穿透黏膜下乃至浆膜和近胃壁周围, 清晰显示胃肠壁的5层结构, 从而明确病变的部位、范围、浸润深度及其与周围组织的关系, 精准判断病变起源层次[22].
在评估十二指肠腺癌患者预后时, 淋巴结转移和疾病分期是至关重要的因素. 已有研究表明[23], 淋巴结转移与远处转移的发生显著相关, 且患者的5年生存率会因疾病分期的不同而存在明显差异, 如Ⅰ期或Ⅱ期肿瘤患者的5年生存率相对较高, 而Ⅲ期和Ⅳ期患者生存率较低. 这为评估患者预后、制定个体化治疗方案提供了重要参考, 同时也凸显了早期诊断和治疗的重要性.
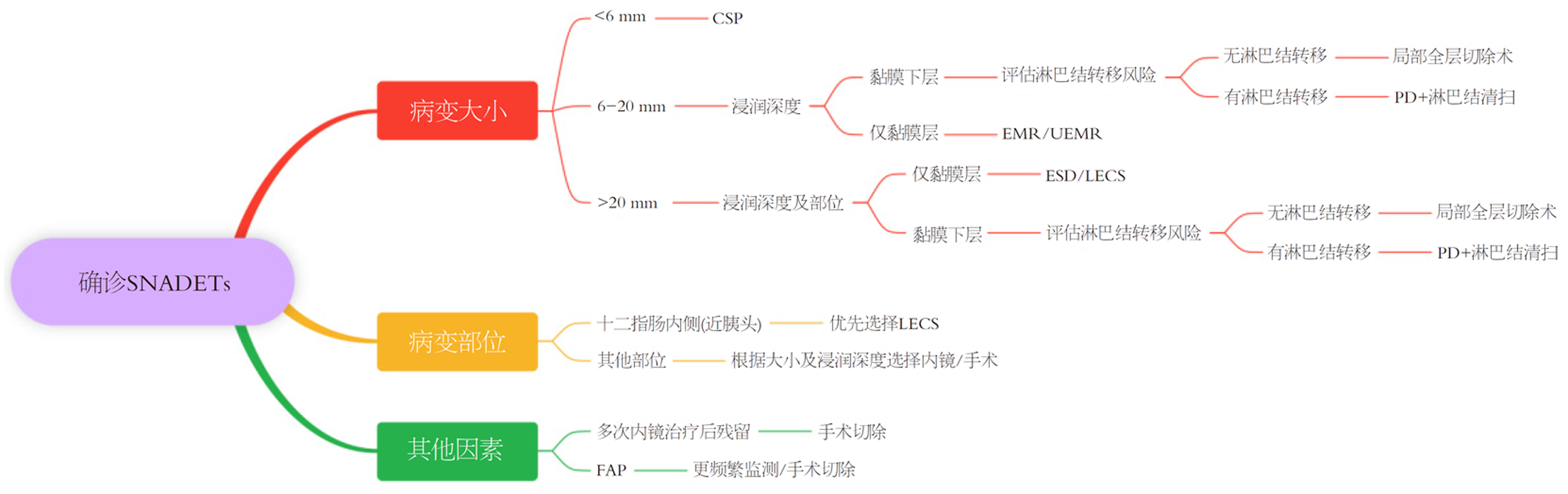
胰十二指肠切除术(pancreaticoduodenectomy, PD)是治疗胰头、壶腹及胆管远端良恶性肿瘤的重要术式, 但并发症发生率高仍是临床关注的重点. Karim等[24]的研究显示, PD术后主要并发症包括伤口感染(23.5%)、胰漏(21.4%)、肺部并发症(17.3%)、腹腔内积液(12.2%)及术后出血(12.2%), 总体并发症发生率高达30%-60%, 与既往文献数据一致. 值得注意的是, 该研究还指出术前内镜逆行胰胆管造影术可能导致术中胆管解剖困难(77.3%患者受影响, P<0.01), 提示术前干预可能间接影响手术范围及操作复杂性. 此外, 手术切除范围和淋巴结清扫的最佳程度仍存在争议, 需结合肿瘤位置、分期及患者个体化因素进行权衡[25]. 因此, 内镜下切除术是治疗十二指肠腺瘤和无淋巴结转移的十二指肠黏膜内癌的可行可靠方法, 优势在于治疗创伤小, 能够最大维持患者术后生活质量[26]. 一项针对113例患者共121个非壶腹部十二指肠肿瘤的研究显示[27], 内镜下治疗方式的分布情况为: 106例(87%)采用内镜黏膜切除术(endoscopic mucosal resection, EMR), 8例(7%)采用内镜黏膜下剥离术(endoscopic submucosal dissection, ESD), 7例(6%)采用息肉切除术. 其中, 整块切除的病变有77个(64%), 43个病变(35%)进行了分块切除, 还有1例因穿孔中断手术. 这些数据直观展示了不同内镜治疗方式在十二指肠肿瘤治疗中的应用比例, 以及整块切除和分块切除的情况, 为探讨各种治疗方式的优劣提供了有力的数据支持(表2).
| 技术 | 适应证 | 并发症(发生率) | 复发率/残留率 | 关键特点 |
| CSP | ≤6 mm小病变、FAP患者腺瘤 | 出血(<2%)、穿孔(0.5%-2%) | 残留率2%-5% | 无需注射, 快速安全; 整块切除率低, 适合低风险病变 |
| EMR | 6-20 mm腺瘤、黏膜内癌(T1a) | 术中穿孔(0%-2%)、出血(5%-15%)、延迟穿孔(0%-4%) | 复发率30%-36% | 需黏膜下注射; 分块切除率高, 需密切随访 |
| ESD | >20 mm病变、黏膜下层癌(T1b) | 延迟穿孔(3%-10%)、出血(5%-10%) | 复发率0%(R0切除时) | 整块切除率高(67%-100%); 需联合OTSC闭合降低风险 |
| UEMR | ≤20 mm平坦型病变 | 出血(<5%)、穿孔(<1%) | 残留率10%-15% | 操作时间短, 无需注水; 残留风险较高 |
在十二指肠肿瘤切除术中, 冷圈套息肉切除术(cold snare polypectomy, CSP)与传统热圈套息肉切除术相比, 无须通电, 因此不必考虑电流烧灼(穿透)的影响, 引起穿孔和继发性出血的概率极低, 并且一次性切除多个肿瘤、更安全高效, 是目前治疗十二指肠息肉最有前景的方法之一[28]. 由于无须局部注射, 操作处置时间较短; 对于有活检瘢痕的患者而言, 如果进行局部注射, 会出现只有病变周围被抬举的情况, 这会导致后续的切除操作变得困难. 而CSP这一术式具有独特优势, 无需进行局部注射, 即便患者存在活检瘢痕, 也能够达到顺利切除病变目的[29].
CSP术式是在消化道管壁浅层进行切除, 对于浸润至黏膜下层的癌变来说, 有残留的可能性, 技术层面应保证对腺瘤性息肉进行完整切除(en bloc). 对小于10 mm的病变可整块切除, 但部分患者存在黏膜肌层未被切除的情况, 其对小SNADETs的有效性, 尤其是病变残留和复发方面, 需进一步研究[30]. 根据ESGE指南, 对于SNADETs<6 mm的息肉建议行CSP. 虽然该证据最初是基于结肠息肉结果的推断, 但最近随着十二指肠小息肉, 尤其是针对家族性腺瘤性息肉病(familial adenomatous polyposis, FAP)研究的增加和实践经验积累, CSP治疗小SNADETs已被认为是有效和安全的.
一例前瞻性国际队列研究[31]纳入了39例FAP患者, 评估CSP切除十二指肠腺瘤的安全性, 针对病理诊断为腺瘤的SNADETs共进行133次CSP. 结果显示, 82%的腺瘤在黏膜下注射后切除, 整块切除率为46%, 分块切除率为54%, 肉眼根治性切除率达97%. 术后未发生临床显著性出血或穿孔, 仅2%的深层黏膜损伤. 这表明在经验丰富的医生操作下, CSP较安全可靠.
除了安全性, CSP在成本效益方面具有显著优势. 相较于内镜黏膜切除术(endoscopic mucosal resection, EMR)和ESD, CSP的操作流程显著简化: 无需黏膜下注射(节省注射针、注射溶液成本), 无需电凝设备及耗材(节省电刀、电极板成本), 手术时间通常更短(节省内镜室占用时间和人力成本), CSP的高效性和低成本使其成为小SNADETs(尤其<6 mm)极具经济吸引力的首选方案.
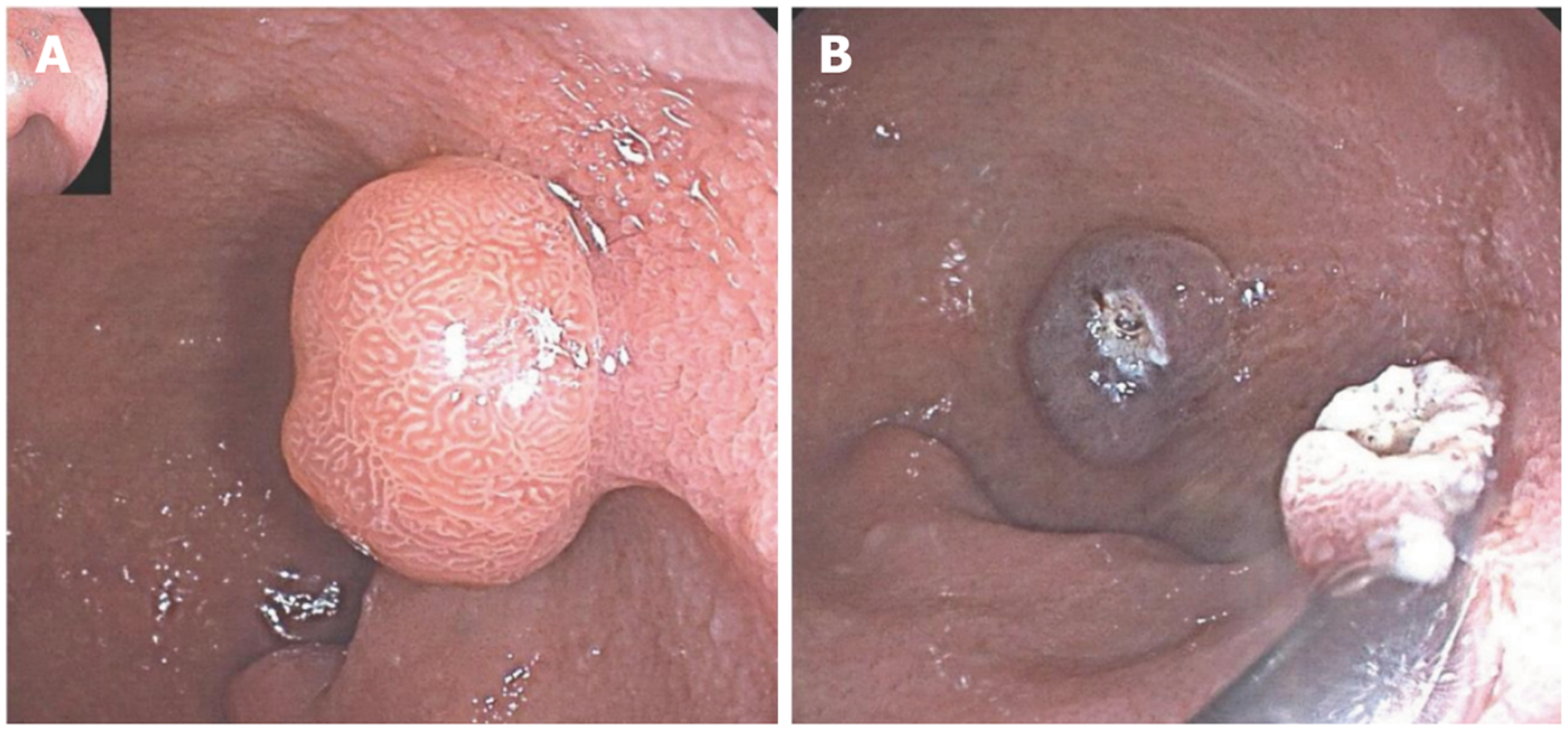
EMR是治疗SNADETs的重要内镜方式. 分为常规内镜黏膜切除术(conventional endoscopic mucosal resection, CEMR)和水下内镜黏膜切除术(underwater endoscopic mucosal resection, UEMR). CEMR是在黏膜下注射后, 使用电圈套器处理并切除病变, 注射溶液包含10%甘油溶液和0.001%肾上腺素[32]. EMR被强烈推荐用于治疗十二指肠>6 mm腺瘤[33]. 虽然相对较小的病变(<20 mm)同样适合EMR, 能实现较高的整块切除率, 但有报道其复发率可达36%[34]; 对于超过20 mm的病变, 整块切除率仅30%-40%. EMR术中穿孔率0%-2%, 延迟穿孔发生率0%-4%, 出血发生率约5%-15%[35]. 对于穿孔, 小穿孔可通过内镜下钛夹或组织覆盖处理, 大穿孔部分病例可能需要手术干预; 对于出血, 可通过有效内镜下止血措施控制(图1). 因此, 在选择治疗方式时, 需综合考虑病变大小、位置、形态等因素[36].
ESD是一项兴起于2000年早期的内镜下切除技术, 在消化道早期癌症的治疗领域得到了广泛应用[37]. 其优势在于能够整块地切除较大的肿瘤性病变. 该技术采用逐步剥离的方式, 适用于存在重度黏膜下纤维化, 无法通过EMR进行治疗的病灶. 由于内镜黏膜下剥离术后极低的局部复发率, 整块切除所允许的组织学分析质量, 以及可接受的并发症率, ESD已成为食管/胃肿瘤性病变的标准切除方式[33].
一项报道表明[38]其整块切除率达67%-100%, R0切除率为29%-90%, 且长期随访结果显示复发率为0%. 这里的R0切除, 是指手术切除肿瘤后, 在显微镜下观察, 肿瘤组织被完全切除, 切缘无肿瘤细胞残留. 与EMR相比, ESD能更好地依据病变形状和大小进行处理, 进而实现更高的切除率和更低的复发率, 也为准确的组织学评估提供了保障. 对于十二指肠肿瘤患者而言, 实现R0切除至关重要, 可以有效降低肿瘤复发风险, 改善患者的长期预后, 提高生存率.
十二指肠ESD术后黏膜缺损暴露于胰胆汁环境, 增加延迟穿孔及出血风险. 传统钛夹闭合失败主要受三方面因素影响: 首先, 肿瘤特性方面, 大肿瘤引起的广泛黏膜缺损超出常规钛夹闭合能力, 特别是球部及降段特殊解剖位置更增加操作难度; 其次, 器械局限性表现为传统钛夹抓持力不足, 难以稳定固定薄层组织, 易发生夹闭不全或脱落, 多枚夹子协同失效时更易引发并发症; 再者, 十二指肠独特的解剖特征构成特殊挑战: 其壁层结构菲薄(仅0.3-0.5 mm), 闭合操作易致医源性穿孔, 即使成功闭合也可能因机械压迫影响血供, 导致延迟性愈合不良.
鉴于上述高风险, 预防性使用内镜下金属夹(over-the-scope clip, OTSC)系统进行创面全层闭合, 已成为降低十二指肠ESD术后不良事件的关键策略, OTSC采用熊齿状全层闭合技术, 通过负压吸引将创面周围组织吸入帽内, 然后释放夹子实现全层闭合(同步抓取黏膜、黏膜下层及肌层组织), 形成稳固的闭合界面. 这种机械性屏障有效隔绝胰胆汁对创面的侵蚀, 减少炎症反应和蛋白溶解, 还能提供更强的组织抓力和更可靠的创面闭合张力, 从病生理层面降低延迟穿孔与出血风险[39].
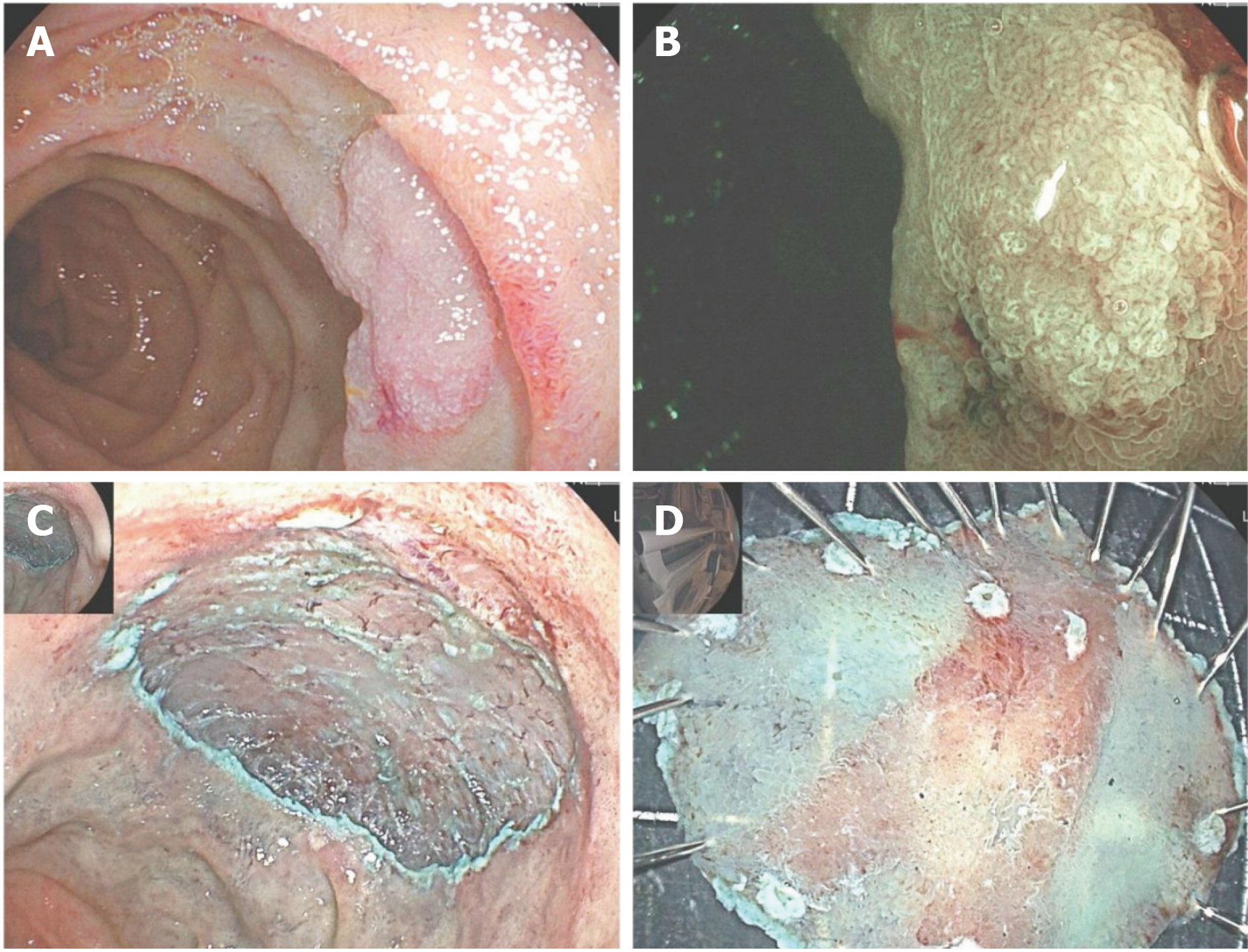
一项回顾性研究[40]纳入2009-01/2019-07接受ESD治疗的SNADETs患者, 结果表明Clutch Cutter-ESD联合预防性OTSC闭合是一种安全可行的微创方法, 为十二指肠肿瘤的ESD治疗提供了新的参考依据(图2).
UEMR是对传统EMR技术的改进. 该术式为在十二指肠中注水后, 利用水的浮力使病变漂浮于水中, 将息肉套入圈套器内进行切除的技术手段, 优势在于十二指肠壁不因CO2(过度)充盈而牵拉, 尽可能保持肠壁厚度[41]. 此外, 由于无须进行局部注射, 黏膜下隆起不会使十二指肠病灶处扩大, 更易为圈套器套取处置. 术中出血少, 保持了良好的手术视野, 处置时间更短[42], 并且复发率低, 安全性高, 术后创面也容易闭合[43].
UEMR在治疗<20 mm的SNADETs中展现双重特性: 研究显示UEMR的整切成功率显著优于传统EMR, 其通过简化操作流程降低技术复杂性, 尤其适用于难以维持黏膜抬举的病例[44]. 但值得注意的是, 虽然UEMR技术成功率高, 但在整块切除率和切缘无肿瘤残留(即R0切除)方面不如传统EMR, 提示这一技术可能存在更高的肿瘤残留风险[45].
目前临床上关于接受UEMR治疗SNADETs的最大规模研究表明: UEMR的中位手术时间相对较短, 无论是专家级内镜医师, 还是普通内镜医师, 在条件完备的情况下均可开展UEMR操作. 虽然部分病例存在病变残留情况, 但通过制定并执行合理的内镜随访策略, 仍能保障治疗的安全性和有效性. 综上所述, UEMR是一种治疗SNADETs极具潜力的方法[46].
氩离子凝固术(argon plasma coagulation, APC)是一种可用于电凝黏膜下血管防止继发性出血的止血技术, 也用于破坏(消融)黏膜切除术边缘可疑残留的腺瘤组织[33].
对于FAP患者同时存在的十二指肠乳头肿瘤, 内镜下乳头切除术(endoscopic papillectomy, EP)后存在复发风险, 如果预估手术创伤过大, APC可作为EP后残留或复发病灶的辅助治疗手段[47]. 对于部分无法通过圈套器息肉切除术进行EMR的患者(因先前使用过电灼术), 可以联合使用冷活检钳和APC进行切除, 到达消融残留组织, 提高肿瘤切除的彻底性这一目的[48]. EMR后若存在少量残留腺瘤, 对无法使用圈套器切除的微小残留, 也考虑采纳APC进行处理[49].
有研究报道[50]内镜下治疗十二指肠腺瘤的总体成功率为70%(20例腺瘤中有14例完全切除), 但初次治疗3个月后的内镜成功率仅为55%(20例腺瘤中有11例完全切除), 且多次治疗后仍有部分患者存在残留或复发. 这提示包括APC的内镜下治疗虽有一定效果, 但仍需多次治疗且存在局限性.
传统手术治疗早期十二指肠肿瘤创伤大, 术后并发症多, 严重影响患者生活质量. 因此亟需探索更为安全有效的治疗方法.
腹腔镜-内镜联合手术(laparoscopic and endoscopic cooperative surgery, LECS), 即腹腔镜与内镜联合手术, 是一种用于治疗十二指肠肿瘤的新兴技术, 为十二指肠肿瘤的治疗提供了新的选择[51]. 通过内镜与腹腔镜的协同操作形成两种核心技术模式: 其一为全层切除型, 由内镜医师在肿瘤周围完成黏膜下层环形切开后, 利用针刀穿孔实施内镜全层切除术或联合腹腔镜辅助整块切除肿瘤, 随后由腹腔镜团队采用多层缝合技术精准闭合肠壁全层缺损, 保障力学完整性; 其二为黏膜切除强化型, 通过内镜完成常规ESD剥离后, 由腹腔镜医师对黏膜缺损区实施浆肌层连续缝合加固, 有效预防术后迟发性穿孔风险. 该技术体系通过时序性多学科协作, 针对性解决了十二指肠壁薄、术后并发症高的临床难题[52].
LECS结合了内镜和腹腔镜手术的优点, 不受肿瘤大小或位置的限制. 相比ESD等术式, LECS在定位肿瘤方面更具优势, 能减少对周围组织的损伤; 相比传统腹腔镜手术, LECS借助内镜可更精确地确定肿瘤边界, 降低切缘阳性率[53]. 既能实现局部切除, 减少对周围组织的破坏, 达到微创效果(图3), 又能充分保留十二指肠的功能[54].
随着精准医学与微创技术的快速发展, SNADETs的诊疗体系正迎来一轮革新. 未来研究方向应聚焦于人工智能(artificial intelligence, AI)辅助诊断、内镜机器人技术、新型生物材料闭合装置的研发, 以及多学科协作模式的优化, 旨在进一步提升诊断准确性、治疗安全性及患者长期预后.
内镜机器人系统通过高精度机械臂与智能化操作平台, 为复杂部位的肿瘤切除提供了全新解决方案, 其核心优势包括: 机器人机械臂具备7自由度运动能力, 可模拟人手腕部灵活性, 同时消除手部震颤, 显著提高ESD和缝合的精准度; 机器人内镜搭载双镜头3D成像系统, 可实时呈现立体术野, 结合AI实时标注病变边界与血管走行, 辅助术者识别高危区域, 降低术中出血与穿孔风险; 5G网络支持下的远程机器人手术可突破地域限制, 实现专家资源的跨区域共享. 同时, 机器人操作平台内置模块化培训程序, 通过力反馈模拟真实手术场景, 加速青年医师的学习曲线.
AI技术在内镜影像分析中的潜力已初步显现, 其在SNADETs的早期识别与风险分层中具有广阔前景. 基于深度学习的AI算法可通过训练大量内镜图像, 自动识别病变的形态特征、表面微结构异常及血管模式改变, 辅助内镜医师快速锁定高危病灶, 减少漏诊与误诊. AI辅助的增强现实技术可实时标注病变边界与切除范围, 指导内镜医师在ESD或EMR中实现精准剥离, 降低切缘阳性率, 同时缩短手术时间.
十二指肠ESD术后黏膜缺损的闭合仍是临床难点和痛点, 现有钛夹或OTSC系统虽有效, 但存在异物残留、闭合不全及机械压迫损伤等局限性. 可降解支架与生物材料的引入有望突破这一瓶颈. 基于聚乳酸或聚己内酯的可降解支架通过内镜植入缺损区域, 提供临时力学支撑并隔绝胰胆汁侵蚀; 温敏性水凝胶可在体温下快速固化, 贴合不规则创面, 形成物理屏障并止血. 联合内镜喷洒技术, 此类材料可简化闭合流程, 尤其适用于球部或降段等操作困难区域.
SNADETs的诊治近年来取得显著进展, 内镜技术的革新为其早期诊断与微创治疗提供了重要支持. 然而, 十二指肠因其解剖结构的特殊性, 无疑对诊断的准确性及治疗的安全性构成了挑战. 未来应探索多模态内镜(如AI辅助的NBI-ME)对SNADETs微血管及黏膜结构的精准识别, 建立统一的诊断标准与术者培训体系. 基于病变大小、形态、浸润深度及分子标志物特征, 制定分层治疗指南或专家共识, 明确CSP、EMR、ESD及LECS的适用边界. 同时开展多中心、前瞻性、大样本研究, 对比不同术式的远期复发率及并发症率, 尤其关注ESD术后黏膜缺损修复技术的创新. 开发更安全的黏膜下注射剂、生物可降解夹闭装置及靶向消融技术, 最大程度降低治疗风险并提高根治性切除率.
综上, SNADETs的诊治已步入精准微创时代, 但临床实践中仍需权衡技术优势与潜在风险. 通过多学科协作、技术创新及高质量循证医学证据的积累, 有望进一步优化诊疗路径, 改善患者预后.
学科分类: 胃肠病学和肝病学
手稿来源地: 陕西省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): B, B
C级 (良好): 0
D级 (一般): D, D, D
E级 (差): 0
科学编辑: 刘继红 制作编辑:张砚梁
| 1. | Kawasaki A, Tsuji K, Uedo N, Kanesaka T, Miyamoto H, Gushima R, Minoda Y, Ihara E, Amano R, Yao K, Naito Y, Aoyagi H, Iwasaki T, Uchita K, Arima H, Doyama H. Non-atrophic gastric mucosa is an independently associated factor for superficial non-ampullary duodenal epithelial tumors: a multicenter, matched, case-control study. Clin Endosc. 2023;56:75-82. [PubMed] [DOI] |
| 3. | Liu J, Duan S, Wang Y, Peng H, Kong Y, Yao S. Efficacy and safety of underwater endoscopic mucosal resection for ≤20 mm superficial non-ampullary duodenal epithelial tumors: Systematic review and meta-analysis. Front Med (Lausanne). 2022;9:1077806. [PubMed] [DOI] |
| 4. | Suwa T, Yoshida M, Ono H. Issues and Prospects of Current Endoscopic Treatment Strategy for Superficial Non-Ampullary Duodenal Epithelial Tumors. Curr Oncol. 2022;29:6816-6825. [PubMed] [DOI] |
| 5. | Kakushima N, Kanemoto H, Sasaki K, Kawata N, Tanaka M, Takizawa K, Imai K, Hotta K, Matsubayashi H, Ono H. Endoscopic and biopsy diagnoses of superficial, nonampullary, duodenal adenocarcinomas. World J Gastroenterol. 2015;21:5560-5567. [PubMed] [DOI] |
| 6. | Kuroki K, Sanomura Y, Oka S, Yorita N, Kurihara M, Mizumoto T, Yoshifuku Y, Arihiro K, Tanaka S, Chayama K. Clinical outcomes of endoscopic resection for superficial non-ampullary duodenal tumors. Endosc Int Open. 2020;8:E354-E359. [PubMed] [DOI] |
| 7. | Nakayama A, Kato M, Takatori Y, Shimoda M, Mizutani M, Tsutsumi K, Kiguchi Y, Akimoto T, Sasaki M, Mutaguchi M, Takabayashi K, Maehata T, Ochiai Y, Kanai T, Yahagi N. How I do it: Endoscopic diagnosis for superficial non-ampullary duodenal epithelial tumors. Dig Endosc. 2020;32:417-424. [PubMed] [DOI] |
| 8. | Goda K, Kikuchi D, Yamamoto Y, Takimoto K, Kakushima N, Morita Y, Doyama H, Gotoda T, Maehata Y, Abe N. Endoscopic diagnosis of superficial non-ampullary duodenal epithelial tumors in Japan: Multicenter case series. Dig Endosc. 2014;26 Suppl 2:23-29. [PubMed] [DOI] |
| 9. | The Paris endoscopic classification of superficial neoplastic lesions: esophagus, stomach, and colon: November 30 to December 1, 2002. Gastrointest Endosc. 2003;58:S3-43. [PubMed] [DOI] |
| 10. | Yoshida M, Toya Y, Notsu A, Kakushima N, Kato M, Yahagi N; on the behalf of Endoscopic Clinical Practice Guideline Committee of the Japan Gastroenterological Endoscopy Society for Non-ampullary Duodenal Epithelial Tumors. White-Light Imaging and Image-Enhanced Endoscopy With Magnifying Endoscopy for the Optical Diagnosis of Superficial Nonampullary Duodenal Epithelial Tumors: A Systematic Review and Meta-Analysis. J Gastroenterol Hepatol. 2025;40:379-386. [PubMed] [DOI] |
| 11. | Kakushima N, Yoshida M, Takizawa K, Yabuuchi Y, Kawata N, Kishida Y, Ito S, Imai K, Hotta K, Ishiwatari H, Matsubayashi H, Ono H. White light and/or magnifying endoscopy with narrow band imaging for superficial nonampullary duodenal epithelial tumors. Scand J Gastroenterol. 2021;56:211-218. [PubMed] [DOI] |
| 12. | Yang Q, Liu Z, Sun H, Jiao F, Zhang B, Chen J. A narrative review: narrow-band imaging endoscopic classifications. Quant Imaging Med Surg. 2023;13:1138-1163. [PubMed] [DOI] |
| 14. | Yoshida N, Inoue K, Ghoneem E, Inagaki Y, Kobayashi R, Iwai N, Dohi O, Hirose R, Itoh Y. The Interpretation of Magnifying Endoscopy for the Diagnosis of Colorectal Lesions. Digestion. 2025;106:107-114. [PubMed] [DOI] |
| 15. | Mukherjee P, George AJP, Yadav BK, Jeyaseelan L, Kumar RM, Mukha RP, Chandrasingh J, Kumar S, Kekre NS, Devasia A. The Impact of Narrow Band Imaging in the Detection and Resection of Bladder Tumor in Transitional Cell Carcinoma of the Bladder: A Prospective, Blinded, Sequential Intervention Randomized Controlled Trial. Urology. 2019;128:55-61. [PubMed] [DOI] |
| 16. | Yoshida N, Hayashi Y, Kashida H, Tomita Y, Dohi O, Inoue K, Hirose R, Itoh Y, Okada M, Yoshimoto S, Fujinuma T, Sakamoto H, Sunada K, Komeda Y, Sekai I, Okai N, Yamamoto H. Images of laser and light-emitting diode colonoscopy for comparing large colorectal lesion visibility with linked color imaging and white-light imaging. Dig Endosc. 2022;34:1413-1421. [PubMed] [DOI] |
| 17. | Chen Y, Wu G, Qu C, Ye Z, Kang Y, Tian X. A multifaceted comparative analysis of image and video technologies in gastrointestinal endoscope and their clinical applications. Front Med (Lausanne). 2023;10:1226748. [PubMed] [DOI] |
| 18. | Goda K, Abe K, Kanamori A, Kondo M, Kojimahara S, Kanazawa M, Tanaka T, Nagashima K, Suzuki T, Yamamiya A, Hoshi K, Tominaga K, Majima Y, Iijima M, Irisawa A. Advanced Endoscopy for Benign Esophageal Disease: A Review Focused on Non-Erosive Reflux Disease and Eosinophilic Esophagitis. Healthcare (Basel). 2022;10:2183. [PubMed] [DOI] |
| 19. | 金 震东. 超声内镜在消化系疾病诊治中的应用进展. 胃肠病学和肝病学杂志. 2009;18:5-9. |
| 20. | ASGE Standards of Practice Committee; Chathadi KV, Khashab MA, Acosta RD, Chandrasekhara V, Eloubeidi MA, Faulx AL, Fonkalsrud L, Lightdale JR, Salztman JR, Shaukat A, Wang A, Cash BD, DeWitt JM. The role of endoscopy in ampullary and duodenal adenomas. Gastrointest Endosc. 2015;82:773-781. [PubMed] [DOI] |
| 21. | Yoshida M. Quantitative diagnosis of superficial nonampullary duodenal adenocarcinoma: Moving forward with formalin-fixed paraffin-embedded specimens. Dig Endosc. 2024;36:939-941. [PubMed] [DOI] |
| 23. | Bourke MJ. Endoscopic resection in the duodenum: current limitations and future directions. Endoscopy. 2013;45:127-132. [PubMed] [DOI] |
| 24. | Karim SAM, Abdulla KS, Abdulkarim QH, Rahim FH. The outcomes and complications of pancreaticoduodenectomy (Whipple procedure): Cross sectional study. Int J Surg. 2018;52:383-387. [PubMed] [DOI] |
| 25. | Sakamoto T, Saiura A, Ono Y, Mise Y, Inoue Y, Ishizawa T, Takahashi Y, Ito H. Optimal Lymphadenectomy for Duodenal Adenocarcinoma: Does the Number Alone Matter? Ann Surg Oncol. 2017;24:3368-3375. [PubMed] [DOI] |
| 26. | Kato M, Kanai T, Yahagi N. Endoscopic resection of superficial non-ampullary duodenal epithelial tumor. DEN Open. 2022;2:e54. [PubMed] [DOI] |
| 27. | Nonaka S, Oda I, Tada K, Mori G, Sato Y, Abe S, Suzuki H, Yoshinaga S, Nakajima T, Matsuda T, Taniguchi H, Saito Y, Maetani I. Clinical outcome of endoscopic resection for nonampullary duodenal tumors. Endoscopy. 2015;47:129-135. [PubMed] [DOI] |
| 28. | Hamada K, Takeuchi Y, Ishikawa H, Ezoe Y, Arao M, Suzuki S, Iwatsubo T, Kato M, Tonai Y, Shichijo S, Yamasaki Y, Matsuura N, Nakahira H, Kanesaka T, Yamamoto S, Akasaka T, Hanaoka N, Higashino K, Uedo N, Ishihara R, Okada H, Iishi H. Safety of cold snare polypectomy for duodenal adenomas in familial adenomatous polyposis: a prospective exploratory study. Endoscopy. 2018;50:511-517. [PubMed] [DOI] |
| 29. | Bourke MJ, Lo SK, Buerlein RCD, Das KK. AGA Clinical Practice Update on Nonampullary Duodenal Lesions: Expert Review. Gastroenterology. 2025;168:169-175. [PubMed] [DOI] |
| 30. | Jeon HK, Kim GH. Endoscopic Resection for Superficial Non-Ampullary Duodenal Epithelial Tumors. Gut Liver. 2025;19:19-30. [PubMed] [DOI] |
| 31. | Aelvoet AS, Karstensen JG, Bastiaansen BAJ, van Leerdam ME, Balaguer F, Kaminski M, Hompes R, Bossuyt PMM, Ricciardiello L, Latchford A, Jover R, Daca-Alvarez M, Pellisé M, Dekker E; European FAP Consortium. Cold snare polypectomy for duodenal adenomas in familial adenomatous polyposis: a prospective international cohort study. Endosc Int Open. 2023;11:E1056-E1062. [PubMed] [DOI] |
| 32. | Hirasawa K, Ozeki Y, Sawada A, Sato C, Ikeda R, Nishio M, Fukuchi T, Kobayashi R, Makazu M, Taguri M, Maeda S. Appropriate endoscopic treatment selection and surveillance for superficial non-ampullary duodenal epithelial tumors. Scand J Gastroenterol. 2021;56:342-350. [PubMed] [DOI] |
| 33. | Basford PJ, Bhandari P. Endoscopic management of nonampullary duodenal polyps. Therap Adv Gastroenterol. 2012;5:127-138. [PubMed] [DOI] |
| 34. | Valerii G, Tringali A, Landi R, Boškoski I, Familiari P, Bizzotto A, Perri V, Petruzziello L, Costamagna G. Endoscopic mucosal resection of non-ampullary sporadic duodenal adenomas: a retrospective analysis with long-term follow-up. Scand J Gastroenterol. 2018;53:490-494. [PubMed] [DOI] |
| 35. | Li A, Shen J. Current endoscopic diagnosis treatment strategy for superficial nonampullary duodenal tumours. Eur J Med Res. 2022;27:290. [PubMed] [DOI] |
| 36. | Hara Y, Goda K, Dobashi A, Ohya TR, Kato M, Sumiyama K, Mitsuishi T, Hirooka S, Ikegami M, Tajiri H. Short- and long-term outcomes of endoscopically treated superficial non-ampullary duodenal epithelial tumors. World J Gastroenterol. 2019;25:707-718. [PubMed] [DOI] |
| 37. | 王 春宝, 王 亚健, 常 红云, 崔 磊, 武 卓越, 任 牡丹, 隋 燕霞. 一种简易内镜下黏膜切除标本病变测量及复原图绘制的新方法. 现代肿瘤医学. 2020;28:4057-4060. |
| 38. | Akahoshi K, Kubokawa M, Inamura K, Akahoshi K, Shiratsuchi Y, Tamura S. Current Challenge: Endoscopic Submucosal Dissection of Superficial Non-ampullary Duodenal Epithelial Tumors. Curr Treat Options Oncol. 2020;21:98. [PubMed] [DOI] |
| 39. | Tashima T, Ohata K, Sakai E, Misumi Y, Takita M, Minato Y, Matsuyama Y, Muramoto T, Satodate H, Horiuchi H, Matsuhashi N, Nonaka K, Ryozawa S. Efficacy of an over-the-scope clip for preventing adverse events after duodenal endoscopic submucosal dissection: a prospective interventional study. Endoscopy. 2018;50:487-496. [PubMed] [DOI] |
| 40. | Dohi O, Yoshida N, Naito Y, Yoshida T, Ishida T, Azuma Y, Kitae H, Matsumura S, Takayama S, Ogita K, Mizuno N, Nakano T, Majima A, Hirose R, Inoue K, Kamada K, Uchiyama K, Takagi T, Ishikawa T, Konishi H, Morinaga Y, Kishimoto M, Itoh Y. Efficacy and safety of endoscopic submucosal dissection using a scissors-type knife with prophylactic over-the-scope clip closure for superficial non-ampullary duodenal epithelial tumors. Dig Endosc. 2020;32:904-913. [PubMed] [DOI] |
| 41. | Miyazaki H, Dohi O, Ishida T, Seya M, Yamauchi K, Fukui H, Yasuda T, Yoshida T, Iwai N, Doi T, Hirose R, Inoue K, Harusato A, Yoshida N, Uchiyama K, Takagi T, Ishikawa T, Konishi H, Morinaga Y, Kishimoto M, Naito Y, Itoh Y. Conventional versus underwater endoscopic resection for superficial non-ampullary duodenal epithelial tumours. Jpn J Clin Oncol. 2024;54:137-145. [PubMed] [DOI] |
| 42. | Yamasaki Y, Uedo N, Akamatsu T, Kagawa T, Higashi R, Dohi O, Furukawa M, Takahashi Y, Inoue T, Tanaka S, Takenaka R, Iguchi M, Kawamura T, Tsuzuki T, Yamasaki T, Yamashina T, Nasu J, Mannami T, Yamauchi A, Matsueda K, Aizawa S, Mitsuhashi T, Okada H; D-UEMR Study Group. Nonrecurrence Rate of Underwater EMR for ≤20-mm Nonampullary Duodenal Adenomas: A Multicenter Prospective Study (D-UEMR Study). Clin Gastroenterol Hepatol. 2022;20:1010-1018.e3. [PubMed] [DOI] |
| 43. | Yamasaki Y, Uedo N, Takeuchi Y, Ishihara R, Okada H, Iishi H. Current Status of Endoscopic Resection for Superficial Nonampullary Duodenal Epithelial Tumors. Digestion. 2018;97:45-51. [PubMed] [DOI] |
| 44. | Lee JG, Lee SP, Jang HJ, Kae SH. Underwater Versus Conventional Endoscopic Mucosal Resection for Superficial Non-ampullary Duodenal Epithelial Tumors: A Systematic Review and Meta-Analysis. Dig Dis Sci. 2023;68:1482-1491. [PubMed] [DOI] |
| 45. | Kiguchi Y, Kato M, Nakayama A, Sasaki M, Mizutani M, Tsutsumi K, Akimoto T, Takatori Y, Mutaguchi M, Takabayashi K, Ochiai Y, Maehata T, Kanai T, Yahagi N. Feasibility study comparing underwater endoscopic mucosal resection and conventional endoscopic mucosal resection for superficial non-ampullary duodenal epithelial tumor < 20 mm. Dig Endosc. 2020;32:753-760. [PubMed] [DOI] |
| 46. | Iwagami H, Takeuchi Y, Yamasaki Y, Nakagawa K, Ohmori M, Matsuno K, Inoue S, Iwatsubo T, Nakahira H, Matsuura N, Shichijo S, Maekawa A, Kanesaka T, Higashino K, Uedo N, Ishihara R. Feasibility of underwater endoscopic mucosal resection and management of residues for superficial non-ampullary duodenal epithelial neoplasms. Dig Endosc. 2020;32:565-573. [PubMed] [DOI] |
| 47. | Cho H, Yamada M, Tanabe N, Yoshida T, Sugano K, Hashimoto T, Hijioka S. Argon Plasma Coagulation With Cholangioscopy as Additional Treatment for Residual Ampullary Tumor in a Young Familial Adenomatous Polyposis Patient. ACG Case Rep J. 2019;6:e00202. [PubMed] [DOI] |
| 48. | Navaneethan U, Lourdusamy D, Mehta D, Lourdusamy V, Venkatesh PG, Sanaka MR. Endoscopic resection of large sporadic non-ampullary duodenal polyps: efficacy and long-term recurrence. Surg Endosc. 2014;28:2616-2622. [PubMed] [DOI] |
| 49. | Alexander S, Bourke MJ, Williams SJ, Bailey A, Co J. EMR of large, sessile, sporadic nonampullary duodenal adenomas: technical aspects and long-term outcome (with videos). Gastrointest Endosc. 2009;69:66-73. [PubMed] [DOI] |
| 50. | Apel D, Jakobs R, Spiethoff A, Riemann JF. Follow-up after endoscopic snare resection of duodenal adenomas. Endoscopy. 2005;37:444-448. [PubMed] [DOI] |
| 51. | Suwa T, Takizawa K, Kawata N, Yoshida M, Yabuuchi Y, Yamamoto Y, Ono H. Current Treatment Strategy for Superficial Nonampullary Duodenal Epithelial Tumors. Clin Endosc. 2022;55:15-21. [PubMed] [DOI] |
| 52. | Ichikawa D, Komatsu S, Dohi O, Naito Y, Kosuga T, Kamada K, Okamoto K, Itoh Y, Otsuji E. Laparoscopic and endoscopic co-operative surgery for non-ampullary duodenal tumors. World J Gastroenterol. 2016;22:10424-10431. [PubMed] [DOI] |
| 53. | Ntourakis D, Mavrogenis G. Cooperative laparoscopic endoscopic and hybrid laparoscopic surgery for upper gastrointestinal tumors: Current status. World J Gastroenterol. 2015;21:12482-12497. [PubMed] [DOI] |
| 54. | Nunobe S, Ri M, Yamazaki K, Uraoka M, Ohata K, Kitazono I, Terashima M, Yamagata Y, Tanabe S, Abe N, Tsuji T, Niimi K, Kawakubo H, Tsukada T, Kitashiro S, Ishizuka N, Hiki N; Society for the Study of Laparoscopic Endoscopic Cooperative Surgery. Safety and feasibility of laparoscopic and endoscopic cooperative surgery for duodenal neoplasm: a retrospective multicenter study. Endoscopy. 2021;53:1065-1068. [PubMed] [DOI] |