修回日期: 2021-06-02
接受日期: 2021-07-27
在线出版日期: 2021-09-08
随着医医疗水平的提高, 胃癌的早期诊断及治疗取得了明显成效, 但患者的死亡率仍居高不下, 且预后较差, 侵袭与转移是影响患者预后的重要因素. 因此, 探究胃癌的发病机制, 抑制胃癌细胞的侵袭转移, 改善患者预后意义重大. 乙酰肝素酶(heparanase, HPSE)是一种内源性糖苷内切酶, 有研究发现, 期在胃癌组织中的表达水平明显升高. 但关于乙酰肝素酶2 (heparanase, HPSE2)在胃癌中的相关作用及其作用机制尚不明确. 本研究旨在HPSE2在胃癌中的相关作用及其作用机制.
分析HPSE2通过抑制核转录因子κB (NF-κB)、wnt基因/β-连环蛋白(Wnt/β-catenin)信号通路调控胃癌细胞恶性生物学行为的机制.
收集2019-09/2021-04期间在本院进行手术切除治疗的74例胃癌患者的胃癌组织及癌旁正常组织, 测定HPSE2的表达水平. 将人胃癌细胞系MKN-28细胞进行传代培养并转染, 获得HPSE2过表达组及对照组. 测定各组细胞增殖能力、细胞凋亡率、细胞侵袭及迁移能力, 并测定细胞中HPSE2、上皮型钙黏蛋白(epithelial cadherin, E-cadherin)、神经型钙黏蛋白(neural cadherin, N-cadherin)、波形蛋白(Vimentin)、转化生长因子-β1(transforming growth factor-β1, TGF-β1)、磷酸化核转录因子-κB p65(nuclear transcription factor κB p65, p-NF-κB p65)、β-catenin表达水平变化.
与癌旁正常组织对比, 胃癌组织中HPSE2表达水平明显降低(P<0.01). 与对照组比较, HPSE2过表达组HPSE2表达水平明显升高(P<0.01). 两组1 d时细胞增殖能力无明显差异(P>0.05); 与2 d与对照组比较, HPSE2过表达组细胞增殖能力明显降低(P<0.05或P<0.01). 与对照组比较, HPSE2过表达组细胞凋亡率及Bax、E-cadherin表达水平均明显升高, 细胞侵袭、迁移能力及Bax、Suivivin、N-cadherin、Vimentin、TGF-β1、p-NF-κB p65、β-catenin表达水平均明显降低(P<0.01).
上调HPSE2表达能够明显抑制细胞增殖、侵袭及迁移, 抑制细胞发生EMT, 促进细胞凋亡, 其可能是通过抑制NF-κB及Wnt/β-catenin信号通路的激活实现.
核心提要: 乙酰肝素酶(heparanase, HPSE)是一种内源性糖苷内切酶, 是人体中唯一能够特异性剪切硫酸乙酰肝素蛋白多糖的酶. HPSE2属于HPSE的同源物, 其不具有肝素酶的活性, 但其能够竞争性结合硫酸乙酰肝素, 从而对肝素酶活性起到一定的抑制作用. 有学者在乳腺癌的研究中发现, HPSE2能够抑制肿瘤细胞的侵袭迁移, 促进新生血管生成. 但关于其在胃癌中的相关作用及其作用机制尚不明确. 本研究旨在探讨HPSE2调控胃癌细胞恶性生物学行为的作用机制.
引文著录: 陈冰冰, 何璠, 郑伟伟. HPSE2通过抑制NF-κB、Wnt/β-catenin信号通路调控胃癌细胞恶性生物学行为的机制. 世界华人消化杂志 2021; 29(17): 1026-1034
Revised: June 2, 2021
Accepted: July 27, 2021
Published online: September 8, 2021
With the improvement of medical level, remarkable progress has been made in the early diagnosis and treatment of gastric cancer, but the mortality of patients with gastric cancer is still high, and the prognosis is poor. Invasion and metastasis are important factors affecting the prognosis of patients. Therefore, it is of great significance to explore the pathogenesis of gastric cancer, inhibit the invasion and metastasis of gastric cancer cells, and improve the prognosis of patients. Heparanase (HPSE) is an endogenous endoglycosidase. Some studies have found that the expression level of HPSE in gastric cancer is significantly increased. However, the role of HPSE2 in gastric cancer is still unclear. This study aimed to investigate the role of HPSE2 in gastric cancer and the underlying mechanism.
To investigate whether HPSE regulates the malignant biological behavior of gastric cancer cells and explore the role of the nuclear factor-κB (NF-κB) and Wnt/β-Catenin signaling pathways in this process.
From September 2019 to April 2021, 74 cases of gastric cancer tissues and adjacent normal tissues were collected, and the expression levels of HPSE2 in these tissues were determined. The human gastric cancer cell line MKN-28 was subcultured and transfected to obtain HPSE2 overexpressing cells. Cell proliferation, apoptosis, invasion, and migration were measured, and the expression levels of HPSE2, E-cadherin, N-cadherin, vimentin, transforming growth factor-β1 (TGF-β1), phosphorylated NF-κB p65 (p-NF-κB p65) and β-Catenin were measured.
Compared with the adjacent normal tissues, the expression level of HPSE2 in gastric cancer tissues was significantly lower (P < 0.01). Compared with control cells, the expression level of HPSE2 in HPSE2 overexpressing cells was significantly higher (P < 0.01). There was no significant difference in cell proliferation ability between the two groups on day 1 (P > 0.05); compared with the control group on day 2, the cell proliferation ability of the HPSE2 overexpression group was significantly decreased (P < 0.05 or P < 0.01). Compared with the control group, the apoptosis rate and the expression levels of Bax and E-cadherin in the HPSE2 overexpression group were significantly increased, while the invasion and migration abilities as well as the expression levels of Bax, Survivin, N-cadherin, vimentin, TGF-β1, p-NF-κB p65, and β-Catenin were significantly decreased (P < 0.01).
Up-regulation of HPSE2 expression can inhibit cell proliferation, invasion, and migration, suppress the epithelial-mesenchymal transition, and promote apoptosis, which may be achieved by inhibiting the NF-κB and Wnt/ β-catenin signaling pathways.
- Citation: Chen BB, He F, Zheng WW. HPSE2 regulates malignant biological behavior of gastric cancer cells by inhibiting NF-κB and Wnt/β-catenin signaling pathways. Shijie Huaren Xiaohua Zazhi 2021; 29(17): 1026-1034
- URL: https://www.wjgnet.com/1009-3079/full/v29/i17/1026.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v29.i17.1026
胃癌是临床上常见的恶性肿瘤之一, 在世界范围内, 其死亡率占所有恶性肿瘤死亡率的第二位, 仅次于肺癌. 随着我国经济及医疗水平的不断提高, 胃癌的早期诊断水平不断提高, 对胃癌的防控治疗取得了重大进步, 但患者的死亡率仍居高不下, 预后较差, 严重影响患者生命[1]. 目前, 治疗胃癌的主要手段为手术切除联合术后放化疗, 但由于胃癌早期发病隐匿, 不能得到患者重视, 易造成误诊漏诊, 从而错失最佳治疗时机, 加大治疗难度. 因此, 探究胃癌的发病机制, 分析其关键调控分子, 早期诊断, 及时治疗对降低患者的死亡率, 改善患者预后具有重要作用. 乙酰肝素酶(heparanase, HPSE)是一种内源性糖苷内切酶, 是人体中唯一能够特异性剪切硫酸乙酰肝素蛋白多糖的酶. 乙酰肝素酶2(heparanase, HPSE2)属于HPSE的同源物, 其不具有肝素酶的活性, 但其能够竞争性结合硫酸乙酰肝素, 从而对肝素酶活性起到一定的抑制作用[2]. 有学者在乳腺癌的研究中发现, HPSE2能够抑制肿瘤细胞的侵袭迁移, 促进新生血管生成[3]. 但关于其在胃癌中的相关作用及其作用机制尚不明确. 本研究旨在探讨HPSE2调控胃癌细胞恶性生物学行为的作用机制.
实验材料: 收集2019-09/2021-04期间在本院进行手术切除治疗的74例胃癌患者的胃癌组织及癌旁正常组织.
人胃癌细胞系MKN-28[赛百慷(上海)生物技术股份有限公司].
主要仪器及试剂: 实时定量荧光PCR仪(济南光耀医疗设备有限公司, 型号: TL-988-IV); 低温高速离心机(华威科创(武汉)科技有限公司, 型号: SIGMA 3-18K); 超低温冰箱(浙江捷盛低温设备有限公司, 型号: DW-86W300); DMEM培养基(黑龙江久丰生物工程有限公司); 胎牛血清(上海恒远生物科技有限公司); PBS缓冲液(重庆赛诺生物药业股份有限公司); 流式细胞仪(美国贝克曼库尔特有限公司, 型号: CytoFLEX); 生物显微镜(上海精密仪器仪表公司, 型号: XSP-8C); 兔抗人HPSE2多克隆抗体(武汉淼灵生物科技有限公司).
1.2.1 实验方法: 采用免疫组化法测定胃癌组织及癌旁正常组织HPSE2表达水平. 取胃癌组织及癌旁正常组织, 常规制作石蜡切片, 烘烤、脱蜡水化、抗原修复、封闭内源性过氧化酶、破膜, 配制HPSE2一抗稀释液, 每片组织切片依次添加相应的一抗稀释液, 4 ℃孵育过夜. 取出组织切片, 加入PBS溶液清洗, 每片组织依次添加辣根过氧化物酶二抗, 37 ℃孵育60 min, 加入PBS溶液清洗, DAB显色、苏木素复染、脱水透明、树脂封片, 显微镜下观察.
细胞培养: 将人胃癌细胞系MKN-28细胞放入DMEM培养基中, 加入10%胎牛血清、100 U/mL青霉素及100 μg/mL链霉素双抗溶液, 在37 ℃、5%CO2恒温培养箱中进行培养. 取生长状态良好的细胞
1.2.2 细胞转染: 在Zheng细胞中加入0.25%胰蛋白酶制成细胞悬液, 将对数生长期的 MKN-28细胞悬液分别以10000个/孔接种于6孔板中, 每组设置6个复孔. 在MKN-28细胞中分别转染HPSE2过表达质粒及空白质粒, 获得HPSE2过表达组及对照组.
采用实时荧光定量PCR法及蛋白质印迹法测定对照组及HPSE2过表达组细胞中HPSE2表达水平. 实时荧光定量PCR法: 将MKN-28细胞接种至6孔板加入裂解液充分裂解, 在室温下静置, 取细胞悬液至1.5 mL EP管中. 加入适量氯仿, 颠倒混匀, 静置, 离心, 取上清液, 加入500 μL异丙醇, 静置, 离心, 取下层沉淀, 即为RNA. 用75%乙醇洗涤沉淀, 离心, 去除上清液, 加入15 μL DEPC水溶解RNA, 测定RNA浓度与纯度, 对RNA进行逆转录反应反转录cDNA, 并进行PCR扩增, 以2-△△Ct计算目的基因相对表达量.
1.2.3 蛋白质印迹法: 收集各组对数生长的MKN-28细胞, 采用加入含有蛋白酶抑制剂和磷酸酶抑制剂PMSF的RIPA裂解液, 充分裂解细胞, 根据BCA试剂盒配制工作液进行蛋白质定量. 将30 μg蛋白与4×上样缓冲液混合离心取上清液, 经SDS-聚丙烯酰胺凝胶电泳分离后转移至PVDF膜, 10 mL 5%的脱脂奶粉室温封闭2 h或4 ℃孵育过夜, 加入HPSE2一抗, 4 ℃冰箱孵育过夜, TBST洗膜, 加入相应的二抗室温孵育1-2 h, TBST洗膜, ECL化学发光法进行显色.
1.2.4 细胞增殖能力: 采用MTT法测定各组细胞增殖能力变化. 将生长良好且处于生长对数期的MKN-28细胞制成细胞悬液, 以10000个/孔接种于96孔板中, 每孔中加入浓度为5 mg/mL的MTT溶液20 μL, 继续培养4 h, 采用酶联免疫检测仪测定各组细胞在520 nm处的吸光度值.
1.2.5 细胞凋亡: 收集各组细胞约1×105个, 离心、清洗, 去除上清液, 避光孵育15 min左右, 加入0.5 mL Annexin V, 采用流式细胞仪测定各组细胞凋亡情况. 采用蛋白质印迹法测定各组细胞凋亡相关蛋白Bcl-2、Bax、Suivivin表达情况.
1.2.6 细胞侵袭能力: 采用Transwell侵袭实验测定各组细胞侵袭能力. 将提前预冷的无胎牛血清的Matrigel胶按照合适比例进行稀释, 取基质胶200 μL加入小室上室, 下室中加入400 μL含10%胎牛血清的完全培养基, 取转染组及对照组细胞以10000个/孔接种至小室上室中, 放于细胞培养箱中培养24 h, 使用结晶紫染液染色, 使用显微镜进行观察.
1.2.7 迁移能力: 采用Transwell迁移实验比较各组细胞迁移能力的变化. 取无血清培养基重悬细胞以适当密度接种至小室上室, 下室中加入含10% 400 μL含10%胎牛血清的完全培养基, 放于培养箱中培养24 h, 使用结晶紫染液染色, 使用显微镜进行观察.
采用蛋白质印迹法测定上皮型钙黏蛋白(epithelial cadherin, E-cadherin)、神经型钙黏蛋白(neural cadherin, N-cadherin)、波形蛋白(Vimentin)、转化生长因子-β1 (transforming growth factor-β1, TGF-β1)、磷酸化核转录因子-κB p65(nuclear transcription factor κB p65, p-NF-κB p65)、β-catenin表达水平.
1.2.8 观察指标: 采用免疫组化法测定胃癌组织及癌旁正常组织HPSE2表达水平.
采用实时荧光定量PCR法及蛋白质印迹法测定对照组及HPSE2过表达组细胞中HPSE2表达水平.
采用MTT法测定各组细胞增殖能力变化.
采用流式细胞仪测定各组细胞凋亡情况. 采用蛋白质印迹法测定各组细胞凋亡相关蛋白Bcl-2、Bax、Suivivin表达情况.
采用Transwell迁移实验比较各组细胞迁移能力的变化.
采用Transwell侵袭实验测定各组细胞侵袭能力变化.
采用蛋白质印迹法测定E-cadherin、N-cadherin、Vimentin、TGF-β1、p-NF-κB p65、β-catenin表达水平.
统计学处理 本组研究中计量资料比较均符合正态分布, 均采用独立样本t检验, 以(mean±SD)表示. 本组研究中采用SPSS 24.0软件进行统计学数据分析, 以统计学结果P<0.05视为差异具有统计学意义.
与癌旁正常组织对比, 胃癌组织中HPSE2表达水平明显降低(P<0.01). 见表1.
| 分组 | 例数 | HPSE2 |
| 胃癌组织 | 74 | 4.54±0.85 |
| 癌旁正常组织 | 74 | 7.27±0.36 |
| t | 25.441 | |
| P | <0.001 |
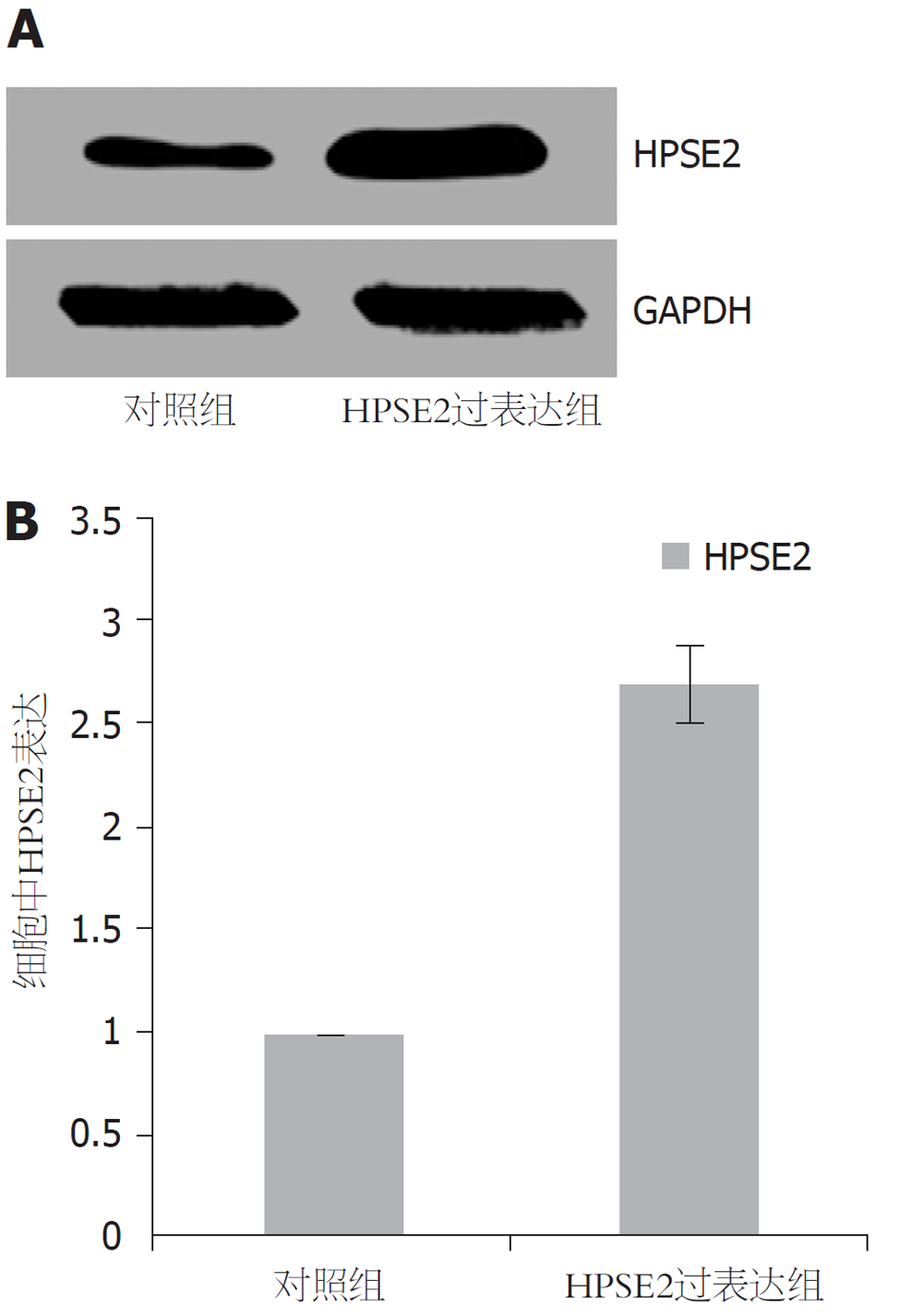
与对照组比较, HPSE2过表达组HPSE2表达水平明显升高(P<0.01). 见图1, 表2.
| 分组 | HPSE2 |
| 对照组 | 1.00±0.01 |
| HPSE2过表达组 | 2.69±0.18 |
| t | 22.963 |
| P | <0.001 |
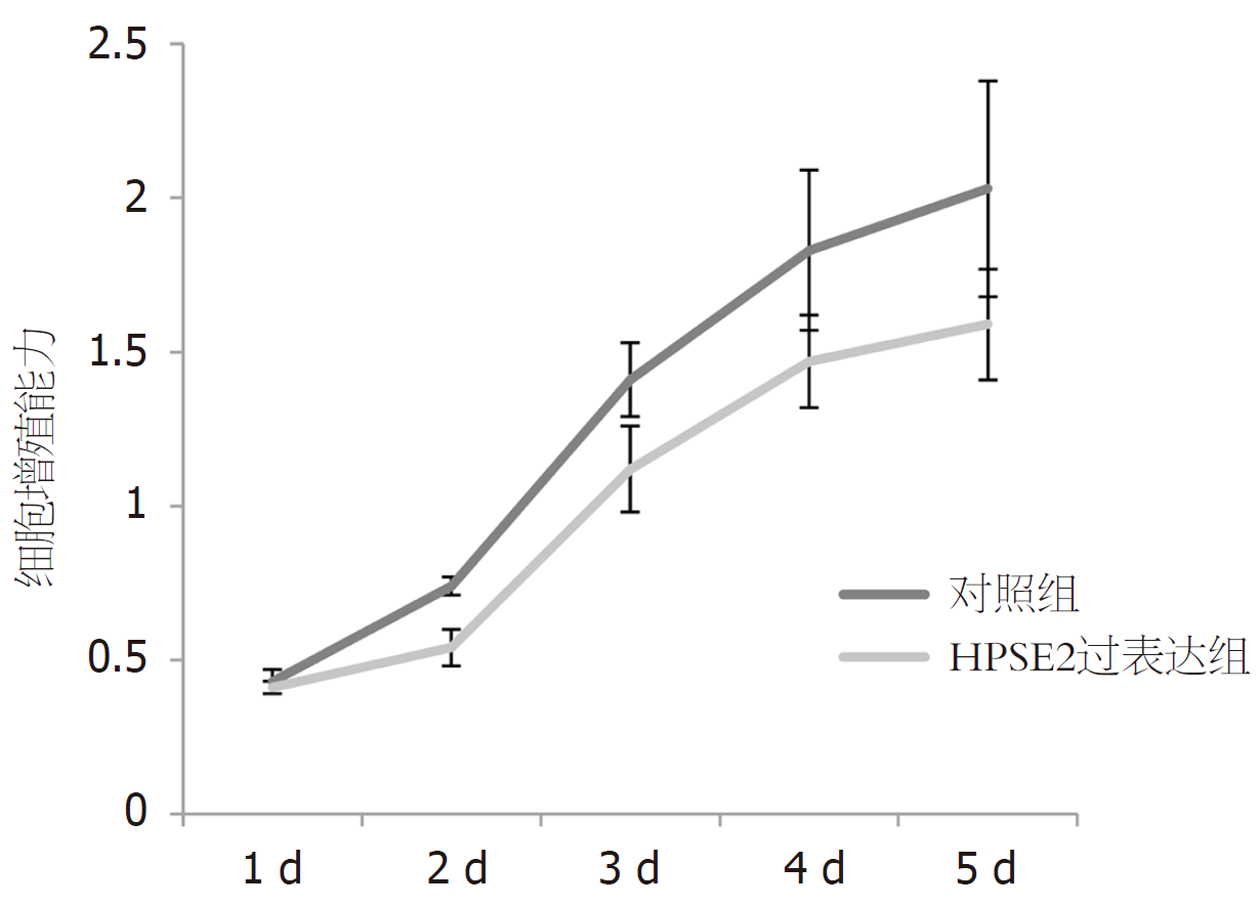
两组1 d时细胞增殖能力无明显差异(P>0.05); 与2 d与对照组比较, HPSE2过表达组细胞增殖能力明显降低(P<0.05或P<0.01). 见表3, 图2.
| 分组 | 增殖能力 | ||||
| 1 d | 2 d | 3 d | 4 d | 5 d | |
| 对照组 | 0.43±0.04 | 0.74±0.03 | 1.41±0.12 | 1.83±0.26 | 2.03±0.35 |
| HPSE2过表达组 | 0.41±0.02 | 0.54±0.06 | 1.12±0.14 | 1.47±0.15 | 1.59±0.18 |
| t | 1.095 | 7.303 | 3.852 | 2.938 | 2.738 |
| P | 0.299 | <0.001 | 0.003 | 0.015 | 0.021 |
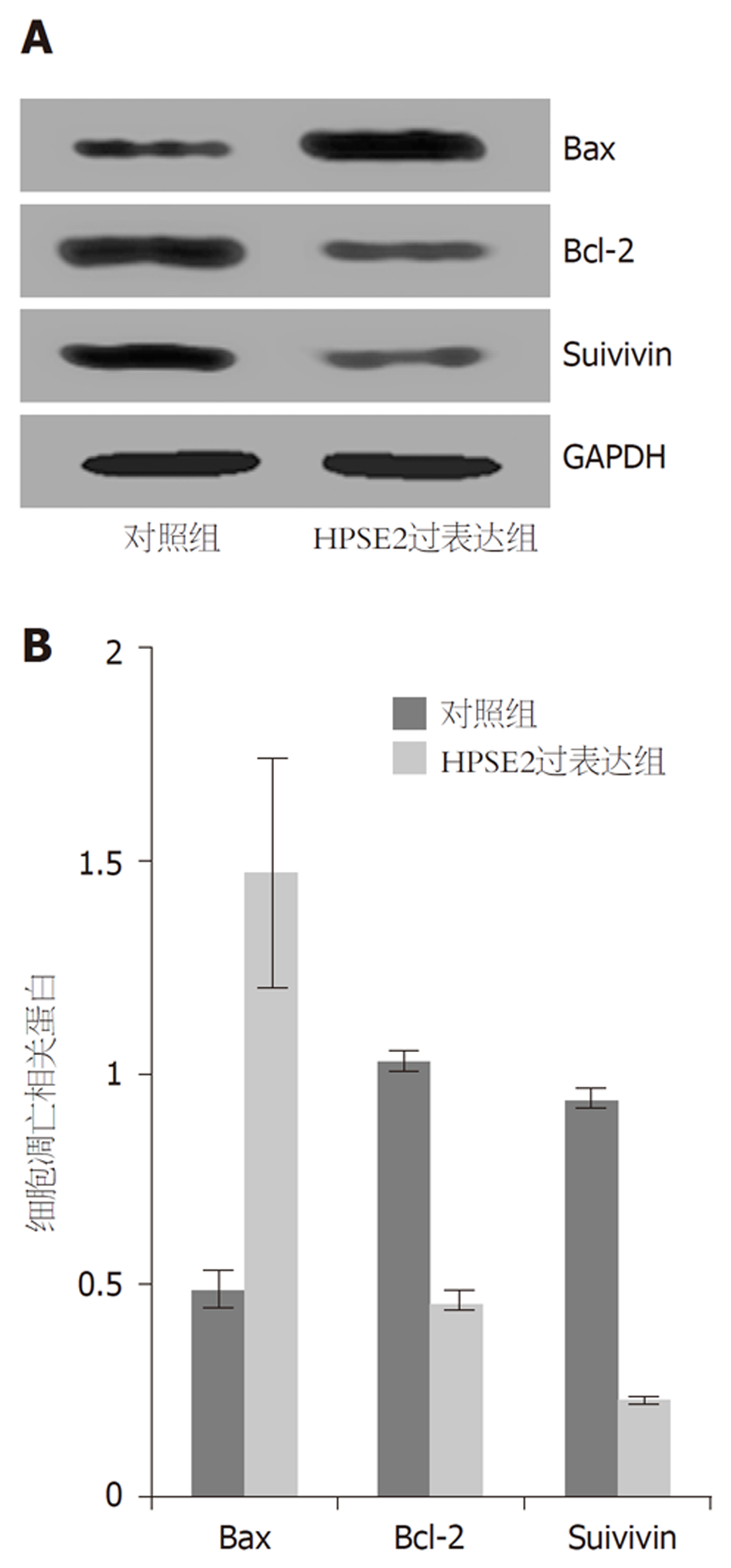
与对照组比较, HPSE2过表达组细胞凋亡率及Bax表达水平均明显升高, Bax、Suivivin表达水平均明显降低(P<0.01). 见表4, 表5, 图3.
| 分组 | 细胞凋亡率(%) |
| 对照组 | 4.21±0.14 |
| HPSE2过表达组 | 29.67±3.52 |
| t | 17.703 |
| P | <0.001 |
| 分组 | Bax | Bcl-2 | Suivivin |
| 对照组 | 0.49±0.04 | 1.03±0.02 | 0.94±0.03 |
| HPSE2过表达组 | 1.48±0.27 | 0.46±0.03 | 0.23±0.01 |
| t | 8.885 | 38.724 | 54.996 |
| P | <0.001 | <0.001 | <0.001 |
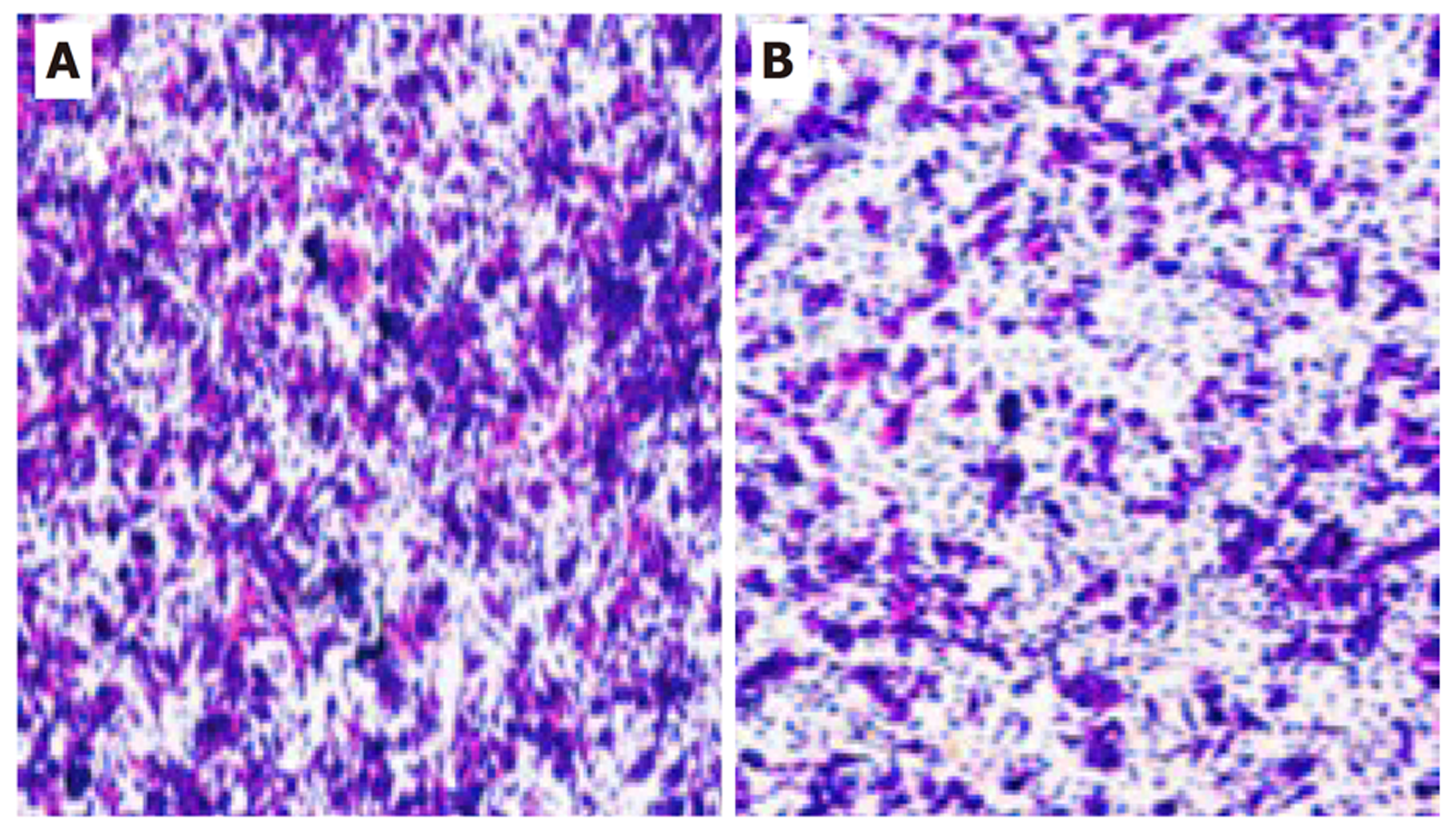
与对照组比较, HPSE2过表达组细胞迁移能力明显降低(P<0.01). 见图4, 表6.
| 分组 | 迁移细胞数(个) |
| 对照组 | 126.58±8.74 |
| HPSE2过表达组 | 78.72±11.37 |
| t | 8.145 |
| P | <0.001 |
与对照组比较, HPSE2过表达组细胞侵袭能力明显降低(P<0.01). 见图5, 表7.
| 分组 | 侵袭细胞数(个) |
| 对照组 | 121.00±10.58 |
| HPSE2过表达组 | 63.15±1.26 |
| t | 13.300 |
| P | <0.001 |
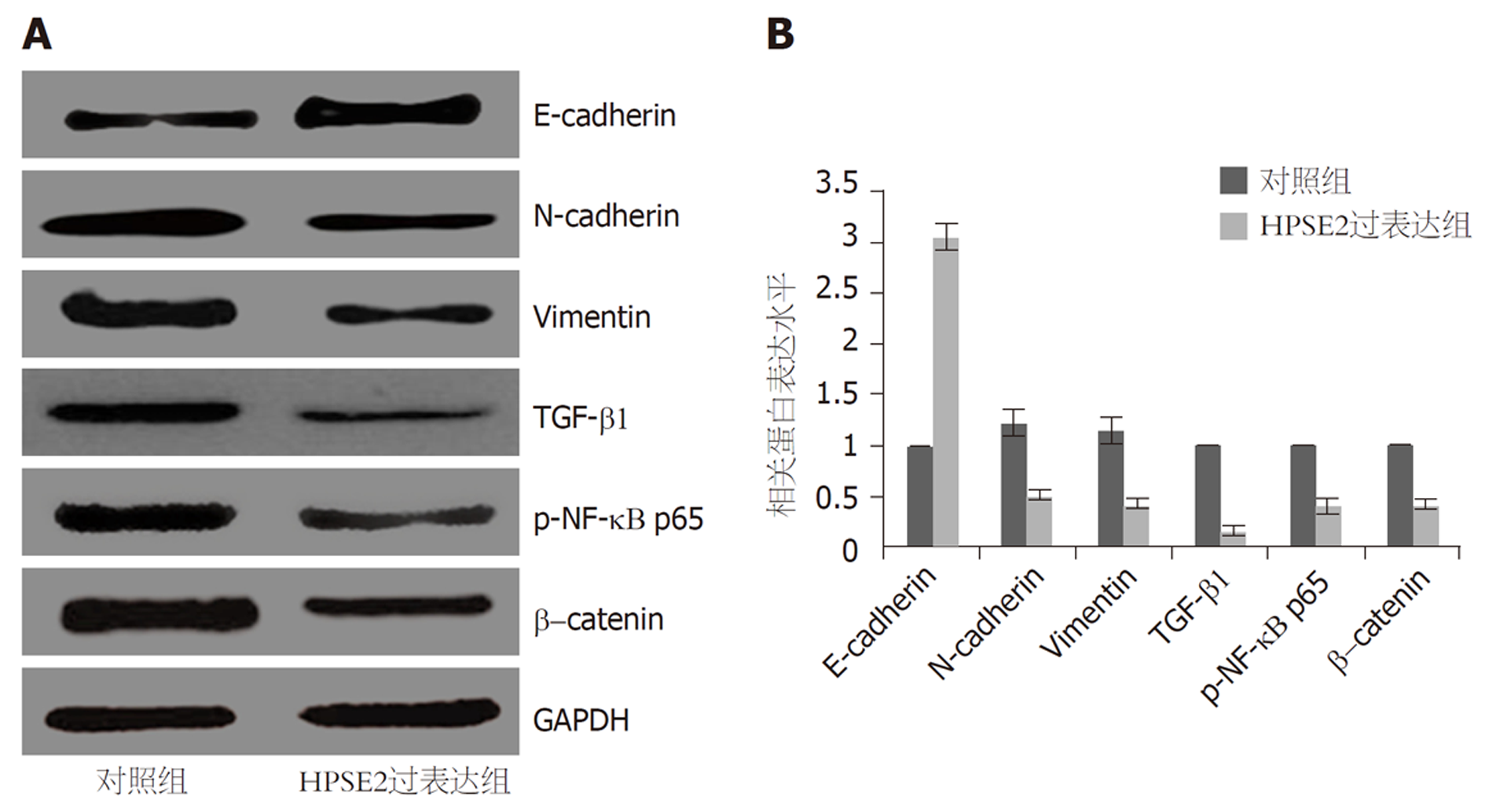
与对照组比较, HPSE2过表达组N-cadherin、Vimentin、TGF-β1、p-NF-κB p65、β-catenin表达水平均明显降低, E-cadherin表达水平明显升高(P<0.01). 见图6, 表8.
| 分组 | E-cadherin | N-cadherin | Vimentin | TGF-β1 | p-NF-κB p65 | β-catenin |
| 对照组 | 1.00±0.01 | 1.23±0.14 | 1.15±0.14 | 1.01±0.02 | 1.01±0.01 | 1.00±0.01 |
| HPSE2过表达组 | 3.05±0.12 | 0.51±0.05 | 0.42±0.08 | 0.18±0.03 | 0.41±0.08 | 0.44±0.06 |
| t | 41.701 | 11.864 | 11.090 | 56.387 | 18.230 | 22.551 |
| P | <0.001 | <0.001 | <0.001 | <0.001 | <0.001 | <0.001 |
胃癌是一种发病机制较为复杂的疾病, 研究发现, 其发病可能与吸烟、饮酒、幽门螺旋杆菌感染、胃溃疡、精神心理状态、饮食习惯等多种因素综合作用的结果. 其发病率较高, 且由于肿瘤的远处转移, 使患者的死亡率明显升高[4]. 因此, 抑制肿瘤细胞的侵袭及转移可以作为胃癌治疗研究中的重要环节. HPSE2作为HPSE的同源基因, 与HPSE有着相反的生物学特性, 其能够抑制肝素酶活性, 抑制多种肿瘤的生长. 有研究发现, HPSE2在前列腺、乳腺、卵巢等多种组织中均有表达. Zhang等[5]在乳腺癌的研究中发现, HPSE2在乳腺癌组织中的表达水平明显降低. Zheng等[6]在膀胱癌的研究中发现, HPSE2在膀胱癌细胞中的表达水平明显降低, 而上调HPSE2的表达后, 癌细胞增殖及迁移能力均明显降低. HPSE2可能在抑制肿瘤血管生成、促进肿瘤细胞分化等方面扮演着重要角色. 本研究主要对HPSE2在胃癌细胞中的相关作用及机制进行了探讨分析.
细胞进入无限增殖状态为肿瘤发生的标志, 而相关研究表明, 肿瘤不仅一种细胞增殖及分化异常的疾病, 也是一种细胞凋亡异常的疾病[7]. 细胞凋亡减少、生存期延长, 细胞大量堆, 其可能是胃癌发生、发展的基础. 本研究中通过测定胃癌MKN-28细胞增殖及凋亡能力的变化, 发现, HPSE2过表达能够明显抑制胃癌细胞增殖, 促进细胞凋亡. Bax是一种促凋亡基因, 能够拮抗Bcl-2蛋白抑制凋亡的作用. 有研究发现[8], 当细胞内Bax表达水平明显升高时, 凋亡细胞明显增多. Bcl-2是一种原癌基因, 能够抑制有多种细胞毒因素引起的细胞死亡. 有研究发现[9], Bcl-2能够增强细胞对大多数DNA损伤因子的抵抗性, 抑制大多数化疗药物引起的靶细胞凋亡. Suivivin属于凋亡抑制蛋白家族成员之一, 其在多种肿瘤组织中呈高表达. 有研究发现[10], Suivivin表达水平与胃癌严重程度明显相关, 其对判断患者预后具有重要的指导作用. Suivivin可以作为判断患者预后及复发的重要指标.
侵袭与迁移是肿瘤的重要特征, 也是影响患者治疗的重要原因. 研究证实, 上皮间充质转化(epithelial mesenchymal transition, EMT)在肿瘤的发生、转移过程中扮演着重要角色[11]. E-cadherin作为TGF-β1的下游蛋白, 是EMT的一种关键分子, 能够维持细胞间连接的稳定性, 维持细胞骨架与连接支架的稳定. E-cadherin表达水平的降低即为EMT发生的标志[12]. Vimentin是一种中间丝纤维蛋白, 研究发现, 其表达水平与肿瘤分化程度及侵袭能力呈明显负相关[13]. 本研究结果表明, 上调HPSE2表达能够明显抑制胃癌细胞发生EMT现象, 抑制细胞侵袭及迁移能力.
众多研究表明, 在胃癌的发生、发展中多条信号通路参与其中, 调控细胞的活化增殖、细胞因子释放、细胞外基质的合成与降解[14,15]. 其中NF-κB是一种核转录蛋白, 能够协调多种基因的表达, 影响机体内的细胞分化、细胞凋亡及肿瘤生长等多种生物学功能[16]. 据相关报道, p65与p50的二聚体为NF-κB最重要的修饰方式之一, 而p65的磷酸化为NF-κB最重要的修饰方式之一[17]. Wnt/β-catenin信号通路是一种具有高度保守性的信号调节系统, 存在于多种哺乳动物中, 参与细胞的生长、分化及迁移等. β-catenin为Wnt/β-catenin信号通路经典通路的关键效应分子, 正常情况下, β-catenin主要存在于细胞膜处, 在细胞骨架与钙黏蛋白的结合中起连接作用, 而当Wnt/β-catenin信号通路被激活后, β-catenin表达明显增加, 进而影响细胞的增殖、侵袭及迁移等生物学过程[18]. 本研究结果表明, 上调HPSE2的表达能够抑制NF-κB及Wnt/β-catenin信号通路的激活.
综上所述, 上调HPSE2表达能够明显抑制细胞增殖、侵袭及迁移, 抑制细胞发生EMT, 促进细胞凋亡, 其可能是通过抑制NF-κB及Wnt/β-catenin信号通路的激活实现.
随着医医疗水平的提高, 胃癌的早期诊断及治疗取得了明显成效, 但患者的死亡率仍居高不下, 且预后较差, 侵袭与转移是影响患者预后的重要因素. 因此, 探究胃癌的发病机制, 抑制胃癌细胞的侵袭转移, 改善患者预后意义重大. 乙酰肝素酶(heparanase, HPSE)是一种内源性糖苷内切酶, 有研究发现, 期在胃癌组织中的表达水平明显升高. 但关于乙酰肝素酶2 (heparanase, HPSE2)在胃癌中的相关作用及其作用机制尚不明确. 本研究旨在HPSE2在胃癌中的相关作用及其作用机制.
分析HPSE2通过抑制核转录因子κB (NF-κB)、wnt基因/β-连环蛋白(Wnt/β-catenin)信号通路调控胃癌细胞恶性生物学行为的机制.
为明确HPSE2在胃癌恶性进程中的作用, 我们通过免疫组化法测定胃癌组织及癌旁正常组织HPSE2表达水平, 探讨期潜在的临床价值, 后通过质粒转染获得过表达HPSE2的胃癌细胞株, 分析HPSE2表达水平对胃癌细胞生物学行为的影响, 并进行下游基因与分子通路的筛选验证, 进一步揭示HPSE2发挥肿瘤调控作用的分子机制, 为探索HPSE2可否作为胃癌治疗的新靶点提供初步理论基础.
收集2019-09/2021-04期间在本院进行手术切除治疗的74例胃癌患者的胃癌组织及癌旁正常组织, 测定HPSE2的表达水平. 将人胃癌细胞系MKN-28细胞进行传代培养并转染, 获得HPSE2过表达组及对照组. 测定各组细胞增殖能力、细胞凋亡率、细胞侵袭及迁移能力, 并测定细胞中HPSE2、E-cadherin、N-cadherin、Vimentin、TGF-β1、p-NF-κB p65、β- catenin表达水平变化.
与癌旁正常组织对比, 胃癌组织中HPSE2表达水平明显降低(P<0.01). 与对照组比较, HPSE2过表达组HPSE2表达水平明显升高(P<0.01). 两组1 d时细胞增殖能力无明显差异(P>0.05); 与2 d与对照组比较, HPSE2过表达组细胞增殖能力明显降低(P<0.05或P<0.01). 与对照组比较, HPSE2过表达组细胞凋亡率及Bax、E-cadherin表达水平均明显升高, 细胞侵袭、迁移能力及Bax、Suivivin、N-cadherin、Vimentin、TGF-β1、p-NF-κB p65、β- catenin表达水平均明显降低(P<0.01).
上调HPSE2表达能够明显抑制细胞增殖、侵袭及迁移, 抑制细胞发生EMT, 促进细胞凋亡, 其可能是通过抑制NF-κB及Wnt/β-catenin信号通路的激活实现.
本次研究中, 我们发现, 上调HPSE2表达能够明显抑制细胞增殖能力(MTT实验证明)、侵袭能力(Transwell实验证明)及迁移能力(Transwell实验证明), 促进细胞凋亡能力(流式细胞仪及蛋白质印记法测定证明). 我们进一步分析了这种现象发生的原因, 发现, HPSE2处理后的MKN-28细胞中p-NF-κB p65、β-catenin表达水平均明显下降. 表明HPSE2在抗肿瘤, 尤其是抑制胃癌细胞增殖、侵袭、迁移房间具有一定作用, 为今后胃癌的临床治疗用药的选择提供了帮助. 接下来本实验将继续挖掘HPSE2对胃癌细胞中各个通路的影响及其机制, 并将其应用至在体实验模型中证明, 从而能够更全面的探索HPSE2对胃癌细胞基因表达差异的影响.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C, C
D级 (一般): 0
E级 (差): 0
科学编辑: 刘继红 制作编辑:张砚梁
| 1. | Logan RP. Helicobacter pylori and gastric cancer. Lancet (London, England). 2019;344:1078-1079. |
| 2. | Kiyan Y, Tkachuk S, Kurselis K, Shushakova N, Stahl K, Dawodu D, Kiyan R, Chichkov B, Haller H. Heparanase-2 protects from LPS-mediated endothelial injury by inhibiting TLR4 signalling. Sci Rep. 2019;9:13591. [PubMed] [DOI] |
| 3. | Freeman C, Parish CR. A rapid quantitative assay for the detection of mammalian heparanase activity. Biochem J. 1997;325:229-237. [PubMed] [DOI] |
| 4. | Spolverato G, Pawlik TM. Clinicopathological evaluation of recurrence in early gastric cancer. American Journal of Surgery. 2019;157:202-207. |
| 5. | Zhang GL, Gutter-Kapon L, Ilan N, Batool T, Singh K, Digre A, Luo Z, Sandler S, Shaked Y, Sanderson RD, Wang XM, Li JP, Vlodavsky I. Significance of host heparanase in promoting tumor growth and metastasis. Matrix Biol. 2020;93:25-42. [PubMed] [DOI] |
| 6. | Zheng F, Wang M, Li Y, Huang C, Tao D, Xie F, Zhang H, Sun J, Zhang C, Gu C, Wang Z, Jiang G. CircNR3C1 inhibits proliferation of bladder cancer cells by sponging miR-27a-3p and downregulating cyclin D1 expression. Cancer Lett. 2019;460:139-151. [PubMed] [DOI] |
| 7. | Wang X, Guo J, Dai M, Wang T, Yang T, Xiao X, Tang Q, Zhang L, Jia L. PLOD2 increases resistance of gastric cancer cells to 5-fluorouracil by upregulating BCRP and inhibiting apoptosis. J Cancer. 2020;11:3467-3475. [PubMed] [DOI] |
| 8. | Yuan H, Zhang J, Li F, Li W, Wang H. Sinomenine exerts antitumour effect in gastric cancer cells via enhancement of miR-204 expression. Basic Clin Pharmacol Toxicol. 2019;125:450-459. [PubMed] [DOI] |
| 9. | Zhuang K, Guo H, Tang H, Yan Y, Yang Z, Wang Y. Suppression of FAK by nexrutine inhibits gastric cancer progression. Life Sci. 2020;257:118100. [PubMed] [DOI] |
| 10. | Nolen LD, Vindigni SM, Parsonnet J; Symposium leaders. Combating Gastric Cancer in Alaska Native People: An Expert and Community Symposium. Gastroenterology. 2020;158:1197-1201. [PubMed] [DOI] |
| 11. | Yu J, Zhou Z, Wei Z, Wu J, OuYang J, Huang W, He Y, Zhang C. FYN promotes gastric cancer metastasis by activating STAT3-mediated epithelial-mesenchymal transition. Transl Oncol. 2020;13:100841. [PubMed] [DOI] |
| 12. | Eom BW, Won Ryu K, Man Yoon H, Kook MC. Predictive value of E-cadherin and EpCAM for detection of metastatic lymph node in early gastric cancer. Chin J Cancer Res. 2020;32:614-620. [PubMed] [DOI] |
| 13. | Chen XB, Li W, Chu AX. MicroRNA-133a inhibits gastric cancer cells growth, migration, and epithelial-mesenchymal transition process by targeting presenilin 1. J Cell Biochem. 2019;120:470-480. [PubMed] [DOI] |
| 14. | Wang L, Bo X, Yi X, Xiao X, Zheng Q, Ma L, Li B. Exosome-transferred LINC01559 promotes the progression of gastric cancer via PI3K/AKT signaling pathway. Cell Death Dis. 2020;11:723. [PubMed] [DOI] |
| 15. | Liu H, Liu Y, Zhang X, Wang X. Current Study of RhoA and Associated Signaling Pathways in Gastric Cancer. Curr Stem Cell Res Ther. 2020;15:607-613. [PubMed] [DOI] |
| 16. | Zheng J, Zhang H, Ma R, Liu H, Gao P. Long non-coding RNA KRT19P3 suppresses proliferation and metastasis through COPS7A-mediated NF-κB pathway in gastric cancer. Oncogene. 2019;38:7073-7088. [PubMed] [DOI] |
| 17. | Wang F, Zhang Y, Qu X, Wang Z, Tao Yang. Effect of hyperoside on the proliferation and apoptosis of human gastric cancer cells by inhibiting the NF-κB pathway. Acta Medica Mediterranea. 2020;36:471-475. [DOI] |
| 18. | Choi MY, Cho M H, Chang H J, Lee SN, Lee KE. Investigation of enhanced antitumor effects via co-inhibition of Wnt/β-catenin and PI3K/Akt/mTOR signaling pathways in human gastric cancer. Journal of Clinical Oncology. 2019;37:e15553-e15553. [DOI] |