修回日期: 2019-03-26
接受日期: 2019-04-16
在线出版日期: 2019-05-08
结肠癌是严重威胁人类生命健康的常见病. 近年来, 结肠癌的发病率呈明显上升趋势, 其复发转移及化疗耐药则是影响结直肠癌患者长期生存的首要障碍, 越来越多的研究提示表明miRNA参与了结肠癌的发病与耐药.
探讨miR-20b在结肠癌细胞耐药中的作用, 并对其机制进行了研究.
通过细胞活性实验确认了普通结肠癌细胞(SW480)与耐药细胞(SW480/5-FU)对5-氟尿嘧啶(5-fluorouracil, 5-FU)的耐药性. 通过逆转录实验, 检测SW480/5-FU细胞中miR-20b的表达水平. 根据结果对SW480/5-FU细胞转染转入外源性miR-20b, 观察其耐药性, 转染和侵袭能力. 最后我们通过免疫印迹法检测了几种Janus激酶/信号转导与转录激活子(janus kinase/signal transducer and activator of tran-ions, JAK/STAT)信号通路在其中的变化.
在细胞活性实验中, 相比于SW480, SW480/5-FU表现出对5-FU明显的耐药性. 在逆转录实验中, SW480/5-FU细胞中miR-20b表达水平明显下调, 将外源性miR-20b转染入SW480/5-FU细胞中后, 其耐药性明显下降, 并且其转染和侵袭能力明显下降. 免疫印迹法实验显示, 转染miR-20b后的SW480/5-FU细胞络氨酸激酶(janus kinase, JAK)与转录因子(signal transducers and activators of transcription, STAT)磷酸化比例下调, JAK/STAT3信号通路被抑制.
SW480/5-FU对5-FU的耐药性可由miR-20b介导, 其机制可能与JAK-STAT信号通路表达下调相关.
核心提要: 结肠癌的复发转移及化疗耐药直接影响结直肠癌患者寿命, 越来越多的研究提示miRNA参与了结肠癌的耐药过程. 在本研究中, 我们对miR-20b在结肠癌细胞耐药中的作用进行了探讨. 相比于普通结肠癌细胞, 耐药细胞系细胞中miR-20b表达水平明显下调. 我们的结果表明耐药细胞系细胞对5-氟尿嘧啶的耐药性可由miR-20b介导, 其机制与Janus激酶/信号转导与转录激活子信号通路表达下调相关.
引文著录: 余灵芝, 戴丹平, 项秀瑶. miR-20b通过抑制JAK/STAT3信号通路逆转结肠癌细胞5-FU耐药性的研究. 世界华人消化杂志 2019; 27(9): 544-550
Revised: March 26, 2019
Accepted: April 16, 2019
Published online: May 8, 2019
Colon cancer is a common disease that seriously threatens human life and health. In recent years, the incidence of colon cancer has been increasing significantly. Recurrence, metastasis, and chemotherapy resistance are the main obstacles to long-term survival of patients with colorectal cancer. More and more studies suggest that microRNAs are involved in the pathogenesis and drug resistance of colon cancer.
To investigate the role of microRNA-20b in drug resistance of colon cancer cells and the underlying mechanism.
The resistance of common colon cancer cells (SW480) and drug-resistant cells (SW480/5-FU) to 5-fluorouracil (5-FU) was confirmed by MTT assay. The expression of microRNA-20b in SW480/5-FU cells was detected by reverse transcription-polymerase chain reaction (RT-PCR). SW480/5-FU cells were transfected with exogenous microRNA-20b, and their drug resistance, migration, and invasion were observed. Finally, we detected the changes of several members of the Janus kinase/signal transducer and activator of transcription (JAK-STAT) signaling pathway by immunoblotting.
Compared with the normal colon cancer cell line (SW480), the drug-resistant cell line (SW480/5-FU) showed obvious resistance to 5-FU. The expression of microRNA-20b in SW480/5-FU cells was significantly down-regulated. When exogenous microRNA-20b was transfected into SW480/5-FU cells, the drug resistance, migration, and invasion of SW480/5-FU cells decreased significantly. Immunoblotting assay showed that the phosphorylation of JAK and STAT in SW480/5-FU cells transfected with microRNA-20b was decreased. The JAK/STAT3 signaling pathway was inhibited after transfection with microRNA-20b.
The resistance of SW480/5-FU to 5-FU is mediated by microRNA-20b, which may be related to the inhibition of the JAK-STAT signaling pathway.
- Citation: Yu LZ, Dai DP, Xiang XY. MiR-20b reverses 5-FU resistance in colon cancer cells by inhibiting JAK/STAT3 signaling pathway. Shijie Huaren Xiaohua Zazhi 2019; 27(9): 544-550
- URL: https://www.wjgnet.com/1009-3079/full/v27/i9/544.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v27.i9.544
结肠癌是一种常见的肿瘤, 在世界范围内均造成极大的公共健康问题负担. 近几十年来, 我国结肠癌的发病率和死亡率呈上升趋势[1]. 5-氟尿嘧啶(5-fluorouracil, 5-FU)是广泛用于结肠癌治疗的主流化疗药物[2,3]. 5-FU的药理作用是通过阻断胸腺嘧啶的合成来阻断DNA复制的[4,5], 5-FU可以影响细胞周期从而导致细胞凋亡[6]. 然而许多结肠癌患者在使用5-FU化疗后表现出耐药性和高复发率. 因此, 耐药性被认为是结肠癌化疗治疗中最大的障碍之一, 目前迫切需要提高结肠癌化疗治疗的敏感性和预防化疗耐药性的新策略.
miRNA是一类高度保守的小型非编码RNA, 通过抑制mRNA的翻译和降解来调节基因表达[7]. 越来越多的证据表明, miRNA在细胞功能中起重要作用, 在结肠癌细胞中, 许多miRNAs的表达失调与结肠癌细胞对5-FU的耐药性有关[8-10], 但具体机制并不清楚. 先前的研究已经表明, 特异性靶向miRNA可以通过降低癌细胞耐药性从而改善化疗效果, 从而为癌症治疗开辟新的途径[11]. 近年来研究发现, miR-20b在许多类型的癌组织中表达下调. 此外, miR-20b通过介导细胞周期调控和SP-1介导的MMP-2表达抑制膀胱癌EJ细胞的增殖、迁移和侵袭[12]. 研究发现miR-20b在结肠癌中的表达比正常结肠组织低, 表明miR-20b在结肠癌细胞发展中起重要作用[13]. 然而, miR-20b在结肠癌细胞耐药中的作用及机制尚不清楚.
鉴于对耐药机制的更好理解可以为结肠癌的治疗提供新的见解, 我们使用对5-FU敏感或耐药的两个同源细胞系SW480进行了研究, 探讨了miR-20b在结肠癌细胞对5-FU化疗耐药中的作用. 我们的研究结果提示, miR-20b通过调节Janus激酶/信号转导与转录激活子(janus kinase/signal transducer and activator of tran-ions, JAK/STAT)信号通路从而调节了SW480对5-FU的耐药性.
结肠癌细胞系SW480, 购自美国类型培养物收藏中心(ATCC; Manassas, VA, 美国), 细胞培养用5-FU、无血清培养基、胰岛素、表皮生长因子以及转铁蛋白均购自于美国Sigma-Aldrich. 细胞活力测定中MTT、McCoy5A无血清培养基和二甲基亚砜购自于美国Sigma-Aldrich, 细胞活力测定试剂盒CellTiter 96 AQueous One Solution Cell Proliferation Assay购自于美国Promega. RNA干扰实验中miR-20b模拟物及其阴性对照购自中国RiboBio, RNA寡核苷酸转染试剂Lipofectamine®2000购自于美国Invitrogen, Opti-MEM®培养基购自于美国Gibco. 逆转录实验中, TRIzol®试剂购自于美国Invitrogen, 逆转录试剂盒以及SYBR® Premix Ex Taq™ II购自于日本TaKaRa Bio, 寡聚体(dT)12-18和miRNA特异性引物由中国RiboBio合成. 免疫印迹实验中用到的RIPA裂解液购自于中国Solarbio, BCA试剂盒购自于美国Thermo, 其余相关试剂以及细胞迁移及侵袭相关试剂均购自于美国Sigma-Aldrich.
1.2.1 细胞培养: 结肠癌细胞系SW480对5-FU敏感, SW480/5-FU细胞系对5-FU具有抗性, 通过将SW480细胞与水平不断增加的5-FU共同孵育而产生. 在37 ℃和5%CO2浓度下, McCoy5A无血清培养基培养两种细胞, 培养基中加入20 μg/mL胰岛素、10 ng/mL表皮生长因子和4 g/mL转铁蛋白. 持续药物处理耐药细胞系.
1.2.2 细胞活力测定: 将细胞以2×104细胞/100 mL的浓度在96孔板中培养, 并用5-FU(分别为5、10、15和20 μg/mL)处理指定的时间以评估增殖. 培养72 h后存活的细胞用MTT染色2 h. 用分光光度计测定二甲基亚砜溶解在570 nm处的吸光度. 细胞活力测定使用CellTiter 96 AQueous One Solution Cell Proliferation Assay试剂盒, 根据说明将OD的比率计算出细胞存活率.
1.2.3 miRNA和RNA干扰: miR-20b模拟物及其阴性对照通过RiboBio公司合成. RNA寡核苷酸转染在Opti-MEM®培养基中利用Lipofectamine® 2000进行转染, 根据说明操作. miR-20b最终浓度为100 nmol/L, 48 h后测定其表达水平.
1.2.4 RNA提取和逆转录PCR: 根据说明, 用TRIzol®试剂从细胞培养物中提取总RNA. 使用PrimeScript™逆转录试剂盒进行逆转录. 加入寡聚体(dT)12-18或miRNA特异性引物启动cDNA合成. PCR在实时PCR系统(Applied Biosystems, 美国)中进行, PCR体系中添加SYBR® Premix Ex Taq™ II.
1.2.5 免疫印迹试验: 检测蛋白表达. 首先用RIPA裂解液裂解细胞, 取全蛋白. 利用BCA法将蛋白样品定量至统一浓度后, 取20 μg蛋白样品通过十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离总蛋白. 电泳结束后, 将蛋白质转移至甲醇预活化的PVDF膜, 转膜条件为100 V/2 h. 转模结束后利用5%脱脂牛奶室温下封闭1 h并以1:1000的稀释比例孵育一抗并4 ℃过夜. 第二天, 以TBST洗涤后室温孵育相应的HRP标记的二抗1 h, 以TBST洗涤后利用化学发光成像仪显影.
1.2.6 细胞迁移和侵袭能力实验: 将Matrigel 1:8稀释包被在Transwell小室底部膜的上室面, 置于37 ℃ 30 min使Matrigel聚合成凝胶, 使用前将基底膜水化. 消化后的细胞离心弃去培养液并重悬, 调整细胞密度至5×105/mL. 取悬液100 μL加入Transwell小室, 常规培养24 h. 取出Transwell小室, 弃去孔中培养液, PBS洗2遍后甲醇固定30 min. 0.1%结晶紫染色20 min, 400倍显微镜下记数.
统计学处理 使用Graphpad Prism 7.0软件对数据进行分析. 方差分析后进行单因素方差分析或非配对t检验. 数据表示为mean±SD. P<0.05认为有统计学差异.
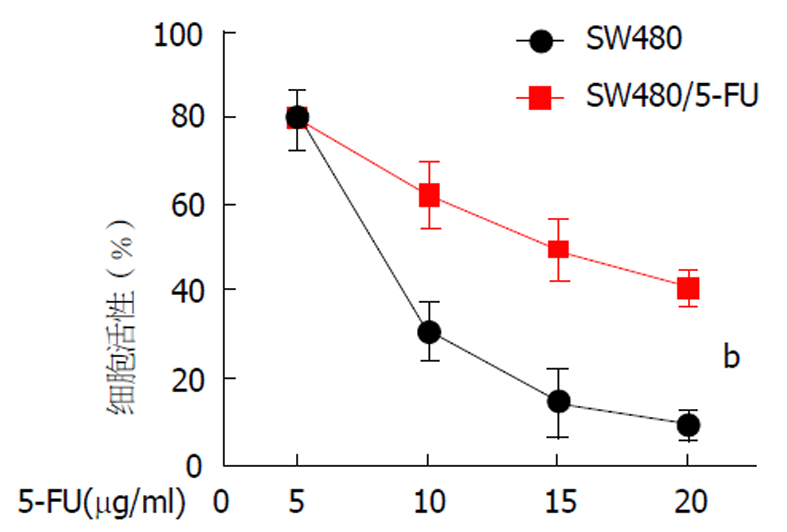
为了解结肠癌细胞对5-FU耐药的机制, 我们测定了5-FU对SW480与SW480/5-FU细胞生长的影响, 发现5-FU以剂量依赖的方式降低了结肠癌细胞的活性, 5-FU对SW480细胞的抑制作用比SW480/5-FU细胞更为明显(图1). 两组细胞分别用5、10、15或20 μg/ml 5-FU处理SW480和SW480/5-FU细胞72 h后进行观察, 随着5-FU浓度的增加, SW480相比于SW480/5-FU细胞存活率下降明显. 当5-FU浓度为15 μg/mL和20 μg/mL时, SW480细胞存活率分别为SW480/5-FU细胞的31.56%和16.27%, 差异具有统计学意义(P<0.001).
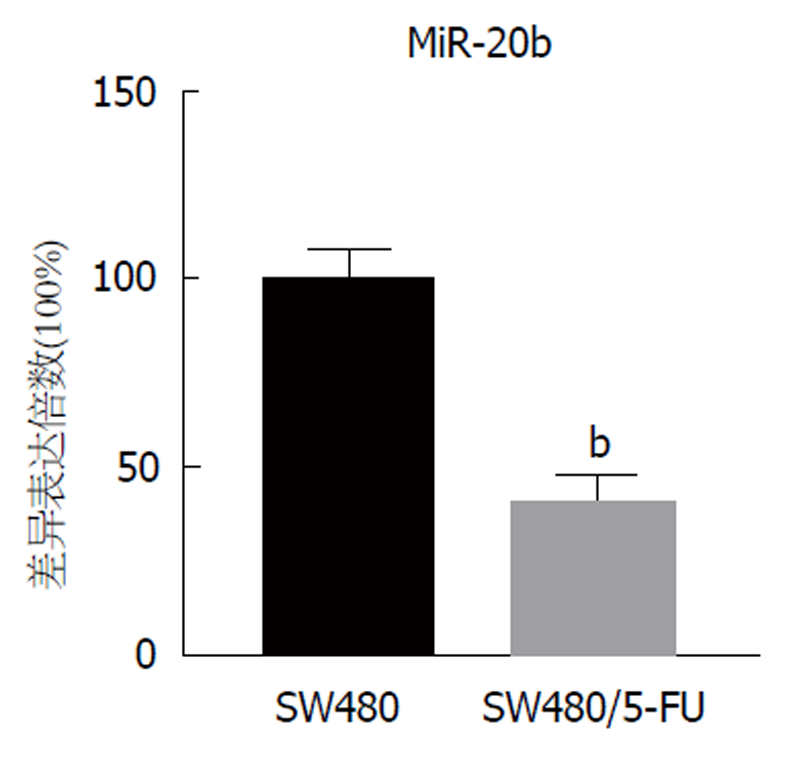
随后我们检测了SW480与SW480/5-FU细胞中miR-20b表达量的差异, 结果显示, 相比于SW480细胞, SW480/5-FU细胞中miR-20b表达量明显下降, 具有统计学差异(P<0.01, 图2), 提示着miR-20b可能在SW480/5-FU细胞对5-FU的耐药性中发挥作用.
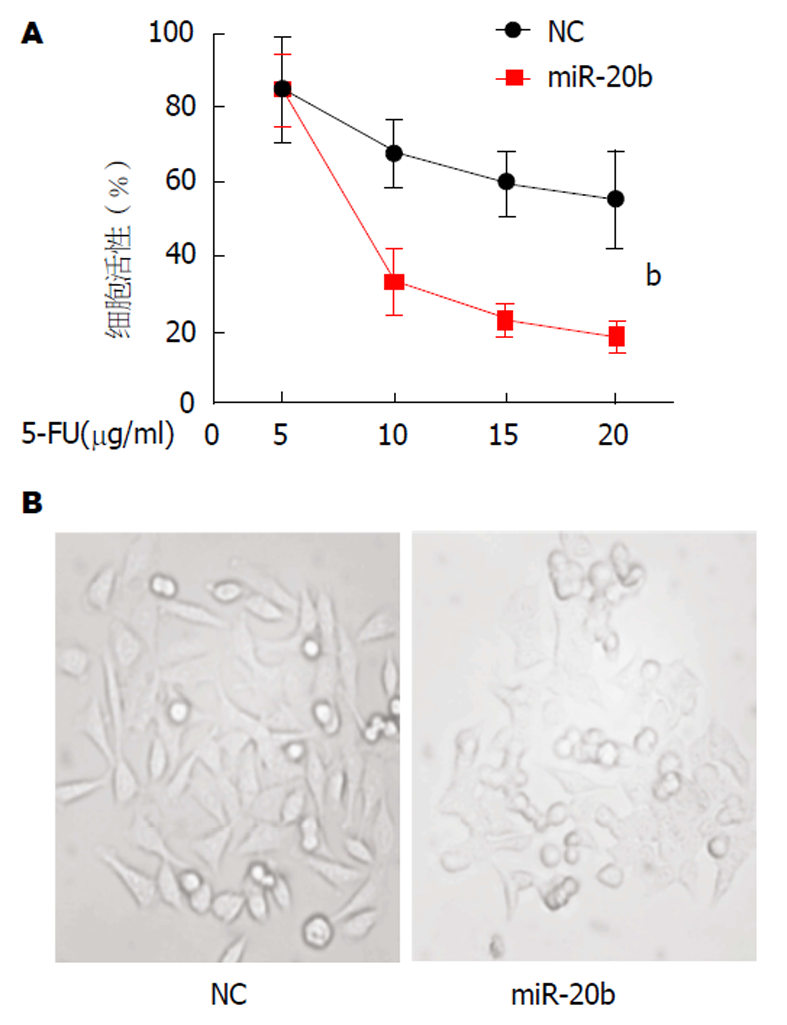
为了进一步验证miR-20b在SW480/5-FU细胞耐药性中的作用, 我们将外源性miR-20b类似物转染进入SW480/5-FU细胞中, 相比于对照组, 转染miR-20b后的细胞活性明显降低(图3A). 观察细胞形态发现, 转染miR-20b后的SW480/5-FU细胞表现出轮廓皱缩, 突起减少等增殖能力减弱特征(图3B), 这些证据表明miR-20b的过表达可减弱细胞的增殖状态和活性.
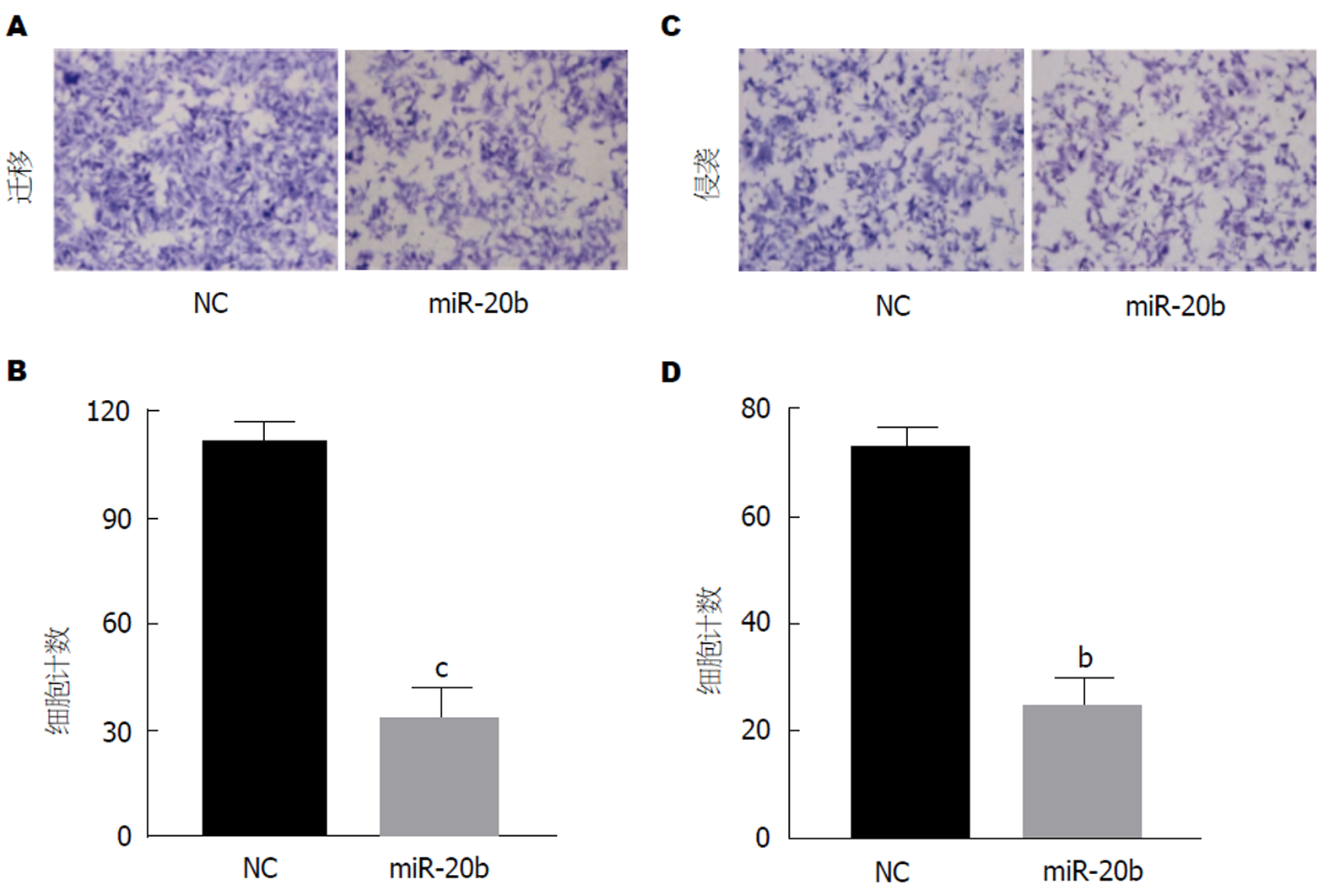
随后, 我们进一步观察了转染miR-20b后SW480/5-FU细胞迁移和侵袭能力的改变. 将外源性miR-20b转染入SW480/5-FU细胞, 用Transwell法检测细胞迁移和侵袭. 结果显示miR-20b抑制了SW480/5-FU细胞的迁移和侵袭, 相比于对照组, 细胞计数明显降低, 在细胞迁移实验中, 转染miR-20b组相比于对照组细胞计数下降了63.5%, 在细胞侵袭实验中, 转染miR-20b组下降了60.2%, 结果具有统计学差异(图4).
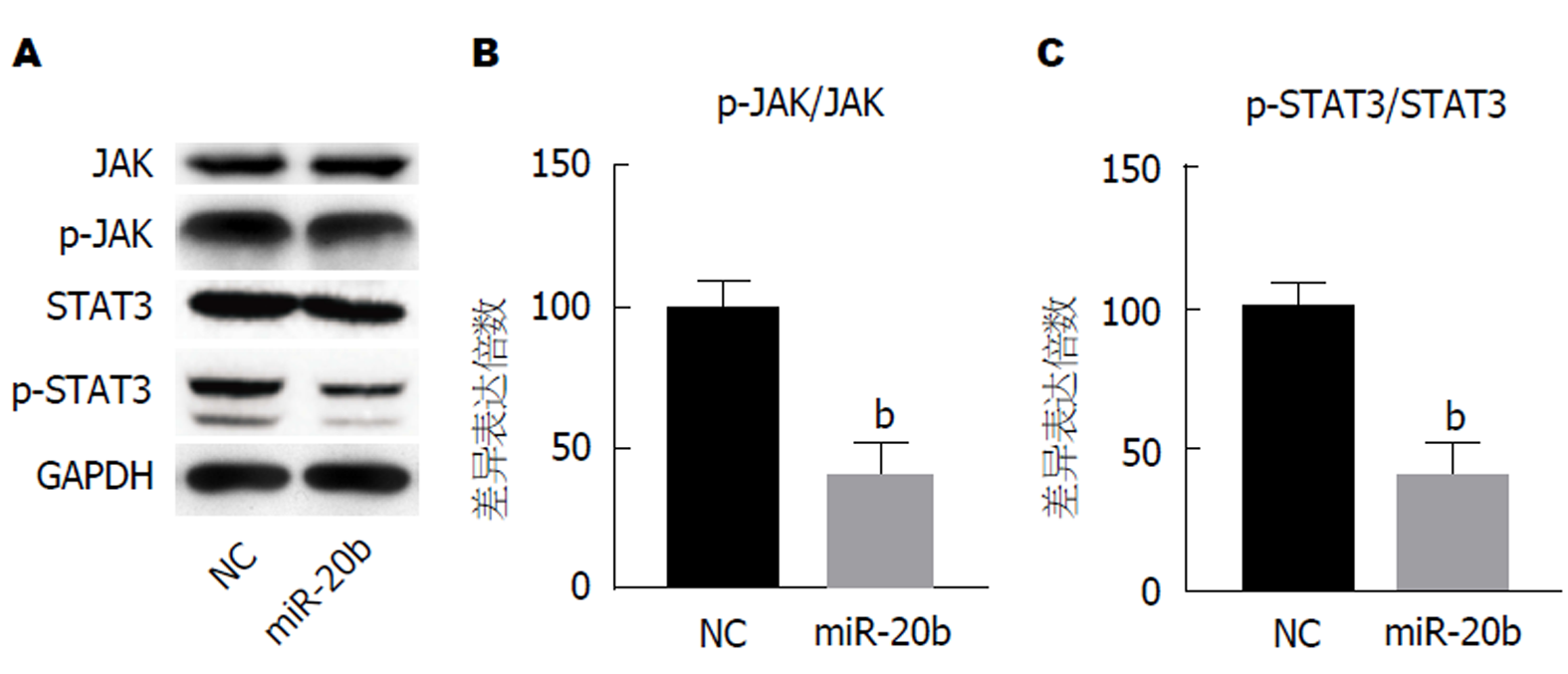
JAK/STAT3在细胞的增殖及癌症耐药中发挥重要作用[14], 为了探索miR-20b对调节SW480/5-FU细胞耐药性及影响增殖作用的机制, 我们对SW480/5-FU细胞中JAK/STAT3信号通路进行了检测. 通过蛋白质免疫印迹实验发现, 转染了miR-20b后的SW480/5-FU细胞中, JAK/STAT3信号通路中的关键蛋白的磷酸化水平显著下降. 我们发现相对于对照组, miR-20b过表达组JAK、STAT3含量基本无变化而p-JAK、p-STAT3表达均下调(图5A), 差异有统计学意义, 提示miR-20b抑制SW480/5-FU细胞的增殖和迁移可能是通过抑制JAK/STAT3信号通路激活而介导的.
结肠癌是常见的、病发于结肠部位的恶性肿瘤. 5-FU被广泛认为是结肠癌治疗的标准疗法, 临床上通常与叶酸钙联合使用. 虽然5-FU能使结肠癌患者的中位生存期提高近两年[15], 但5-FU的耐药性是结肠癌治疗过程中的一个严重问题. 为了探讨结肠癌细胞对5-FU的耐药机制, 我们从结肠癌细胞系SW480建立了对5-FU耐药细胞系SW480/5-FU, 我们的实验发现此细胞系对5-FU不敏感. 随后, 我们通过逆转录实验发现, SW480/5-FU细胞中miR-20b表达量明显下降.
miRNA是一组含量丰富的内源性小分子非编码RNA, 通过翻译抑制或降解其靶mRNA来发挥蛋白编码基因的调节作用[16]. 近年来, 越来越多的证据表明, miRNA在癌症发生中起着重要作用, 这其中有许多在结肠癌细胞中异常表达[17-19]. 有报道认为, miRNA可以作为筛选结肠癌的标志物[20,21]. 关于miRNA在结肠癌耐药性方面的研究, 有人曾报道了microRNA-425-5p通过调节细胞程序性死亡来降低结肠癌细胞对5-FU耐药性[22], 然而miR-20b在结肠癌中的耐药性研究却罕见报道. 为了探究miR-20b在SW480/5-FU细胞耐药性的作用, 我们将外源性miR-20b转染入SW480/5-FU细胞, 观察其细胞活性以及其对SW480/5-FU细胞迁移和侵袭的影响. 将外源性miR-20b转入SW480/5-FU细胞后我们发现, 相比于对照组其耐药性降低, 细胞迁移和侵袭能力下降.
细胞内信号分子的异常激活是癌细胞的特性之一, 这其中就包括JAK/STAT信号通路. JAK/STAT信号通路主要调节胚胎发育, 参与干细胞维持、造血和炎症反应等过程. 活化后JAK激活STAT, STAT随后形成二聚体并转移到细胞核. STAT二聚体与特定的启动子序列结合并调节控制细胞增殖、分化和凋亡等细胞过程的基因转录[23]. 近些年, 有许多报道证明了JAK/STAT信号通路的异常激活与多种癌症发病具有相关性, 这其中就包括结肠癌[24,25]. 然而, JAK/STAT信号通路在结肠癌耐药性的作用并不明晰. 为了证明miR-20b是否通过JAK/STAT信号通路调控了SW480/5-FU细胞的耐药性, 我们检测了SW480/5-FU细胞中JAK/STAT3信号通路中相关蛋白表达情况. 我们发现, 转染了外源性miR-20b的SW480/5-FU细胞中, p-JAK、p-STAT3的表达均下调, 而JAK、STAT3变化不大, 因此p-JAK/JAK、p-STAT3/STAT3比值显著下降, 说明此信号通路被抑制.
总之, 本研究发现SW480/5-FU细胞相比于SW480细胞miR-20b表达量明显下降, 转染外源性的miR-20b后, SW480/5-FU细胞耐药性明显下降, 细胞迁移和增殖能力相比于对照组明显降低. 因此, 我们有理由认为miR-20b可降低结肠癌细胞对5-FU的耐药性. 蛋白免疫印迹实验结果提示miR-20b可能通过抑制JAK/STAT3信号通路提高了SW480/5-FU细胞对5-FU的敏感性. 我们的研究结果提示了一种结肠癌细胞对5-FU耐药的新机制, 为结肠癌细胞耐药性的分子病理机制提供了新的解释, 并为其治疗提供了潜在靶点.
结肠癌是我国最常见的恶性肿瘤之一, 虽然结肠癌的诊疗取得了较大的进展, 但化疗的耐药性仍是临床治疗的难点, 严重影响着患者预后.
MiRNA可通过抑制相关蛋白mRNA的翻译和降解来调节基因表达. 越来越多的研究表明, miRNA在结肠癌细胞中发挥重要作用. 以往的研究发现, 通过调节miRNA可以改变癌细胞对化疗药物的敏感性从而改善化疗效果, 这为癌症的治疗提供了新思路. 研究发现miR-20b在多种肿瘤组织中表达下调. 在结肠癌中miR-20b的表达比正常结肠组织低, 提示miR-20b的抑癌作用. miRNA与结肠癌细胞对5-氟尿嘧啶(5-fluorouracil, 5-FU)的耐药性的具体作用及机制并不清楚.
对耐药机制的新探索可以为结肠癌的治疗提供新的思路, 我们使用对5-FU敏感或耐药的两个同源细胞系SW480进行了研究, 探讨了miR-20b在结肠癌细胞对5-FU化疗耐药中的作用及机制.
通过药物筛选分选出普通结肠癌细胞(SW480)与耐药细胞(SW480/5-FU). 对两种细胞的miRNA水平进行检测, 寻找有差异的miRNA并进行干预. 在表对SW480/5-FU细胞转染转入外源性目标miRNA后, 观察对其耐药性及其他肿瘤生物特性的影响并寻找其中的机制.
耐药细胞系对5-FU表现出明显的耐药性. 逆转录实验结果表明耐药细胞系miR-20b表达明显下调, 将miR-20b转染入耐药细胞后, 显著降低了其耐药性, 并且降低了其转移和侵袭能力明. WB实验显示, 转染miR-20b后的耐药细胞络氨酸激酶(janus kinase, JAK)与转录因子(signal transduction and activator of transcription, STAT)磷酸化比例下调, JAK/STAT3信号通路被抑制.
SW480/5-FU对5-FU的耐药性可由miR-20b介导, 其机制与JAK-STAT信号通路表达下调相关.
结肠癌是美国癌症死亡的第三大原因. 早期结肠癌可以手术切除, 但晚期疾病则需要更多的靶向疗法. 研究结肠癌的研究人员长期以来被结肠癌的耐药性困扰, 传统化疗药物对阻断促进结肠癌进展的效果有限, 通过对miRNA调控这一新策略, 我们对结肠癌细胞耐药性的分子病理机制提供了新的解释, 并为其治疗提供了潜在靶点.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): 0
D级 (一般): D
E级 (差): 0
编辑: 崔丽君 电编:刘继红
| 3. | Longley DB, Harkin DP, Johnston PG. 5-fluorouracil: mechanisms of action and clinical strategies. Nat Rev Cancer. 2003;3:330-338. [PubMed] [DOI] |
| 4. | Murakami J, Lee YJ, Kokeguchi S, Tsujigiwa H, Asaumi J, Nagatsuka H, Fukui K, Kuroda M, Tanaka N, Matsubara N. Depletion of O6-methylguanine-DNA methyltransferase by O6-benzylguanine enhances 5-FU cytotoxicity in colon and oral cancer cell lines. Oncol Rep. 2007;17:1461-1467. [PubMed] [DOI] |
| 5. | Ruddick JA, Runner MN. 5-FU in chick embryos as a source of label for DNA and a depressant of protein synthesis. Teratology. 1974;10:39-45. [PubMed] [DOI] |
| 7. | Lin S, Gregory RI. MicroRNA biogenesis pathways in cancer. Nat Rev Cancer. 2015;15:321-333. [PubMed] [DOI] |
| 8. | 杨 光磊, 胡 岩芳, 胡 延伟, 王 钊, 张 仕东, 葛 国庆. 结肠癌细胞HIF-1α及MDR1 miRNA重组慢病毒干扰体系多药耐药研究. 实用癌症杂志. 2017;4:545-547. [DOI] |
| 10. | 路 丹, 王 文秀, 曲 迪, 孙 文吉, 郭 晓菲, 李 逸文. 细胞因子诱导的凋亡抑制因子1靶向miRNA预测及其在乳腺癌耐药细胞株中的表达. 肿瘤研究与临床. 2016;28:735-738. [DOI] |
| 11. | Park SL, Cho TM, Won SY, Song JH, Noh DH, Kim WJ, Moon SK. MicroRNA-20b inhibits the proliferation, migration and invasion of bladder cancer EJ cells via the targeting of cell cycle regulation and Sp-1-mediated MMP-2 expression. Oncol Rep. 2015;34:1605-1612. [PubMed] [DOI] |
| 15. | Bartel DP. MicroRNAs: genomics, biogenesis, mechanism, and function. Cell. 2004;116:281-297. [PubMed] |
| 17. | 刘 棣, 张 寅斌, 宋 玲琴, 闫 婉君, 赵 小瑶, 盛 倩文, 许 朋, 张 淑群. miRNA-34a在胃癌细胞KATOⅢ中对5-Fu的增敏作用. 西北药学杂志. 2018;33:658-661. [DOI] |
| 19. | 田 晰晰, 珠 珠, 黄 鉴, 任 俊宇, 王 跃, 张 楠, 陈 明清, 董 坚. 遗传性非息肉性大肠癌生物标志物的血清miRNAs的筛选. 世界华人消化杂志. 2013;11:1040-1045. [DOI] |
| 21. | Zhang Y, Hu X, Miao X, Zhu K, Cui S, Meng Q, Sun J, Wang T. MicroRNA-425-5p regulates chemoresistance in colorectal cancer cells via regulation of Programmed Cell Death 10. J Cell Mol Med. 2016;20:360-369. [PubMed] [DOI] |
| 22. | Thomas SJ, Snowden JA, Zeidler MP, Danson SJ. The role of JAK/STAT signalling in the pathogenesis, prognosis and treatment of solid tumours. Br J Cancer. 2015;113:365-371. [PubMed] [DOI] |
| 24. | 张 斌, 钟 德玝, 王 群伟, 苗 雄鹰, 戴 卫东, 刘 春, 潘 凯华. JAK/STAT信号通路与肝细胞性肝癌的肿瘤进展和预后的相关性研究. 细胞与分子免疫学杂志. 2010;26:368-370; 373. |