修回日期: 2014-12-14
接受日期: 2014-12-18
在线出版日期: 2015-01-28
目的: 研究结肠癌干细胞的肿瘤形成价值及其可能的临床价值.
方法: 对结肠癌干细胞进行无血清培养, 以流式细胞仪检测CD133和CD44表达, 以5-氟尿嘧啶(5-flurouracil, 5-Fu)处理结肠癌干细胞并观察其增殖抑制, 对结肠癌干细胞进行动物实验以确定其成瘤特征.
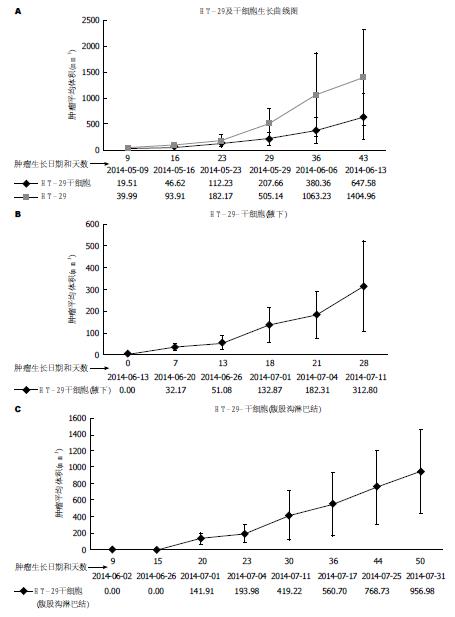
结果: Hoechest33342染色后, HT-29干细胞相对于HT-29细胞有明显的核拒染现象; 流式细胞仪发现HT-29细胞CD133阳性表达比率为44.6%, CD44阳性表达比率为0.6%; 而经过培养提纯后的HT-29干细胞CD133阳性表达比率为92.6%, CD44阳性表达比率为97.8%, CD133与CD44阳性表达比率显著提高; HT-29干细胞相对于HT-29细胞对5-Fu有明显的耐药作用, HT-29细胞IC50值为1.394 µg/mL, HT-29干细胞的IC50值为13.087 µg/mL, IC50值有明显的增高在恢复血清培养后, 体外增殖活性明显增强; HT-29干细胞体内生长速度比HT-29细胞体内生长速度显著要缓慢, HT-29细胞的肿瘤体积是HT-29干细胞肿瘤体积的两倍多; HT-29干细胞在小鼠富血管区(腋下和腹股沟淋巴结)的生长速率比皮下生长速率有明显的提高, 但与HT-29细胞的生长速率还有明显差距.
结论: 在结肠癌细胞株存在结肠癌干细胞, 通过无血清培养能分离出具有干细胞特征的结肠癌干细胞株, 结肠癌干细胞对5-Fu具有耐药性, 在适当微环境下其能快速生长, 转化为成熟的结肠癌细胞, 提示了改变结肠癌干细胞微环境可能是防止肿瘤复发的一个途径.
核心提示: 通过对结肠癌干细胞进行无血清培养, 以流式细胞仪检测CD133以及CD44的表达, 以5-氟尿嘧啶(5-flurouracil)进行处理结肠癌干细胞并观察其增殖抑制, 对结肠癌干细胞进行动物实验以确定其成瘤特征. 通过鉴定肿瘤干细胞, 寻找到调节肿瘤干细胞生物行为的因子, 将会给临床肿瘤的治疗起到巨大的推动作用.
引文著录: 邓超, 陈豪, 金黑鹰, 王水明. 结肠癌干细胞的肿瘤形成特征及其临床价值. 世界华人消化杂志 2015; 23(3): 363-372
Revised: December 14, 2014
Accepted: December 18, 2014
Published online: January 28, 2015
AIM: To explore the tumorigenic features of colon cancer stem cells and to analyze their clinical significance.
METHODS: HT-29 colon cancer cells were cultured in serum free medium, and the expression of CD133 and CD44 was detected by flow cytometry. The inhibitory effect of 5-flurouracil (5-Fu) on HT-29 cells and HT-29 cancer stem cells was assessed, and the tumorigenic features of HT-29 cancer stem cells were studied using a mouse model.
RESULTS: Hoechest33342 staining showed that less intense nuclear staining was observed in HT-29 cancer stem cells compared with HT-29 cancer cells. The positive expression rates of CD133 and CD44 were 44.6% and 0.6% in HT-29 cells, and 92.6% and 97.8% in HT-29 cancer stem cells, respectively. HT-29 cancer stem cells were resistant to 5-Fu and the half maximal (50%) inhibitory concentration (IC) of 5-Fu was 13.087 µg/mL, significantly higher than that for HT-29 cells (1.394 µg/mL). In mouse models, the growth rate of HT-29 cancer stem cells was slower than that of HT-29 cells, but the growth rate of HT-29 cancer stem cells in lymph nodes was more quickly than that under the skin.
CONCLUSION: There is a small proportion of cancer stem cells among HT-29 colon cancer cell line. Colon cancer stem cell can be isolated by culture in serum-free medium, and the stem cells show 5-Fu resistance. Colon cancer stem cells can progress to mature cancer cells in a proper microenvironment, which implies that changing the microenvironments of cancer stem cells can prevent the cancer stem cells from progressing to mature cancer cells.
- Citation: Deng C, Chen H, Jin HY, Wang SM. Tumorigenic features of colon cancer stem cells. Shijie Huaren Xiaohua Zazhi 2015; 23(3): 363-372
- URL: https://www.wjgnet.com/1009-3079/full/v23/i3/363.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i3.363
肿瘤干细胞在实体肿瘤发生中发挥重要作用, 肿瘤干细胞指肿瘤细胞中存在的一小群具有自我更新、无限增殖能力和多向分化潜能的肿瘤细胞, 在肿瘤形成的起始细胞并维持肿瘤的生长发挥重要作用, 而且近年来研究[1]发现肿瘤干细胞可能是肿瘤转移、复发的根本原因. 以往认为肿瘤干细胞只存在于血液系统和淋巴系统肿瘤中, 目前已确定在所有的实体肿瘤中, 肿瘤干细胞也发挥重要作用[2].
人体结肠的隐窝中存在的一些细胞, 这些细胞具有自我更新、分化功能, 为结肠干细胞, 这些细胞在一系列基因的调解下在结肠自我更新、修复中发挥重要作用, 维持结肠的动态平衡. 当结肠干细胞受到外来的打击发生了第一次突变, 这样这些干细胞可以长期的存在, 随着时间的延长, 致癌基因突变进一步累积, 使干细胞发生转化, 出现了不对称分裂的干细胞, 进而产生了结肠癌干细胞. 结肠癌干细胞(colon cancer stem cell)指具有像结肠干细胞一样自我分化和自我更新的特点, 但是结肠癌干细胞具有促使肿瘤发生、异常分化的作用, 尽管结肠癌干细胞只占结肠癌的一小部分, 但是在结直肠癌发生、复发和转移中发挥重要的作用[3,4]. 目前主要根据干细胞表明的分子标记来检测和分离结肠癌干细胞, 最常用的分子标记有CD133和CD44, 其次还有CD24、上皮特异性抗原(epithelial-specific antigen, ESA)、CD166、CD29和Lgr等[2,5,6]. 一些信号通路Wnt/β-catenin、Notch、转化生长因子-β(transforming growth factor-β, TGF-β)等在维持结肠癌干细胞的生长和功能发挥了重要作用[7-9]. 由于结肠癌干细胞在结直肠癌发生、发展、复发和转移中发挥重要作用, 而且对化疗耐药有重要的关系, 因此研究认为可能是结直肠癌预防和治疗的一个重要靶点[10].
但是在临床实践中, 结肠癌干细胞存在于哪里? 既然干细胞是结肠癌发生的最早期阶段, 那么其应该不具备侵袭性, 也就是不具备远处转移能力, 由此推测结肠癌干细胞只能存在于原发肿瘤部位、而与远处转移没有关系. 但是近年来的研究却认为, 结肠癌干细胞与结肠癌复发和转移具有重要的意义[11-13]. 如果说结肠癌干细胞与结直肠癌的复发、转移有关的话, 那么其在结直肠癌发生的"腺瘤-癌"途径中就不是处于腺瘤的早期阶段, 而是在腺瘤到癌发生的一个中间阶段, 由此又可以推出一个矛盾的结论, 腺瘤-癌途径存在一个中间阶段[14,15].
尽管目前对结肠癌干细胞的研究处于广受追捧的阶段, 认为是结肠癌治疗的新靶点, 但是对于结肠癌干细胞的了解仍然处于起步阶段. 本研究拟对结肠癌干细胞进行分离、对其生物学特性和成瘤特征进行研究, 以期进一步了解其生物学特征, 为进一步临床研究提供了基础.
HT-29细胞购自美国Atcc公司、RPMI-1640培养基、无血清DMEM/F12培养基、表皮生长因子(epidermal growth factor, EGF)、碱性成纤维细胞生长因子(basic fibroblast growth factor, bGFG)、胰岛素购自Sigma、牛血清白蛋白(bovine serum albumin, BSA)、白细胞抗原(B27)、胎牛血清(fetal bovine serum, FBS)购自Gibco公司、anti-CD44-APC抗体、anti-CD133-APC抗体、FCR-block抗体(Santa Cruz公司); 酶联仪(Thermo, 产地: 美国)、流式细胞仪(BD公司, 美国)、荧光倒置显微镜(Olympus, 产地: 日本)、细胞培养瓶(康宁, 产地: 美国)、孔悬浮培养板(广州洁特).
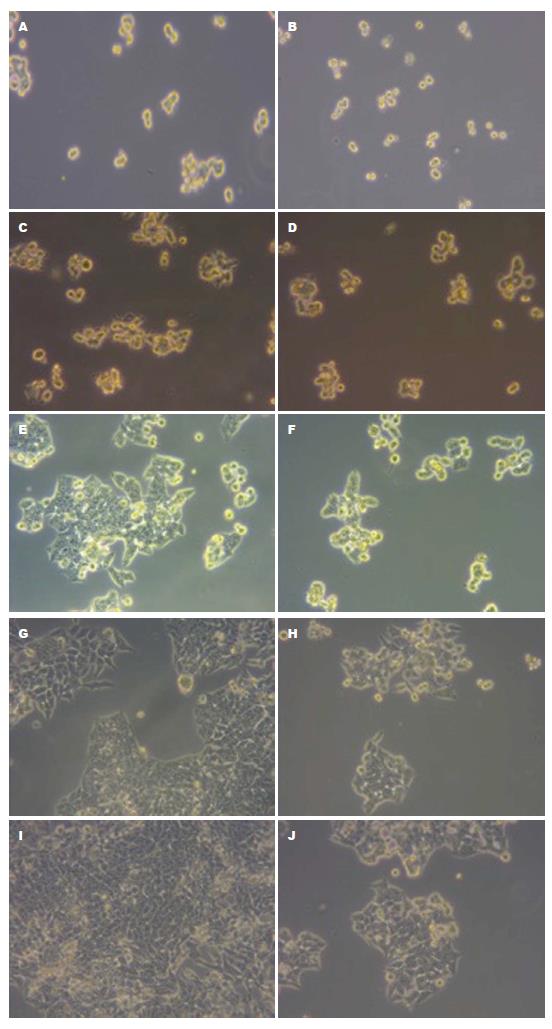
1.2.1 HT-29干细胞的培养: 人结肠癌细胞株HT-29培养于含10%FBS的RPMI-1640培养基中, 细胞生长至90%汇合度时, 0.125%EDTA-胰酶消化、洗涤与收集细胞, 离心去上清后用无血清DMEM/F12培养基(含20 ng/mL EGF, 10 ng/mL bGFG, 5 µg/mL Insulin, 0.4%BSA, 2%B27)重悬细胞计数, 以1×104个/mL的浓度接种于6孔悬浮培养板中, 在37 ℃, 50 mL/L CO2条件下培养, 经3-7 d培养后可见球体细胞生长, 37 ℃沉淀30 min去除上清(含少量单个细胞及细胞碎片), 加入无血清DMEM/F12培养基扩大培养. 离心球体细胞, 消化, 传代培养, 几代提纯后收集细胞进行药物敏感性、增殖实验、流式表型及Hoechest33342染色鉴定.
1.2.2 HT-29干细胞的特性与鉴定: (1)Hoechest33342染色: HT-29细胞和HT-29干细胞分别用含EDTA的胰酶消化打散至单个细胞, 迅速分别加入RPMI-1640及DMEM/F12培养基; 培养基洗涤2次后, 分别用培养基重悬细胞悬液, 混匀, 取2×105加入2 mL细胞培养皿中, 37 ℃培养箱放置2-3 h, 使其贴壁; 用超纯水按1:500比例稀释1 mg/mL的Hochest染色至终浓度2 µg/mL; 细胞培养皿中的贴壁细胞经PBS洗涤后, 加入Hoechst3342染液500 µL, 10 min后, PBS清洗3次, 荧光显微镜拍照; (2)流式细胞分析: 先将HT-29细胞和HT-29干细胞分别用含EDTA的胰酶消化打散至单个细胞, 迅速加DMEM/F12培养基稀释, 混匀; 1500 r/min离心5 min后, 弃上清液, 加PBS洗涤2次; 分别用PBS重悬细胞悬液300 µL, 混匀; 将两种细胞悬液分别均匀分成3份, 每个100 µL; 一份空白对照, 一份加10 µL的anti-CD44-APC抗体, 混匀后4 ℃避光15 min, 另一份加10 µL的Fcr Block, 混匀, 44 ℃放置15 min后, 再加anti-CD133-APC抗体10 µL, 混匀, 4 ℃放置20 min(以上都要避光操作), PBS洗涤; PBS重悬至400 µL, 混匀后, 上流式细胞仪分别检测HT-29及HT-29细胞干细胞表面CD44、CD133的阳性表达率; (3)药物敏感性测定: 将HT-29细胞和HT-29干细胞均以5000个/孔的浓度铺入96孔细胞培养板中. 待细胞贴壁后加入不同浓度的5-氟尿嘧啶(5-flurouracil, 5-Fu)作用72 h后(每个浓度设3个复孔), 加入20 mL MTT溶液, 4 h后弃去96孔板中的培养基, 加入150 µL DMSO, 振荡, 570 nm波长测定A值, 分别计算出5-Fu对两种细胞的IC50值; (4)增殖实验: HT-29细胞和HT-29干细胞分别用含EDTA的胰酶消化打散至单个细胞, 迅速加含10%血清的1640培养基终止消化; PBS洗涤2次后, 分别用PBS重悬细胞悬液, 混匀, 分别接种至六孔板, 培养96 h, 观察细胞生长情况, 显微镜拍照.
1.2.3 体内生长试验: 分别使用HT-29干细胞及HT-29细胞进行双侧肩胛下注射, 并对HT-29干细胞进行腹股沟和腋下淋巴结注射, 观察成瘤情况. 动物数量为20只. 注射干细胞后即开始观察动物身体情况. 当有动物出现死亡或者肿瘤直径超过20 mm后, 结束实验. 进行动物尸检, 观察动物身体各个部位的肿瘤生成情况, 并拍摄照片. 计算各个部位肿瘤的发生率. 按照以下公式分别计算出肿瘤体积及增长率: 肿瘤体积(mm3) = 0.5×a×b2(a为肿瘤长径, b为肿瘤短径); 肿瘤增长率 = (测量时间点肿瘤大小-开始肿瘤大小)/开始肿瘤大小.
统计学处理 所有数据用SPSS18.0统计分析, 计量资料mean±SD表示, 独立样本t检验或方差分析进行检验, 连续测量数据使用线性模型进行分析. P<0.05为差异具有统计学意义.
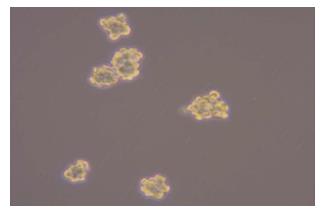
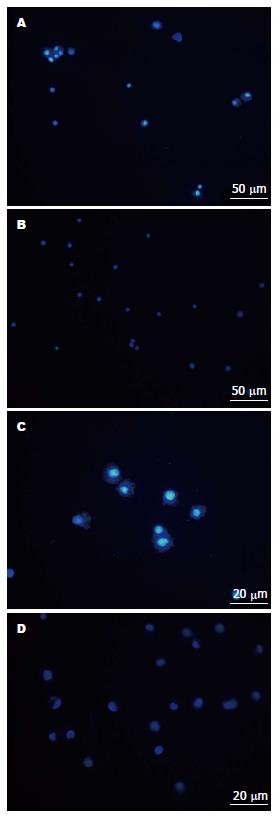
经无血清培养后, HT-29细胞呈梭形细胞, 而HT-29干细胞呈球形生长; Hoechst33342染色后, HT-29干细胞相对于HT-29细胞有明显的核拒染现象(图1, 图2).
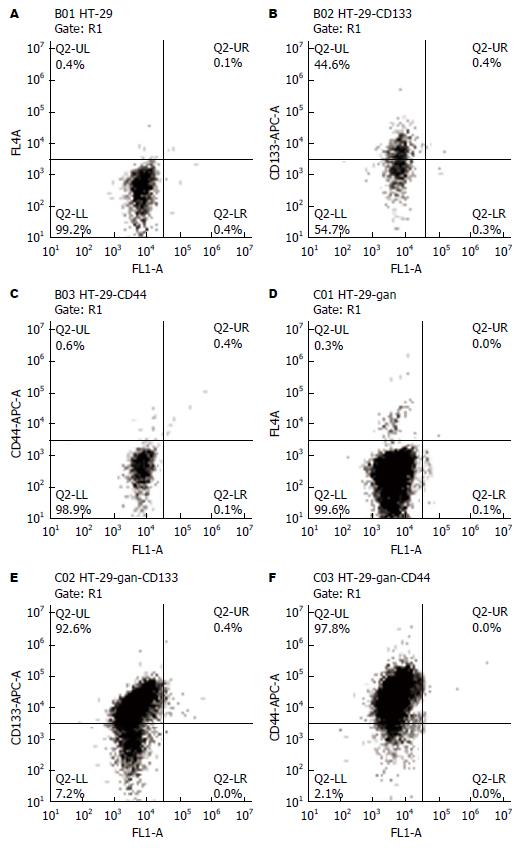
HT-29细胞CD133阳性表达比率为44.6%, CD44阳性表达比率为0.6%; 而经过培养提纯后的HT-29干细胞CD133阳性表达比率为92.6%, CD44阳性表达比率为97.8%, CD133与CD44阳性表达比率显著提高(P<0.001) (图3).
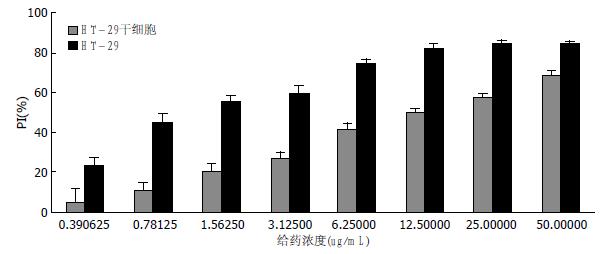
HT-29干细胞相对于HT-29细胞对5-Fu有明显的耐药作用, HT-29细胞IC50值为1.394 μg/mL, HT-29干细胞的IC50值为13.087 μg/mL, IC50值有明显的增高(P<0.001)(图4).
HT-29干细胞相对于HT-29细胞, 在恢复血清培养后, 体外增殖活性明显增强. 进行连续测量数据比较, 差异有统计学意义(P<0.001)(图5).
结肠癌干细胞是结肠癌研究的热点课题之一, 结肠癌干细胞与结肠癌的发生、发展、转移和复发有密切的关系, 因此认为结肠癌干细胞是结肠癌治疗的重要靶点[16-18]. 尽管对结肠癌干细胞进行许多的研究, 但是结肠癌干细胞是如何发展成结肠癌? 如何在结肠癌复发和转移中发挥作用? 目前尚没有定论.
目前分离结肠癌干细胞的方法是使用无血清培养的方法和流式细胞仪分离方法[19,20], 无血清培养的方法基本的原理是结肠癌干细胞是可以自我分化和自我更新能力, 因此在无血清的情况下, 肿瘤细胞无法生长而结肠癌干细胞可以自我繁殖, 达到分离结肠癌干细胞的作用[21,22]. 本研究采用了无血清培养的方法分离干细胞, 分离出HT-29结肠癌干细胞具有球形生长、Hoechest33342染色呈核拒染现象, 而且使用结肠癌干细胞常使用的表面标志CD133和CD44进行流失细胞仪分析显示, CD133和CD44阳性表达分别达到92.6%和97.8%, 提示为结肠癌干细胞. 在对HT-29细胞进行流式细胞仪检测时发现CD133阳性表达比率为44.6%, CD44阳性表达比率为0.6%, 明显低于无血清培养后的结肠癌干细胞的阳性表达率, 结果与Fan等[22]结果类似. 该结果提示在结肠癌细胞株中, 除存在大量的成熟结肠癌细胞以外, 可能也存在一些少量的结肠癌干细胞, 结肠癌细胞株中的这些结肠癌干细胞是怎么发育来的, 其能否转化为结肠癌细胞目前尚没有定论. 结肠癌细胞株中为什么存在结肠癌干细胞, 他是原来在分离时就存在的还是成熟的结肠癌可以"返祖"成为结肠癌干细胞, 尚需要进行进一步的分析和研究.
本研究中, 发现结肠癌干细胞对于5-Fu不敏感, 本研究中HT-29细胞IC50值为1.394 μg/mL, HT-29干细胞的IC50值为13.087 μg/mL, IC50值有明显的增高, 提示在常规剂量下, 结肠癌干细胞对于化疗药呈耐药状态. 本结果与国内外一些研究成果类似[23,24], 因此, 近年来研究认为结肠癌干细胞存在是结肠癌对5-Fu耐药的一个重要指标, 特别对于结肠癌的远期复发和转移有重要的意义[25-27]. 但是结肠癌干细胞是一个不具有侵袭力的细胞株, 他是如何随原发肿瘤"转移"至其他部位的, 目前尚无定论. 结肠癌干细胞生长比较缓慢, 本研究比较了HT-29细胞和HT-29结肠癌干细胞皮下成瘤特点, 发现结肠癌干细胞肿瘤生长明显缓慢, 不及HT-29细胞株的一半. 但是当结肠癌干细胞肿瘤位于血供比较丰富的腋下和淋巴结局域时, 结肠癌干细胞增殖速度明显增加, 因此可以推论, 结肠癌干细胞在适当的组织微环境下, 特别是有足够的血供和营养供养的条件下, 其可能容易出现转化, 进而发展成为肿瘤. 为了验证正常营养供应对于结肠癌干细胞作用, 我们对结肠癌干细胞和结肠癌细胞同时进行血清培养, 发现结肠癌干细胞增殖速度也明显增加, 虽然低于结肠癌细胞株, 但是明显快于无血清培养结肠癌干细胞. 因此本研究提示, 对于结肠癌干细胞, 当没有适合生长、成瘤的微环境时, 其可以通过自身的自我复制维持生存, 成为一个结肠癌复发或转移的"种子", 当有适合的微环境时, 特别是处于血液和营养供应丰富的环境时, 结肠癌干细胞可以逐渐发育成结肠癌细胞, 导致结肠癌的复发和转移[28-30]. 由于结肠癌干细胞首先要发育成成熟的结肠癌细胞, 然后才能表现出结肠癌的快速增长、侵袭和转移的特性, 因此可以理解结肠癌干细胞形成肿瘤慢于结肠癌细胞株的特性.
总之, 本研究发现, 在结肠癌细胞株存在结肠癌干细胞, 通过无血清培养能分离出具有干细胞特征的结肠癌干细胞株, 结肠癌干细胞对5-Fu具有耐药性, 在适当微环境下其能快速生长, 转化为成熟的结肠癌细胞, 提示改变结肠癌干细胞微环境可能是防止肿瘤复发一个途径.
传统观念认为肿瘤细胞是由体细胞突变而形成的, 突变使其可以获得无限制生长的能力, 但并不是所有的肿瘤细胞都可以无限制生长. 研究表明, 部分肿瘤细胞的生长、转移和复发的特点与干细胞十分类似, 因此有学者提出了肿瘤干细胞(cancer stem cell, CSC)理论, 目前已在白血病、乳腺癌、恶性黑素瘤、肠癌、肝癌等多种肿瘤中证实CSC的存在. CSC学说认为肿瘤组织内有一小群细胞与干细胞具有类似的广泛增殖、自我更新以及分化潜能等特性, 并且能表达与某些正常干细胞相同的标记蛋白. CSC理论让人们重新认识了肿瘤的起源和特性, 并且对肿瘤的临床治疗提供了新思路和新方向.
卢宁, 副主任医师, 中国人民解放军兰州军区乌鲁木齐总医院肿瘤科
探索肿瘤干细胞从肿瘤组织分离及体外培养扩增建系的方法, 建立合理的体外模型也是需要解决的问题.
玛格利特公主癌症研究中心研究团队在小鼠体内复制了人类结肠癌模型以明确能否将干细胞作为临床治疗的特异性靶点. 首先, 研究人员证实了在其他肿瘤中与干细胞维持有关的基因BMI-1是结肠癌干细胞的重要调控因子, 他启动了周期性的自我更新、增殖及细胞存活; 其次, 研究者使用已知的小分子抑制剂成功阻断了BMI-1基因, 间接证实了该方法的可行性.
本研究采用了无血清培养的方法分离干细胞, 分离出HT-29结肠癌干细胞具有球形生长、Hochest33342染色呈核拒染现象, 而且使用结肠癌干细胞常使用的表面标志CD133和CD44进行流失细胞仪分析显示, CD133和CD44阳性表达分别达到92.6%和97.8%, 提示为结肠癌干细胞. 在对HT-29细胞进行流式细胞仪检测时发现CD133阳性表达比率为44.6%, CD44阳性表达比率为0.6%, 明显低于无血清培养后的结肠癌干细胞的阳性表达率. 本研究比较了HT-29细胞和HT-29结肠癌干细胞皮下成瘤特点, 发现结肠癌干细胞肿瘤生长明显缓慢, 不及HT-29细胞株的一半.
肿瘤干细胞假说提出了只有一小部分肿瘤细胞可以产生肿瘤并维持肿瘤生长及异质性, 与肿瘤的发生、转移以及复发有着直接的联系, 为癌症的临床治疗提供了全新的视角. 彻底有效地根除癌症需要消灭肿瘤干细胞又避免伤害正常的干细胞, 而在急性白血病以及一些实体瘤中的研究发现肿瘤干细胞对常规癌症治疗手段具有耐药性, 因此发展肿瘤干细胞的筛选鉴定方法, 进一步开发只针对肿瘤干细胞的药物以及肿瘤方法对于癌症的临床治疗具有重要的意义.
本文通过无血清培养的方法培养HT-29结肠癌干细胞, 以流式细胞仪检测CD133和CD44表达, 以5-氟尿嘧啶处理结肠癌干细胞并观察其增殖抑制, 对结肠癌干细胞进行动物实验以确定其成瘤特征. 初步阐明了结肠癌干细胞的生物学特点, 对临床有一定的指导意义.
编辑:郭鹏 电编:都珍珍
| 1. | Buczacki S, Davies RJ, Winton DJ. Stem cells, quiescence and rectal carcinoma: an unexplored relationship and potential therapeutic target. Br J Cancer. 2011;105:1253-1259. [PubMed] [DOI] |
| 2. | Kemper K, Grandela C, Medema JP. Molecular identification and targeting of colorectal cancer stem cells. Oncotarget. 2010;1:387-395. [PubMed] |
| 3. | Zeki SS, Graham TA, Wright NA. Stem cells and their implications for colorectal cancer. Nat Rev Gastroenterol Hepatol. 2011;8:90-100. [PubMed] [DOI] |
| 4. | Anderson EC, Hessman C, Levin TG, Monroe MM, Wong MH. The role of colorectal cancer stem cells in metastatic disease and therapeutic response. Cancers (Basel). 2011;3:319-339. [PubMed] [DOI] |
| 5. | Ahuja N. Colorectal cancer stem cells--hype or real?: comment on "Combined CD133+/CD44+ expression as a prognostic indicator of disease-free survival in patients with colorectal cancer". Arch Surg. 2012;147:24-25. [PubMed] [DOI] |
| 6. | Lenz HJ, Kahn M. Safely targeting cancer stem cells via selective catenin coactivator antagonism. Cancer Sci. 2014;105:1087-1092. [PubMed] [DOI] |
| 7. | Shaukat A, Mongin SJ, Geisser MS, Lederle FA, Bond JH, Mandel JS, Church TR. Long-term mortality after screening for colorectal cancer. N Engl J Med. 2013;369:1106-1114. [PubMed] [DOI] |
| 8. | Apostolou P, Toloudi M, Ioannou E, Kourtidou E, Chatziioannou M, Kopic A, Komiotis D, Kiritsis C, Manta S, Papasotiriou I. Study of the interaction among Notch pathway receptors, correlation with stemness, as well as their interaction with CD44, dipeptidyl peptidase-IV, hepatocyte growth factor receptor and the SETMAR transferase, in colon cancer stem cells. J Recept Signal Transduct Res. 2013;33:353-358. [PubMed] [DOI] |
| 9. | Katsuno Y, Lamouille S, Derynck R. TGF-β signaling and epithelial-mesenchymal transition in cancer progression. Curr Opin Oncol. 2013;25:76-84. [PubMed] [DOI] |
| 10. | Botchkina G. Colon cancer stem cells--from basic to clinical application. Cancer Lett. 2013;338:127-140. [PubMed] [DOI] |
| 11. | Shiozawa Y, Nie B, Pienta KJ, Morgan TM, Taichman RS. Cancer stem cells and their role in metastasis. Pharmacol Ther. 2013;138:285-293. [PubMed] [DOI] |
| 12. | Zhou W, Wang G, Guo S. Regulation of angiogenesis via Notch signaling in breast cancer and cancer stem cells. Biochim Biophys Acta. 2013;1836:304-320. [PubMed] [DOI] |
| 13. | Yan K, Yang K, Rich JN. The evolving landscape of glioblastoma stem cells. Curr Opin Neurol. 2013;26:701-707. [PubMed] [DOI] |
| 14. | Sampieri K, Fodde R. Cancer stem cells and metastasis. Semin Cancer Biol. 2012;22:187-193. [PubMed] [DOI] |
| 15. | Susman S, Tomuleasa C, Soritau O, Mihu C, Rus-Ciuca D, Sabourin JC, Bibeau F, Irimie A, Buiga R. The colorectal cancer stem-like cell hypothesis: a pathologist's point of view. J BUON. 2012;17:230-236. [PubMed] |
| 16. | Leedham SJ. Measuring stem cell dynamics in the human colon--where there's a wiggle, there's a way. J Pathol. 2014;234:292-295. [PubMed] [DOI] |
| 17. | Cernat L, Blaj C, Jackstadt R, Brandl L, Engel J, Hermeking H, Jung A, Kirchner T, Horst D. Colorectal cancers mimic structural organization of normal colonic crypts. PLoS One. 2014;9:e104284. [PubMed] [DOI] |
| 18. | Dean M, Fojo T, Bates S. Tumour stem cells and drug resistance. Nat Rev Cancer. 2005;5:275-284. [PubMed] |
| 19. | Cammareri P, Lombardo Y, Francipane MG, Bonventre S, Todaro M, Stassi G. Isolation and culture of colon cancer stem cells. Methods Cell Biol. 2008;86:311-324. [PubMed] [DOI] |
| 20. | Li YF, Xiao B, Lai ZS, Tu SF, Wang YY, Zhang XL. [Spheres isolated from Colo205 cell line possess cancer stem-like cells under serum-free culture condition]. Nanfang Yike Daxue Xuebao. 2008;28:236-240. [PubMed] |
| 21. | Lin L, Liu Y, Li H, Li PK, Fuchs J, Shibata H, Iwabuchi Y, Lin J. Targeting colon cancer stem cells using a new curcumin analogue, GO-Y030. Br J Cancer. 2011;105:212-220. [PubMed] [DOI] |
| 22. | Fan X, Ouyang N, Teng H, Yao H. Isolation and characterization of spheroid cells from the HT29 colon cancer cell line. Int J Colorectal Dis. 2011;26:1279-1285. [PubMed] [DOI] |
| 23. | Vincent Z, Urakami K, Maruyama K, Yamaguchi K, Kusuhara M. CD133-positive cancer stem cells from Colo205 human colon adenocarcinoma cell line show resistance to chemotherapy and display a specific metabolomic profile. Genes Cancer. 2014;5:250-260. [PubMed] |
| 24. | Jao SW, Chen SF, Lin YS, Chang YC, Lee TY, Wu CC, Jin JS, Nieh S. Cytoplasmic CD133 expression is a reliable prognostic indicator of tumor regression after neoadjuvant concurrent chemoradiotherapy in patients with rectal cancer. Ann Surg Oncol. 2012;19:3432-3440. [PubMed] [DOI] |
| 25. | Shakibaei M, Buhrmann C, Kraehe P, Shayan P, Lueders C, Goel A. Curcumin chemosensitizes 5-fluorouracil resistant MMR-deficient human colon cancer cells in high density cultures. PLoS One. 2014;9:e85397. [PubMed] [DOI] |
| 26. | Touil Y, Igoudjil W, Corvaisier M, Dessein AF, Vandomme J, Monté D, Stechly L, Skrypek N, Langlois C, Grard G. Colon cancer cells escape 5FU chemotherapy-induced cell death by entering stemness and quiescence associated with the c-Yes/YAP axis. Clin Cancer Res. 2014;20:837-846. [PubMed] [DOI] |
| 27. | Xiong B, Ma L, Hu X, Zhang C, Cheng Y. Characterization of side population cells isolated from the colon cancer cell line SW480. Int J Oncol. 2014;45:1175-1183. [PubMed] [DOI] |
| 28. | Moghbeli M, Moghbeli F, Forghanifard MM, Abbaszadegan MR. Cancer stem cell detection and isolation. Med Oncol. 2014;31:69. [PubMed] [DOI] |
| 29. | Hongo K, Tsuno NH, Kawai K, Sasaki K, Kaneko M, Hiyoshi M, Murono K, Tada N, Nirei T, Sunami E. Hypoxia enhances colon cancer migration and invasion through promotion of epithelial-mesenchymal transition. J Surg Res. 2013;182:75-84. [PubMed] [DOI] |
| 30. | Malfettone A, Silvestris N, Paradiso A, Mattioli E, Simone G, Mangia A. Overexpression of nuclear NHERF1 in advanced colorectal cancer: association with hypoxic microenvironment and tumor invasive phenotype. Exp Mol Pathol. 2012;92:296-303. [PubMed] [DOI] |