修回日期: 2014-12-04
接受日期: 2014-12-18
在线出版日期: 2015-01-28
目的: 通过检测信号传导与转录激活因子3(signal transducer and activator of trans-cription 3, Stat3)信号通路相关分子白介素- 11(interleukin-11, IL-11)及存活素(Survivin)在胃癌患者组织中的差异性表达, 探讨IL-11和Survivin在胃癌发生、进展、转移及预后中的作用.
方法: 收集2004-01-01/2007-12-31于石河子大学医学院第一附属医院手术的59例胃癌患者的胃癌及其癌旁5 cm石蜡包埋组织, 制作组织芯片. 采用免疫组织化学Envision法检测组织中IL-11和Survivin的表达水平. 对59例胃癌患者进行了124 mo(10.3年)的随访, 并结合患者的临床病理特征及随访资料进行了分析.
结果: (1)IL-11在胃癌组织中的表达率为96.6%(57/59)高于癌旁正常组织88.1%(52/59) (χ2 = 7.252, (P = 0.025); Survivin在胃癌组织中的表达率为93.2%(55/59)明显高于癌旁正常组织72.9%(43/59)(χ2 = 41.988, P<0.001). 在胃癌组织中IL-11和Survivin的表达呈明显正相关(r = 0.442, P<0.001); 而在癌旁组织却并未存在这种相关性(r = 0.103, (P = 0.438); (2)IL-11的高表达与较高的胃癌临床分期显著相关((P = 0.002); 而Survivin的高表达则与胃癌的淋巴结转移和较高的临床分期相关((P = 0.028, 0.002); (3)首次提出IL-11和Survivin的高表达都与胃癌患者的生存预后不良相关, 表达越高, 预后越差((P = 0.004, P<0.001); (4)Cox多因素回归模型分析提示, 临床分期是影响胃癌患者生存预后的独立危险因素((P = 0.017).
结论: 胃癌患者IL-11和Survivin的高表达与患者的生存预后不良相关, 且二者在胃癌的发生、发展及预后过程中可能存在协同作用.
核心提示: 白介素-11(interleukin-11, IL-11)及相关的信号通路以及预后的整体的研究较少, 本研究发现IL-11与其相关因子Survivin在胃癌组织中的表达具有提示预后的作用, 该发现可能将为预测胃癌预后及临床靶向药物的使用提供更好的选择依据.
引文著录: 张楠, 李一鑫, 陶林, 杨兰, 赵瑾, 张文杰. 胃癌患者IL-11和Survivin高表达的临床病理学意义及其在癌进展和生存预后中的作用. 世界华人消化杂志 2015; 23(3): 373-380
Revised: December 4, 2014
Accepted: December 18, 2014
Published online: January 28, 2015
AIM: To investigate the differential expression of interleukin-11 (IL-11) and Survivin in gastric cancer (GC) to understand their possible roles in carcinogenesis, progression and prognosis.
METHODS: Paraffin-embedded samples were obtained from 59 GC patients who underwent surgical operations at the First Affiliated Hospital of Shihezi University School of Medicine, Shihezi, China, between January 1, 2004 and December 31, 2007. All of the patients were followed to April 1, 20014. The expression of IL-11 and Survivin was detected using tissue chip and immunohistochemistry.
RESULTS: The positive expression rate of IL-11 was 96.6% in GC tissues, significantly higher than that in adjacent normal tissues (88.1%; χ2 = 7.252, (P = 0.025). The positive expression rate of Survivin in GC tissues was also significantly higher than that in adjacent normal tissues (93.2% vs 72.9%, χ2 = 41.988, P < 0.001). In GC tissues, there was a positive correlation between IL-11 and Survivin expression (r = 0.442, P < 0.001), but no correlation was found in adjacent normal tissues (r = 0.103, (P = 0.438). The expression of IL-11 was correlated with higher clinical stage ((P = 0.002), while Survivin expression was correlated with lymph node metastasis and higher clinical stage ((P = 0.002, 0.028). Higher levels of IL-11 and Survivin were linked to poor prognosis in GC patients ((P = 0.004 and P < 0.001, respectively). Cox multi-factorial regression analysis demonstrated clinical stage being an independent factor predicting overall survival of GC patients ((P = 0.017).
CONCLUSION: Overexpression of IL-11 and Survivin correlates with poor prognosis of GC patients, and they may play a coordinated role in the development, progression and prognosis of GC.
- Citation: Zhang N, Li YX, Tao L, Yang L, Zhao J, Zhang WJ. Clinicopathological and prognostic significance of IL-11 and Survivin overexpression in gastric cancer. Shijie Huaren Xiaohua Zazhi 2015; 23(3): 373-380
- URL: https://www.wjgnet.com/1009-3079/full/v23/i3/373.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i3.373
胃癌是世界上常见的恶性肿瘤之一, GLOBOCAN 2012[1]表明, 全球胃癌发病总人数为95.2万余人, 占全球癌症发病人数的6.8%, 位列第5位; 因胃癌死亡的人数位列癌症总致死人数的第3位, 其中中国胃癌的发病率及死亡率居于前列[2]. 信号传导与转录激活因子3(signal transducer and activator of transcription 3, Stat3)是癌症时常见的转录调节因子, Stat3信号的失调可能与胃癌的发生有关[3,4]. 白介素-6(interleukin-6, IL-6)通过激活下游的gp130/Stat3信号通路作为推动许多癌症的标志. 然而, 近期研究表明, 和IL-6同一家族的IL-11可能同样具有促进Stat3活化的功能[5-7]. 凋亡在多细胞生物体的发育和维持组织稳态中起到重要作用, 其状态异常也是导致包括肿瘤在内的多种疾病的重要原因[8]. Survivin是细胞凋亡蛋白家族的抑制剂, 因为其抑制凋亡有利于肿瘤细胞存活而得名为存活素, 常受Stat3的调控而表达水平升高. 随着研究的深入, 在尿路上皮癌、肺癌和其他恶性肿瘤中发现Survivin表达水平的增高[9]. 本研究通过检测Stat3信号通路相关分子IL-11及Survivin在胃癌患者组织中的差异性表达, 首次将IL-11在胃癌中与Stat3信号通路及其下游因子Survivin联系起来, 探讨了IL-11和Survivin在胃癌发生、进展、转移及预后中的作用.
石蜡包埋标本取自2004-01-01/ 2007-12-31于石河子大学医学院第一附属医院进行手术的59例胃癌患者. 其中男41例, 女18例, 年龄27-81岁, 平均年龄61.0岁±11.0岁, 中位年龄62岁. 所有患者未曾接受过术前放化疗, 且无自身免疫性疾病. 随访至2014-04-01, 患者平均生存时间为38.4 mo±36.0 mo(0-116 mo), 生存期被定义为手术日期与死亡或最后随访日期之间的间隔. 胃癌组织分期参照美国癌症联合委员会(American Joint Committee on Cancer, AJCC)和国际抗癌联盟(Union for International Cancer Control, UICC)在2010年共同修订的第七版TNM分期标准[10], Ⅰ-Ⅱ期癌23例、Ⅲ-Ⅳ期癌36例. 患者临床病例资料齐全, 且全部进行了随访. 选取59例胃癌患者的癌旁组织, 切缘距离癌组织5 cm以外的非癌组织作为对照组. 一抗兔抗人IL-11多克隆抗体(美国LSBio公司, 产品号LS-C177617, 稀释度1:100); 兔抗人Survivin单克隆抗体(美国Abcam公司, ab76424, 稀释度1:100); DAB显色剂(丹麦Dako公司); 其余试剂均来自北京中杉金桥生物有限公司. 用PBS缓冲液代替一抗作为空白对照. 采用奥林巴斯十人共览电子显微镜进行读片.
1.2.1 HE染色及免疫组织化学检测: 所有胃癌组和癌旁对照组病例均置于40 g/L甲醛中固定、石蜡包埋组织, 4 µm厚切片、做常规HE染色. 由2名病理学教授对HE切片进行组织学观察, 选定区域, 制作组织芯片, 4 µm厚连续切片, 采用免疫组织化学Envision两步法: 对切片梯度脱蜡和脱水后, IL-11放入枸盐酸中、Survivin则采用EDTA进行抗原热修复(均高压8 min). 用肝癌患者阳性切片作为阳性对照, 用PBS液代替一抗作为阴性对照.
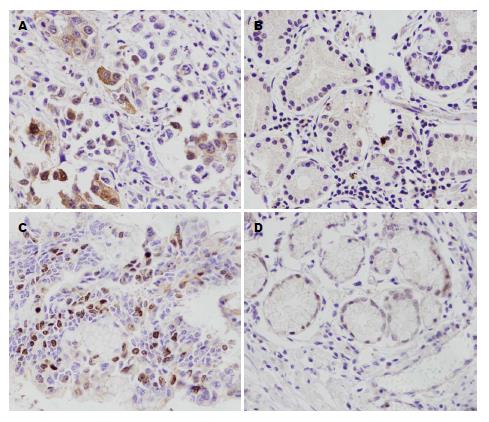
1.2.2 结果判定标准: IL-11免疫组织化学阳性结果多为细胞质内出现棕褐色颗粒或棕黄色颗粒, Survivin免疫组织化学阳性结果多位于细胞核内. 免疫组织化学得分与已报道的文献相似[11], 为阳性着色细胞占细胞总数的百分比计分与染色强度计分的乘积. 阳性着色细胞数的百分比计分: <5%为0分, 6%-25%为1分, 26%-50%为2分, 51%-75%为3分, 76%-100%为4分. 染色强度计分: 无着色为0分, 浅棕黄色为1分, 棕黄色为2分, 棕褐色为3分. 两项结果相乘: 0-1分为阴性( - ), 2-4分为弱阳性(1+), 5-8分为(2+), 9-12分为(3+), (2+-3+)为强阳性.
统计学处理 应用统计软件SPSS17.0进行统计分析, IL-11和Survivin表达在癌与非癌间表达差异的比较, 以及IL-11和Survivin表达与患者临床病理资料间的关系采用列联表法Fisher精确检验. IL-11和Survivin表达的相关性采用Spearman等级相关分析. 生存期及生存曲线分析用Kaplan-Meier法. 生存时间单因素及多因素分析采用Cox比例风险回归模型. 检验水准α = 0.05. P<0.05为差异具有统计学意义.
图1所示, IL-11和Survivin的阳性着色部位分别为细胞质和胞核. 表1所示, 胃癌组织中IL-11阴性( - )表达2例(3.4%), 弱阳性(+)37例(62.7%), 强阳性(2+)20例(33.9%); 癌旁组织中IL-11阴性表达7例(11.9%), 弱阳性43例(72.9%), 强阳性9例(15.3%). IL-11在胃癌组织中的表达均高于癌旁, 差异有统计学意义(χ2 = 7.252, (P = 0.025). 胃癌组织中Survivin阴性( - )表达4例(6.8%), 弱阳性(+)26例(44.1%), 强阳性(2+/3+)29例(49.2%); 癌旁组织中Survivin IL-11阴性表达16例(27.1%), 弱阳性42例(71.2%), 强阳性仅1例(1.7%), 胃癌组织中的表达均高于癌旁, 差异有统计学意义(χ2 = 41.988, P<0.001).
| 蛋白类型 | - | 1+ | 2+/3+ | χ2值 | P值 |
| IL-11 | 7.252 | 0.025 | |||
| 胃癌 | 2(3.4) | 37(62.7) | 20(33.9) | ||
| 癌旁 | 7(11.9) | 43(72.9) | 9(15.3) | ||
| Survivin | 41.988 | <0.001 | |||
| 胃癌 | 4(6.8) | 26(44.1) | 29(49.2) | ||
| 癌旁 | 16(27.1) | 42(71.2) | 1(1.7) |
表2所示, 59例胃癌组织中2例IL-11阴性表达, 37例弱阳性(+)表达, 20例呈强阳性(2+)表达; 4例Survivin阴性表达, 26例为弱阳性(+)表达, 29例为强阳性(2+/3+)表达. 59例胃癌组织中IL-11和Survivin的表达进行双变量的相关性分析, 得出相关系数r = 0.442, P<0.001, 说明胃癌中IL-11和Survivin的表达之间有相关性. 但是在癌旁组织中并未发现这种相关性关系(r = 0.103, (P = 0.438).
| Survivin表达水平 | IL-11表达水平 | r值 | P值 | |||
| - | + | 2+ | 总计 | |||
| 胃癌组织 | 0.442 | <0.001 | ||||
| - | 2 | 2 | 0 | 4 | ||
| 1+ | 0 | 21 | 5 | 26 | ||
| 2+/3+ | 0 | 14 | 15 | 29 | ||
| 总计 | 2 | 37 | 20 | 59 | ||
| 癌旁组织 | 0.103 | 0.438 | ||||
| - | 4 | 3 | 0 | 7 | ||
| 1+ | 9 | 33 | 1 | 43 | ||
| 2+/3+ | 3 | 6 | 0 | 9 | ||
| 总计 | 16 | 42 | 1 | 59 | ||
表3所示, IL-11仅与较高的临床分期有关, 与年龄、性别、组织学分型等指标无关. IL-11在临床分期Ⅱ、Ⅲ、Ⅳ的阳性表达率均为100%, 明显高于Ⅰ期的阳性表达率(χ2 = 16.931, (P = 0.002). Survivin不仅与较高的临床分期有关(χ2 = 18.226, (P = 0.002); 还与淋巴结转移有关(χ2 = 6.703, (P = 0.028).
| 病理特征 | n | IL-11 | P值 | Survivin | P值 | ||||
| - | + | 2+ | - | + | 2+/3+ | ||||
| 年龄(岁) | 0.893 | 0.325 | |||||||
| <60 | 25 | 1(4.0) | 15(60.0) | 9(36.0) | 3(12.0) | 12(48.0) | 10(40.0) | ||
| ≥60 | 34 | 1(2.9) | 22(64.7) | 11(32.4) | 1(2.9) | 14(44.2) | 19(55.9) | ||
| 性别 | 0.596 | 0.821 | |||||||
| 男 | 41 | 2(4.9) | 24(58.5) | 15(36.6) | 3(7.3) | 19(46.3) | 19(46.3) | ||
| 女 | 18 | 0(0.0) | 13(72.2) | 5(27.8) | 1(5.6) | 7(38.9) | 10(55.6) | ||
| WHO分型 | 0.063 | 0.160 | |||||||
| 高分化腺癌 | 3 | 1(33.3) | 1(33.3) | 1(33.3) | 1(33.3) | 2(66.7) | 0(0.0) | ||
| 中分化腺癌 | 18 | 0(0.0) | 14(77.8) | 4(22.2) | 1(5.6) | 9(50.0) | 8(44.4) | ||
| 低分化腺癌 | 31 | 1(3.2) | 20(64.5) | 10(32.3) | 1(3.2) | 14(45.2) | 16(51.6) | ||
| 黏液腺癌 | 3 | 0(0.0) | 0(0.0) | 3(100.0) | 0(0.0) | 1(33.3) | 2(66.7) | ||
| 印戒细胞癌 | 4 | 0(0.0) | 2(50.0) | 2(50.0) | 1(25.0) | 0(0.0) | 3(75.0) | ||
| 浸润深度 | 0.050 | 0.053 | |||||||
| T1 | 8 | 2(25.0) | 4(50.0) | 2(25.0) | 3(37.5) | 2(25.0) | 3(37.5) | ||
| T2 | 10 | 0(0.0) | 8(80.0) | 2(20.0) | 0(0.0) | 5(50.0) | 5(50.0) | ||
| T3 | 41 | 0(0.0) | 25(61.0) | 16(39.0) | 1(2.4) | 19(46.3) | 21(51.2) | ||
| 淋巴结转移 | 0.202 | 0.028 | |||||||
| 无 | 25 | 2(8.0) | 16(64.0) | 7(28.0) | 4(16.0) | 12(48.0) | 9(36.0) | ||
| 有 | 34 | 0(0.0) | 21(61.8) | 13(38.2) | 0(0.0) | 14(41.2) | 20(58.8) | ||
| 远处转移 | 0.196 | 0.384 | |||||||
| 无 | 49 | 2(4.1) | 33(67.3) | 14(28.6) | 4(8.2) | 23(46.9) | 22(44.9) | ||
| 有 | 10 | 0(0.0) | 4(40.0) | 6(60.0) | 0(0.0) | 3(30.0) | 7(70.0) | ||
| 临床分期 | 0.002 | 0.002 | |||||||
| 0+Ⅰ | 11 | 2(18.2) | 5(45.5) | 4(36.4) | 3(27.3) | 3(27.3) | 5(0.0) | ||
| Ⅱ | 12 | 0(0.0) | 12(100.0) | 0(0.0) | 1(8.3) | 10(83.3) | 1(8.3) | ||
| Ⅲ | 25 | 0(0.0) | 16(64.0) | 9(36.0) | 0(0.0) | 10(40.0) | 15(60.0) | ||
| Ⅳ | 11 | 0(0.0) | 4(36.4) | 7(63.6) | 0(0.0) | 3(27.3) | 8(72.7) | ||
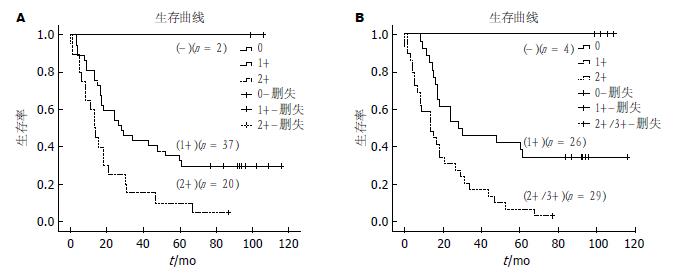
59例胃癌患者的随访结果有13例存活, 46例死亡; 存活时间最长的为116 mo; 总中位生存期为21 mo. Kaplan-Meier法进行生存分析结果如图2, IL-11和Survivin的表达与胃癌患者的生存均呈负相关, 患者IL-11和Survivin表达量越高, 预后越差((P = 0.004和P<0.001).
Cox单因素回归模型分析结果如表4显示, 胃癌患者的总生存期与其淋巴结转移((P = 0.015), 远处转移((P = 0.037)和临床分期(P<0.001)呈负相关; Cox多因素回归模型分析, 得出胃癌患者的总生存期仅与临床分期相关((P = 0.017), 高临床分期显著增加胃癌患者的死亡风险; Ⅲ期、Ⅳ期胃癌患者比Ⅰ、Ⅱ期的死亡风险增加了近5倍(Hr = 4.88, 95%CI: 1.33-17.93).
| 变量 | 单因素分析 | 多因素分析 | ||
| HR(95%CI) | P值 | HR(95%CI) | P值 | |
| 性别(女vs男) | 0.87(0.45-1.69) | 0.678 | 0.94(0.45-1.95) | 0.865 |
| 年龄(<60岁vs≥60岁) | 0.66(0.36-1.21) | 0.176 | 0.91(0.46-1.83) | 0.798 |
| 分化(低vs高+中) | 1.80(0.95-3.40) | 0.070 | 1.20(0.61-2.37) | 0.604 |
| 浸润深度(T2/T3 vs T1) | 1.92(0.69-5.37) | 0.215 | 0.40(0.12-1.33) | 0.134 |
| 淋巴结转移(N1/N3 vs N0) | 2.18(1.16-4.10) | 0.015 | 0.65(0.21-2.00) | 0.455 |
| 远处转移(M0 vs M1) | 0.47(0.23-0.95) | 0.037 | 0.94(0.38-2.35) | 0.897 |
| 临床分期(Ⅲ/ⅣvsⅠ/Ⅱ) | 4.00(1.96-8.14) | <0.001 | 4.88(1.33-17.93) | 0.017 |
| IL-11表达(1+/2+vs -) | 22.57(0.11-4871) | 0.256 | - | 0.983 |
| Survivin表达(1+/2+/3+vs -) | 25.74(0.52-1271) | 0.103 | - | 0.980 |
胃癌的发生发展是由多因子参与调控的复杂过程, 他与幽门螺杆菌(Helicobacter pylori, H. pylori)感染、慢性胃炎以及炎性信号通路密切相关[12], 而在众多炎性信号通路中, 核因子-κB(nuclear factor-κB, NF-κB)和Stat3信号通路是胃癌发生中最重要的两条炎性信号通路[13,14], IL-11和Survivin分别是Stat3信号通路的上下游因子[15], 在肿瘤的发生发展中起到至关重要的作用.
IL-11是新近发现的具有多种生物学功能的一种细胞因子, 他和IL-6同属于造血因子超家族gp130家族, 是强烈的免疫调节因子, 主要来源于间质细胞和骨髓基质细胞[16], 随着不断深入研究发现IL-11与炎性信号通路以及肿瘤的发生发展密切相关[17]. IL-6细胞因子家族通过共同的信号转导受体β亚基gp130发挥作用, 其中IL-6或IL-11分别与其特异性受体α-亚单位(IL-6Rα或IL-11Rα)结合, 诱导gp130的同源二聚化, 从而激活Stat3炎性信号通路, 导致肿瘤的发生及发展[18,19]. 另一方面, IL-11可能通过升高多功能蛋白聚糖(Versican)的表达, 从而促进肿瘤的形成[20]. Versican是一种细胞外基质(extracellular matrix, EMC)分子, 有助于EMC的动态平衡, 他积累在肿瘤基质和细胞中, 能调节细胞增殖、分化、黏附和迁移, 所有这些都是肿瘤侵袭和转移的特征[21]. 本研究发现, IL-11在胃癌中的表达较癌旁明显升高, 强阳性表达率在胃癌与癌旁之间的差异尤为显著. 多因素分析结果显示, 临床分期是影响胃癌预后的一个独立因素, 较高的临床分期对生存的影响是较低临床分期的近5倍. 胃癌患者IL-11表达的升高不仅与较高的临床分期相关, 还与胃癌患者的生存时间密切相关, 说明在胃癌的发生发展过程中, IL-11都起到了至关重要的作用. 孙传政等[22]在肝癌组织中的研究结果与我们相似, 他们发现IL-11、IL-11R在肝癌组织中表达水平显著高于癌旁肝组织, 且与包膜是否受侵犯、门静脉有无癌栓相关; 亦有研究表明IL-11及其受体在乳腺癌和结肠癌[23]中表达升高, 且IL-11增强肿瘤细胞的侵犯作用. Laura等[24]在与我们类似的研究中虽然没有证实IL-11高表达与较差的预后相关, 但也发现了这种趋势, 若其扩大样本量进行重复试验可能会出现这种相关性. 这些均提示IL-11及受体可能影响肿瘤的形成、发展.
同时, IL-11通过Stat3炎性信号通路, 调节Survivin的表达. Survivin是凋亡蛋白抑制剂, 他可以调控细胞周期并对细胞凋亡起到抑制作用[25]. 以前的研究已经表明, Survivin大量表达于胚胎和胎儿组织中, 在大多数终末分化的正常组织中几乎是检测不到的, 而与此相反的是, 在大多数肿瘤组织中Survivin均有不同程度的表达[26], 他减少肿瘤细胞的凋亡, 从而在恶性肿瘤的发生发展及预后过程中起到重要作用. 研究指出Survivin上具有Stat3结合位点, 通过抑制Stat3的表达可以减少Survivin蛋白的表达, 从而促进肿瘤细胞的凋亡[27]. 现在越来越多的实验研究提示Survivin与多种肿瘤发生密切相关[28,29], Survivin的表达增高会增加患胃癌的风险[30]. 本实验发现Survivin在胃癌组织中的表达远远高于癌旁组织, 且与淋巴结转移以及较高的临床分期相关, 同时与胃癌患者的生存预后密不可分. 宋国华等[31]在结肠腺癌中研究发现Survivin蛋白的异常表达可能对结肠腺癌的发生发展及淋巴结转移起着至关重要的作用; 朱燕等[32]在研究发现, Survivin在宫颈癌中表达升高, 且与淋巴结转移相关, 这些都与我们的研究结果相一致. 另外, 我们IL-11和Survivin检测结果的相关性分析显示, 二者之间相关性显著, 可能共同促进胃癌的细胞增殖、侵袭及转移. 虽然Survivin在肿瘤发生中的确切功能尚不清楚, 一个可能的解释可能是, Survivin基因的突变加强了凋亡抑制和调节细胞分裂, 提高了肿瘤细胞的生存能力[30].
本研究提出IL-11与胃癌的生存预后相关, 提示我们可以从IL-11以及Survivin的综合靶向治疗下手, 研究出能够延长癌症患者生命、减轻其痛苦的方法, 提高胃癌患者的生存质量.
我国胃癌无论发病率还是死亡率都远远高于世界水平(接近世界水平的2倍). 在过去的数十年中, 发生率、检查诊断和治疗选择已经发生了很大的变化, 由于胃癌发生、发展及转移的相关分子机制仍不明确及缺乏有效实验研究支撑的临床试验, 胃癌患者预后令人失望, 特别是晚期患者.
姜春萌, 教授, 主任, 大连医科大学附属第二医院消化科
现有一线化疗方案与生物靶向制剂(包括: 单克隆抗体、酪氨酸激酶抑制剂及哺乳动物雷帕霉素蛋白抑制剂)的联合有望取得显著进展, 许多相应的临床试验目前正在进行之中, 从胃癌发生的分子机制上为靶向药物的研发及临床应用提供数据支撑, 本研究是胃癌研究的热点之一.
Necula等研究中虽然没有证实白介素-11(interleukin-11, IL-11)高表达与较差的预后相关, 但发现了这种趋势, 若其进行扩大样本量的重复试验可能会出现这种相关性.
针对肿瘤组织中存在IL-11及其调控的Stat3信号通路下游因子存活素(Survivin)进行研究, 经过收集患者临床病理信息、随访及分析, 观察IL-11和Survivin对胃癌患者预后的影响; 同时为胃癌靶向药物的研究和选用提供实验数据.
IL-11和Survivin作为独立又相关的靶点, 可作为生物靶向制剂与一线化疗方案共同, 可能能够改善患者的生活质量及预后.
本文有重要的临床指导价值.
编辑: 郭鹏 电编:都珍珍
| 1. | Ferlay J, Soerjomataram I, Ervik M, Dikshit R, Eser S, Mathers C, Rebelo M, Parkin DM, Forman D, Bray . GLOBOCAN 2012 v1.0, Cancer Incidence and Mortality Worldwide: IARC CancerBase No. 11 [Internet]. Lyon, France: International Agency for Research on Cancer, 2013. Available from: http: //globocan.iarc.fr. |
| 3. | Okamoto W, Okamoto I, Arao T, Yanagihara K, Nishio K, Nakagawa K. Differential roles of STAT3 depending on the mechanism of STAT3 activation in gastric cancer cells. Br J Cancer. 2011;105:407-412. [PubMed] [DOI] |
| 4. | Woo S, Lee BL, Yoon J, Cho SJ, Baik TK, Chang MS, Lee HE, Park JW, Kim YH, Kim WH. Constitutive activation of signal transducers and activators of transcription 3 correlates with better prognosis, cell proliferation and hypoxia-inducible factor-1α in human gastric cancer. Pathobiology. 2011;78:295-301. [PubMed] [DOI] |
| 5. | Lee MJ, Lee JK, Choi JW, Lee CS, Sim JH, Cho CH, Lee KH, Cho IH, Chung MH, Kim HR. Interleukin-6 induces S100A9 expression in colonic epithelial cells through STAT3 activation in experimental ulcerative colitis. PLoS One. 2012;7:e38801. [PubMed] [DOI] |
| 6. | Zhang L, Yang J, Qian J, Li H, Romaguera JE, Kwak LW, Wang M, Yi Q. Role of the microenvironment in mantle cell lymphoma: IL-6 is an important survival factor for the tumor cells. Blood. 2012;120:3783-3792. [PubMed] [DOI] |
| 7. | Putoczki TL, Thiem S, Loving A, Busuttil RA, Wilson NJ, Ziegler PK, Nguyen PM, Preaudet A, Farid R, Edwards KM. Interleukin-11 is the dominant IL-6 family cytokine during gastrointestinal tumorigenesis and can be targeted therapeutically. Cancer Cell. 2013;24:257-271. [PubMed] [DOI] |
| 8. | Zhu Y, Li Y, Zhu S, Tang R, Liu Y, Li J. Association of survivin polymorphisms with tumor susceptibility: a meta-analysis. PLoS One. 2013;8:e74778. [PubMed] [DOI] |
| 9. | Karam JA, Lotan Y, Ashfaq R, Sagalowsky AI, Shariat SF. Survivin expression in patients with non-muscle-invasive urothelial cell carcinoma of the bladder. Urology. 2007;70:482-486. [PubMed] |
| 10. | Stephen B, April G, David R. Cancer Staging Manual. Seventh Edition. AJCC. 2010;. |
| 11. | 李 一鑫, 张 楠, 陶 林, 杨 兰, 赵 瑾, 张 文杰. 胃癌患者VEGF、VEGFR2高表达的临床病理学意义及其在胃癌进展与生存预后中的作用. 世界华人消化杂志. 2014;22:4406-4414. [DOI] |
| 13. | Gagliani N, Hu B, Huber S, Elinav E, Flavell RA. The fire within: microbes inflame tumors. Cell. 2014;157:776-783. [PubMed] [DOI] |
| 14. | Grivennikov SI, Karin M. Dangerous liaisons: STAT3 and NF-kappaB collaboration and crosstalk in cancer. Cytokine Growth Factor Rev. 2010;21:11-19. [PubMed] [DOI] |
| 15. | Merchant JL. What lurks beneath: IL-11, via Stat3, promotes inflammation-associated gastric tumorigenesis. J Clin Invest. 2008;118:1628-1631. [PubMed] [DOI] |
| 16. | Silver JS, Hunter CA. gp130 at the nexus of inflammation, autoimmunity, and cancer. J Leukoc Biol. 2010;88:1145-1156. [PubMed] [DOI] |
| 17. | Howlett M, Chalinor HV, Buzzelli JN, Nguyen N, van Driel IR, Bell KM, Fox JG, Dimitriadis E, Menheniott TR, Giraud AS. IL-11 is a parietal cell cytokine that induces atrophic gastritis. Gut. 2012;61:1398-1409. [PubMed] [DOI] |
| 18. | Wu D, Tao J, Ding J, Qu P, Lu Q, Zhang W. Interleukin-11, an interleukin-6-like cytokine, is a promising predictor for bladder cancer prognosis. Mol Med Rep. 2013;7:684-688. [PubMed] [DOI] |
| 19. | Onnis B, Fer N, Rapisarda A, Perez VS, Melillo G. Autocrine production of IL-11 mediates tumorigenicity in hypoxic cancer cells. J Clin Invest. 2013;123:1615-1629. [PubMed] [DOI] |
| 20. | Zhang Z, Zhang J, Miao L, Liu K, Yang S, Pan C, Jiao B. Interleukin-11 promotes the progress of gastric carcinoma via abnormally expressed versican. Int J Biol Sci. 2012;8:383-393. [PubMed] [DOI] |
| 21. | Ricciardelli C, Sakko AJ, Ween MP, Russell DL, Horsfall DJ. The biological role and regulation of versican levels in cancer. Cancer Metastasis Rev. 2009;28:233-245. [PubMed] [DOI] |
| 23. | Yoshizaki A, Nakayama T, Yamazumi K, Yakata Y, Taba M, Sekine I. Expression of interleukin (IL)-11 and IL-11 receptor in human colorectal adenocarcinoma: IL-11 up-regulation of the invasive and proliferative activity of human colorectal carcinoma cells. Int J Oncol. 2006;29:869-876. [PubMed] |
| 24. | Necula LG, Chivu-Economescu M, Stanciulescu EL, Bleotu C, Dima SO, Alexiu I, Dumitru A, Constantinescu G, Popescu I, Diaconu CC. IL-6 and IL-11 as markers for tumor aggressiveness and prognosis in gastric adenocarcinoma patients without mutations in Gp130 subunits. J Gastrointestin Liver Dis. 2012;21:23-29. [PubMed] |
| 25. | Bayram S, Akkız H, Bekar A, Akgöllü E. The association between the survivin -31G/C promoter polymorphism and hepatocellular carcinoma risk in a Turkish population. Cancer Epidemiol. 2011;35:555-559. [PubMed] [DOI] |
| 26. | 4 Wang W, Ji W, Hu H, Ma J, Li X, Mei W, Xu Y, Hu H, Yan Y, Song Q. Survivin promoter-regulated oncolytic adenovirus with Hsp70 gene exerts effective antitumor efficacy in gastric cancer immunotherapy. Oncotarget. 2014;5:150-160. [PubMed] |
| 28. | Upadhyay R, Khurana R, Kumar S, Ghoshal UC, Mittal B. Role of survivin gene promoter polymorphism (-31G& gt; C) in susceptibility and survival of esophageal cancer in northern India. Ann Surg Oncol. 2011;18:880-887. [PubMed] [DOI] |
| 29. | Gazouli M, Tzanakis N, Rallis G, Theodoropoulos G, Papaconstantinou I, Kostakis A, Anagnou NP, Nikiteas N. Survivin -31G/C promoter polymorphism and sporadic colorectal cancer. Int J Colorectal Dis. 2009;24:145-150. [PubMed] [DOI] |