修回日期: 2015-08-17
接受日期: 2015-08-27
在线出版日期: 2015-09-18
目的: 探讨人肝细胞癌(hepatocellular carcinoma, HCC)组织中星形细胞上调基因-1(astrocyte elevated gene-1, AEG-1)、核因子-κB(nuclear factor-κB, NF-κB) p65的表达及临床意义.
方法: 采用免疫组织化学SP法检测AEG-1和NF-κB p65蛋白在40例HCC组织、对应癌旁肝组织及8例正常肝组织中的表达情况. 用Western blot方法检测肝癌及癌旁肝组织、正常肝组织中AEG-1和NF-κB p65的表达水平. 应用Kaplan-Meier法分析AEG-1和NF-κB p65的表达与肝癌患者预后的关系.
结果: HCC组织、癌旁肝组织、正常肝组织中的AEG-1阳性表达率分别是72.5%(29/40)、60%(24/40)、12.5%(1/8), 三者之间的差异具有统计学意义(χ2 = 9.74, P<0.05). 且AEG-1在HCC组织、癌旁组织中的表达明显高于在正常肝组织中的表达(P<0.05). NF-κB p65在HCC组织、癌旁组织、正常肝组织中的阳性表达率分别是75%(30/40)、62.5%(25/40)、12.5%(1/8), 三者之间的差异具有统计学意义(χ2 = 11.29, P<0.05), 且NF-κB p65在HCC组织、癌旁组织中的表达明显高于在正常肝组织中的表达(P<0.05). Western blot结果与免疫组织化学结果一致. AEG-1、NF-κB p65双阳性组的生存率低于单阳性组, 差异有显著性(P<0.05).
结论: AEG-1可能通过上调NF-κB p65的表达而促进HCC的发生和转移, 联合检测AEG-1及NF-κB p65在人肝细胞癌中的表达, 有望成为肝癌分子靶向治疗及预后评价的重要指标.
核心提示: 肝癌组织中星形细胞上调基因-1(astrocyte elevated gene-1, AEG-1)与核因子-κB(nuclear factor-κB, NF-κB) p65的表达明显高于癌旁组织和正常肝组织, AEG-1可能通过与NF-κB p65相互作用, 诱导NF-κB通路活化, 导致肝癌的发生、发展.
引文著录: 于营, 罗新华, 程明亮, 程云娟. AEG-1和NF-κB p65在人肝细胞癌中的表达及其临床意义. 世界华人消化杂志 2015; 23(26): 4193-4199
Revised: August 17, 2015
Accepted: August 27, 2015
Published online: September 18, 2015
AIM: To detect the expression of astrocyte elevated gene-1 (AEG-1) and nuclear factor-κB (NF-κB) p65 proteins in hepatocellular carcinoma (HCC) and to analyze their clinical significance.
METHODS: The expression of AEG-1 and NF-κB p65 proteins was detected by immunohistochemical analysis in 40 HCC samples, 40 tumor adjacent tissue samples, and 8 normal hepatic tissue samples. Western blot was also performed for detecting protein levels of AEG-1 and NF-κB p65 in part of the above tissue samples. The relationship between survival and expression of AEG-1 and NF-κB p65 was analyzed by Kaplan-Meier analysis.
RESULTS: The positive expression rates of AEG-1 in HCC, tumor adjacent tissue and normal tissue samples were 72.5% (29/40), 60% (24/40), and 12.5% (1/8), respectively; the differences among the three groups were statistically significant (χ2 = 9.74, P < 0.05). The expression of AEG-1 protein was significantly higher in HCC and tumor adjacent tissue than in normal tissue (P < 0.05). The expression rates of NF-κB p65 protein in HCC, tumor adjacent tissue and normal tissue samples were 75% (30/40), 62.5% (25/40), and 12.5% (1/8), respectively; the differences among the three groups were statistically significant (χ2 = 11.29, P < 0.05). The expression of NF-κB p65 protein was significantly higher in HCC and tumor adjacent tissue than in normal tissue (P < 0.05). The expression of AEG-1 and NF-κB p65 protein determined by Western blot was similar to that by immunohistochemical analysis. The survival rates in patients with positive expression of AEG-1 and NF-κB p65 were significantly lower than those in patients with negative expression (P < 0.05).
CONCLUSION: AEG-1 may promote invasion and metastasis of HCC through up-regulation of NF-κB p65 expression and activity. The combined detection of expression of AEG-1 and NF-κB p65 has significance in gene therapy and in predicting the prognosis of patients with HCC.
- Citation: Yu Y, Luo XH, Cheng ML, Cheng YJ. Clinical significance of expression of AEG-1 and NF-κB p65 proteins in human primary hepatocellular carcinoma. Shijie Huaren Xiaohua Zazhi 2015; 23(26): 4193-4199
- URL: https://www.wjgnet.com/1009-3079/full/v23/i26/4193.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i26.4193
肝癌是异质性强、死亡率高的难治性恶性肿瘤, 我国肝癌的病死率位居肿瘤第2位, 仅次于肺癌[1-3]. 目前认为肝细胞性肝癌(hepatocellular carcinoma, HCC)的发生发展是多诱因、多基因参与、多步骤调控的复杂过程[4]. 星形细胞上调基因-1(astrocyte elevated gene-1, AEG-1)是近年来新发现的癌基因, AEG-1作为肿瘤介质在肿瘤进展的各个方面发挥重要作用[5], 有研究发现, AEG-1可提高肿瘤细胞的锚定生长能力及侵袭性, 并通过激活核因子-κB(nuclear factor-κB, NF-κB)信号通路来增加黏附分子的表达, 促进肿瘤的侵袭和转移. Emdad等[6]研究发现AEG-1通过激活NF-κB信号通路, 能显著提高肝癌细胞株的侵袭能力. 本研究通过检测人肝癌组织中AEG-1和NF-κB p65的表达水平, 探讨AEG-1在HCC发生、发展中的作用, 寻找肝癌早期诊断和分子靶向治疗的新靶标, 为肝癌的诊治提供新途径.
40例肝癌及对应癌旁组织均来自贵州省人民医院肝胆外科2013-08/2014-03手术切除的标本, 癌旁组织距肿瘤边缘2-5 cm. 同时收集正常肝组织标本8例(来自肝血管瘤和肝外伤手术切除的肝组织). 患者术前均未行放、化疗, 所有标本均经病理组织学诊断证实. 其中男性33例, 女性7例, 平均年龄57.47岁±10.03岁. HBsAg阳性27例, 阴性13例, 肿瘤直径≤5 cm的29例, >5 cm的11例; 肝癌病理分化程度参照Edmonson-Steiner标准进行分级[7], 其中Ⅰ/Ⅱ级(高分化)16例, Ⅲ/Ⅳ级(中/低分化)24例; 肝癌TNM分期参照2011年我国原发性肝癌诊疗规范[8]:Ⅰ/Ⅱ期22例, Ⅲ/Ⅳ期18例; 有门脉癌栓形成者15例, 所有病例均有手术前后完整的病案资料. 所选取的40例肝癌标本均分为2份, 一份保存于40 g/mL甲醛中固定以观察病理改变, 一份保存于-80 ℃冰箱中用于Western blot检测, 手术后均进行随访, 随访率100%, 随访起始时间为手术治疗开始日起, 观察终止时间为2015-05-18.
1.2.1 免疫组织化学法: 采用SP法, 微波加热抗原修复, 以DAB显色. 兔抗人AEG-1单克隆抗体为Abcam公司产品, 兔抗人NF-κB p65多克隆抗体及免疫组织化学试剂盒均购自武汉博士德生物技术有限公司. 操作程序按说明书进行. 阴性对照以PBS替代一抗, 用已知阳性标本作阳性对照.
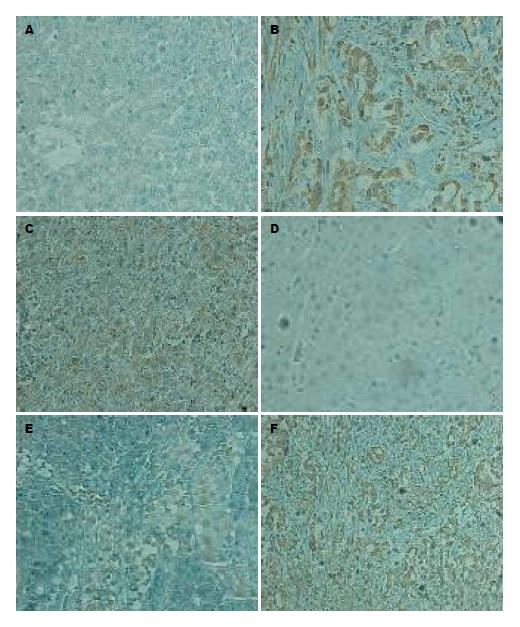
1.2.2 染色结果判定标准: 原发性肝癌组织和癌周组织中阳性细胞检测参照胞核或胞质中出现棕黄色颗粒者为阳性细胞. AEG-1定位于核周, 胞质中可见部分表达; NF-κB p65主要定位于细胞质, 部分可见胞核表达. 由两位医师采用双盲法观察每张切片. 参照综合染色强度和阳性细胞数(占总细胞数的百分比)来进行半定量处理. 染色强度按下列评分标准评分: 细胞无显色者为0分, 细胞呈浅黄色者为1分, 细胞呈棕黄色者2分, 细胞呈棕褐色者为3分(染色深浅需与背景着色相对比); 阳性细胞数评分方法: 阳性细胞占总细胞的0-10%者为0分, 10%-50%者为1分, 51%-80%者为2分, >80%者为3分. 上述两项评分(1)与(2)相乘, 以4分为界, ≥4分者为高表达, <4分者为低表达[9].
1.2.3 Western blot检测法: 用RIPA细胞裂解液提取各组细胞总蛋白, BCA法测蛋白浓度, 变性处理后进行聚丙烯酰胺凝胶电泳, 半干转至PVDF膜, 5%脱脂牛奶室温封闭1 h, 加入单抗4 ℃过夜后, 再加1:1000稀释的HRP标记的二抗, 室温孵育1 h, 经PBST清洗3次, ECL发光显影.
统计学处理 采用SPSS17.0统计软件进行数据分析, AEG-1和NF-κB p65在肝癌组织、癌旁组织、正常组织中的表达差异以及与各临床病理类型的关系采用Pearson χ2检验或Fisher确切概率法, AEG-1和NF-κB p65在HCC中的相关性采用Spearman等级相关分析; 用Kaplan-Meier法描述生存曲线, Log-rank法进行统计学意义检验. P<0.05为差异有统计学意义.
AEG-1在正常肝组织、癌旁组织、肝癌组织中的总阳性率分别为: 12.5%(1/8)、60%(24/40)、72.5%(29/40), AEG-1在肝癌组织中定位于核周, 胞质中可见部分表达(图1). NF-κB p65在正常肝组织、癌旁组织、肝癌组织中的总阳性率分别为: 12.5(1/8)、62.5%(25/40)、75%(30/40), NF-κB p65在癌组织中以胞质型为主, 部分可见胞核表达(图1).
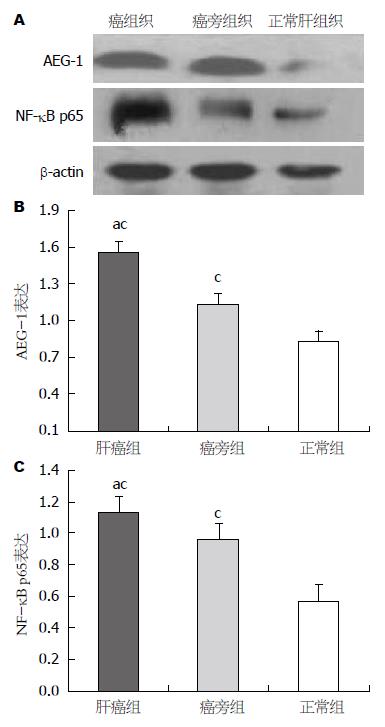
Western blot 结果显示肝癌组织、癌旁组织中的AEG-1和NF-κB p65蛋白高水平表达, 而正常肝组织仅检测出极低水平的AEG-1和NF-κB p65蛋白(图2).
AEG-1和NF-κB p65在HCC中的表达与性别、年龄、HBsAg、肿瘤大小均无关, 而与病理分化程度、TNM分期及转移有关(P<0.05, 表1).
| 临床病理因素 | AEG-1阳性表达 | P值 | NF-κB p65阳性表达 | P值 |
| 性别 | 0.075 | 1.000 | ||
| 男 | 26 | 25 | ||
| 女 | 3 | 5 | ||
| 年龄(岁) | 0.686 | 0.190 | ||
| <50 | 6 | 5 | ||
| ≥50 | 23 | 25 | ||
| HBsAg | 0.128 | 0.246 | ||
| 阳性 | 22 | 22 | ||
| 阴性 | 7 | 8 | ||
| 肿瘤大小(cm) | 0.233 | 0.696 | ||
| ≤5 | 19 | 21 | ||
| >5 | 10 | 9 | ||
| 病理分化程度 | 0.014 | 0.007 | ||
| Ⅰ-Ⅱ | 8 | 8 | ||
| Ⅲ-Ⅳ | 21 | 22 | ||
| TNM分期 | 0.006 | 0.013 | ||
| Ⅰ-Ⅱ | 20 | 13 | ||
| Ⅲ-Ⅳ | 9 | 17 | ||
| 门脉癌栓 | 0.009 | 0.024 | ||
| 有 | 7 | 8 | ||
| 无 | 22 | 22 |
在40例肝细胞性肝癌组织中, AEG-1的表达与NF-κBp65的表达呈正相关性(r = 0.42, P<0.05).
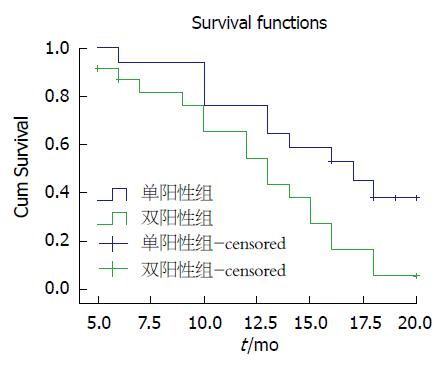
AEG-1和NF-κB p65双阳性表达的患者6、12、20 mo生存率为86.96%、73.91%、56.52%, 单阳性表达的患者6、12、20 mo生存率为94.11%、82.35%、64.70%, 两组间差异有统计学意义(P = 0.019, 图3).
AEG-1基因最初在人胚胎初级星形胶质细胞中发现, 位于与多种恶性肿瘤发生密切相关的人类8号染色体(8q22)上[10], AEG-1在黑色素瘤、恶性胶质瘤、乳腺癌、肺癌等多种恶性肿瘤中表达显著升高[11-14]. 研究[15,16]发现, AEG-1可启动如P13K/Akt、NF-κB、Wnt/β-catenin、MAPK等多个信号转导途径, 在肿瘤的发生、增殖、血管生成、抗凋亡、侵袭以及转移等多方面发挥重要作用[17,18]. 其中NF-κB信号通路持续异常激活可诱导癌基因的表达, 提高肿瘤细胞的浸润和侵袭能力.
NF-κB是一种存在于真核细胞中的重要的核转录因子, 研究[19-21]表明NF-κB 与人体的恶性肿瘤如食管癌、胰腺癌、胃癌、肝癌等多种癌症密切相关. 人体内, p50和p65是NF-κB家族中最为重要的两个因子, 其中, NF-κB p65能够诱导细胞表达大量的抗凋亡基因, 抑制肿瘤细胞的凋亡[22-24], 同时激活原癌基因, 促进细胞增殖. 研究[25]发现, AEG-1在TNF-α诱导或受到其他致癌因素刺激时, 胞质内的AEG-1 N末端第71个氨基酸与抑制因子IkB结合, 促进静止状态的三聚体p50-p65-IkB降解, NF-κB二聚体p50-p65得到释放, 活化的NF-κB转位到核内, 同时P65亚基上的DNA结合位点暴露, 与基因上的κB位点发生特异性结合, 从而启动或增强某些基因的转录. 同时一部分AEG-1也进入细胞核, 在核内与循环的AMP反应元件糖结合蛋白CBP形成蛋白质-蛋白质的结合, 即桥接NF-κB和CBP并与之形成转录基础复合物, 促进包括细胞黏附分子、MMP、环氧化酶-2、炎性细胞因子等NF-κB下游基因的表达[26]. 从而促进肿瘤细胞的侵袭和血管新生. Kikuno等[27]发现沉默AEG-1, 使NF-κB活性下降, 相应的NF-κB调节蛋白表达减少, 明显降低前列腺癌细胞株的侵袭能力.
本实验通过免疫组织化学法及Western blot检测了AEG-1与NF-κB p65在肝癌组织中的表达, 结果发现, 肝癌组织中AEG-1与NF-κB p65的表达明显高于癌旁组织和正常肝组织, 与Wang等[28]对头颈部鳞状细胞癌中AEG-1及NF-κB的研究相符合. Robertson等[29]研究发现, 在敲除AEG-1基因的小鼠中, 肝癌的发生率明显降低, 且AEG-1在通过NF-κB信号调节的过程中, 起着关键性作用. 因此, 我们推测, 当肝组织中AEG-1受到刺激时, 发生核易位, 与NF-κB p65相互作用, 诱导NF-κB通路活化, 引起下游基因异常表达, 导致肝细胞异常增生、癌变. 因此, 如果我们阻断AEG-1表达, 从而抑制NF-κB通路活化, 有可能减少HCC的发生或延缓HCC进展, 这将为肝癌的靶向治疗提供新的途径.
研究发现AEG-1与HCC组织的上皮间质转化和HCC患者临床预后密切相关[16,30]. 本实验对肝癌临床病理特征与生存率进行了相关性分析, 结果发现, AEG-1、NF-κB p65双阳性表达的病例, 其生存率较单阳性表达病例明显降低, 提示在肝癌细胞中, AEG-1和NF-κB p65可能协同促进肝癌的发展演变, 从而影响肝癌患者的预后.
星形细胞上调基因-1(astrocyte elevated gene-1, AEG-1)是近年来新发现的癌基因, 可促进肿瘤的进展和转移. 本研究通过检测人肝癌组织中AEG-1、核因子-κB(nuclear factor-κB, NF-κB) p65的表达水平, 探讨AEG-1在肝细胞癌(hepatocellular carcinoma, HCC)发生、发展中的作用, 为肝癌的诊治提供新途径.
朱争艳, 研究员, 天津市第三中心医院
Robertson等研究发现, AEG-1基因敲除的小鼠, 肝癌发生率和发生肺转移的几率明显降低.
Jung等研究发现, AEG-1的表达水平是肝癌患者手术后生存的独立危险因素.
本研究通过检测AEG-1和NF-κB p65在人肝癌组织中的表达, 并分析肝癌临床病理特征及预后的关系, 为原发性肝癌的诊治提供了理论依据.
联合检测AEG-1和NF-κB p65在肝组织中的表达, 对预测肝癌的发生、发展及预后可能具有潜在的应用价值.
本文探讨AEG-1在HCC发生、发展中的作用, 使其有望成为肝癌早期诊断和分子靶向治疗的新靶标.
编辑: 于明茜 电编: 闫晋利
| 1. | El-Serag HB, Rudolph KL. Hepatocellular carcinoma: epidemiology and molecular carcinogenesis. Gastroenterology. 2007;132:2557-2576. [PubMed] |
| 2. | Parkin DM, Bray F, Ferlay J, Pisani P. Global cancer statistics, 2002. CA Cancer J Clin. 2005;55:74-108. [PubMed] |
| 3. | 叶 胜龙, 秦 叔逵, 吴 孟超, 汤 钊猷, 孙 燕, 管 忠震. 原发性肝癌规范化诊治的专家共识. 胃肠病学和肝病学杂志. 2009;18:483-492. |
| 5. | Chen X, Dong K, Long M, Lin F, Wang X, Wei J, Ren J, Zhang H. Serum anti-AEG-1 auto-antibody is a potential novel biomarker for malignant tumors. Oncol Lett. 2012;4:319-323. [PubMed] |
| 6. | Emdad L, Sarkar D, Su ZZ, Randolph A, Boukerche H, Valerie K, Fisher PB. Activation of the nuclear factor kappaB pathway by astrocyte elevated gene-1: implications for tumor progression and metastasis. Cancer Res. 2006;66:1509-1516. [PubMed] |
| 7. | Edmondson HA, Steiner PE. Primary carcinoma of the liver: a study of 100 cases among 48,900 necropsies. Cancer. 1954;7:462-503. [PubMed] |
| 9. | 张 静波, 李 聪摇, 李 英红, 蔡 健苹, 王 红梅, 刘 嚣嚣, 石 清涛, 耿 敬妹. AEG-1和MMP-9在上皮性卵巢组织中的表达及其临床相关性和病理特征. 实用肿瘤学杂志. 2013;27:234-238. |
| 10. | Anttila V, Stefansson H, Kallela M, Todt U, Terwindt GM, Calafato MS, Nyholt DR, Dimas AS, Freilinger T, Müller-Myhsok B. Genome-wide association study of migraine implicates a common susceptibility variant on 8q22.1. Nat Genet. 2010;42:869-873. [PubMed] [DOI] |
| 11. | Sun S, Ke Z, Wang F, Li S, Chen W, Han A, Wang Z, Shi H, Wang LT, Chen X. Overexpression of astrocyte-elevated gene-1 is closely correlated with poor prognosis in human non-small cell lung cancer and mediates its metastasis through up-regulation of matrix metalloproteinase-9 expression. Hum Pathol. 2012;43:1051-1060. [PubMed] [DOI] |
| 12. | Lee SG, Jeon HY, Su ZZ, Richards JE, Vozhilla N, Sarkar D, Van Maerken T, Fisher PB. Astrocyte elevated gene-1 contributes to the pathogenesis of neuroblastoma. Oncogene. 2009;28:2476-2484. [PubMed] [DOI] |
| 13. | Liu X, Zhang N, Li X, Moran MS, Yuan C, Yan S, Jiang L, Ma T, Haffty BG, Yang Q. Identification of novel variants of metadherin in breast cancer. PLoS One. 2011;6:e17582. [PubMed] [DOI] |
| 14. | Ash SC, Yang DQ, Britt DE. LYRIC/AEG-1 overexpression modulates BCCIPalpha protein levels in prostate tumor cells. Biochem Biophys Res Commun. 2008;371:333-338. [PubMed] [DOI] |
| 15. | Yoo BK, Emdad L, Lee SG, Su ZZ, Santhekadur P, Chen D, Gredler R, Fisher PB, Sarkar D. Astrocyte elevated gene-1 (AEG-1): A multifunctional regulator of normal and abnormal physiology. Pharmacol Ther. 2011;130:1-8. [PubMed] [DOI] |
| 16. | Zheng J, Li C, Wu X, Liu M, Sun X, Yang Y, Hao M, Sheng S, Sun Y, Zhang H. Astrocyte elevated gene-1 (AEG-1) shRNA sensitizes Huaier polysaccharide (HP)-induced anti-metastatic potency via inactivating downstream P13K/Akt pathway as well as augmenting cell-mediated immune response. Tumour Biol. 2014;35:4219-4224. [PubMed] [DOI] |
| 17. | Zheng J, Li C, Wu X, Liu M, Sun X, Yang Y, Hao M, Sheng S, Sun Y, Zhang H. Huaier polysaccharides suppresses hepatocarcinoma MHCC97-H cell metastasis via inactivation of EMT and AEG-1 pathway. Int J Biol Macromol. 2014;64:106-110. [PubMed] [DOI] |
| 18. | 郝 刚, 周 芳, 吴 晓兰, 王 广基. AEG-1基因在肿瘤研究中的进展. 中国临床药理学与治疗学. 2011;16:679-687. |
| 19. | Kang R, Tang D, Schapiro NE, Livesey KM, Farkas A, Loughran P, Bierhaus A, Lotze MT, Zeh HJ. The receptor for advanced glycation end products (RAGE) sustains autophagy and limits apoptosis, promoting pancreatic tumor cell survival. Cell Death Differ. 2010;17:666-676. [PubMed] [DOI] |
| 20. | Jiang W, Wang Z, Li X, Li J, Huang Y, Fan X, Duan Y. Reduced high-mobility group box 1 expression induced by RNA interference inhibits the bioactivity of hepatocellular carcinoma cell line HCCLM3. Dig Dis Sci. 2012;57:92-98. [PubMed] [DOI] |
| 21. | Bellas RE, FitzGerald MJ, Fausto N, Sonenshein GE. Inhibition of NF-kappa B activity induces apoptosis in murine hepatocytes. Am J Pathol. 1997;151:891-896. [PubMed] |
| 22. | Pikarsky E, Porat RM, Stein I, Abramovitch R, Amit S, Kasem S, Gutkovich-Pyest E, Urieli-Shoval S, Galun E, Ben-Neriah Y. NF-kappaB functions as a tumour promoter in inflammation-associated cancer. Nature. 2004;431:461-466. [PubMed] |
| 23. | Barkett M, Gilmore TD. Control of apoptosis by Rel/NF-kappaB transcription factors. Oncogene. 1999;18:6910-6924. [PubMed] |
| 24. | Ehrhardt H, Fulda S, Schmid I, Hiscott J, Debatin KM, Jeremias I. TRAIL induced survival and proliferation in cancer cells resistant towards TRAIL-induced apoptosis mediated by NF-kappaB. Oncogene. 2003;22:3842-3852. [PubMed] |
| 25. | Sarkar D, Park ES, Emdad L, Lee SG, Su ZZ, Fisher PB. Molecular basis of nuclear factor-kappaB activation by astrocyte elevated gene-1. Cancer Res. 2008;68:1478-1484. [PubMed] [DOI] |
| 26. | Emdad L, Sarkar D, Lee SG, Su ZZ, Yoo BK, Dash R, Yacoub A, Fuller CE, Shah K, Dent P. Astrocyte elevated gene-1: a novel target for human glioma therapy. Mol Cancer Ther. 2010;9:79-88. [PubMed] [DOI] |
| 27. | Kikuno N, Shiina H, Urakami S, Kawamoto K, Hirata H, Tanaka Y, Place RF, Pookot D, Majid S, Igawa M. Knockdown of astrocyte-elevated gene-1 inhibits prostate cancer progression through upregulation of FOXO3a activity. Oncogene. 2007;26:7647-7655. [PubMed] |
| 28. | Wang YP, Liu IJ, Chiang CP, Wu HC. Astrocyte elevated gene-1 is associated with metastasis in head and neck squamous cell carcinoma through p65 phosphorylation and upregulation of MMP1. Mol Cancer. 2013;12:109. [PubMed] [DOI] |
| 29. | Robertson CL, Srivastava J, Siddiq A, Gredler R, Emdad L, Rajasekaran D, Akiel M, Shen XN, Guo C, Giashuddin S. Genetic deletion of AEG-1 prevents hepatocarcinogenesis. Cancer Res. 2014;74:6184-6193. [PubMed] [DOI] |
| 30. | Zheng J, Li C, Wu X, Yang Y, Hao M, Sheng S, Sun Y, Zhang H, Long J, Hu C. Astrocyte elevated gene-1 is a novel biomarker of epithelial-mesenchymal transition and progression of hepatocellular carcinoma in two China regions. Tumour Biol. 2014;35:2265-2269. [PubMed] [DOI] |