修回日期: 2015-07-02
接受日期: 2015-08-17
在线出版日期: 2015-09-18
目的: 通过慢病毒-热休克转录因子2-RNA干扰(lentivirus-heat shock transcription factor 2-RNA interference, LV-HSF2-RNAi)人巨噬细胞系(THP-1), 探讨HSF2对THP-1细胞NOD样受体3(NOD-like receptor family, pyrin domain containing 3, NLRP3)炎症复合体及其下游白介素-1β(interleukin-1β, IL-1β)的影响.
方法: 选用THP-1作为研究对象, 使用慢病毒(LV-HSF2-RNAi)转染THP-1, 干扰其HSF2表达, 使用佛波酯(phorbol 12-myristate 13-acetate, PMA)诱导THP-1细胞分化为巨噬细胞; 将细胞分为对照组与转染组, 使用脂多糖(lipopolysaccharides, LPS)刺激细胞; 凝胶电泳PCR检测细胞NLRP3、凋亡相关斑点样蛋白(apoptosis associated speck- like protein containing a CADR domain, ASC)、半胱氨酸蛋白酶-1(cysteine-requiring aspartate protease-1, Caspase1)、IL-1β mRNA表达; 蛋白质免疫印迹实验(Western blot)检测细胞NLRP3、ASC、Caspase1、IL-1β蛋白表达; 酶联免疫吸附测定(ELISA)检测细胞培养基内IL-1β水平.
结果: Western blot检测HSF2干扰组中HSF2蛋白表达明显低于未转染组和阴性对照组(P<0.05); PMA诱导THP-1细胞分化, LPS刺激后, 干扰组NLRP3、ASC、Caspase1、IL-1β mRNA及蛋白表达水平明显高于对照组及干扰对照组(P<0.05); HSF2干扰组IL-1β表达水平明显高于未转染组及阴性对照组(538.800 pg/mL±52.250 pg/mL vs 257.010 pg/mL±26.148 pg/mL, 238.231 pg/mL±29.245 pg/mL, P<0.05).
结论: 干扰HSF2可以明显提高THP-1细胞NLRP3炎症复合体活化水平, 提高IL-1β水平.
核心提示: 前期研究提示热休克转录因子2(heat shock transcription factor 2, HSF2)可能参与溃疡性结肠炎(ulcerative colitis, UC)发生、发展, NLRP3炎症复合体与UC关系密切, 目前国内外暂无HSF2与NOD样受体3(NOD-like receptor family, pyrin domain containing 3, NLRP3)炎症复合体间关系的研究, 本研究发现低水平HSF2可以促进NLRP3炎症复合体在THP-1细胞内的表达, 促进炎症反应.
引文著录: 杨刚, 张峰睿, 李小玉, 牛俊坤, 缪应雷. 干扰HSF2对THP-1细胞NLRP3炎症复合体的影响. 世界华人消化杂志 2015; 23(26): 4184-4192
Revised: July 2, 2015
Accepted: August 17, 2015
Published online: September 18, 2015
AIM: To study the effect of heat shock transcription factor 2 (HSF2) silencing on NLR family, pyrin domain containing 3 (NLRP3) inflammasome in THP-1 cells.
METHODS: THP-1 cells were transfected with a lentivirial vector (LV-HSF2-RNAi) to induce HSF2 silencing. PMA was used to induce THP-1 cells to differentiate into macrophages. Then different groups of cells were stimulated with lipopolysaccharides (LPS). The mRNA and protein expression levels of NLRP3, ASC, Caspase1 and IL-1β were measured by RT-PCR and Western Blot, respectively. The level of IL-1β was measured by ELISA.
RESULTS: The protein level of HSF2 in the HSF2-siRNA group was significantly lower than those in the control group and negative siRNA group (P < 0.05). The mRNA and protein expression levels of NLRP3, ASC, Caspase1 and IL-1β in the HSF2-siRNA group were significantly higher than those in the control group and negative siRNA group (P < 0.05). IL-1β levels in cell supernants in the HSF2-siRNA group were significantly higher than those in the control group and negative siRNA group (control group: 257.010 pg/mL±26.148 pg/mL; siRNA group: 538.800 pg/mL±52.250 pg/mL; negative siRNA group: 238.231 pg/mL±29.245 pg/mL) (P < 0.05).
CONCLUSION: HSF2 silencing significantly raises the mRNA and protein expression of NLRP3 inflammasome and IL-1β in THP-1 cells.
- Citation: Yang G, Zhang FR, Li XY, Niu JK, Miao YL. Effect of HSF2 silencing on NLRP3 inflammasome in THP-1 cells. Shijie Huaren Xiaohua Zazhi 2015; 23(26): 4184-4192
- URL: https://www.wjgnet.com/1009-3079/full/v23/i26/4184.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i26.4184
炎症性肠病(inflammatory bowel disease, IBD)是一种病因不清的世界性医疗难题, 溃疡性结肠炎(ulcerative colitis, UC)是其主要类型, UC是一种以腹痛、腹泻、便血等为临床特征的肠道非特异性炎症疾病, 疾病常反复发作, 病程迁延不愈, 临床需与多种疾病鉴别, 故其诊断十分困难. 近年来, 随着我国社会经济水平及医疗水平的不断提高, IBD发病率及患病率不断上升[1], 其中, UC患病率及发病率远高于CD. 在中国, UC在消化系统疾患中已愈发多见, 因疾病诊疗困难, 常使患者出现"因病致穷、因病致残、因病致死"的情况, 而UC高发年龄分布呈双峰状(20-30岁及60-70岁)[2], 患者多为青壮年及老年人, 造成了越发严重的社会、家庭及医疗负担.
热休克蛋白(heat shock protein, HSP)是细胞在环境高温诱导下, 为了耐受环境变化而产生的一组保护性应激蛋白(stress protein, SP). 2009年, 国外学者研究[3-6]认为HSPs(HSF1、HSP70)可能通过抑制促炎细胞因子、黏附因子及细胞死亡来达到针对IBD的保护作用. HSPs在细胞氧化应激过程中亦扮演重要角色, 其可通过清除氧化性蛋白质的累积、保护抗氧化酶活性等方面达到保护作用.
HSP基因表达的调节主要发生在转录水平, 而热休克转录因子(heat shock transcription factor, HSF)是HSP基因转录的关键调控因子, 受到广泛关注. 真核生物中已发现HSF1、HSF2、HSF3、HSF4四种不同的亚型. 其中, HSF1对热刺激敏感, 也是最主要的, 研究最深入的应激热休克转录因子, 其功能可能包括抗炎、促进肿瘤发生和维持效应、抗衰老、促进生长发育、调节体温、抗凋亡等[7,8].
固有免疫又被称为非特异性免疫, 其作为机体防御的第一道防线, 作用至关重要[9], 巨噬细胞、单核细胞、上皮细胞等均参与固有免疫, 其中, 吞噬细胞可以通过模式识别受体(pattern recognition receptor, PRR)识别并吞噬侵入机体的病原体, 并向下通过一系列细胞信号传导通路, 激活胞内炎性反应, 释放多种促炎细胞因子, 加剧炎症反应[10], PRR可位于胞膜[即Toll样受体(Toll-like receptor, TLR)], 亦可位于胞内[即NOD样受体(NOD-like receptor, NLR)], 二者均可由各种病原相关分子模式(pathogen-associated molecular pattern, PAMP)激活, PAMP是一类微生物病原体共有的保守组分, 包括磷壁酸(teichoic acid, LTA)、脂多糖(lipopolysaccharides, LPS)等[11].
NOD样受体3(NOD-like receptor family, pyrin domain containing 3, NLRP3)炎症复合体属于NLR家族, 是迄今为止研究最为明确的炎症体, 其由NLRP3支架、凋亡相关斑点样蛋白(apoptosis associated speck- like protein containing a CADR domain, ASC)及半胱氨酸蛋白酶-1(cysteine-requiring aspartate protease-1, Caspase1)三部分构成. 在Caspase1信号途径中起到活化因子的作用[12]. Caspase1与促炎症反应关系最为密切, 其前体为无活性的酶原pro-Caspase1, 通过其自身的CARD结构域与ASC的CARD结构域结合, 被激活为有活性的Caspase1形式, 而Caspase1又可继续将无活性的pro-白介素-1β(interleukin-1β, IL-1β)剪切激活成为有生物活性的IL-1β, 最终加剧机体炎症反应[13]. 然而, NLRP3炎症复合体的激活机制尚不明确, 国内外研究提出了三大激活方式, 即细胞内钾离子外流、组织蛋白酶B的释放以及活性氧(reactive oxygen species, ROS)三种方式. 其中, ROS介导的NLRP3炎症复合体激活被认为是调控NLRP3激活的关键途径[14-17].
2008年, 本研究小组采用高通量基因芯片, 发现对于UC患者与健康对照组而言, 在外周血单个核细胞(peripheral blood mononuclear cell, PBMC)中, HSF2为差异表达的基因, 差异达2倍以上. 2010年, 利用蛋白组学双向凝胶电泳(two-dimensional gel electrophoresis, 2-DE)和基质辅助激光解吸电离飞行时间质谱(matrix assisted laser desorption/ionization-time of flight-massspectrometry, MALDI-TOF-MS)发现在UC患者与健康对照者血清中, HSF2蛋白表达存在明显差异[18]. 上述一系列研究均提示HSF2可能与UC的发生、发展相关, 有成为全新UC诊断标志物的潜力.
目前, 国内外暂无HSF2与NLRP3炎症复合体间关系的研究, 故为进一步探索HSF2在UC发生、发展中对机体固有免疫及氧化应激的作用和机制, 本课题通过培养人巨噬细胞系THP-1细胞, 经PMA诱导分化为巨噬细胞后, 使用LPS刺激细胞, 模拟炎性环境, 采用慢病毒RNA干扰技术, 比较正常水平和低水平HSF2对巨噬细胞NLRP3炎症复合体及其下游IL-1β的影响, 为UC的诊治研究提供新思路.
THP-1细胞受赠于中国科学院昆明动物研究所, 采用RPMI 1640培养液及10%胎牛血清(HyClone, USA)于37 ℃、50 mL/L CO2细胞培养箱内培养; 佛波酯及脂多糖购自Thermo公司; HSF2干扰慢病毒(lentivirus-heat shock transcription factor 2-RNA interference, LV-HSF2-RNAi)及慢病毒阴性对照购自中国吉凯基因化学技术有限公司; 总RNA抽提试剂盒购自天根生化科技(北京)有限公司; cDNA第一链合成试剂盒购自TaKaRa公司; NLRP3、ASC、Caspase1及IL-1β引物序列于GenBank查询后由深圳华大基因公司负责完成合成; HSF2抗体(sc-13056)购自Santa Cruz公司; NLRP3(D2P5E)(13158)、ASC(E1E3I)(13833)、Caspase1(D7F10)(3866)及pro-IL-1β(D3U3E)(12703)抗体购自CST公司; β-actin(60008-1-Ig)购自Proteintech公司; PVDF膜购自Millipore, Billerica公司; 蛋白电泳marker及免疫印迹发光显色底物购自Thermo公司; X光片、显影液、定影液购自Eastman Kodak公司; IL-1β Elisa试剂盒购自中国欣博盛生物科技有限公司.
1.2.1 细胞培养: 以常规技术行细胞培养, 3-4 d换液1次. 以生长情况作为传代依据, 按1:2-1:3比例传代.
1.2.2 慢病毒干扰细胞HSF2表达: 上海吉凯基因化学技术有限公司购买1组RNA干扰慢病毒(hU6-MCS-Ubiquitin-EGFP-IRES-puromycin)以及1组阴性对照慢病毒(all negative control)转染入细胞, 通过荧光显微镜观察干扰效率, 通过Western blot验证干扰效果, 以确保后续实验. 慢病毒转染按照产品说明书进行, 荧光显微镜下观察GFP表达情况, 评估转染效率, 并进行后续实验.
实验细胞分组: 未转染组(control): 经160 nmol/L PMA诱导分化为巨噬细胞[19], 后用100 ng/mL LPS处理细胞; 干扰对照组(negative siRNA): 转染入阴性对照慢病毒, 经160 nmol/L PMA诱导分化为巨噬细胞, 后用100 ng/mL LPS处理细胞; 干扰组(siRNA): 转染入RNA干扰慢病毒, 经160 nmol/L PMA诱导分化为巨噬细胞, 后用100 ng/mL LPS处理细胞.
1.2.3 Western blot检测NLRP3、ASC、Caspase1、IL-1β蛋白表达: (1)THP-1细胞蛋白提取: 将各组细胞培养板置于冰上, 吸尽原培养液. 使用PBS充分洗涤, 重复3遍; 向细胞培养板孔内加入电泳上样缓冲液(2×), 均匀刮细胞, 将刮取后的细胞移至1.5 mL离心管中, 后在沸水中煮15-20 min, 使细胞蛋白充分受热变性; -20 ℃低温冰箱保存; (2)蛋白含量测定: 按试剂盒(BCA Protein Assay Kit)说明书操作, 根据标准曲线计算蛋白浓度; (3)Western blot: 按照SDS-PAGE电泳、转膜(湿转)、封闭及抗体孵育、目的蛋白条带显影及结果分析等步骤顺序完成. 运用Image J软件行条带灰度分析比较.
1.2.4 凝胶电泳PCR检测NLRP3、ASC、Caspase1、IL-1βmRNA水平: (1)提取细胞总RNA: 使用天根RNA Simple Total RNA kit试剂盒提取THP-1细胞总RNA并使用紫外线分光光度计测定RNA浓度, 严格保证后续试验mRNA浓度一致; (2)cDNA逆转录: 依照Takara Reverse Transcriptase M-MLV(RNase H-)试剂盒说明书完成cDNA逆转录, 合成的cDNA立即-20 ℃保存; (3)引物设计: 依据GenBank中人NLRP3、ASC、Caspase1、IL-1β和GAPDH的基因序列, 利用Primer Premier 5.0软件设计引物, 引物由华大基因公司合成(表1); (4)待测样品凝胶电泳PCR: 根据TaKaRa Reverse Transcriptase M-MLV(RNase H-)试剂盒说明书配置cDNA样品凝胶电泳PCR反应体系, 后将其上PCR机, 反应条件为: 预变性: 95 ℃ 5 min; 变性: 95 ℃ 30 s; 退火: 55 ℃ 30 s; 延伸: 72 ℃ 3 min; 共30个循环; 补平: 72 ℃ 10 min; (5)PCR产物分析: 配置2%琼脂糖凝胶, 取20 μL上述PCR产物, 依次上样, 样品孔两侧加DNA marker. 90 V电压下电泳至溴酚兰指示剂离胶底0.5 cm. 仔细观察条带, 根据DNA marker确定目标条带, 及时拍照记录. 运用Image J软件行条带灰度分析比较.
| 引物名称 | 序列 | 扩增大小(bp) |
| NLRP3 | F: 5'-TCTCTAGCTGTTCCTGAGGCTG-3' | 228 |
| R: 5'-TAGGCTTCGGTCCACACAGAAA-3' | ||
| ASC | F: 5'-TCTACCTGGAGACCTACGGC-3' | 108 |
| R: 5'-TCCAGAGCCCTGGTGC-3' | ||
| Caspase1 | F: 5'-GCCTGTTCCTGTGATGTGGA-3' | 175 |
| R: 5'-TTCACTTCCTGCCCACAGAC-3' | ||
| IL-1β | F: 5'-CAACAGGCTGCTCTGGGATT-3' | 118 |
| R: 5'-GTCCTGGAAGGAGCACTTCAT-3' | ||
| GAPDH | F: 5'-GGA AGGTGAAGGTCGGAGTC-3' | 285 |
| R: 5'-TCAGCCTTGACGGTGCCATG-3' |
1.2.5 酶联免疫吸附试验: 收集不同分组细胞上清, 分装至不同离心管中按Human IL-1β ELISA试剂盒说明书检测细胞因子, 测定A450值. 保存结果.
统计学处理 实验数据均来源至少3次独立实验, 有可重复性. 所有数据采用SPSS19.0软件进行统计分析, 计量资料数据经正态检验均为正态分布, 用mean±SD表示, 多组间计量资料的比较采用单因素方差分析(one-way ANOVA), P<0.05为差异具有统计学意义.
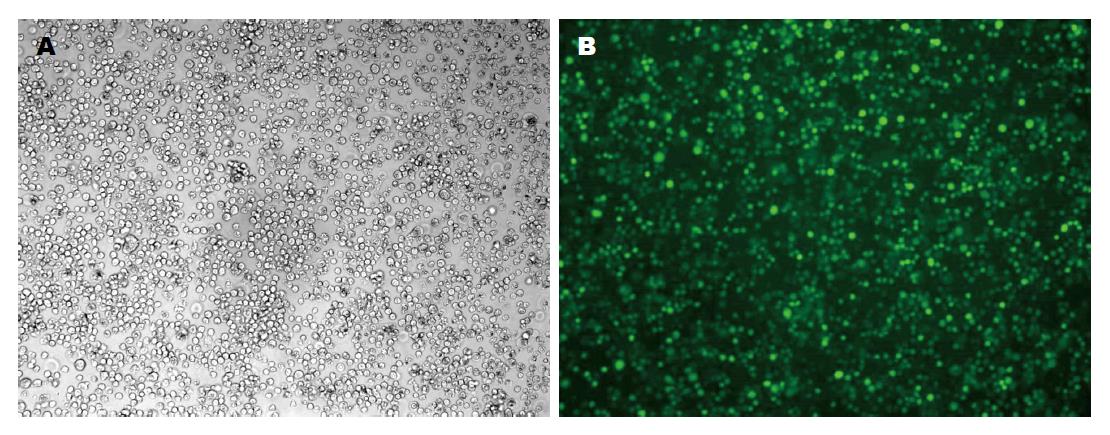
倒置荧光显微镜观察GFP表达情况, 结果提示转染组(HSF2干扰组+慢病毒阴性对照组)可见明显GFP表达, 转染效率>80%(图1). Western blot检测HSF2蛋白干扰情况显示转染入慢病毒(LV-HSF2-RNAi)细胞的HSF2蛋白质水平较未转染组(Control)及阴性对照组(Negative siRNA)显著减少(F = 1609.351, P<0.05).
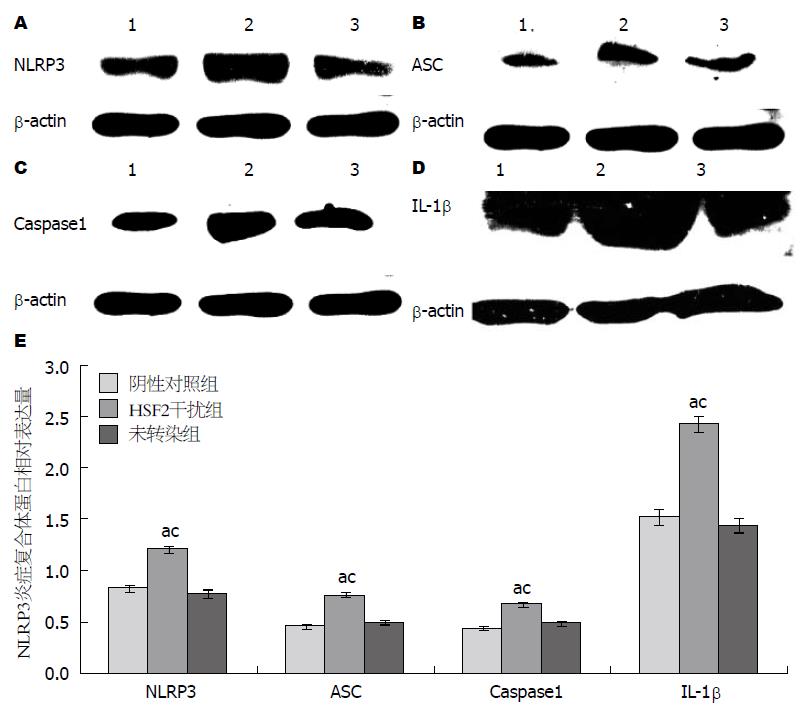
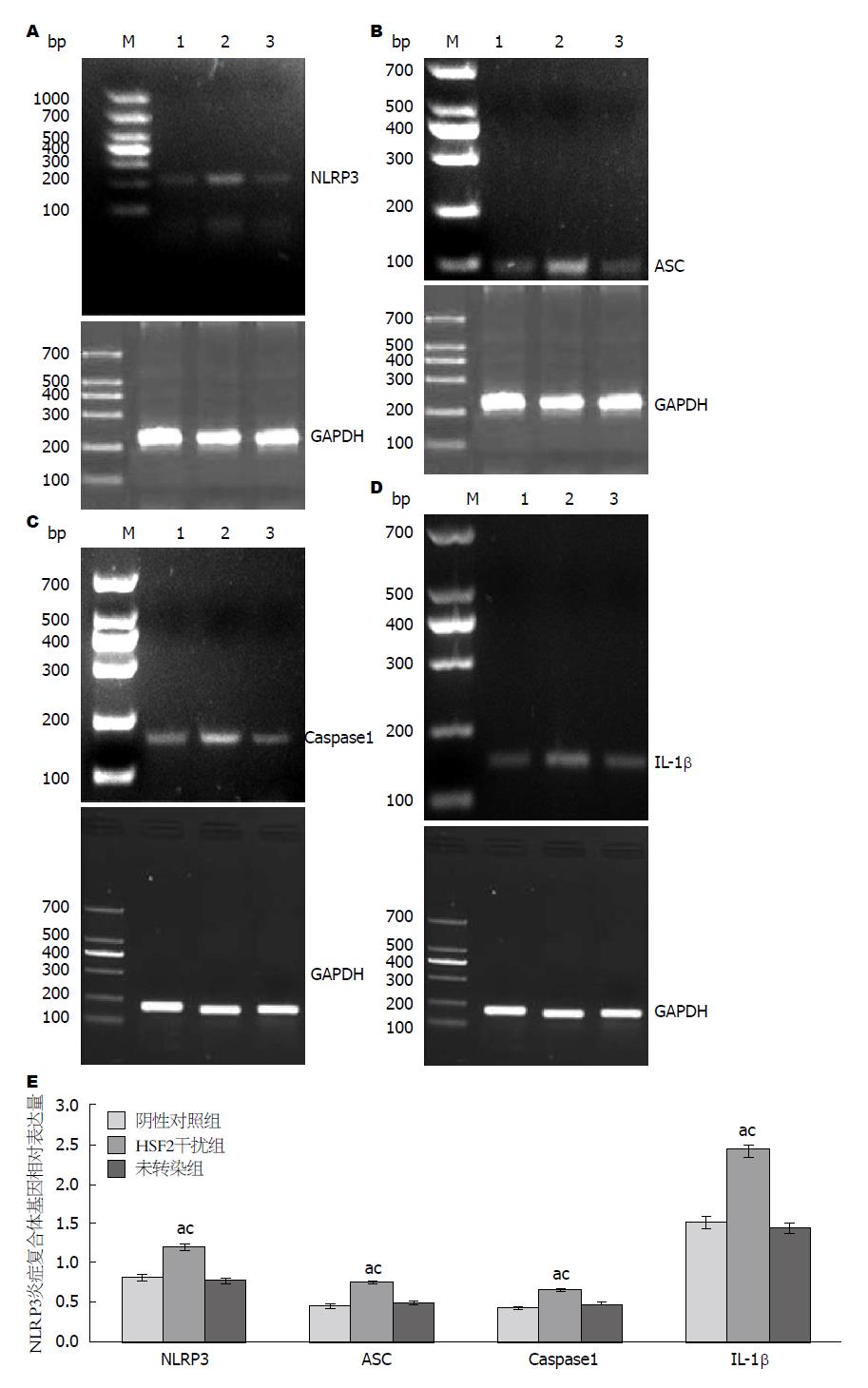
HSF2干扰组NLRP3、ASC、Caspase1及IL-1β蛋白表达水平和mRNA表达水平明显高于阴性对照组及未转染组(P<0.05)(图2, 3).
ELISA标准曲线相关系数R>0.98, 曲线线性佳. 在细胞培养基内IL-1β水平的比较中, HSF2干扰组(638.800 pg/mL±62.250 pg/mL)明显较未转染组(357.010 pg/mL±36.148 pg/mL)及阴性对照组(338.231 pg/mL±39.245 pg/mL)升高(P<0.05).
免疫紊乱是UC病因学中重要的组分, 固有免疫作为机体免疫的第一道防线, 其功能状态与UC的发生、发展关系密切, 近年来, NLR作为固有免疫的重要成员, 愈发受到重视, 其中, 目前研究最为清晰的当属NLRP3炎症复合体, 然而, 作为机体重要的抗损伤组分HSP, 其与固有免疫间的关系, 鲜有报道. 作为UC患者与正常对照者间的差异表达蛋白, HSF2在UC发生、发展中的作用受到我们研究团队的重视, 在本团队相关研究中发现, HSF2在UC患者中与疾病严重程度有关, 随着UC病情的增重, HSF2表达也逐渐增加[20]. 在与肠结核、克罗恩病、肠淋巴瘤等需鉴别的疾病对比中, 发现HSF2在UC患者黏膜表达明显高于其他疾病[21]. 一系列研究提示HSF2与UC关系密切, 参与了UC的发生发展过程, 能间接反映炎症程度, 其表达量可作为判断UC病情严重程度及治疗疗效的指标之一. 本研究在UC患者与正常对照患者HSF2不同水平表达的理论基础上, 通过PMA诱导THP-1细胞转化为巨噬细胞, 经LPS刺激, 模拟炎性环境, 使用慢病毒干扰沉默技术, 比较不同HSF2水平对巨噬细胞内NLRP3炎症复合体的影响, 试图探寻HSF2与机体固有免疫间的关系. 结果显示干扰HSF2能明显提高LPS诱导的巨噬细胞内NLRP3炎症复合体各组分及其下游IL-1β的基因、蛋白表达水平, 明显促进炎症反应.
固有免疫细胞通过PRRs模式识别病原体携带的病原相关分子模式(PAMP), 从而启动免疫反应, 其中, TLR位于胞膜, 而NLR位于胞质, NLRP3炎症复合体是NLR家族内最为典型的组分, 其由NLRP3骨架、ASC及Caspase1组成. 目前研究提示, NLRP3炎症复合体的激活主要通过三种方式(细胞内钾离子外流、释放组织蛋白酶B及ROS), 受PAMP刺激并激活后的NLRP3骨架与ASC结合, 从而剪切无活性的pro-Caspase1转变为活性体Caspase1, Caspase1又可继续剪切无活性的pro-IL-1β转变为活性体IL-1β, 从而参与炎症反应. IL-1β是诱导IBD肠道炎症的一种极为重要的细胞因子, 他与抗原协同作用, 使CD4+ T细胞活化, IL-2R表达, 促进B细胞生长和活化, 促进单核巨噬细胞等抗原提呈细胞的抗原表达, 引起炎症介质释放[22]. 一系列临床或基础研究[23-27]均提示, IL-1β与UC的发生、发展关系密切.
NLRP3炎症复合体的激活包括预激与活化两个步骤, 其中, 预激步骤在PAMP刺激细胞后, 由诱导核因子-κB(nuclear factor-κB, NF-κB)主导活化, 上调pro-IL-1β和NLRP3基因与蛋白表达, 为NLRP3炎症复合体的激活提供准备, 而NF-κB的预激对NLRP3炎症复合体的激活至关重要[28]. 对IBD起主要致病作用的细胞因子如IL-1β、TNF-α、IL-8等在转录水平均由NF-κB调控[29-31], 其重要程度不言而喻. 本团队前提研究[25]提示, 在Caco-2细胞中, 干扰HSF2后, 明显提高了细胞NF-κB活化程度.
IL-1家族包括IL-1α、IL-1β及IL-1受体拮抗剂(IL-1Ra), 其中, IL-1β是IL-1家族中的重要活性组分, 其可以诱导细胞内皮活化, 刺激中性粒细胞合成并释放炎症介质, 直接参与了机体炎症发生过程, 在其中起到了明显的致炎作用[32]. 国外研究[32-36]提示, IL-1β mRNA水平与不同的UC疾病程度呈正相关, IL-1β基因多态性则与UC病程及疾病活动程度相关, 而对于UC患者IL-1β升高机制方面, 则提出其原因可能来自于UC患者结肠巨噬细胞受刺激后, 增加了IL-1β向结肠上皮细胞的分泌, 加剧了结肠上皮细胞炎症. 如前文所述, NLRP3炎症复合体参与了IL-1β的活化及分泌过程, 故本研究希望通过慢病毒干扰技术, 降低THP-1细胞HSF2表达, 探讨低水平HSF2对巨噬细胞NLRP3炎症复合体及其下游IL-1β的影响, 进一步寻找HSF2与炎症发生、发展间的关系.
在本研究中, 干扰THP-1细胞HSF2表达后, 采用了凝胶电泳PCR技术检测NLRP3、ASC、Caspase1及pro-IL-1β mRNA表达, 发现HSF2干扰组基因表达水平均较阴性对照组及未转染组明显提高(P<0.05); 采用Western blot技术检测NLRP3、ASC、Caspase1及pro-IL-1β蛋白表达, 同样发现HSF2干扰组蛋白表达水平均较阴性对照组及未转染组明显提高(P<0.05); 采用ELISA技术检测细胞培养基内IL-1β蛋白表达, HSF2干扰组表达量亦明显高于阴性对照组及未转染组, 结合本研究团队前期研究结果, 我们推测, HSF2对NLRP3炎症复合体的影响机制可能来源于低水平HSF2增强了NF-κB的活化程度, 从而促进了NF-κB对NLRP3炎症复合体的预激, 上调了pro-IL1β及NLRP3基因及蛋白水平, 在充分预激的基础上, 通过增强某种NLRP3活化途径, 提高了NLRP3炎症复合体活化水平, 引起NLRP3炎症复合体各组分及其下游IL-1β基因与蛋白表达水平提高, 加重炎症反应.
总之, 目前国内外尚无HSF2对NLRP3炎症复合体影响的研究, 在本研究中, 发现HSF2与固有免疫中的NLRP3炎症复合体及其下游IL-1β关系密切, 低水平HSF2有助于提高NLRP3炎症复合体组分基因及蛋白表达, 从而增加其下游IL-1β的表达, 促进机体炎症反应, 然而, NLRP3炎症复合体活化途径目前尚无定论, 如上所述包括细胞内钾离子外流、释放组织蛋白酶B及ROS三种可能, HSF2与NLRP3炎症复合体的三种活化途径间的关系, 仍需进一步研究探索.
HSP作为机体保护自身免受应激损伤所产生的物质, 其保护性作用得到学者广泛认同[37-40], 结合课题组的前期研究, 我们认为: 在UC发生、发展中, 病变肠道黏膜受到外界刺激, 肠黏膜细胞及免疫细胞接受PAMP刺激, 在NF-κB预激作用下, NLRP3炎症复合体被活化, 其下游IL-1β释放量增加, 从而产生免疫反应和炎症, 当发生上述损害时, 机体为了抵抗并耐受这一反应, 肠上皮细胞及巨噬细胞发生自我保护, 其中应当包含对HSFs家族的激活, 使其调控胞内外多种信号传导通路, 发挥抗炎作用. 本课题组已通过一系列实验证实UC患者HSF2基因与蛋白表达明显较正常对照者升高, 本实验又从THP-1细胞水平发现低水平HSF2可以促进NLRP3炎症复合体基因及蛋白表达, 从而增加其下游IL-1β的表达, 体现了干扰HSF2对THP-1细胞NLRP3炎症复合体的影响, 这一系列研究提示HSF2在UC 的发生、发展中起到了重要作用, 为UC的诊治提供了一种新的思路.
热休克转录因子2(heat shock transcription factor 2, HSF2)是热休克转录因子家族一员, 前期研究提示其可能为溃疡性结肠炎(ulcerative colitis, UC)保护性因素, NOD样受体3(NOD-like receptor family, pyrin domain containing 3, NLRP3)炎症复合体是经典的促炎症小体, 其与UC发生、发展密切联系, 目前国内外暂无HSF2与NLRP3炎症复合体关系的研究.
李慧, 副教授, 复旦大学基础医学院病理学系
炎症反应是UC发生、发展的重要环节, 而NLRP3炎症复合体是固有免疫重要组成部分, 其下游释放的白介素-1β(interleukin-1β, IL-1β)是经典的促炎细胞因子; 经过研究发现, HSF2具有治疗作, 并有成为UC血清学标志物的潜力.
本团队前期研究提示HSF2与UC疾病活动度呈正相关, 且通过细胞研究, 提示HSF2通过影响核因子-κB(nuclear factor-κB, NF-κB)的表达, 从而具有抗炎作用, 在UC发生、发展中可能起到保护性作用.
本研究进一步揭示HSF2在炎症反应中的作用, 为将来HSF2的基础研究提供理论依据.
本研究有一定的前期工作基础, 在HSF和IBD的关系研究中有不少积累, 国内外暂无HSF2与NLRP3炎症复合体间关系的研究, 故新颖性突出, 为HSF2在UC发生、发展中可能的机制提供了新的理论依据.
编辑: 郭鹏 电编: 闫晋利
| 1. | Zeng Z, Zhu Z, Yang Y, Ruan W, Peng X, Su Y, Peng L, Chen J, Yin Q, Zhao C. Incidence and clinical characteristics of inflammatory bowel disease in a developed region of Guangdong Province, China: a prospective population-based study. J Gastroenterol Hepatol. 2013;28:1148-1153. [PubMed] [DOI] |
| 2. | Sonnenberg A. Age distribution of IBD hospitalization. Inflamm Bowel Dis. 2010;16:452-457. [PubMed] [DOI] |
| 3. | Gil Del Valle L. Withdrawn: Oxidative stress in aging: Theoretical outcomes and clinical evidences in humans. Biomed Pharmacother. 2010; Sep 25. [Epub ahead of print]. [PubMed] |
| 4. | Singh U, Bongcam-Rudloff E, Westermark B. A DNA sequence directed mutual transcription regulation of HSF1 and NFIX involves novel heat sensitive protein interactions. PLoS One. 2009;4:e5050. [PubMed] [DOI] |
| 5. | Vanhooren V, Liu XE, Desmyter L, Fan YD, Vanwalleghem L, Van Molle W, Dewaele S, Praet M, Contreras R, Libert C. Over-expression of heat shock protein 70 in mice is associated with growth retardation, tumor formation, and early death. Rejuvenation Res. 2008;11:1013-1020. [PubMed] [DOI] |
| 6. | Khaleque MA, Bharti A, Gong J, Gray PJ, Sachdev V, Ciocca DR, Stati A, Fanelli M, Calderwood SK. Heat shock factor 1 represses estrogen-dependent transcription through association with MTA1. Oncogene. 2008;27:1886-1893. [PubMed] |
| 8. | Akerfelt M, Morimoto RI, Sistonen L. Heat shock factors: integrators of cell stress, development and lifespan. Nat Rev Mol Cell Biol. 2010;11:545-555. [PubMed] [DOI] |
| 9. | Medzhitov R, Janeway C. Innate immune recognition: mechanisms and pathways. Immunol Rev. 2000;173:89-97. [PubMed] |
| 10. | Franchi L, McDonald C, Kanneganti TD, Amer A, Núñez G. Nucleotide-binding oligomerization domain-like receptors: intracellular pattern recognition molecules for pathogen detection and host defense. J Immunol. 2006;177:3507-3513. [PubMed] |
| 11. | Hoffman HM, Wanderer AA. Inflammasome and IL-1beta-mediated disorders. Curr Allergy Asthma Rep. 2010;10:229-235. [PubMed] [DOI] |
| 12. | Bauernfeind F, Hornung V. Of inflammasomes and pathogens--sensing of microbes by the inflammasome. EMBO Mol Med. 2013;5:814-826. [PubMed] [DOI] |
| 13. | Miao EA, Leaf IA, Treuting PM, Mao DP, Dors M, Sarkar A, Warren SE, Wewers MD, Aderem A. Caspase-1-induced pyroptosis is an innate immune effector mechanism against intracellular bacteria. Nat Immunol. 2010;11:1136-1142. [PubMed] [DOI] |
| 14. | Tschopp J, Schroder K. NLRP3 inflammasome activation: The convergence of multiple signalling pathways on ROS production? Nat Rev Immunol. 2010;10:210-215. [PubMed] [DOI] |
| 15. | Lane T, Flam B, Lockey R, Kolliputi N. TXNIP shuttling: missing link between oxidative stress and inflammasome activation. Front Physiol. 2013;4:50. [PubMed] [DOI] |
| 16. | Zhang Z, Zhang ZY, Wu Y, Schluesener HJ. Immunolocalization of Toll-like receptors 2 and 4 as well as their endogenous ligand, heat shock protein 70, in rat traumatic brain injury. Neuroimmunomodulation. 2012;19:10-19. [PubMed] [DOI] |
| 17. | Shi H, Zhang Z, Wang X, Li R, Hou W, Bi W, Zhang X. Inhibition of autophagy induces IL-1β release from ARPE-19 cells via ROS mediated NLRP3 inflammasome activation under high glucose stress. Biochem Biophys Res Commun. 2015;463:1071-1076. [PubMed] [DOI] |
| 20. | 朱 艳平. HSF2和ApoC-Ⅲ在溃疡性结肠炎结肠黏膜表达的研究. 昆明: 昆明医学院 2011; . |
| 21. | 童 明霞. HSF2和ApoC-III在溃疡性结肠炎诊断及鉴别诊断中的研究. 昆明: 昆明医科大学 2012; . |
| 23. | Chen WN, Liu LL, Jiao BY, Lin WS, Lin XJ, Lin X. Hepatitis B virus X protein increases the IL-1β-induced NF-κB activation via interaction with evolutionarily conserved signaling intermediate in Toll pathways (ECSIT). Virus Res. 2015;195:236-245. [PubMed] [DOI] |
| 24. | Wei DD, Lin XH, Wang HC, Wang B, Bai CY, Wang YQ, Li GE, Ren XQ. [Apocynin relieves inflammation in dextran sulfate sodium-induced ulcerative colitis mice: the role of NOXs-ROS-p38MAPK pathway]. Shengli Xuebao. 2015;67:74-82. [PubMed] |
| 25. | Miao J, Niu J, Wang K, Xiao Y, Du Y, Zhou L, Duan L, Li S, Yang G, Chen L. Heat shock factor 2 levels are associated with the severity of ulcerative colitis. PLoS One. 2014;9:e88822. [PubMed] [DOI] |
| 26. | Sakthivel KM, Guruvayoorappan C. Protective effect of Acacia ferruginea against ulcerative colitis via modulating inflammatory mediators, cytokine profile and NF-κB signal transduction pathways. J Environ Pathol Toxicol Oncol. 2014;33:83-98. [PubMed] |
| 27. | Wu P, Guo Y, Jia F, Wang X. The Effects of Armillarisin A on Serum IL-1β and IL-4 and in Treating Ulcerative Colitis. Cell Biochem Biophys. 2014; Nov 25. [Epub ahead of print]. [PubMed] |
| 28. | Bauernfeind FG, Horvath G, Stutz A, Alnemri ES, MacDonald K, Speert D, Fernandes-Alnemri T, Wu J, Monks BG, Fitzgerald KA. Cutting edge: NF-kappaB activating pattern recognition and cytokine receptors license NLRP3 inflammasome activation by regulating NLRP3 expression. J Immunol. 2009;183:787-791. [PubMed] [DOI] |
| 29. | Tak PP, Firestein GS. NF-kappaB: a key role in inflammatory diseases. J Clin Invest. 2001;107:7-11. [PubMed] |
| 30. | Moynagh PN. The NF-kappaB pathway. J Cell Sci. 2005;118:4589-4592. [PubMed] |
| 31. | Jobin C, Sartor RB. The I kappa B/NF-kappa B system: a key determinant of mucosalinflammation and protection. Am J Physiol Cell Physiol. 2000;278:C451-C462. [PubMed] |
| 32. | Ashwood P, Harvey R, Verjee T, Wolstencroft R, Thompson RP, Powell JJ. Functional interactions between mucosal IL-1, IL-ra and TGF-beta 1 in ulcerative colitis. Inflamm Res. 2004;53:53-59. [PubMed] |
| 33. | Bamba T, Yamamoto T, Umegae S, Matsumoto K. Effects of preoperative leukocytapheresis on inflammatory cytokines following surgery for ulcerative colitis: a prospective randomized study. J Clin Apher. 2014;29:107-112. [PubMed] [DOI] |
| 34. | Wang S, Zhou T, Zhai JP, Wang LH, Chen J. Effects of modified Sanhuang decoction () enema on serum tumor necrosis factor-α and colonic mucosa interleukin-1β, interleukin-6 levels in ulcerative colitis rats. Chin J Integr Med. 2014;20:865-869. [PubMed] [DOI] |
| 35. | Dahlén R, Magnusson MK, Bajor A, Lasson A, Ung KA, Strid H, Öhman L. Global mucosal and serum cytokine profile in patients with ulcerative colitis undergoing anti-TNF therapy. Scand J Gastroenterol. 2015;50:1118-1126. [PubMed] [DOI] |
| 36. | Yamamoto-Furusho JK, Santiago-Hernández JJ, Pérez-Hernández N, Ramírez-Fuentes S, Fragoso JM, Vargas-Alarcón G. Interleukin 1 β (IL-1B) and IL-1 antagonist receptor (IL-1RN) gene polymorphisms are associated with the genetic susceptibility and steroid dependence in patients with ulcerative colitis. J Clin Gastroenterol. 2011;45:531-535. [PubMed] [DOI] |
| 37. | Tanaka K, Namba T, Arai Y, Fujimoto M, Adachi H, Sobue G, Takeuchi K, Nakai A, Mizushima T. Genetic evidence for a protective role for heat shock factor 1 and heat shock protein 70 against colitis. J Biol Chem. 2007;282:23240-23252. [PubMed] |
| 38. | Schilling D, Kühnel A, Tetzlaff F, Konrad S, Multhoff G. NZ28-induced inhibition of HSF1, SP1 and NF-κB triggers the loss of the natural killer cell-activating ligands MICA/B on human tumor cells. Cancer Immunol Immunother. 2015;64:599-608. [PubMed] [DOI] |
| 39. | Ferns JE, Theisen CS, Fibuch EE, Seidler NW. Protection against protein aggregation by alpha-crystallin as a mechanism of preconditioning. Neurochem Res. 2012;37:244-252. [PubMed] [DOI] |