修回日期: 2015-08-03
接受日期: 2015-08-26
在线出版日期: 2015-09-18
目的: 检测大肠癌组织中上皮生长因子受体(epidermal growth factor receptor, EGFR)、PIK3CA和PIK3CB的表达水平, 分析EGFR与PIK3CA、PIK3CB之间的相关性, 探讨三者在大肠癌发生、发展及对靶向治疗的影响.
方法: 应用免疫组织化学EnVision法检测120例大肠癌组织、30例正常大肠黏膜(距病变边缘>5 cm)病例组织中的EGFR、PIK3CA和PIK3CB蛋白的表达情况, 并结合临床病理因素进行相关分析.
结果: 在大肠癌组织中EGFR、PIK3CA、PIK3CB蛋白表达的阳性率依次为48%、55.7%和75.9%, 显著高于正常黏膜(P<0.05). 大肠癌中EGFR阳性同时伴有68.9%的PIK3CA阳性及86.2%的PIK3CB阳性, 而EGFR阴性时依然伴有PIK3CA(43.5%)、PIK3CB(66.1%) 阳性. EGFR受体的表达水平与PIK3CA、PIK3CB蛋白的表达差异有显著(P<0.05). 大肠癌组织中EGFR、PIK3CA和PIK3CB蛋白与肿瘤的分化程度、淋巴结转移成正相关(P<0.05). 120例大肠癌患者的中位生存期为54.5 mo, 5年生存率为49.2%, Cox多因素分析结果显示, PIK3CA、PIK3CB、EGFR、淋巴结转移均是影响大肠癌患者预后的独立因素, 而患者年龄、性别、肿瘤大小、分化程度均不是影响大肠癌预后的独立因素.
结论: 大肠癌组织中存在EGFR、PIK3CA与PIK3CB的高表达, 并且与大肠癌的分化程度、淋巴结转移等临床病理因素密切相关; PIK3CA、PIK3CB的高表达不仅与EGFR的激活有关, 同时存在自身突变引起的高表达, PIK3CA、PIK3CB、EGFR、淋巴结转移均是影响大肠癌患者预后的独立因素, PIK3CA、PIK3CB突变可成为影响以EGFR为靶点治疗的因素.
核心提示: 检测大肠癌组织中上皮生长因子受体(epidermal growth factor receptor, EGFR)、PIK3CA和PIK3CB的表达水平, 分析EGFR与PIK3CA、PIK3CB之间的相关性, 探讨三者在大肠癌发生、发展及对靶向治疗的影响.
引文著录: 王雷动, 吴淑华, 李扬扬, 高向前, 何双, 温菲菲. 大肠癌中PIK3CA、PIK3CB与EGFR表达的相关性及其临床意义. 世界华人消化杂志 2015; 23(26): 4200-4207
Revised: August 3, 2015
Accepted: August 26, 2015
Published online: September 18, 2015
AIM: To investigate the expression of epidermal growth factor receptor (EGFR), PIK3CA and PIK3CB in colorectal cancer (CRC), to analyze the correlation between EGFR, PIK3CA and PIK3CB expression, and to discuss their role in the occurrence, development and targeted therapy of CRC.
METHODS: Immunohistochemistry was employed to detect the expression of EGFR, PIK3CA and PIK3CB in 120 CRC and 30 normal mucosa tissue sample (from the margin of the lesion > 5 cm), and the correlation between EGFR, PIK3CA and PIK3CB expression as well their relationship with clinicopathological factors were analyzed.
RESULTS: The positive expression rates of EGFR, PIK3CA and PIK3CB in CRC were 48%, 55.7% and 75.9%, respectively, which were significantly higher than those in tumor adjacent tissues (P < 0.05). In EGFR positive CRC tissues, 68.9% were PIK3CA positive and 72.4% was PIK3CB positive, while in EGFR negative CRC tissues, 43.5% were PIK3CA positive and 21.0% were PIK3CB positive. EGFR receptor expression was significantly different from the expression of PIK3CA and PIK3CB (P < 0.05). The expression of EGFR, PIK3CA and PIK3CB was positively correlated with tumor differentiation and lymph node metastasis in CRC (P < 0.05). Kaplan-Meier analysis revealed that the 5-year survival rate was significantly correlated with lymph node metastasis, EGFR, PIK3CA and PIK3CB expression. Multivariate analysis revealed that lymph node metastasis, EGFR, PIK3CA and PIK3CB expression could serve as independent predictive factors for overall survival.
CONCLUSION: EGFR, PIK3CA and PIK3CB are highly expressed in CRC, and their expression is closely correlated with tumor differentiation and lymph node metastasis. The high expression of PIK3CA and PIK3CB is not only correlated with the activation of EGFR, but also correlated with mutation by itself. The mutation of PIK3CA and PIK3CB genes in colorectal cancer may be a factor to influence therapies targeting EGFR in CRC.
- Citation: Wang LD, Wu SH, Li YY, Gao XQ, He S, Wen FF. Expression of EGFR, PIK3CA and PIK3CB in colorectal carcinoma. Shijie Huaren Xiaohua Zazhi 2015; 23(26): 4200-4207
- URL: https://www.wjgnet.com/1009-3079/full/v23/i26/4200.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i26.4200
大肠癌是危害人类健康的常见恶性肿瘤. 目前对结直肠癌的治疗依然采取综合性治疗措施, 而肿瘤的个性化治疗则成为目前治疗的新方向[1]. 上皮生长因子受体(epidermal growth factor receptor, EGFR)是目前常用的个性化治疗的重要靶点之一, 临床以EGFR突变为靶点的靶向治已取得较好的疗效, 但仍有部分患者疗效不佳[2]. 磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinases, PI3K)/AKT信号通路中是受EGFR调控的下游信号通路, 明确通路中关键分子异常活化与EGFR突变的相关性对于有效的靶向治疗具有重要意义. 本文运用免疫组织化学EnVision法检测大肠癌肿瘤组织中PI3K/AKT信号通路中关键分子PIK3CA、PIK3CB和EGFR的表达, 探讨EGFR与PIK3CA、PIK3CB的相互关系, 为临床合理选择靶向药物及判断预后提供有价值的参考指标.
选取滨州医学院附属医院2008-01/2013-07手术切除的大肠癌疾病患者临床病理资料120例, ≥60岁66例, <60岁54例. 肿瘤大小: 直径≥5 cm者63例, 直径<5 cm者57例. 分化程度: 低、中、高分化分别为37、40、43例; 淋巴结转移者85例, 无淋巴结转移者35例; 30例正常大肠黏膜(距病变边缘>5 cm)病例. 肿瘤组织标本均经用40 g/L甲醛固定, 石蜡包埋, 并经HE染色组织学确诊. 并重切蜡块、制片, 由2位以上资深病理专家重新阅片, 所有病例术前均未行放化疗. 兔抗人PI3Kp110α单克隆抗体浓缩液(HongKong, 批号ab71090)和鼠抗人PI3Kp110β单克隆抗体浓缩液(HongKong, 批号ab55593)抗体购自Abcam公司, EGFR即用型兔抗人单克隆抗体及通用型二抗和其他辅助试剂购自北京中杉金桥生物技术有限公司.
1.2.1 免疫组织化学检测: 所有标本用40 g/L甲醛固定, 将石蜡包埋组织3 μm厚切片, 65 ℃烘片10 min, 脱蜡至水, 用3%过氧化氢去除内源性过氧化物酶, EGFR经EDTA高压加热抗原修复, PI3Kp110α、PI3Kp110β经柠檬酸高温高压进行抗原修复. 一抗PI3Kp110α按照1:150稀释, PI3Kp110β按照1:200稀释. 一抗4 ℃孵育过夜, PBS冲洗后滴加通用型二抗, 37 ℃孵育30 min, 然后DAB显色, 脱水透明, 中性树胶封固. 以PBS代替一抗作为阴性对照, 用已知PIK3CA阳性表达的脑组织切片, 已知PIK3CB蛋白阳性表达的扁桃体组织切片, 已知EGFR蛋白阳性表达的乳腺癌组织切片作阳性对照.
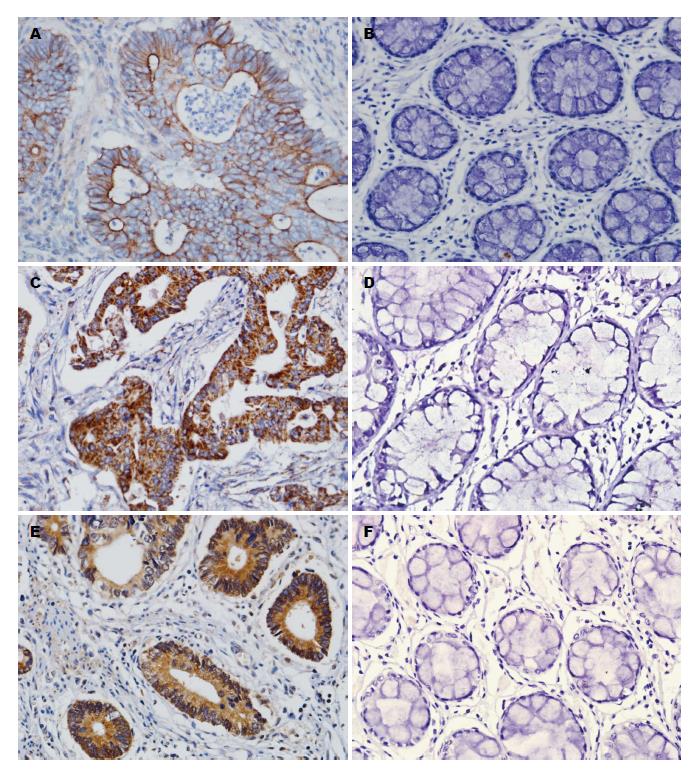
1.2.2 结果判定: EGFR主要在细胞膜表达, PIK3CA及PIK3CB均在细胞质表达, 胞膜或胞质内见淡黄色细颗粒明显高于背景色为阳性细胞. 在200倍的视野下随机选取10个视野, 记数每个视野中正常黏膜或肿瘤细胞的染色情况, 依据染色强度和阳性细胞率的乘积进行评分, ≥4分判为阳性. (1)细胞的染色强度评分: 细胞无染色为0分, 淡黄色为1分, 棕黄色为2分, 棕褐色为3分; (2)阳性细胞比例: ≤5%为0分, 6%-25%为1分, 26%-50%为2分, 51%-75%为3分, >75%为4分. 两种评分的乘积为染色总分, ≥4分判为阳性, <4分判为阴性[3]. 评分过程由2名高年资病理科医生独立完成.
统计学处理 采用SPSS19.0软件进行统计学处理. EGFR、PIK3CA蛋白、PIK3CB蛋白在两组间的表达差异及与临床病理因素关系采用χ2检验, EGFR与PIK3CA蛋白、PIK3CB蛋白的相关性采用Spearman相关性分析, 生存分析采用Kaplan-Meier法, 并以Log-rank法检验, 采用Cox比例风险回归模型进行多因素生存分析. P<0.05为差异有统计学意义.
大肠癌组织中EGFR和PIK3CA、PIK3CB蛋白的阳性率分别为48.0%、55.7%和75.9%, 显著高于正常大肠黏膜组织的表达率(P<0.05)(表1, 图1).
| 组织类型 | n | EGFR阳性率 | P值 | PIK3CA阳性率 | P值 | PIK3CB阳性率 | P值 |
| 大肠癌 | 120 | 48.0(58/120) | 0.001 | 55.7(67/120) | 0.001 | 75.9(91/120) | 0.003 |
| 正常黏膜 | 30 | 33.3(10/30) | 40(12/30) | 47%(14/30) |
经χ2检验进行相关性分析显示, EGFR受体的表达水平与PIK3CA、PIK3CB蛋白的表达之间存在相关性, 其相关性差异具有统计学意义(P<0.05)(表2).
| 蛋白类型 | n | EGFR | P值 | |
| (+) | (-) | |||
| PIK3CA | 58 | 62 | 0.005 | |
| + | 67 | 40(68.9) | 27(43.5) | |
| - | 53 | 18(31.1) | 35(56.5) | |
| PIK3CB | 0.011 | |||
| + | 91 | 50(86.2) | 41(66.1) | |
| - | 29 | 8(13.8) | 21(33.9) | |
大肠癌组织中EGFR和PIK3CA、PIK3CB蛋白的表达与患者的年龄、肿瘤的大小均无相关性(P>0.05), 而与肿瘤的分化程度、有无淋巴结转移具有相关性, 三者在中、低分化腺癌中的表达明显高于高分化者, 有淋巴结转移者明显高于无淋巴结转移者(P<0.05)(表3).
| 临床病理参数 | n | EGFR | P值 | PIK3CA | P值 | PIK3CB | P值 | |||
| - | + | - | + | - | + | |||||
| 年龄(岁) | 0.485 | 0.155 | 0.211 | |||||||
| ≥60 | 66 | 36 | 30 | 33 | 33 | 23 | 43 | |||
| <60 | 54 | 26 | 28 | 20 | 34 | 16 | 48 | |||
| 性别 | 0.065 | 0.196 | 0.249 | |||||||
| 男 | 69 | 41 | 28 | 27 | 42 | 14 | 55 | |||
| 女 | 51 | 21 | 30 | 26 | 25 | 15 | 36 | |||
| 肿瘤大小(cm) | 0.841 | 0.502 | 0.448 | |||||||
| ≥5 | 63 | 32 | 31 | 26 | 37 | 17 | 46 | |||
| <5 | 57 | 30 | 27 | 27 | 30 | 12 | 45 | |||
| 分化程度 | 0.001 | 0.007 | 0.001 | |||||||
| 中、低分化 | 77 | 32 | 45 | 27 | 50 | 12 | 65 | |||
| 高分化 | 43 | 30 | 13 | 26 | 17 | 27 | 26 | |||
| 淋巴结转移 | 0.001 | 0.012 | 0.010 | |||||||
| 有 | 85 | 45 | 40 | 29 | 56 | 15 | 70 | |||
| 无 | 35 | 17 | 18 | 24 | 11 | 14 | 21 | |||
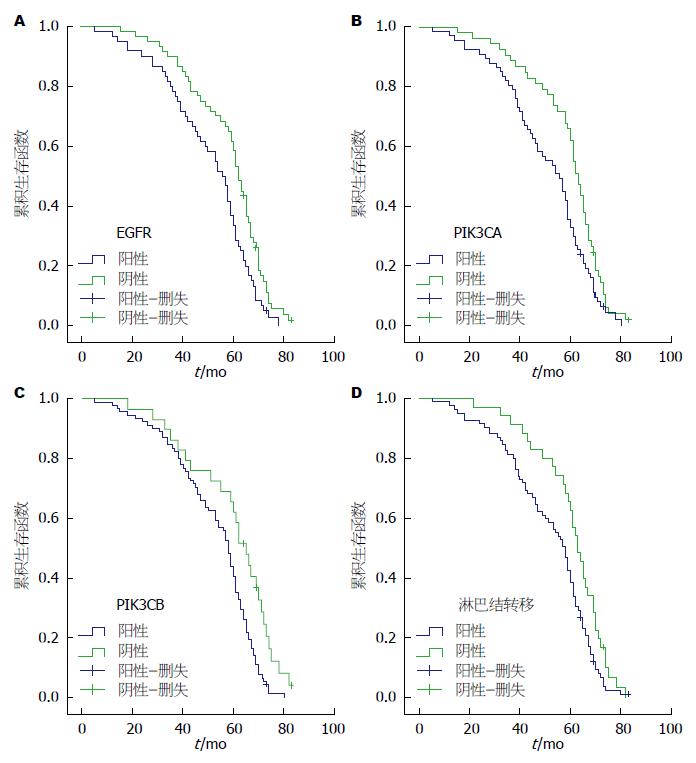
120例大肠癌患者的中位生存期为54.5 mo, 5年生存率为49.2%, Kaplan Meier分析结果显示, 与大肠癌预后相关的临床病理因素包括EGFR、PIK3CA、PIK3CB和淋巴结转移(P<0.05), EGFR阳性患者的平均生存时间为50.6 mo, 阴性患者为58.4 mo; PIK3CA阳性患者的平均生存时间50.7 mo, 阴性患者为59.2 mo; PIK3CB阳性患者的平均生存时间为52.8 mo, 阴性患者为59.9 mo(图2). 多因素生存分析结果显示, PIK3CA、PIK3CB、EGFR、淋巴结转移均是影响大肠癌患者预后的独立因素, 而患者年龄、性别、肿瘤大小、分化程度均不是影响大肠癌预后的独立因素(表4).
| 参数 | β | SE | Wald | Exp(β) | P值 |
| EGFR | 0.325 | 0.191 | 2.898 | 0.722 | 0.045 |
| PIK3CA | 0.547 | 0.233 | 5.483 | 0.579 | 0.019 |
| PIK3CB | 0.577 | 0.198 | 8.494 | 1.781 | 0.004 |
| GST-π | 0.589 | 0.215 | 7.48 | 0.555 | 0.006 |
在肿瘤的个性化治疗中, EGFR已成为非小细胞肺癌、结肠癌成熟的治疗靶点, 吉非替尼、爱必妥等是临床常用的结肠癌EGFR靶点突变的抑制剂. EGFR属于酪氨酸激酶受体家族的重要成员, 是位于PI3K/AKT信号通路上游的跨膜分子. 研究表明[3,4], EGFR突变可导致其下游PI3K/AKT信号通路的异常活化, 促进肿瘤细胞增殖、抑制凋亡, 并与肿瘤转移和放化疗耐受相关. 然而, 众所周知, 肿瘤发生过程是一个多途径、多基因突变的过程. 细胞信号通路的激活不仅依赖于其上游的始动分子, 通路中的许多关键位点, 尤其是癌基因的突变同样会使该通路处于激活状态. 目前已有研究表明, 在34%的人类实体肿瘤中存在PI3K/AKT通路中PIK3CA的突变[5-7]. 本课题组前期研究[8-10]显示, 大肠癌组织中不仅PIK3CA蛋白呈高表达, 而且其另一关键分子PIK3CB蛋白也呈高表达, 并且与腺瘤癌变、大肠癌的分化、淋巴结转移等临床病理因素密切相关. 因此, 探讨大肠癌中EGFR与PIK3CA以及PIK3CB之间的相关性, 对于临床合理选择靶点药物具有重要的意义.
现已研究[11-14]表明, PIK3CA基因是定位于染色体3q26.3的癌基因, 位于EGFR下游, 是PI3K/AKT信号通路重要的核心分子之一, 其编码蛋白是p110催化亚单位p110α, 在乳腺癌、结肠癌、卵巢癌和子宫内膜癌等都存在该基因的突变. PIK3CB则是定位于染色体3q22.3的癌基因, 编码蛋白是p110的另一亚单位p110β[15]. 研究发现在前列腺癌、星形胶质细胞瘤、结直肠癌、乳腺癌等恶性肿瘤中p110β均呈高表达[16-21], 并且与肿瘤的发生发展密切相关. 本研究结果显示, EGFR、PIK3CA与PIK3CB在大肠癌中高表达, 其阳性表达率分别为48%、55.7%和75.9%, 显著高于正常黏膜(P≤0.05). 在与临床病理因素的相关性分析中表明, EGFR、PIK3CA、PIK3CB的表达与大肠癌的分化程度、淋巴结转移呈正相关, 结果提示存在EGFR和PIK3CA、PIK3CB同时突变的大肠癌, 其恶性程度更高, 淋巴结转移几率更大.
吉非替尼、爱必妥均是酪氨酸激酶受体抑制剂, 能特异性结合EGFR, 阻断EGFR介导的下游PI3K/AKT信号转导通路, 抑制肿瘤细胞的增殖, 促进肿瘤细胞的凋亡, 减少肿瘤细胞对正常组织的侵袭及降低发生转移的可能性[22-24]. 在临床治疗中吉非替尼对部分大肠癌患者有显著疗效, 可明显提高患者的生存率, 延长缓解期. 但临床资料显示[25], 有高达80%的大肠癌患者对吉非替尼的靶向治疗出现化疗失败或化疗耐药. 有研究[26]认为EGFR表达水平与吉非替尼敏感性无关, 下游信号通路中K-ras突变、PTEN表达缺失、AKT和MAPK的异常活化等与患者对吉非替尼的反应性有关[27,28]. 近期有临床回顾性研究[29]证明, PIK3CA基因突变状态与吉非替尼、爱必妥的疗效密切相关, 发生PIK3CA基因突变的患者, 其疗效低, 反之疗效高. 研究[28]显示, 在PIK3CA基因尚未突变的病例中仍有70%的出现化疗失败. 本研究结果中, EGFR阳性的大肠癌中有68.9%的PIK3CA蛋白阳性及86.2%的PIK3CB蛋白阳性, 而在EGFR阴性组中PIK3CA、PIK3CB蛋白依然有较高的阳性表达率, 并且显著高于正常黏膜组(P<0.05). 由此我们认为, EGFR异常扩增可导致PI3K/AKT信号通路异常活化, 引起下游PIK3CA蛋白和PIK3CB蛋白的高表达. 然而, 作为癌基因PIK3CA和PIK3CB在实体肿瘤中存在较高的突变率, 而自身突变同样可引起其编码蛋白的高表达, 并不单纯依赖于上游EGFR突变的激活. 因此, 我们认为大肠癌中同时存在PIK3CA和PIK3CB的突变, 并且可能成为影响EGFR靶点治疗效果的因素之一, 其机制有待于进一步研究.
Ogino等[30]研究发现PIK3CA基因突变与大肠癌术后患者的生存率有关, PIK3CA基因突变的大肠癌患者生存时间显著降低. 本实验通过随访120例大肠癌术后患者, 结合PIK3CA、PIK3CB和EGFR的表达水平及临床病理因素进行生存分析, 结果发现PIK3CA、PIK3CB、EGFR及淋巴结转移的表达水平与大肠癌患者预后密切相关, PIK3CA、PIK3CB、EGFR阳性患者的5年生存率均低于阴性患者. 我们认为, 一方面PIK3CA、PIK3CB的高表达能诱导肿瘤细胞耐药, 降低化疗药物对肿瘤细胞的杀伤作用; 另一方面, EGFR的高表达激活其下游通路, 肿瘤的恶性程度增高.
总之, PIK3CA、PIK3CB、EGFR在大肠癌组织中高表达, 不仅PIK3CA、PIK3CB、EGFR的表达与大肠癌的分化、淋巴结转移等临床病理因素相关, 而且在大肠癌中存在因自身突变引起的PIK3CA、PIK3CB的高表达. 因此, 同步检测PIK3CA、PIK3CB、EGFR蛋白不仅对于临床预测大肠癌的恶性程度、初步判断预后有重要价值, 而且对于临床合理筛选有效的化疗药物具有重要的指导意义.
目前, 以上皮生长因子受体(epidermal growth factor receptor, EGFR)为靶点的靶向治疗已取得较好的疗效, 其突变可导致靶向治疗的失败, 明确其下游通路中关键分子异常活化与EGFR突变的相关性对于有效的靶向治疗具有重要意义.
郭炜, 教授, 河北医科大学第四医院河北省肿瘤研究所病理研究室
PIK3CA、PIK3CB的突变与大肠癌的发生、发展及多药耐药密切相关, 其突变是否影响大肠癌的靶向治疗效果尚不明确.
研究表明, PIK3CA基因突变状态与吉非替尼、爱必妥的疗效密切相关, 发生PIK3CA基因突变的患者, 其疗效低, 反之疗效高. 而对于通路中的另一关键分子PIK3CB基因的突变状态与靶向治疗的关系尚不明确.
PIK3CA、PIK3CB、EGFR在大肠癌组织中高表达, PIK3CA、PIK3CB的高表达不仅与EGFR的激活有关, 同时存在自身突变引起的高表达, PIK3CA、PIK3CB基因突变可成为影响以EGFR为靶点治疗的因素.
同步检测PIK3CA, PIK3CB, EGFR蛋白不仅对于临床预测大肠癌的恶性程度、初步判断预后有重要价值, 而且对于临床合理筛选有效的化疗药物具有重要的指导意义.
靶向治疗: 在细胞分子水平上, 针对已经明确的致癌位点(该位点可以是肿瘤细胞内部的一个蛋白分子, 也可以是一个基因片段), 来设计相应的治疗药物, 药物进入体内会特异地选择致癌位点来相结合发生作用, 使肿瘤细胞特异性死亡, 而不会波及肿瘤周围的正常组织细胞.
本文通过免疫组织化学方法分析了EGFR与PIK3CA、PIK3CB之间的相关性, 运用Kaplan-Meier法并采用Cox比例风险回归模型分析发现PIK3CA、PIK3CB、EGFR及淋巴结转移是影响大肠癌预后的因素, 同步检测PIK3CA、PIK3CB、EGFR 蛋白对于临床预测大肠癌的恶性程度、初步判断预后有重要价值.
编辑: 郭鹏 电编: 闫晋利
| 1. | Hartmann JT, Pintoffl JP, Kröning H, Bokemeyer C, Holtmann M, Höhler T. Gefitinib in combination with oxaliplatin and 5-fluorouracil in irinotecan-refractory patients with colorectal cancer: a phase I study of the Arbeits gemeinschaft Internistische Onkologie (AIO). Onkologie. 2008;31:237-241. [PubMed] [DOI] |
| 2. | Dienstmann R, Salazar R, Tabernero J. Overcoming Resistance to Anti-EGFR Therapy in Colorectal Cancer. Am Soc Clin Oncol Educ Book. 2015;35:e149-e156. [PubMed] [DOI] |
| 4. | Horn D, Hess J, Freier K, Hoffmann J, Freudlsperger C. Targeting EGFR-PI3K-AKT-mTOR signaling enhances radiosensitivity in head and neck squamous cell carcinoma. Expert Opin Ther Targets. 2015;19:795-805. [PubMed] [DOI] |
| 5. | Izycka-Swieszewska E, Brzeskwiniewicz M, Wozniak A, Drozynska E, Grajkowska W, Perek D, Balcerska A, Klepacka T, Limon J. EGFR, PIK3CA and PTEN gene status and their protein product expression in neuroblastic tumours. Folia Neuropathol. 2010;48:238-245. [PubMed] |
| 6. | Janku F, Tsimberidou AM, Garrido-Laguna I, Wang X, Luthra R, Hong DS, Naing A, Falchook GS, Moroney JW, Piha-Paul SA. PIK3CA mutations in patients with advanced cancers treated with PI3K/AKT/mTOR axis inhibitors. Mol Cancer Ther. 2011;10:558-565. [PubMed] [DOI] |
| 7. | Marqués M, Kumar A, Cortés I, Gonzalez-García A, Hernández C, Moreno-Ortiz MC, Carrera AC. Phosphoinositide 3-kinases p110alpha and p110beta regulate cell cycle entry, exhibiting distinct activation kinetics in G1 phase. Mol Cell Biol. 2008;28:2803-2814. [PubMed] [DOI] |
| 9. | 燕 炜, 吴 淑华, 李 杨扬, 高 向前, 孟 晓. 大肠癌组织中PI3KCA和PI3KCB的表达及意义. 临床与实验病理学杂志. 2013;29:18-22. |
| 10. | 温 菲菲, 吴 淑华, 李 扬扬, 高 向前, 何 双. 大肠癌组织中PIK3CA、PIK3CB蛋白与多药耐药基因产物表达的相关性及其临床意义. 世界华人消化杂志. 2015;23:202-209. [DOI] |
| 11. | De Laurentiis A, Pardo OE, Palamidessi A, Jackson SP, Schoenwaelder SM, Reichmann E, Scita G, Arcaro A. The catalytic class I(A) PI3K isoforms play divergent roles in breast cancer cell migration. Cell Signal. 2011;23:529-541. [PubMed] [DOI] |
| 12. | Baba Y, Nosho K, Shima K, Hayashi M, Meyerhardt JA, Chan AT, Giovannucci E, Fuchs CS, Ogino S. Phosphorylated AKT expression is associated with PIK3CA mutation, low stage, and favorable outcome in 717 colorectal cancers. Cancer. 2011;117:1399-1408. [PubMed] [DOI] |
| 13. | De Marco C, Rinaldo N, Bruni P, Malzoni C, Zullo F, Fabiani F, Losito S, Scrima M, Marino FZ, Franco R. Multiple genetic alterations within the PI3K pathway are responsible for AKT activation in patients with ovarian carcinoma. PLoS One. 2013;8:e55362. [PubMed] [DOI] |
| 14. | Weigelt B, Warne PH, Lambros MB, Reis-Filho JS, Downward J. PI3K pathway dependencies in endometrioid endometrial cancer cell lines. Clin Cancer Res. 2013;19:3533-3544. [PubMed] |
| 15. | Dbouk HA, Backer JM. A beta version of life: p110β takes center stage. Oncotarget. 2010;1:729-733. [PubMed] |
| 16. | Lee SH, Poulogiannis G, Pyne S, Jia S, Zou L, Signoretti S, Loda M, Cantley LC, Roberts TM. A constitutively activated form of the p110beta isoform of PI3-kinase induces prostatic intraepithelial neoplasia in mice. Proc Natl Acad Sci USA. 2010;107:11002-11007. [PubMed] [DOI] |
| 17. | Chen H, Mei L, Zhou L, Shen X, Guo C, Zheng Y, Zhu H, Zhu Y, Huang L. PTEN restoration and PIK3CB knockdown synergistically suppress glioblastoma growth in vitro and in xenografts. J Neurooncol. 2011;104:155-167. [PubMed] [DOI] |
| 18. | 高 向前, 吴 淑华, 李 扬扬, 曹 彰, 纪 洪. 结直肠癌与不同上皮内瘤变腺瘤中PI3Kp110β的表达及临床意义. 临床与实验病理学杂志. 2012;28:518-521. |
| 19. | Utermark T, Rao T, Cheng H, Wang Q, Lee SH, Wang ZC, Iglehart JD, Roberts TM, Muller WJ, Zhao JJ. The p110α and p110β isoforms of PI3K play divergent roles in mammary gland development and tumorigenesis. Genes Dev. 2012;26:1573-1586. [PubMed] [DOI] |
| 20. | Grabinski N, Ewald F, Hofmann BT, Staufer K, Schumacher U, Nashan B, Jücker M. Combined targeting of AKT and mTOR synergistically inhibits proliferation of hepatocellular carcinoma cells. Mol Cancer. 2012;11:85. [PubMed] [DOI] |
| 21. | Zhu Q, Youn H, Tang J, Tawfik O, Dennis K, Terranova PF, Du J, Raynal P, Thrasher JB, Li B. Phosphoinositide 3-OH kinase p85alpha and p110beta are essential for androgen receptor transactivation and tumor progression in prostate cancers. Oncogene. 2008;27:4569-4579. [PubMed] [DOI] |
| 22. | Nabeshima A, Matsumoto Y, Fukushi J, Iura K, Matsunobu T, Endo M, Fujiwara T, Iida K, Fujiwara Y, Hatano M. Tumour-associated macrophages correlate with poor prognosis in myxoid liposarcoma and promote cell motility and invasion via the HB-EGF-EGFR-PI3K/Akt pathways. Br J Cancer. 2015;112:547-555. [PubMed] [DOI] |
| 23. | Zhu G, Fan Z, Ding M, Zhang H, Mu L, Ding Y, Zhang Y, Jia B, Chen L, Chang Z. An EGFR/PI3K/AKT axis promotes accumulation of the Rac1-GEF Tiam1 that is critical in EGFR-driven tumorigenesis. Oncogene. 2015; Mar 9. [Epub ahead of print]. [PubMed] |
| 24. | Massimiani M, Vecchione L, Piccirilli D, Spitalieri P, Amati F, Salvi S, Ferrazzani S, Stuhlmann H, Campagnolo L. Epidermal growth factor-like domain 7 promotes migration and invasion of human trophoblast cells through activation of MAPK, PI3K and NOTCH signaling pathways. Mol Hum Reprod. 2015;21:435-451. [PubMed] [DOI] |
| 25. | Sartore-Bianchi A, Martini M, Molinari F, Veronese S, Nichelatti M, Artale S, Di Nicolantonio F, Saletti P, De Dosso S, Mazzucchelli L. PIK3CA mutations in colorectal cancer are associated with clinical resistance to EGFR-targeted monoclonal antibodies. Cancer Res. 2009;69:1851-1857. [PubMed] |
| 26. | Pinter F, Papay J, Almasi A, Sapi Z, Szabo E, Kanya M, Tamasi A, Jori B, Varkondi E, Moldvay J. Epidermal growth factor receptor (EGFR) high gene copy number and activating mutations in lung adenocarcinomas are not consistently accompanied by positivity for EGFR protein by standard immunohistochemistry. J Mol Diagn. 2008;10:160-168. [PubMed] [DOI] |
| 27. | Bardelli A, Siena S. Molecular mechanisms of resistance to cetuximab and panitumumab in colorectal cancer. J Clin Oncol. 2010;28:1254-1261. [PubMed] |
| 28. | Broadbridge VT, Karapetis CS, Price TJ. Cetuximab in metastatic colorectal cancer. Expert Rev Anticancer Ther. 2012;12:555-565. [PubMed] [DOI] |
| 29. | Mao C, Yang ZY, Hu XF, Chen Q, Tang JL. PIK3CA exon 20 mutations as a potential biomarker for resistance to anti-EGFR monoclonal antibodies in KRAS wild-type metastatic colorectal cancer: a systematic review and meta-analysis. Ann Oncol. 2012;23:1518-1525. [PubMed] [DOI] |
| 30. | Ogino S, Nosho K, Kirkner GJ, Shima K, Irahara N, Kure S, Chan AT, Engelman JA, Kraft P, Cantley LC. PIK3CA mutation is associated with poor prognosis among patients with curatively resected colon cancer. J Clin Oncol. 2009;27:1477-1484. [PubMed] [DOI] |