修回日期: 2013-09-17
接受日期: 2013-09-30
在线出版日期: 2013-12-28
目的: 探讨细胞外的热休克蛋白70及HSP70肽复合物(heat shock protein 70/peptide complexes, HSP70/HSP70-PCs)对肝癌细胞HepG2缺氧诱导因子1α(hypoxia-induciblefactor-1α, HIF-1α)、葡萄糖转运蛋白1(glucose transporter 1, Glut1)、血管内皮生长因子(vascular endothelial growth factor, VEGF)表达的影响及可能机制.
方法: 将肝癌细胞分为3组: 正常对照组、细胞外HSP70/HSP70-PCs诱导实验组(终浓度2 μg/mL)、细胞外HSP70/HSP70-PCs+siRNA转染组. 应用Real-time RT-PCR与Western blot法检测HIF-1α、Glut1和VEGF的表达变化.
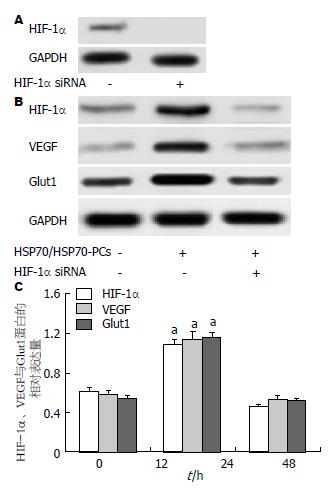
结果: 细胞外HSP70/HSP70-PCs诱导实验组HIF-1α、VEGF与Glut1蛋白表达显著升高, 与对照组相比有显著差异(P<0.05), 表明细胞外HSP70/HSP70-PCs促进肝癌细胞的HIF-1α、Glut1和VEGF表达; 应用siRNA阻断HIF-1α后, 细胞外HSP70/HSP70-PCs对Glut1和VEGF的上调表达作用消失, 与对照组相比有明显差异(P<0.05).
结论: 细胞外HSP70/HSP70-PCs可以上调肝癌细胞HepG2中Glut1和VEGF表达, 并且这一作用是通过HIF-1α来实现的.
核心提示: 本研究证实细胞外热休克蛋白70(heat shock protein 70, HSP70)/HSP70肽复合物(HSP70-peptide complexes, HSP70-PCs)能够通过缺氧诱导因子-1α(hypoxia-induciblefactor-1α促进Glut1与血管内皮生长因子(vascular endothelial growth factor)的表达, 这对肝癌的侵袭和转移机制的研究及治疗具有一定的价值. 如果能够抑制HSP70/HSP70-PCs释放到肝癌微环境中, 就有可能阻碍肝癌细胞的能量代谢过程, 阻止癌细胞的侵袭和转移, 这为临床上肝癌癌的治疗提供了新的思路.
引文著录: 李航宇, 杨福全, 李岩, 刘丹, 刘金钢. 细胞外HSP70/HSP70-PCs通过HIF-1α影响肝癌细胞HepG2 Glut1与VEGF的表达. 世界华人消化杂志 2013; 21(36): 4175-4179
Revised: September 17, 2013
Accepted: September 30, 2013
Published online: December 28, 2013
AIM: To investigate the effect of extracellular heat shock protein 70 (HSP70)-peptide complexes (HSP70-PCs) on the expression of glucose transporter 1 (Glut1) and vascular endothelial growth factor (VEGF) in HepG2 cells and to explore the possible mechanisms involved.
METHODS: HepG2 cells were randomly divided into three groups: a control group, an extracellular HSP70 PC (final concentration, 2 μg/mL) group and an extracellular HSP70/HSP70-PCs + HIF-1α siRNA group. The expression of HIF-1α, Glut1 and VEGF was examined by real-time RT-PCR and Western blot.
RESULTS: Compared with the control group, the expression of HIF-1α, Glut1 and VEGF was significantly increased in the extracellular HSP70-PC group (all P < 0.05), suggesting that extracellular HSP70 PCs promote the expression of HIF-1α, Glut1 and VEGF in HepG2 cells. SiRNA-mediated blockage of HIF-1α significantly inhibited the up-regulation of Glut1 and VEGF expression in HepG2 cells (both P < 0.05).
CONCLUSION: Extracellular HSP70-PCs promote the expression of Glut1 and VEGF via HIF-1α in HepG 2 cells.
- Citation: Li HY, Yang FQ, Li Y, Liu D, Liu JG. Extracellular HSP70 peptide complexes alter expression of Glut1 and VEGF in HepG 2 cells via HIF-1α. Shijie Huaren Xiaohua Zazhi 2013; 21(36): 4175-4179
- URL: https://www.wjgnet.com/1009-3079/full/v21/i36/4175.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i36.4175
肝细胞癌(hepatocellular carcinoma, HCC)是最常见的恶性肿瘤之一, 占全世界癌症死亡原因的第3位[1]. 我国是世界上肝癌发病率最高的国家, 肝癌占癌症死亡原因的第2位, 死亡率约26.26/10万人[2]. 热休克蛋白70(heat shock protein 70, HSP70), 在细胞中广泛表达. 他在肿瘤中可以作为肽的运载工具, 发挥"分子伴侣"的作用, 也可以参与肿瘤细胞内的信号调节[3]. HSP70不仅在细胞内发挥重要作用, 还能被多种肿瘤细胞释放到细胞外[4]. 研究发现, 释放到肿瘤肿瘤微环境中的HSP70及HSP70肽复合物(HSP70-peptide complexes, HSP70-PCs)不仅能够调控肿瘤的免疫反应, 还参与调控肿瘤的多种生物学行为[5]. 缺氧诱导因子-1α(hypoxia-induciblefactor-1α, HIF-1α)在肿瘤中普遍表达, 介导肿瘤细胞适应缺氧微环境, 参与调控肿瘤的多种生物学行为, 包括增殖、凋亡、侵袭等[6]. Wu等[7]的研究表明, 在喉癌中HIF-1α与葡萄糖转运蛋白1(glucose transporter 1, Glut1)的表达明显相关. Skinner等[8]研究并阐述了HIF-1α能够调节VEGF的转录活性. Glut1是人类葡萄糖跨膜转运最主要的载体, 与细胞葡萄糖转运和能量代谢关系密切, 恶性肿瘤细胞对葡萄糖的摄取及代谢均处于增高状态, 研究表明Glut1及其基因的异常高表达与肿瘤细胞的高能量代谢状态密切相关[9]. 血管内皮生长因子(vascular endothelial growth factor, VEGF)通过参与肿瘤新生血管的形成也能调控肿瘤的能量代谢[10]. 我们的前期研究发现, 肿瘤微环境中的HSP70/HSP70PCs能够上调HIF-1α的表达. 那么, 微环境中的HSP70/HSP70-PCs是否通过调控HIF-1α的表达影响Glut1与VEGF进而对肿瘤的能量代谢产生影响值得研究.
本实验拟观察在肝癌细胞HepG2中, 细胞外HSP70/HSP70PCs对HIF-1α调控Glut1与VEGF表达的影响及其可能机制, 为进一步治疗肝癌提供理论依据.
人肝癌细胞株HepG2购自中国科学院上海生命科学研究院生物化学与细胞生物学研究所; 小鼠抗人HIF-1α单克隆抗体购博士的生物技术有限公司; VEGF购自Santa Cruze公司; 鼠抗人多克隆GAPDH抗体购自Sigma公司; HRP标记的羊抗鼠、羊抗兔二抗购自武汉博士德公司; 逆转录试剂盒与PCR试剂盒购自Promega公司; TRIzol Reagent购自美国Invitrogen公司.
1.2.1 细胞培养: 细胞分成3组: 正常对照组、细胞外HSP70/HSP70-PCs诱导实验组(终浓度10 μg/mL)、细胞外HSP70/HSP70-PCs+siRNA转染组. 细胞以含100 mL/L胎牛血清的高糖DMEM培养基, 于37 ℃、50 mL/L CO2培养箱中培养, 胰酶消化、传代, 取对数生长期细胞实验.
1.2.2 细胞外HSP70/HSP70-PCs的构建: GST-HSP70融合蛋白购自Sigma公司, 采用Blachere等[11]的方法进行抗原肽和GST-HSP70体外结合. 反应体系含1 mmol/L ADP、1mmol/L MgCl2、75 μg/mL 抗原肽、250 μg/mL GST-HSP70, 37 ℃水浴2 h.
1.2.3 Western blot检测HIF-1α、VEGF与Glut1蛋白的表达: 提取细胞总蛋白, BCA法测定各组蛋白浓度. 根据浓度上样行电泳后, 转膜至PVDF膜上, 5%脱脂奶粉的TBST封闭1 h, 加一抗(HIF-1α 1:500、VEGF 1:500、Glut 1:500、GAPDH 1:5000), 4 ℃杂交过夜, TBST漂洗, 加二抗(1:5000)室温孵育2 h, TBST漂洗, 化学发光试剂检测蛋白条带, 测定各条带积分吸光度(A)值, 定量分析.
1.2.4 Real-time RT-PCR检测HIF-1α、VEGF与Glut1 mRNA的表达: 细胞外HSP70/HSP70-PCs刺激24 h后, 分别收集各组细胞, 采用TRIzol试剂提取细胞总RNA, 紫外分光光度计测定A260/280为1.75-1.95. 取2 μg RNA, 应用逆转录试剂盒按20 μL逆转录体系合成cDNA. PCR引物由应用软件Primer5.0设计(表1), 由北京鼎国合成. 荧光定量PCR反应体系为25 μL, 内含500 ng cDNA模板, 终浓度为250 nmol/L的上下游引物及SYBR Green Real-time PCR Master Mix 12.5 μL. 反应条件为95 ℃ 60 s, 95 ℃15 s, 退火15 s, 72 ℃ 45 s, 荧光收集, 40个循环. 每个样本重复3次. 以相对Ct值(即2-△△Ct)表示目的基因的相对表达量, 以空白细胞为对照.
| 引物名称 | 引物序列 |
| HIF-1α | F: 5'-CTTCTGGATGCTGGTG-3' |
| R: 5'-TCGGCTAGTTAGGGTAC-3' ' | |
| Glut1 | F: 5'-GGTTGTGCCATACTCATGACC-3' |
| R: 5'- CAGATAGGACATCCAGGGTAGC | |
| VEGF | F: 5'-AGGAGGAGGGCAGAATC-3' |
| R: 5'-ATGTGCTGGCCTTGGT-3' | |
| GAPDH | F: 5'-GGATTTGGTCGTATTGGG-3' |
| R: 5'-TCGCTCCTGGAAGATGG-3' |
1.2.5 针对HIF-1α特异性siRNA转染: 接种适量细胞至六孔板, 确保第2天细胞约30%铺满, 采用Lipofectamine 2000转染, 6 h后更换新鲜培养基, 48 h检测蛋白水平的变化. siRNA靶向HIF-1α的序列是siRNA上链序列是5'-GTGAAAGGATTCATATCTA-3', 下链序列是3'-GACACAGCCTCGATATGAA-5'.
统计学处理 所有实验均重复3次以上, 用SPSS13.0软件进行统计分析, 定量结果采用mean±SD表示, 多组均数间比较采用单因素方差分析, 两两组间比较采用组间t检验, 以P<0.05为差异有统计学意义.
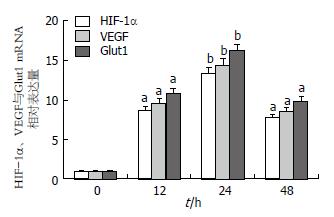
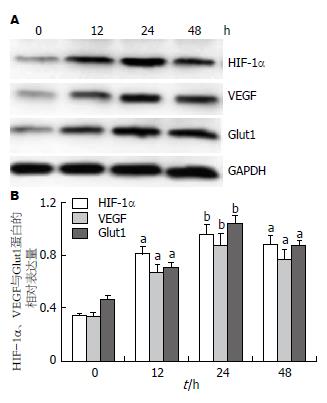
Real-time RT-PCR检测各组细胞HIF-1α、VEGF与Glut1 mRNA的表达(图1), 结果显示: 细胞外HSP70/HSP70-PCs诱导实验组HIF-1α、VEGF与Glut1 mRNA表达显著升高, 与对照组相比有显著差异(P<0.05). 通过Western blot检测各组细胞HIF-1α、VEGF与Glut1蛋白的表达(图2), 结果与Real-time RT-PCR结果一致, 细胞外HSP70/HSP70-PCs诱导实验组HIF-1α、VEGF与Glut1蛋白表达显著升高, 与对照组相比有显著差异(P<0.05).
HSP70是在生物体内普遍存在的蛋白质家族, 根据分布位置不同分为细胞内HSP70与细胞外HSP70. 人们对细胞内HSP70的作用了解比较清楚, 生理状态下作为分子伴侣参与蛋白的折叠、构象、修复以及跨膜转运; 应激时呈高表达, 起到应激保护作用. Mambula等[12]研究发现HSP70不仅存在与细胞内, 还能释放到肿瘤微环境中. Sims等[13]研究表明, 细胞外存在的HSP70参与肿瘤的侵袭转移.
肿瘤细胞新陈代谢速度快, 繁殖能力强等特点决定了肿瘤对于氧气、葡萄糖等能能量物质的需求要远高于正常细胞. 同时, 肿瘤细胞体积的不断增加, 致使肿瘤细胞远离了营养丰富的血管, 进一步导致了肿瘤微环境的缺氧情况. 在缺氧条件下, HIF-1相关的基因被诱导[14]. HIF-1由α和β亚基组成, 其中HIF-1α是受氧分子调节的主要功能亚基. 有研究发现, HIF-1是下游基因Glut1的重要调控因子, 对糖代谢有明显影响[15]. 活化的HIF-1与Glut1 5'端的增强子DNA的结合位点结合, 诱导Glut1过度表达[16]. HIF-1α也能够上调VEGF的转录活性, 促进VEGF的表达, 调节新生血管的生成, 为肿瘤的代谢提供营养[17]. 通过Real-time RT-PCR与Western blot检测发现, 细胞外HSP70/HSP70-PCs能够上调HIF-1α mRNA与蛋白的表达, 同时伴随Glut1与VEGF mRNA与蛋白的表达上调. 通过siRNA技术阻断HIF-1α的表达发现, 阻断HIF-1α的表达能够有效抑制细胞外HSP70/HSP70-PCs对Glut1与VEGF的上调作用. 该结果提示, 细胞外HSP70/HSP70-PCs是通过HIF-1α调控Glut1与VEGF的表达.
总之, 细胞外HSP70/HSP70-PCs能够促进Glut1与VEGF的表达, 这种作用是通过HIF-1α途径来实现的. 本研究结果为肝癌的治疗提供了新的理论和实验依据.
肝细胞癌是最常见的恶性肿瘤之一, 占全世界癌症死亡原因的第3位, 我国是世界上肝癌发病率最高的国家. 热休克蛋白70(heat shock protein 70, HSP70)在细胞中广泛表达, 他可以参与肿瘤细胞内的多种信号转导通路的调节. HSP70不仅在细胞内发挥重要作用, 还能被多种肿瘤细胞释放到细胞外, 释放到肿瘤微环境中的HSP70及HSP70肽复合物不仅能够调控肿瘤的免疫反应, 还参与调控肿瘤的多种生物学行为, 因此研究细胞外HSP70/HSP70PCs如何调控肝细胞癌中相关信号转导通路对于降低患者死亡率至关重要, 并为肝癌的治疗提供了新的理论和实验依据.
单云峰, 副主任医师, 温州医学院第一附属医院肝胆外科
肝细胞癌的发生发展过程非常复杂, 细胞外HSP70/HSP70PCs对肝癌的影响机制日益引起人们的关注, 对于细胞外HSP70/HSP70PCs如何调控肝癌的发展是目前研究的热点问题.
HSP70在细胞中广泛表达, 他可以参与多种肿瘤细胞内的信号调节. HSP70不仅在细胞内发挥重要作用, 还能被多种肿瘤细胞释放到细胞外. 研究发现, 释放到肿瘤肿瘤微环境中的HSP70及HSP70肽复合物不仅能够调控肿瘤的免疫反应, 还参与调控肿瘤的多种生物学行为.
本实验应用HSP70/HSP70PCs对肝癌细胞HepG2进行体外干预, 探讨细胞外HSP70/HSP70PCs对HIF-1α调控Glut1与VEGF表达的影响及其可能机制, 旨在为将来组织水平研究肝癌的发生发展提供理论基础, 并为肝癌的治疗打开一个新的思路. 截至目前, 细胞外HSP70/HSP70PCs在肝癌中的研究鲜见报道.
本研究结果表明细胞外HSP70/HSP70PCs可以上调肝癌细胞HepG2中Glut1和VEGF表达, 并且这一作用是通过HIF-1α来实现的. 这为肝癌的治疗提供理论基础.
热休克蛋白70: 在细胞中广泛表达. 他在肿瘤中可以作为肽的运载工具, 发挥"分子伴侣"的作用, 也可以参与肿瘤细胞内的信号调节;
缺氧诱导因子-1α: 在肿瘤中普遍表达, 介导肿瘤细胞适应缺氧微环境, 参与调控肿瘤的多种生物学行为, 包括增殖、凋亡、侵袭等;
GLUT-1: 人类葡萄糖跨膜转运最主要的载体, 与细胞葡萄糖转运和能量代谢关系密切, GLUT-1及其基因的异常高表达与肿瘤细胞的高能量代谢状态密切相关.
本实验应用HSP70/HSP70PCs对肝癌细胞HepG2进行体外干预, 探讨细胞外HSP70/HSP70PCs对HIF-1α调控Glut1与VEGF表达的影响及其可能机制. 为肝癌的治疗提供了理论基础. 论文选题新颖, 设计合理, 论据充分.
编辑:郭鹏 电编:闫晋利
| 1. | Jemal A, Bray F, Center MM, Ferlay J, Ward E, Forman D. Global cancer statistics. CA Cancer J Clin. 2011;61:69-90. [PubMed] [DOI] |
| 2. | Chen JG, Zhang SW. Liver cancer epidemic in China: past, present and future. Semin Cancer Biol. 2011;21:59-69. [PubMed] [DOI] |
| 3. | Duffy DJ, Millane RC, Frank U. A heat shock protein and Wnt signaling crosstalk during axial patterning and stem cell proliferation. Dev Biol. 2012;362:271-281. [PubMed] [DOI] |
| 4. | Schmitt E, Gehrmann M, Brunet M, Multhoff G, Garrido C. Intracellular and extracellular functions of heat shock proteins: repercussions in cancer therapy. J Leukoc Biol. 2007;81:15-27. [PubMed] [DOI] |
| 5. | Wu FH, Yuan Y, Li D, Liao SJ, Yan B, Wei JJ, Zhou YH, Zhu JH, Zhang GM, Feng ZH. Extracellular HSPA1A promotes the growth of hepatocarcinoma by augmenting tumor cell proliferation and apoptosis-resistance. Cancer Lett. 2012;317:157-164. [PubMed] [DOI] |
| 7. | Wu XH, Chen SP, Mao JY, Ji XX, Yao HT, Zhou SH. Expression and significance of hypoxia-inducible factor-1α and glucose transporter-1 in laryngeal carcinoma. Oncol Lett. 2013;5:261-266. [PubMed] [DOI] |
| 8. | Skinner HD, Zheng JZ, Fang J, Agani F, Jiang BH. Vascular endothelial growth factor transcriptional activation is mediated by hypoxia-inducible factor 1alpha, HDM2, and p70S6K1 in response to phosphatidylinositol 3-kinase/AKT signaling. J Biol Chem. 2004;279:45643-45651. [PubMed] |
| 9. | Kunkel M, Reichert TE, Benz P, Lehr HA, Jeong JH, Wieand S, Bartenstein P, Wagner W, Whiteside TL. Overexpression of Glut-1 and increased glucose metabolism in tumors are associated with a poor prognosis in patients with oral squamous cell carcinoma. Cancer. 2003;97:1015-1024. [PubMed] [DOI] |
| 10. | Finley SD, Popel AS. Effect of tumor microenvironment on tumor VEGF during anti-VEGF treatment: systems biology predictions. J Natl Cancer Inst. 2013;105:802-811. [PubMed] [DOI] |
| 11. | Blachere NE, Li Z, Chandawarkar RY, Suto R, Jaikaria NS, Basu S, Udono H, Srivastava PK. Heat shock protein-peptide complexes, reconstituted in vitro, elicit peptide-specific cytotoxic T lymphocyte response and tumor immunity. J Exp Med. 1997;186:1315-1322. [PubMed] |
| 12. | Mambula SS, Calderwood SK. Heat shock protein 70 is secreted from tumor cells by a nonclassical pathway involving lysosomal endosomes. J Immunol. 2006;177:7849-7857. [PubMed] |
| 13. | Sims JD, McCready J, Jay DG. Extracellular heat shock protein (Hsp)70 and Hsp90α assist in matrix metalloproteinase-2 activation and breast cancer cell migration and invasion. PLoS One. 2011;6:e18848. [PubMed] [DOI] |
| 14. | Rankin EB, Wu C, Khatri R, Wilson TL, Andersen R, Araldi E, Rankin AL, Yuan J, Kuo CJ, Schipani E. The HIF signaling pathway in osteoblasts directly modulates erythropoiesis through the production of EPO. Cell. 2012;149:63-74. [PubMed] [DOI] |
| 16. | Hayashi M, Sakata M, Takeda T, Yamamoto T, Okamoto Y, Sawada K, Kimura A, Minekawa R, Tahara M, Tasaka K. Induction of glucose transporter 1 expression through hypoxia-inducible factor 1alpha under hypoxic conditions in trophoblast-derived cells. J Endocrinol. 2004;183:145-154. [PubMed] [DOI] |
| 17. | Na YR, Han KC, Park H, Yang EG. Menadione and ethacrynic acid inhibit the hypoxia-inducible factor (HIF) pathway by disrupting HIF-1α interaction with p300. Biochem Biophys Res Commun. 2013;434:879-884. [PubMed] [DOI] |