修回日期: 2007-07-24
接受日期: 2007-07-28
在线出版日期: 2007-07-28
目的: 观察克隆小鼠结肠特异性基因RELMβ, 并构建其真核表达载体.
方法: 采用Western blot、Northern blot方法检测RELMβ基因在小鼠不同脏器中的表达; 从小鼠结肠组织中提取总RNA, 采用逆转录聚合酶链反应(RT-PCR)扩增RELMβ全长cDNA, 克隆至T载体后进行核酸序列分析, 并将其正向插入到真核表达载体pcDNA3.1/Zeo(+)的限制性内切酶位点EcoRⅠ; 重组子在阳离子脂质体Lipofectamine 2000的介导下瞬时转染小鼠胚胎纤维母细胞NIH/3T3、结肠癌细胞系CT26, Western blot及RT-PCR法检测细胞RELMβ表达水平.
结果: RELMβ mRNA和蛋白特异表达于小鼠结肠, 而其他脏器未见表达. 成功克隆了小鼠RELMβ全长cDNA(318 bp), 与已报道序列的同源性高达99%, 获得GenBank登录号DQ157777. 真核表达载体pcDNA3.1-RELMβ转染细胞后, 细胞内RELMβ mRNA和蛋白水平均显著增高(P<0.01).
结论: 从小鼠结肠组织中克隆出RELMβ特异性表达基因, 为深入研究RELMβ基因的生物学作用及其在结肠疾病靶向治疗中的作用奠定了基础.
引文著录: 郑丽端, 童强松, 吕清, 杨秀萍, 董继华. 结肠特异性基因RELMβ的克隆及其真核表达载体构建. 世界华人消化杂志 2007; 15(21): 2284-2289
Revised: July 24, 2007
Accepted: July 28, 2007
Published online: July 28, 2007
AIM: To clone mouse resistin-like molecule beta (RELMβ), a colon-specific gene, and construct its eukaryotic expression vector.
METHODS: RELMβ expression in diverse organs and tissues in mice was investigated by Western and Northern blotting. Total RNA was extracted from mouse colon tissues. Full-length cDNA of the RELMβ gene was amplified by reverse transcriptase-polymerase chain reaction (RT-PCR), inserted into T/A vector, validated by nucleic acid sequencing, and subcloned into the EcoRI restriction site of eukaryotic vector pcDNA3.1/Zeo(+). Under induction with Lipofectamine 2000, the recombinant cDNA was transferred into mouse embryonic fibroblast NIH/3T3 cells and colon cancer CT26 cells. Cellular expression levels of RELMβ were measured with Western blotting and RT-PCR.
RESULTS: RELMβ mRNA and protein were specifically expressed in mouse colon rather than in other organs. The mouse full-length RELMβ cDNA (318 bp) was successfully cloned, with 99% homology with the reported sequence. A GenBank access number was achieved as DQ157777. RELMβ mRNA and protein levels were enhanced after transfection of cells with eukaryotic vector pcDNA3.1-RELMβ (P < 0.01).
CONCLUSION: The colon-specific gene RELMβ was cloned from mouse colon tissues, which established a basis for further exploring the biological functions of RELMβ and potential strategies for targeted therapy of colon diseases.
- Citation: Zheng LD, Tong QS, Lv Q, Yang XP, Dong JH. Cloning of colon-specific gene resistin-like molecule beta and construction of its eukaryotic expression vector. Shijie Huaren Xiaohua Zazhi 2007; 15(21): 2284-2289
- URL: https://www.wjgnet.com/1009-3079/full/v15/i21/2284.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i21.2284
Resistin样分子家族(resistin-like molecules, RELMs)是新近确认的啮齿类和人类基因家族, 共有4个成员, 包括Resistin、RELMα、RELMβ和RELMγ[1-5]. RELMβ, 亦称发现于炎症带2(found in inflammatory zone 2, FIZZ2), 是一种特异表达于人和小鼠结肠的分泌蛋白, 与肠管细胞增殖、免疫反应密切相关[1,6-8], 因而成为研究结肠疾病及其靶向治疗的新靶标. 我们观察了RELMβ在小鼠各脏器中的表达, 并克隆了小鼠RELMβ基因, 为深入研究RELMβ的生物学功能奠定了基础.
真核表达载体pcDNA3.1/Zeo(+)、T4DNA连接酶、感受态细胞TOP10购自Promega公司. RNeasy Mini Kit、QIAquick Gel Extraction Kit、QIA Prep Miniprep kit购自Qiagen生物公司; Transcriptor First Strand cDNA Synthesis及地高辛核酸探针标记、检测试剂盒购自Roche公司; T/A克隆载体pCRII-TOPO购自Invitrogen公司; 限制性内切酶EcoRⅠ购自New England Biolabs公司; 第3代阳离子脂质体Lipofectamine2000购自Life Technologies公司; RELMβ多克隆抗体购自Abcam公司; GAPDH mAb购自Santa Cruz公司; ECL底物显色试剂盒购自Amersham公司. 核酸序列分析由大连宝生物公司完成. ♂C57BL/6小鼠, 8-10 wk, 购自中国医学科学院肿瘤研究所, 以过剂量氟烷处死小鼠. 分别收集脑、心脏、肺、胃、结肠、小肠、肝脏、脾脏、肾脏和肌肉等组织, 立即冷冻于-80℃, 用于Western blot、Northern blot检测及RT-PCR扩增.
参考GenBank提供的小鼠RELMβ mRNA序列(登陆号: NM_023881), 采用Primer Premier 5.0软件设计RELMβ扩增引物序列: 上游引物P1: 5'-CACCATGAAGCCTACACTGTGTTTCC-3'(针对RELMβ mRNA的244-265 bp); 下游引物P2: 5'-TTAAACCATTCGGCAGCAGCGG-3'(针对RELMβ mRNA的540-561 bp). 预期扩增产物长度为322 bp, 包含RELMβ全长cDNA基因(318 bp). 引物由大连宝生物公司合成. 按照RNeasy Mini Kit说明书提取小鼠结肠总RNA. 逆转录反应参照Transcriptor First Strand cDNA Synthesis试剂盒说明书进行. GAPDH, 上游引物5'-GCCAAGGTCATCCATGACAACTTTGG-3', 下游引物5'-GCCTGCTTCACCACCTTCTTGATGTC-3', 扩增产物314 bp. 梯度PCR反应条件: 95℃预变性3 min, 95℃变性30 s, 55℃-65℃退火30 s, 72℃延伸1 min, 循环35次, 最后产物在72℃延伸10 min. 10 g/L琼脂糖凝胶电泳分离PCR条带, 以GAPDH作为反应内参照, 采用Phoretix 1D软件进行半定量分析. 参照说明书将RELMβ RT-PCR产物连接至pCRII-TOPO载体上, 进行T/A克隆反应, 转化感受态细胞TOP10, 涂布于含Amp(50 mg/L)、20 μLX-gal(80 g/L)的LB固体平皿, 进行蓝白斑筛选. 挑选白色菌落扩增, 碱裂解法小量提取质粒, 进行核酸序列分析, 将阳性重组子命名为pCRII-RELMβ.
1.2.1 真核表达载体的构建和鉴定: 重组子pCRII-RELMβ、表达载体pcDNA3.1/Zeo(+) 经EcoRⅠ酶切后, 从凝胶中分别回收目的基因和线性化载体片断. 对pcDNA3.1/Zeo(+)去磷处理, 以防止载体自身环化. 连接反应体系如下: 目的基因片断6 μL, 线性化载体3 μL, 5×T4连接酶buffer 4 μL, T4DNA连接酶1 μL, ddH2O 6 μL, 16℃反应16-20 h. 连接产物经转化、扩增后, 小量提取质粒, 以EcoRⅠ单切重组子, 酶切产物经10 g/L琼脂糖电泳, 紫外灯下观察并拍照. 以重组子为模板, 采用T7通用型引物、RELMβ下游引物进行PCR扩增, 鉴定RELMβ cDNA插入方向, 将正向插入的真核表达载体命名为pcDNA3.1-RELMβ.
1.2.2 细胞培养和基因转染: 小鼠胚胎纤维母细胞NIH/3T3、结肠癌细胞系CT26购自美国典型培养物保藏中心(ATCC), 在含有100 mL/L新生牛血清、青霉素100 KU/L 及链霉素100 g/L的RPMI 1640培养基中, 37℃、50 mL/L CO2条件下培养, 每3 d传代1次. 取对数生长期细胞接种于6孔板, 设置未转染对照组、空载体pcDNA3.1/Zeo(+) 转染组、pcDNA3.1-RELMβ转染组. 基因转染步骤参照Lipofectamine2000试剂盒说明书进行. 转染48 h后, 采用RT-PCR、Western blot法检测细胞RELMβ mRNA及蛋白表达水平.
1.2.3 基因表达检测: 制备不同脏器组织匀浆, 每个样本取蛋白50 µg或者培养基上清液50 µL, 在40-200 g/L预制的聚丙烯酰胺凝胶中电泳, 转膜至聚偏二氟乙烯膜, 脱脂奶粉室温封闭1 h, 分别与针对RELMβ(1:1000滴度)[9]、GAPDH(1:1000滴度)的一抗4℃孵育过夜, 再与辣根过氧化酶标记的山羊抗兔二抗(稀释度为1:3000)室温孵育1 h, 运用ECL底物试剂盒显色. 提取小鼠不同脏器组织总RNA, 每个样本取10 µg RNA, 在10 g/L变性琼脂糖凝胶中电泳, 转膜至硝化纤维素膜. 地高辛标记核酸探针的制备、封闭及杂交参照试剂盒说明书进行, CSPD工作液显色, X线胶片常温下曝光10 min检测信号.
统计学处理 采用t检验或方差分析, 运用SPSS10.0 统计学软件进行数据分析.
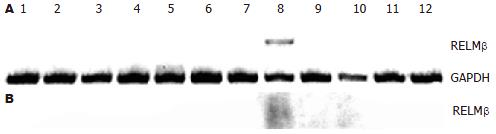
在小鼠各脏器中, RELMβ蛋白特异表达于结肠组织, 而在脑、心脏、肺、肝脏、脾脏、肾脏和肌肉等组织无表达(图1A). Northern blot检测亦进一步发现RELMβ mRNA主要表达于结肠组织, 而在其他脏器缺如(图1B).
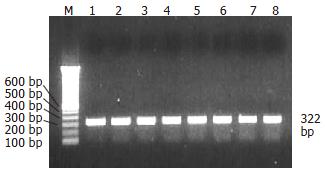
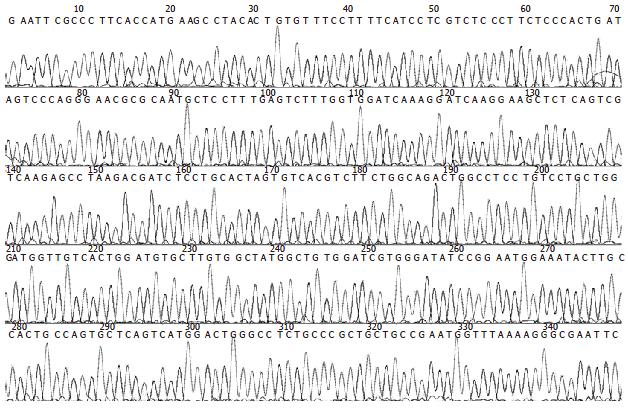
提取小鼠结肠组织总RNA, 逆转录得到cDNA第1链, 以此为模板, 利用特异性引物进行PCR扩增, 获得约322 bp的片段(其中包含RELMβ cDNA 318 bp), 与预期的片段大小相符(图2). 对pCRII-RELMβ测序结果进行BLAST检索, 结果表明, 所克隆的序列与GenBank报道的RELMβ序列(NM_023881)同源性高达99%, 在第43 bp碱基为"C"并非"T", 反应了基因多态性, 获得GenBank序列登陆号(DQ157777, 图3).
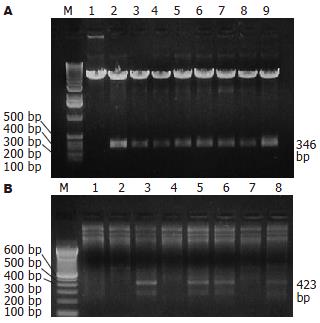
根据目的基因和载体的物理图谱, 选定EcoRⅠ单酶切pcDNA3.1-RELMβ. 重组体经EcoRⅠ酶切后, 释放出346 bp的基因片段(图4A); 以重组子为模板, 采用T7通用型引物、RELMβ下游引物进行PCR, 扩增出423 bp大小产物者为正向插入, 将真核表达载体命名为pcDNA3.1-RELMβ(图4B).
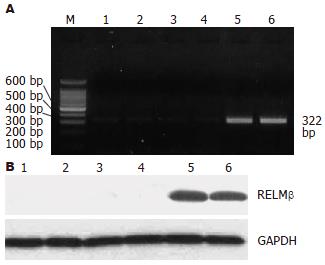
2.4 外源性RELMβ基因在细胞中的表达 未转染对照组和空载体pcDNA3.1/Zeo(+)转染组NIH/3T3、CT26细胞中仅见微弱的RELMβ mRNA 表达, 未检测到RELMβ蛋白表达. RELMβ真核表达载体pcDNA3.1-RELMβ转染细胞48 h 后, Western blot检测到细胞培养上清中存在高水平的RELMβ蛋白, RT-PCR可检测到明显的322 bp 扩增条带, 证实所构建的表达载体能促使外源性RELMβ基因在小鼠多种细胞中高效表达(图5A-B).
Resistin是由脂肪细胞特异性分泌、具有胰岛素抵抗作用的循环蛋白[10-20]. 2001年, Steppan et al[1]运用功能性基因组方法, 发现了一类具有独特半胱氨酸结构的小鼠和人类resistin样分子家族(resistin-like molecules), 即RELMs[17]; 他们发现RELMs是具有特异性组织分布的分泌蛋白, 并且有可能是信号分子. 其中, RELMβ最初发现于结肠EST文库, 其晶体结构与resistin高度相关, 均可通过双硫键形成六聚体[21-22]. 对小鼠组织的Northern blot分析表明, RELMβ mRNA在结肠中非常丰富, 但是在许多其他组织中, 包括resistin特异表达的白色脂肪组织, 都没有RELMβ表达. 人类和小鼠的RELMβ高度同源, 尤其是在富含半胱氨酸的C末端. Steppan et al[1]运用人类RELMβ探针进行多个组织的Northern分析, 发现人的RELMβ特定分布于结肠和小肠. 本研究采用Western blot、Northern blot方法检测了小鼠多种脏器组织中RELMβ的表达, 发现RELMβ只特异分布在小鼠的结肠, 与文献报道结果一致[1]. 目前, RELMβ的生物学功能尚未完全阐明. 在小鼠胚胎形成过程中, 直到第17天才能检测到RELMβ的表达, 值得注意的是, 这也是啮齿类结肠从未分化的层状上皮转变成简单的柱状上皮的时期[1]. 运用原位杂交技术确定RELMβ在结肠中的表达定位, 发现RELMβ mRNA在隐窝基底部增生性上皮中较为丰富, 从隐窝基底部到腔面, 其表达水平逐渐减弱. 在具有APC基因突变表型、易患肠道肿瘤的小鼠的肠道中, RELMβ mRNA表达水平较野生型小鼠显著增高. 此外, RELMβ具有针对肠道病原体的免疫效应子功能, 在感染后的肠道中, RELMβ定位于杯状细胞, 表达显著上调, 且与Th2细胞因子、杯细胞增生及宿主保护性免疫[6,23-27]同步. 新近研究表明, 在葡聚糖硫酸钠诱导的小鼠溃疡性结肠炎模型中RELMβ表达显著上调, 并且提示RELMβ可能通过活化巨噬细胞释放肿瘤坏死因子α等炎性因子加重肠道上皮的损伤[28-30]. 由此可见, RELMβ可能与肠道上皮分化、细胞增殖、免疫反应和炎症密切相关.
基因克隆、基因转染已成为明确基因功能的主要研究手段. 目前国际上只有3个实验室相继克隆出小鼠RELMβ基因. 我们从C57BL/6小鼠结肠组织中成功克隆出RELMβ基因全长cDNA序列(318 bp), 提交并与GenBank RELMβ序列(NM_023881)进行对照, 结果发现克隆出的RELMβ全长cDNA序列的阅读框与后者(源于FVB/N小鼠)的同源性为99%, 说明RELMβ基因在不同种株间具有高度的保守性. 差异性核酸序列位于RELMβ cDNA的第43个碱基. 运用Psort和SignalP软件预测RELMβ N末端的信号肽序列, 均提示其信号肽切割位点位于第23和24个氨基酸之间, 预计切割后RELMβ分子质量是9 kDa[21-22]. 因此, 我们认为RELMβ基因可能在其信号肽区域存在多态性, 将该序列上传至GenBank, 获得了登录号DQ157777. 至此, 我们在国际上第4个克隆出RELMβ全长cDNA基因序列. 为确定RELMβ能在细胞水平有效表达, 我们通过脂质体介导的基因转染方法, 将携带有RELMβ的真核表达载体转染入小鼠胚胎纤维母细胞和结肠癌细胞, 结果在培养上清中均能检测到RELMβ蛋白, 说明外源性RELMβ基因在细胞内高效表达, 并分泌至胞外. 而且, Western blot检测发现RELMβ的为Mr18 000, 符合其二聚体结构特点[21-22].
总之, 我们成功克隆了RELMβ这一结肠组织特异性基因, 为进一步揭示RELMβ的生物学功能及其在结肠疾患发病机制中的作用奠定了基础. 同时, 如果以RELMβ基因为靶标, 通过靶向技术携带生物治疗性药物, 将为结肠疾病的靶向治疗提供全新的视野和重要途径.
寻求结肠特异性表达基因一直是众多学者致力的研究方向. 抵抗素样分子β(RELMβ)是近年来发现的一种特异表达于人和小鼠结肠的分泌蛋白, 与肠管细胞增殖、免疫反应密切相关, 因而成为研究结肠疾病及其靶向治疗的新靶标.
本研究的重点是观察RELMβ基因在小鼠各脏器中的表达情况, 并克隆了小鼠RELMβ基因, 旨在为进一步研究RELMβ的生物学功能奠定基础.
目前, 国际上只有3个实验室相继克隆出小鼠RELMβ基因. 本研究从C57BL/6小鼠结肠组织中成功克隆出RELMβ基因全长cDNA序列, 与GenBank对比同源性为99%, 获得GenBank登录号DQ157777. 说明RELMβ基因在不同种株间具有 高度的保守性, 但在其信号肽区域存在多态性.
RELMβ基因的成功克隆为进一步揭示RELMβ的生物学功能及其在结肠疾患发病机制中的作用奠定了基础. 同时, 如果以RELMβ基因为靶标, 通过靶向技术携带生物治疗性药物, 将为结肠疾病的靶向治疗提供全新的视野和重要途径.
抵抗素(Resistin):是脂肪细胞分泌一种信号分子, 参与了饮食诱导或遗传性肥胖小鼠胰岛素抵抗发生. 抵抗素 mRNA的表达可被噻唑烷二酮类药物抑制, 成为联系肥胖与胰岛素抵抗的中介环节之一.
本文检测了小鼠 基因RELMβ的组织表达. 克隆并构建了真核表达载体, 并观察到籍由该基因的转染导致的表达增强, 为研究该基因的功能奠定了基础, 论文表达清晰, 照片质量亦较好, 是一篇较好的学术论文, 有一定的学术价值.
编辑:程剑侠 电编:何基才
| 1. | Steppan CM, Brown EJ, Wright CM, Bhat S, Banerjee RR, Dai CY, Enders GH, Silberg DG, Wen X, Wu GD. A family of tissue-specific resistin-like molecules. Proc Natl Acad Sci U S A. 2001;98:502-506. [PubMed] |
| 2. | Gerstmayer B, Kusters D, Gebel S, Muller T, Van Miert E, Hofmann K, Bosio A. Identification of RELMgamma, a novel resistin-like molecule with a distinct expression pattern. Genomics. 2003;81:588-595. [PubMed] |
| 3. | Tong Q, Zheng L, Lin L, Li B, Wang D, Li D. Hypoxia-induced mitogenic factor promotes vascular adhesion molecule-1 expression via the PI-3K/Akt-NF-kappaB signaling pathway. Am J Respir Cell Mol Biol. 2006;35:444-456. [PubMed] |
| 4. | Dai MH, Xia T, Chen XD, Gan L, Feng SQ, Qiu H, Peng Y, Yang ZQ. Cloning and characterization of porcine resistin gene. Domest Anim Endocrinol. 2006;30:88-97. [PubMed] |
| 5. | Pravenec M, Kazdova L, Landa V, Zidek V, Mlejnek P, Jansa P, Wang J, Qi N, Kurtz TW. Transgenic and recombinant resistin impair skeletal muscle glucose metabolism in the spontaneously hypertensive rat. J Biol Chem. 2003;278:45209-45215. [PubMed] |
| 6. | Artis D, Wang ML, Keilbaugh SA, He W, Brenes M, Swain GP, Knight PA, Donaldson DD, Lazar MA, Miller HR. RELMbeta/FIZZ2 is a goblet cell-specific immune-effector molecule in the gastrointestinal tract. Proc Natl Acad Sci U S A. 2004;101:13596-13600. [PubMed] |
| 7. | Kawai Y, Yamauchi J, Soga K, Yamada M, Uchikawa R, Tegoshi T, Arizono N. T cell-dependent and -independent expression of intestinal epithelial cell-related molecules in rats infected with the nematode Nippostrongylus brasiliensis. APMIS. 2007;115:210-217. [PubMed] |
| 8. | Dann SM, Eckmann L. Innate immune defenses in the intestinal tract. Curr Opin Gastroenterol. 2007;23:115-120. [PubMed] |
| 9. | Shojima N, Ogihara T, Inukai K, Fujishiro M, Sakoda H, Kushiyama A, Katagiri H, Anai M, Ono H, Fukushima Y. Serum concentrations of resistin-like molecules beta and gamma are elevated in high-fat-fed and obese db/db mice, with increased production in the intestinal tract and bone marrow. Diabetologia. 2005;48:984-992. [PubMed] |
| 10. | Steppan CM, Lazar MA. The current biology of resistin. J Intern Med. 2004;255:439-447. [PubMed] |
| 11. | Beltowski J. Adiponectin and resistin--new hormones of white adipose tissue. Med Sci Monit. 2003;9:RA55-61. [PubMed] |
| 12. | Ukkola O. Resistin - a mediator of obesity-associated insulin resistance or an innocent bystander? Eur J Endocrinol. 2002;147:571-574. [PubMed] |
| 13. | Song H, Shojima N, Sakoda H, Ogihara T, Fujishiro M, Katagiri H, Anai M, Onishi Y, Ono H, Inukai K. Resistin is regulated by C/EBPs, PPARs, and signal-transducing molecules. Biochem Biophys Res Commun. 2002;299:291-298. [PubMed] |
| 14. | Milan G, Granzotto M, Scarda A, Calcagno A, Pagano C, Federspil G, Vettor R. Resistin and adiponectin expression in visceral fat of obese rats: effect of weight loss. Obes Res. 2002;10:1095-1103. [PubMed] |
| 15. | Schinke T, Haberland M, Jamshidi A, Nollau P, Rueger JM, Amling M. Cloning and functional characterization of resistin-like molecule gamma. Biochem Biophys Res Commun. 2004;314:356-362. [PubMed] |
| 16. | Blagoev B, Kratchmarova I, Nielsen MM, Fernandez MM, Voldby J, Andersen JS, Kristiansen K, Pandey A, Mann M. Inhibition of adipocyte differentiation by resistin-like molecule alpha. Biochemical characterization of its oligomeric nature. J Biol Chem. 2002;277:42011-42016. [PubMed] |
| 17. | Kushiyama A, Shojima N, Ogihara T, Inukai K, Sakoda H, Fujishiro M, Fukushima Y, Anai M, Ono H, Horike N. Resistin-like molecule beta activates MAPKs, suppresses insulin signaling in hepatocytes, and induces diabetes, hyperlipidemia, and fatty liver in transgenic mice on a high fat diet. J Biol Chem. 2005;280:42016-42025. [PubMed] |
| 18. | Kusminski CM, McTernan PG, Kumar S. Role of resistin in obesity, insulin resistance and Type II diabetes. Clin Sci (Lond). 2005;109:243-256. [PubMed] |
| 19. | Krassas GE, Pontikides N, Loustis K, Koliakos G, Constantinidis T, Panidis D. Resistin levels in hyperthyroid patients before and after restoration of thyroid function: relationship with body weight and body composition. Eur J Endocrinol. 2005;153:217-221. [PubMed] |
| 20. | Adeghate E. An update on the biology and physiology of resistin. Cell Mol Life Sci. 2004;61:2485-2496. [PubMed] |
| 21. | Patel SD, Rajala MW, Rossetti L, Scherer PE, Shapiro L. Disulfide-dependent multimeric assembly of resistin family hormones. Science. 2004;304:1154-1158. [PubMed] |
| 22. | Banerjee RR, Lazar MA. Dimerization of resistin and resistin-like molecules is determined by a single cysteine. J Biol Chem. 2001;276:25970-25973. [PubMed] |
| 23. | Li ZD, Ma QY, Xu J, Li M. Colocalized expression of Fas and Fas-ligand in acute pancreatitis and its correlation with cell apoptosis. Nan Fang Yi Ke Da Xue Xue Bao. 2006;26:25-29. [PubMed] |
| 24. | Wang ML, Shin ME, Knight PA, Artis D, Silberg DG, Suh E, Wu GD. Regulation of RELM/FIZZ isoform expression by Cdx2 in response to innate and adaptive immune stimulation in the intestine. Am J Physiol Gastrointest Liver Physiol. 2005;288:G1074-1083. [PubMed] |
| 25. | Hogan SP, Seidu L, Blanchard C, Groschwitz K, Mishra A, Karow ML, Ahrens R, Artis D, Murphy AJ, Valenzuela DM. Resistin-like molecule beta regulates innate colonic function: barrier integrity and inflammation susceptibility. J Allergy Clin Immunol. 2006;118:257-268. [PubMed] |
| 26. | Reece JJ, Siracusa MC, Scott AL. Innate immune responses to lung-stage helminth infection induce alternatively activated alveolar macrophages. Infect Immun. 2006;74:4970-4981. [PubMed] |
| 27. | Artis D. New weapons in the war on worms: identification of putative mechanisms of immune-mediated expulsion of gastrointestinal nematodes. Int J Parasitol. 2006;36:723-733. [PubMed] |
| 28. | McVay LD, Keilbaugh SA, Wong TM, Kierstein S, Shin ME, Lehrke M, Lefterova MI, Shifflett DE, Barnes SL, Cominelli F. Absence of bacterially induced RELMbeta reduces injury in the dextran sodium sulfate model of colitis. J Clin Invest. 2006;116:2914-2923. [PubMed] |
| 29. | Fasshauer M, Klein J, Neumann S, Eszlinger M, Paschke R. Tumor necrosis factor alpha is a negative regulator of resistin gene expression and secretion in 3T3-L1 adipocytes. Biochem Biophys Res Commun. 2001;288:1027-1031. [PubMed] |
| 30. | Nair MG, Gallagher IJ, Taylor MD, Loke P, Coulson PS, Wilson RA, Maizels RM, Allen JE. Chitinase and Fizz family members are a generalized feature of nematode infection with selective upregulation of Ym1 and Fizz1 by antigen-presenting cells. Infect Immun. 2005;73:385-394. [PubMed] |