修回日期: 2007-07-17
接受日期: 2007-07-28
在线出版日期: 2007-07-28
目的: 观察肝细胞癌变过程中Bcl-2的动态表达与其病理学特征的关系.
方法: 以2-乙酰氨基芴(2-FAA)喂饲♂SD大鼠诱发肝癌发生, 分别观察肝细胞形态学和肝细胞质Bcl-2蛋白水平变化. 以免疫组织化学法观察鼠肝组织中Bcl-2表达, 分析Bcl-2蛋白水平变化与其病理学特征在肝癌发生过程中的关系.
结果: 诱癌过程从肝细胞出现颗粒样变性, 不典型增生到原发性肝细胞癌(HCC)的形成过程中, 肝细胞质Bcl-2的表达水平随肝组织学形态的改变呈增高趋势, 表现为癌变组明显高于变性组和正常对照组(5.28±1.10 nmol/g vs 2.78±1.07 nmol/g, 1.77±0.60 nmol/g, F = 9.85, P<0.01), 而癌前组又高于癌变组(6.21±3.34 nmol/g vs 5.28±1.10 nmol/g), 但无统计学差异.
结论: Bcl-2参与肝细胞的癌变过程, Bcl-2过表达可能促进了肝癌的发生和发展.
引文著录: 宗蕾, 姚登福, 吴玮, 邱历伟, 吴信华. Bcl-2在肝细胞癌变过程中凋亡抑制作用的动态分析. 世界华人消化杂志 2007; 15(21): 2279-2283
Revised: July 17, 2007
Accepted: July 28, 2007
Published online: July 28, 2007
AIM: To investigate the dynamic expression and clinicopathological alterations of B-cell lymphoma-2 (Bcl-2) during the development of hepatocellular carcinoma (HCC).
METHODS: Hepatoma was induced by 2-fluorenylacetamide (2-FAA) in male Sprague-Dawley rats. Morphological changes in rat livers were observed by pathological examination (HE staining). Dynamic changes in Bcl-2 in rat livers were quantitatively analyzed by enzyme-linked immunosorbent assay. The expression and cellular distribution of liver Bcl-2 were simultaneously detected by immunohistochemistry.
RESULTS: Histological examination confirmed that rat hepatocytes changed from granule-like degeneration to atypical hyperplasia and HCC development after induction by 2-FAA. There were progressive increases in the level of hepatic Bcl-2 expression during the course. The levels of Bcl-2 in hepatoma tissues were significantly higher than those in normal and degenerative tissue (5.28 ± 1.10 nmol/g vs 2.78 ± 1.07 nmol/g, 1.77 ± 0.60 nmol/g, F = 9.85, P < 0.01). Immunohistochemical evidence indicated positive expression and hepatocyte distribution of Bcl-2 in rat hepatoma tissue.
CONCLUSION: Hepatic Bcl-2 protein may participate in the carcinogenesis of hepatocytes, and its overexpression may accelerate the occurrence and development of HCC.
- Citation: Zong L, Yao DF, Wu W, Qiu LW, Wu XH. Dynamic analysis of B-cell lymphoma-2 apoptotic inhibitory effects during the development of hepatocellular carcinoma. Shijie Huaren Xiaohua Zazhi 2007; 15(21): 2279-2283
- URL: https://www.wjgnet.com/1009-3079/full/v15/i21/2279.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i21.2279
胃B细胞淋巴瘤-2(bcl-2)基因是公认的最重要的抑制细胞凋亡基因, 在肿瘤组织中过量表达, 与肿瘤发生、发展密切相关[1]. 细胞增殖和死亡是调节细胞数量的2个因素, 两者相互作用. 肿瘤的发生是不断增殖和抑制凋亡的结果[2]. Bcl-2异常增多使细胞数目增加, 同时未成熟细胞和老化细胞亦增多, 意味着肝细胞受到致癌因素攻击而发生变性可能性增加, 易于致肝脏肿瘤产生, 但其在肝细胞发生癌变过程中的作用与动态改变机制尚不清楚. 我们以2-乙酰氨基芴(2-fluorenyl acetamide, 2-FAA)诱发肝细胞癌变[3], 以免疫组织化学法观察Bcl-2的胞内定位及其在肝细胞癌变过程中的动态表达, 探讨Bcl-2在肝细胞癌变过程中凋亡抑制的作用.
♂Sprague-Dawley(SD)大鼠48只, 4-6周龄, 体质量120-160 g, 由南通大学实验动物中心提供, 清洁级. 分笼喂养于8个等大的笼中, 普通大鼠颗粒饲料由南通大学实验动物中心提供. 随机分为6只/笼, 随机挑选1个笼子的大鼠作为正常对照组, 其余为实验组(其中1组为备用组). 对照鼠给予一般颗粒饲料, 实验鼠以0.5 g/L的2-FAA颗粒饲料作恒环境饲养. 实验期间剔除死亡鼠, 以备用鼠补足. 每2 wk取1只正常鼠和1组实验鼠, 以乙醚轻度麻醉. 从心尖取血5 mL分离血清, 置-20℃冰箱保存; 肝组织洗去血迹, 部分用40 g/L中性甲醛液固定作病理学检查(HE染色)和免疫组织化学染色, 其余组织置-80℃保存(Sanyo超低温冰箱). 肝组织经40 g/L中性甲醛液固定, 脱水、透明、石蜡包埋后, 经切片(厚度4 µm)、展片、贴片、烤片后制成空白片. 经脱蜡、水化, HE染色. Olympus BX 50光学显微镜下观察.
1.2.1 SP法免疫组织化学染色: 新鲜鼠肝组织经固定、浸蜡, 做成厚度4 µm的组织切片; 常规脱蜡、水化; 双氧水阻断内源性过氧化物酶; 高压加热法修复抗原; 正常动物血清封闭非特异性结合; 滴加兔多克隆Bcl-2抗体, 4℃过夜, 磷酸盐缓冲液(PBS)漂洗; 滴加生物素标记的第二抗体(山羊抗兔), 室温孵育10 min, PBS漂洗; 滴加链霉素抗生物素蛋白-过氧化酶, 室温孵育10 min, PBS冲洗; 滴加新鲜配制的四盐酸二氨基联苯胺(DAB)溶液, 室温显色, 蒸馏水洗涤; 苏木素复染. Olympus BX 50光学显微镜观察、摄像. 以0.01 mol/L PBS液(pH7.5)分别替代一抗、二抗和链霉素菌抗生物素蛋白过氧化酶(SP)试剂作阴性对照, 已知表达Bcl-2的乳腺癌组织作阳性对照. 组织中显示棕黄色颗粒为Bcl-2表达阳性. 肝组织中Bcl-2表达强度: +, 阳性细胞数为10%-25%; ++, 阳性细胞数为26%-50%; +++, 阳性细胞数为>50%.
1.2.2 大鼠肝细胞质蛋白浓度测定: 取肝组织60 mg左右, 剪碎. 按20:1混合适当量的细胞质蛋白抽提试剂(碧云天公司)A和B, 加入蛋白酶抑制剂苯甲基磺酰氟(PMSF)至终浓度为1 mmol/L配制成组织匀浆液. 取匀浆液与组织混合充分匀浆. 冰浴15 min, 4℃ 15 000 g离心5 min. 分离上清至预冷的塑料管中, 为部分质蛋白. 每20 µL沉淀加入添加了PMSF的试剂A 200 µL. 高速剧烈振摇5 s, 使沉淀完全悬浮分散开. 冰浴15 min. 加试剂B 10 µL. 高速剧烈振摇5 s, 冰浴1 min. 高速剧烈振摇5 s, 4℃ 12 000-16 000 g离心5 min. 立即吸取上清至上述塑料管中, 即为抽提得到的质蛋白. 肝细胞质蛋白浓度以蛋白定量(BCA)法测定, 按50:1混合BCA试剂A, B配制适量BCA工作液. 蛋白标准品稀释10倍. 稀释后的标准品按0, 1, 2, 4, 8, 12, 16, 20 µL加至标准品孔中, 加水补足到20 µL. 加适当体积样品至样品孔中, 加水稀释到20 µL. 各孔加入BCA工作液200 µL, 37℃放置30 min. 测定A578. 根据标准曲线计算出蛋白浓度.
1.2.3 大鼠肝组织Bcl-2测定: 从肝组织中制备匀浆液, 以大鼠Bcl-2 ELISA试剂盒(BPB公司)分析. 其方法为: 浓缩洗涤液稀释50倍, 加入标准品100 µL, 已稀释标本100 µL于相应反应板孔中. 加入50 µL酶标记物, 轻轻混匀30 s, 20℃温育90 min. 反复洗板5次, 每次静置10-20 s. 加底物A, B液各50 µL, 轻轻混匀10 s, 20℃温育15 min. 每孔加入终止液50 µL. 轻轻混匀30 s; 测定A450. 根据标准曲线计算其浓度.
统计学处理 数据以mean±SD表示, 多个样本均数间的比较先进行方差齐性检验, 再进行方差分析, 两样本均数的比较采用q检验, 样本率之间的比较采用Fisher确切概率法; 相关性用直线相关分析. P<0.05表示差异有显著性.
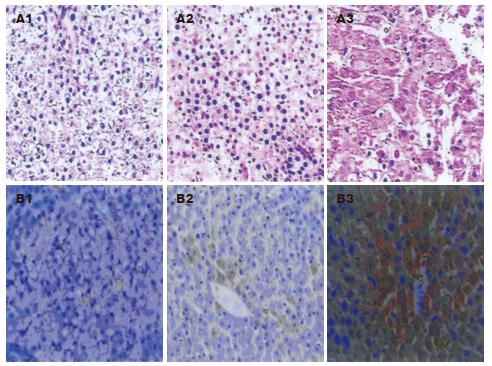
在2-FAA的诱癌过程中, 对照鼠肝细胞在形态学上无明显变化; 实验鼠在诱癌不同时期肝脏形态学发生动态变化. 对照组(n = 6), 肝细胞形态正常, 无改变; 变性鼠(n = 22), 肝细胞胞质出现颗粒样变性, 偶见大的异型胞核; 癌前鼠(n = 6), 肝板细胞、局灶细胞层次增多, 核质增粗, 核质比例增大; 癌变鼠(n = 8), 结构消失, 排列成巢状、条索状, 核大, 核质增粗, 核质比增大(图1A). 诱癌后6 wk绝大多数鼠肝细胞表现为肝细胞变性, 7-9 wk大部分鼠肝呈现癌前病变, 10-12 wk大部分实验鼠肝表现为已发生癌变, 且为高分化肝细胞癌.
Bcl-2表达阳性物质呈棕黄色颗粒, 主要定位于胞质, 少数细胞出现胞核着色, 胞膜未见着色(图1B). 随着大鼠肝组织癌变的发生, Bcl-2阳性率逐渐增高, 正常鼠无阳性表达, 变性组阳性率仅为59%, 癌前组与癌变组明显上升, 阳性率已达100%, 差别均有显著性意义(P<0.01). 而且Bcl-2表达强度呈增强趋势, 在变性鼠阳性中多呈"+"表达水平, 癌前鼠已有3例达"++"或"+++"水平, 而癌变组的8例中有4例为"++" 和1例"+++"水平(表1).
在大鼠肝细胞诱癌过程中, 肝细胞质Bcl-2的表达水平随肝组织学形态的改变呈增高趋势, 表现为癌前病变组>癌变组>肝细胞变性组>正常对照组, 其变化趋势有显著性意义(F = 9.85, P<0.01). 肝细胞质中Bcl-2平均浓度在癌前病变组明显高于正常组及变性组, 癌变组明显高于正常组和变性组(表1).
bcl-2基因位于18号染色体, 定位于细胞线粒体膜、内质网膜和核膜孔周围. 他是凋亡抑制基因, 其功能是通过阻断程序性死亡或凋亡过程促进细胞生长[4]. bcl-2原癌基因是重要的能抑制细胞凋亡的基因, 他编码分子量为26 kDa的蛋白, 正常情况下在各种组织均有表达, 调节细胞凋亡速度, 维持机体细胞数目的相对平衡. 机体细胞的增殖和死亡是调节细胞数量的2个因素, 两者相互作用, 相互影响. Bcl-2的异常增多, 使细胞数目增加, 同时未成熟细胞和老化细胞亦增多, 细胞受到致癌因素攻击而变性的可能性大大提高, 更易于导致肿瘤的产生[1-2]. 研究表明在多种肿瘤组织中均发现Bcl-2的表达异常增多, 与肿瘤的发生、发展密切相关[5-7]. 但他们在肝癌中表达情况尚不明确. 本研究以免疫组织化学法分析了肝癌模型, 并定量分析了诱癌过程中鼠肝Bcl-2蛋白水平的变化趋势, 探寻Bcl-2表达在肝癌发生与发展中的动态变化与临床价值.
Bcl-2通过抑制细胞的凋亡而起作用: 在肿瘤产生的早期, Bcl-2过表达抑制细胞凋亡, 使肿瘤细胞增殖, 使其数目大大增加, Bcl-2在肿瘤的早期扮演了较为重要的角色; 而随着肿瘤的进展, Bcl-2表达却越来越弱(高于正常), 提示癌前组高于癌变组, 这时不仅肿瘤细胞增殖加快, 而且凋亡率也增加, 在增生活跃的基础上使细胞增殖和凋亡达到了新的平衡. 而肿瘤晚期细胞凋亡之所以会增多, 可能由于一方面使过度增殖过程中同样增殖的非肿瘤细胞凋亡, 纯化肿瘤细胞群; 另一方面也可以使"体质较弱"的肿瘤细胞凋亡掉, 保证了侵袭性强的肿瘤细胞能够不断地生长, 为肿瘤转移的发生提供了良好的物质基础. HCC组织中随癌细胞恶性程度的增高, 凋亡细胞密度呈递减趋势, 而肝硬变中不但有细胞增殖, 同时存在大量细胞凋亡; HCC中由于细胞凋亡减少, 细胞聚集速率相对明显增加, 使HCC生长快, 并表现为恶性行为增加. HCC组织中Bcl-2蛋白的表达强度明显高于肝硬变, 推测Bcl-2可通过其表达产物调控肝硬变和HCC组织中的细胞凋亡, 该基因蛋白的异常表达抑制细胞凋亡, 阻止带有恶性潜能细胞的清除, 促进HCC的发生与发展[8-9]. 本研究中Bcl-2蛋白的表达普遍存在于肝癌细胞中, 其阳性细胞率均显著高于正常组织(P<0.05), Bcl-2蛋白的过表达在肿瘤中起着重要的作用. 提示Bcl-2过表达可促进肝癌发生、发展, 但作用机制有待研究.
Bcl-2在多种肿瘤组织中呈高表达, 并且转染bcl-2基因能够抑制多种因素诱导的多种细胞凋亡: 转染bcl-2基因表达能够防护fas分子与单抗形成二聚体而启动凋亡信号的传递或TGF-b诱导的肝细胞凋亡, 转染bcl-2基因可抑制化疗药物、加热、放射线、细胞生长因子、c-myc或p53基因等多种因素诱导的多种细胞的凋亡, 延长细胞生存时间[10-15], 过表达Bcl-2蛋白对乙醇诱导的HCC-9204细胞凋亡具有明显的抑制作用[16]; bcl-2基因敲除的小鼠肝细胞也因抗氧化作用减弱而容易发生凋亡, 说明Bcl-2对某些因素诱导的肝癌细胞凋亡具有一定的抑制作用[17-18]. 但有学者认为肝癌组织只能低度表达或不表达Bcl-2蛋白, 并且其阳性率有时低于癌旁肝组织[19-21]. 且转染Bcl-2不能抑制肝细胞凋亡[22]. 在HBV或HCV导致原发性肝癌中, 在肿瘤早期Bcl-2蛋白表达明显高于癌旁组织, 推测Bcl-2过表达抑制由肝炎病毒导致的细胞凋亡, 从而有利于阻止具有恶性潜能细胞的清除[23-25]. 另有研究指出, 导入bcl-2基因并不抑制某些细胞的凋亡[26], 提示Bcl-2在不同细胞的凋亡过程中调控作用有差异, Bcl-2在肝癌细胞凋亡调控中的作用可能具有特殊性.
研究表明Bcl-2及其同源类似物Bcl-xl在调节正常和肝癌细胞凋亡时起了非常重要的作用, 转染bcl-2基因不能抑制肝细胞凋亡, 转染Bcl-xl基因却能抑制肝细胞凋亡, 提示虽然bcl-2基因不参与某些情况下的肝细胞或肝癌细胞凋亡, bcl-2基因家族在肝细胞或肝癌细胞凋亡调控中可能仍具有重要的作用[1,21]. Bcl-2主要通过与其家族成员Bax形成二聚体而发挥作用, 当Bcl-2表达量较高时, Bcl-2与Bax形成异源二聚体而抑制细胞凋亡[27]. 当Bax表达量较高时, Bax之间形成同源二聚体而促进细胞凋亡[28].
我国为肝癌高发区, 对肝癌的早期诊断是治疗的重点和难点. 近年来, 通过监测癌基因或癌相关基因以提高肝癌早期诊断率的研究成为国际上的热点. B细胞淋巴瘤-2(bcl-2)基因是公认的最重要的抑制细胞凋亡基因, 在肿瘤组织中过量表达, 与肿瘤发生、发展密切相关, 其在肝癌发生、发展过程中的作用机制日益受到关注.
目前, 通过监测肝癌患者血清中Bcl-2水平以阐明其在肝癌发生发展过程中的意义的研究较为深入, 但通过动物实 验直接观察大鼠肝脏诱癌过程中 Bcl-2表达与改变的研究尚较少见.
关于Bcl-2水平与肝癌关系的研究目前大都集中在临床血清学检测及临床病理标本检测方面. 本文则在大鼠肝脏诱癌的动物实验中, 以病理学方法(HE染色, SP法)和酶联免疫吸附法(ELISA), 分别观察肝细胞形态学、肝及血Bcl-2的动态变化. 以免疫组织化学法分析肝组织Bcl-2的表达、胞内定位及变化规律.
本文为进一步探讨Bcl-2在肝癌发生发展过程中的作用机制及其表达规律提供了新的研究思路和方法, 今后可从基因水平对Bcl-2的表达做进一步的研究.
本研究采用2-乙酰氨基芴(2-FAA)喂饲♂SD鼠诱发癌发生, 通过免疫组织化学和 ELISA法检测鼠 组织中B细胞淋巴瘤-2(Bcl-2) 的表达和分布, 设计合理, 实验方法可靠, 结果清晰, 研究内容具有实际意义, 有一定的参考价值.
编辑:程剑侠 电编:张敏
| 1. | Burlacu A. Regulation of apoptosis by Bcl-2 family proteins. J Cell Mol Med. 2003;7:249-257. [PubMed] |
| 2. | Pierce RH, Vail ME, Ralph L, Campbell JS, Fausto N. Bcl-2 expression inhibits liver carcinogenesis and delays the development of proliferating foci. Am J Pathol. 2002;160:1555-1560. [PubMed] |
| 3. | Yao DF, Wu W, Yao M, Qiu LW, Wu XH, Su XQ, Zou L, Yao DB, Meng XY. Dynamic alteration of telomerase expression and its diagnostic significance in liver or peripheral blood for hepatocellular carcinoma. World J Gastroenterol. 2006;12:4966-4972. [PubMed] |
| 4. | Petros AM, Olejniczak ET, Fesik SW. Structural biology of the Bcl-2 family of proteins. Biochim Biophys Acta. 2004;1644:83-94. [PubMed] |
| 5. | Duarte RL, Paschoal ME. Molecular markers in lung cancer: prognostic role and relationship to smoking. J Bras Pneumol. 2006;32:56-65. [PubMed] |
| 6. | Zusman I, Gurevich P, Gurevich E, Ben-Hur H. The immune system, apoptosis and apoptosis-related proteins in human ovarian tumors (a review). Int J Oncol. 2001;18:965-972. [PubMed] |
| 7. | Wang G, Reed E, Li QQ. Molecular basis of cellular response to cisplatin chemotherapy in non-small cell lung cancer (Review). Oncol Rep. 2004;12:955-965. [PubMed] |
| 8. | Garcia EJ, Lawson D, Cotsonis G, Cohen C. Hepatocellular carcinoma and markers of apoptosis (bcl-2, bax, bcl-x): prognostic significance. Appl Immunohistochem Mol Morphol. 2002;10:210-217. [PubMed] |
| 9. | Ikeguchi M, Hirooka Y, Kaibara N. Quantitative analysis of apoptosis-related gene expression in hepatocellular carcinoma. Cancer. 2002;95:1938-1945. [PubMed] |
| 10. | Chiu CT, Yeh TS, Hsu JC, Chen MF. Expression of Bcl-2 family modulated through p53-dependent pathway in human hepatocellular carcinoma. Dig Dis Sci. 2003;48:670-676. [PubMed] |
| 11. | Tobiume K. Involvement of Bcl-2 family proteins in p53-induced apoptosis. J Nippon Med Sch. 2005;72:192-193. [PubMed] |
| 12. | Takahashi M, Saito H, Okuyama T, Miyashita T, Kosuga M, Sumisa F, Yamada M, Ebinuma H, Ishii H. Overexpression of Bcl-2 protects human hepatoma cells from Fas-antibody-mediated apoptosis. J Hepatol. 1999;31:315-322. [PubMed] |
| 13. | Takahashi M, Saito H, Atsukawa K, Ebinuma H, Okuyama T, Ishii H. Bcl-2 prevents doxorubicin-induced apoptosis of human liver cancer cells. Hepatol Res. 2003;25:192-201. [PubMed] |
| 14. | Delgado MB, Anderson JR, Whittle IR, Wharton SB. Expression of Bcl-2 and Bax in oligodendrogliomas and their relationship to apoptosis. Neuropathol Appl Neurobiol. 1999;25:400-407. [PubMed] |
| 15. | de La Coste A, Mignon A, Fabre M, Gilbert E, Porteu A, Van Dyke T, Kahn A, Perret C. Parado-xical inhibition of c-myc-induced carcinogenesis by Bcl-2 in transgenic mice. Cancer Res. 1999;59:5017-5022. [PubMed] |
| 16. | Yang L, Si X, Wang W. Overexpression of bcl-2 protects hepatoma cell line HCC-9204 from ethanol-induced apoptosis. Chin Med J (Engl). 2002;115:8-11. [PubMed] |
| 17. | Pattingre S, Levine B. Bcl-2 inhibition of autophagy: a new route to cancer? Cancer Res. 2006;66:2885-2888. [PubMed] |
| 18. | Hochman A, Liang H, Offen D, Melamed E, Sternin H. Developmental changes in antioxidant enzymes and oxidative damage in kidneys, liver and brain of bcl-2 knockout mice. Cell Mol Biol (Noisy-le-grand). 2000;46:41-52. [PubMed] |
| 19. | Duan XX, Ou JS, Li Y, Su JJ, Ou C, Yang C, Yue HF, Ban KC. Dynamic expression of apoptosis-related genes during development of laboratory hepatocellular carcinoma and its relation to apoptosis. World J Gastroenterol. 2005;11:4740-4744. [PubMed] |
| 20. | Farinati F, Marino D, De Giorgio M, Baldan A, Cantarini M, Cursaro C, Rapaccini G, Del Poggio P, Di Nolfo MA, Benvegnu L. Diagnostic and prognostic role of alpha-fetoprotein in hepatocellular carcinoma: both or neither? Am J Gastroenterol. 2006;101:524-532. [PubMed] |
| 21. | Guo XZ, Shao XD, Liu MP, Xu JH, Ren LN, Zhao JJ, Li HY, Wang D. Effect of bax, bcl-2 and bcl-xL on regulating apoptosis in tissues of normal liver and hepatocellular carcinoma. World J Gastroenterol. 2002;8:1059-1062. [PubMed] |
| 22. | Ravazoula P, Tsamandas AC, Kardamakis D, Gogos C, Karatza C, Thomopoulos K, Tepetes K, Kourelis T, Petsas T, Bonikos DS. The potential role of bcl-2 mRNA and protein exression in hepatocellular carcinomas. Anticancer Res. 2002;22:1799-1805. [PubMed] |
| 23. | Nakopoulou L, Stefanaki K, Vourlakou C, Manolaki N, Gakiopoulou H, Michalopoulos G. Bcl-2 protein expression in acute and chronic hepatitis, cirrhosis and hepatocellular carcinoma. Pathol Res Pract. 1999;195:19-24. [PubMed] |
| 24. | Elgendy SM, Hessien M, Elsherbiny MM, Abd El-Salam IM, El-Attar IA, El-Asser Ael-B. A panel of molecular markers in hepatitis C virus-related hepatocellular carcinoma. J Egypt Natl Canc Inst. 2005;17:270-278. [PubMed] |
| 25. | Sultan AS, S el G, Hessien M, Mahmoud el S, Ibrahim AS, Sherif ZA. Molecular markers of hepatitis C virus-related hepatocellular carcinoma. Cancer Biol Ther. 2006;5:623-629. [PubMed] |
| 26. | Coultas L, Strasser A. The role of the Bcl-2 protein family in cancer. Semin Cancer Biol. 2003;13:115-123. [PubMed] |
| 27. | Thorgeirsson SS, Grisham JW. Molecular pathogenesis of human hepatocellular carcinoma. Nat Genet. 2002;31:339-346. [PubMed] |
| 28. | De Miglio MR, Muroni MR, Simile MM, Calvisi DF, Tolu P, Deiana L, Carru A, Bonelli G, Feo F, Pascale RM. Implication of Bcl-2 family genes in basal and D-amphetamine-induced apoptosis in preneoplastic and neoplastic rat liver lesions. Hepatology. 2000;31:956-965. [PubMed] |