修回日期: 2025-06-24
接受日期: 2025-08-18
在线出版日期: 2025-08-28
巴雷特食管是胃食管反流病一个重要的并发症, 具有高转化为食管腺癌的风险, 其病理特征为食管鳞状上皮被柱状上皮取代, 部分伴肠化生, 其发病机制非常复杂, 涉及的致病因素及信号通路纷繁复杂. 酸反流与胆汁酸是主要致病因素, 可损伤食管黏膜、激活炎症及氧化应激反应, 还能通过调控CDX2、MUC2等基因表达促进肠化生; 高脂饮食、胃泌素及食管菌群改变等也参与其中. 分子机制方面, BMP-4/Smad、NOTCH、Hedgehog、WNT、NF-κB、IL-6/STAT3等信号通路异常激活, 在细胞转化、增殖及肠化生中起关键作用. 本文系统阐述了巴雷特食管一些潜在致病机制, 着重探讨涉及的信号转导通路, 为后续巴雷特食管的早期预防和靶向治疗提供新思路.
核心提要: 巴雷特食管为胃食管反流病常见的并发症之一, 因其显著的食管腺癌转化风险, 始终是临床与科研领域的焦点. 其病理演变涉及食管鳞状上皮被异常柱状上皮取代, 部分患者还伴随肠上皮化生, 这一过程的分子机制极为复杂, 涵盖多条信号传导通路的异常激活与调控失衡. 近年来在细胞分子生物学层面的研究不断深入, 但确切的发病机制仍存在诸多未知领域. 目前对于巴雷特食管的防治, 部分中药复方或单体成分经临床实践与基础研究证实, 能够有效抑制柱状上皮化生进程, 甚至逆转早期病变, 现阐述巴雷特食管的发病机制, 深入分析所涉及的包含胃酸与胆汁酸为主的致病因素, 及包含炎症与化生相关的分子信号通路, 为未来研制有效的化学预防药物提供线索.
引文著录: 李思琪, 杨磊, 李培彩, 弓艳霞. 巴雷特食管致病因素与相关信号转导通路的研究进展. 世界华人消化杂志 2025; 33(8): 619-624
Revised: June 24, 2025
Accepted: August 18, 2025
Published online: August 28, 2025
Barrett's esophagus (BE) is a significant complication of gastroesophageal reflux disease, carrying a high risk of transformation into adenocarcinoma of the esophagus. Its pathological feature is the replacement of the squamous epithelium by columnar epithelium in the esophagus, with some accompanied by intestinal metaplasia. This process is extremely complex, involving a multitude of pathogenic factors and signal transduction pathways. Acid reflux and bile acids are the primary pathogenic factors, which can damage the esophageal mucosa, activate inflammatory and oxidative stress responses, and promote intestinal metaplasia by regulating the expression of genes such as CDX2 and MUC2. Additionally, high-fat diet, gastrin, and alterations in esophageal microbiota are also involved. In terms of molecular mechanisms, abnormal activation of signaling pathways such as BMP-4/Smad, Notch, Hedgehog, Wnt, NF-κB, and IL-6/STAT3 plays a critical role in the pathogenesis of BE. This article systematically expounds on the potential pathogenic mechanisms of BE and the signal transduction pathways involved, with an aim to provide new insights for the early prevention and targeted therapy of this condition.
- Citation: Li SQ, Yang L, Li PC, Gong YX. Progress in research of pathogenic factors and signal transduction pathways in Barrett's esophagus. Shijie Huaren Xiaohua Zazhi 2025; 33(8): 619-624
- URL: https://www.wjgnet.com/1009-3079/full/v33/i8/619.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v33.i8.619
巴雷特食管(Barrett's esophagus, BE)为胃食管反流(gastroesophageal reflux disease, GERD)常见的并发症之一, 因其显著的食管腺癌转化风险, 始终是临床与科研领域的焦点. 其病理演变涉及食管鳞状上皮被异常柱状上皮取代, 部分患者还伴随肠上皮化生, 这一过程的分子机制极为复杂, 涵盖多条信号传导通路的异常激活与调控失衡. 尽管近年来在细胞分子生物学层面的研究不断深入, 但确切的发病机制仍存在诸多未知领域. 对BE相关信号传导通路实施靶向干预, 极有可能阻断乃至逆转BE向食管腺癌的演进进程, 具有很高的临床价值, 这一领域亦成为当前临床研究的重点方向. 现阐述BE的发病机制, 深入分析所涉及的致病因素与可能的分子信号通路, 为未来研制有效的化学预防药物提供线索.
BE与GERD症状具有很强的关联性, 在具有反流症状或患有GERD病的个体中, 经组织学确诊的BE患者, 范围约为3%-14%, 内镜下疑似BE的患病率则更高[1]. BE在西方人群中的发病率在过去四十年显著上升, 与食管腺癌的流行趋势一致, 存在明显的性别差异(男性发病率约为女性2倍), 长段BE进展为食管腺癌的年风险达0.33%; 亚洲地区BE患病率为0.06%-5%, 低于西方, 以短段BE为主, 新加坡、日本等地发病率呈上升趋势, 台湾研究[2,3]显示非异型增生BE进展为低级别异型增生和食管腺癌的年风险分别为2.9%和0.4%, 因进展风险较低, 亚洲指南不推荐对非异型增生BE常规内镜监测, 而西方指南建议根据BE段长度分层监测. BE是GERD病的常见并发症, 具有高转化为腺癌的风险, 是目前食管腺癌唯一已知癌前病变, 与食管腺癌的进展风险相关, 非异型增生、低级别及高级别异型增生每年进展为腺癌的风险分别为0.33%、1%和6%[3]. 故针对于BE发生机制的研究及预防具有很大的临床意义.
BE的诊断目前还存在一定争议. 美国与德国等一些西方国家认为, 食管鳞状上皮中出现含杯状细胞的肠化生, 它是BE组织学确诊的必要条件, 这部分学者认为, 缺乏杯状细胞的柱状上皮可能仅是胃黏膜异位或短暂的适应性改变, 并非真正意义上的BE. 而英国、日本等国家则认为BE的产生是一个动态过程, 具有渐进性, 早期阶段可能尚未出现典型肠化生特征, 即便未出现杯状细胞, 只要存在食管固有腺体缺失、上皮细胞呈柱状排列等特征, 也应被视为BE[4]. 基于不同国家对BE组织学上的不同看法, 关于肠化生在BE确诊中的必要性, 学术界尚存在争议, 但它被公认为是评估BE癌变风险的关键预测因素. 与之形成对比的是, 柱状上皮在BE的诊断标准中具有更明确的界定作用.
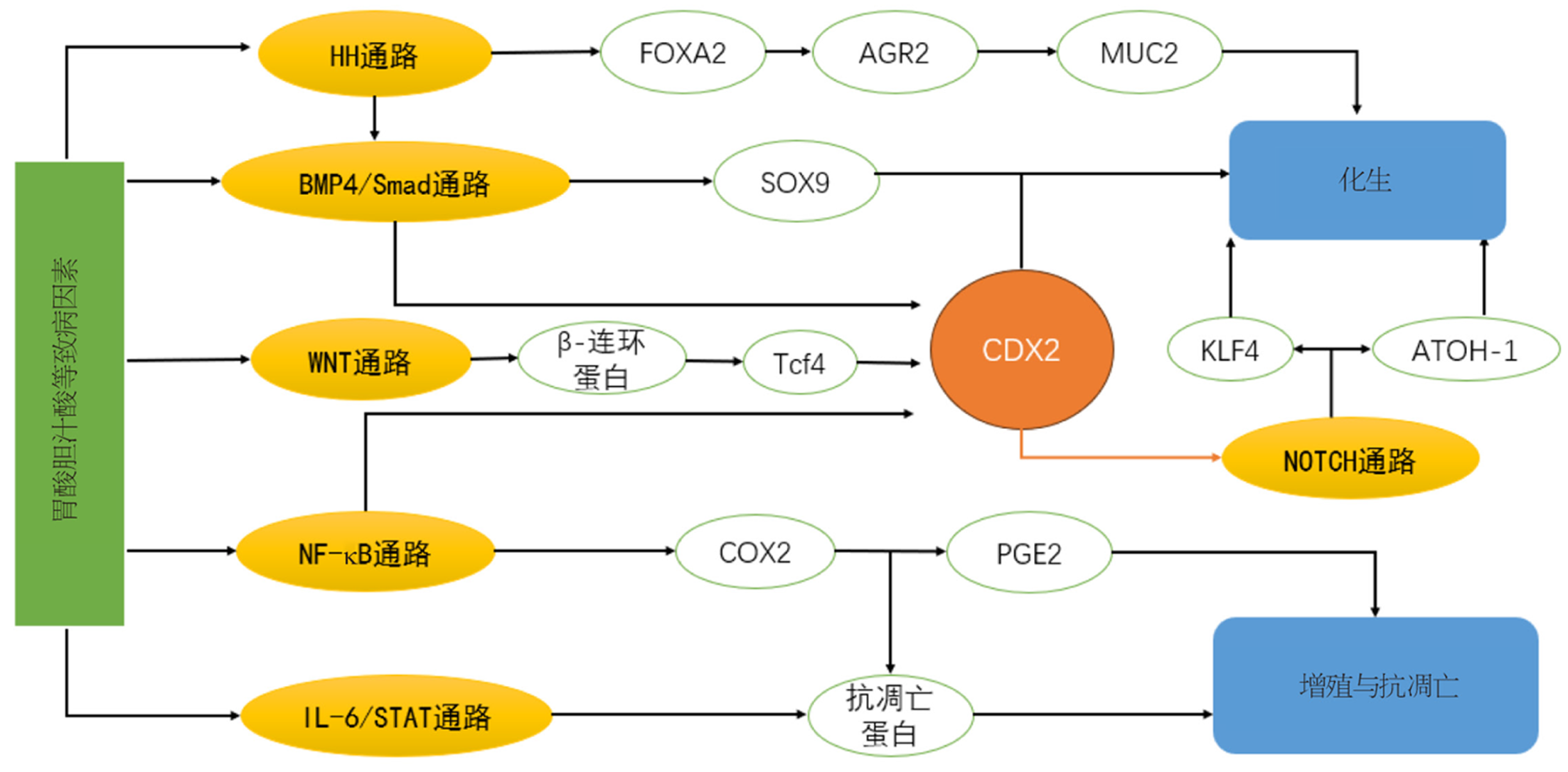
信号传导通路的激活在化生的发展中起重要作用, 相关研究显示, 在BE的形成过程中, 多种信号传导通路被异常激活, 为BE的研究提供全新视角. 本综述将从两个层面展开系统性剖析: 一方面, 深入探究导致信号通路异常激活的潜在致病因素; 另一方面, 对信号转导通路的内在机制进行全面而深度的挖掘.
正常食管黏膜在一些致病因素的作用下, 导致食管黏膜损伤, 进而激活相关信号传导通路, 使食管黏膜发生化生, 导致BE的发生, 以下是对一些致病因素的总结.
BE是GERD病一个重要的并发症, 酸过度反流可导致食管黏膜破损, 被认为可能是导致BE的一个重要条件. 酸反流所导致BE的形成机制比较复杂, 目前认为BE的形成过程中酸反流起着关键的启动和促进作用, 它会损伤食管细胞, 促进炎症反应, 激活细胞内一氧化氮合酶途径诱导细胞内活性氧生成, 长期酸反流所导致的炎症与氧化应激环境会诱导食管黏膜逐渐失去正常形态[5]. 酸反流可以导致环氧化酶-2(COX2)表达升高, 进而使一系列分子通路异常激活, 参与细胞增殖与肠化生的发展进程中[6]. 胃酸反流在食管化生段所形成的PH梯度使胆盐的溶解度达到最佳状态, 使其能够顺利进入上皮细胞, 进而刺激多种信号通路. 虽然目前对于酸反流的具体机制还没有完全明确, 但由于它与BE的强关联性, 故目前西药方面对BE的治疗还更聚焦于抑酸剂的使用.
胆汁酸是另一种与BE相关的损伤因素. 有学者对BE患者的唾液中的胆汁酸进行测定, 证实几乎所有类型胆汁酸含量都很高, 提示胆汁酸也是研究BE发病机制的一个重要致病因素[7]. 目前对胆汁酸致病机制的研究可以大致分为两个方面, 一是促进炎症反应: 胆汁酸可以直接通过激活食管上皮细胞内的炎症信号通路, 使炎症反应从慢性向急性中性粒细胞反应转变, 推动BE发展[8]. 二是调节基因的表达: 胆汁酸可导致CDX2、Muc2、Bmp4、Kit19和Tff2等基因表达上调, 其中CDX2基因参与肠道分化, 其表达上调可能促使食管上皮细胞向肠型上皮细胞转化, 这是Barrett食管形成的重要特征之一. Muc2是由杯状细胞分泌的特异性蛋白质, 其表达上调代表肠化生的发生. 其余基因表达上调会扰乱食管上皮的正常生理功能, 共同促进BE的发展.胆汁酸及胃酸共同作用, 参与到BE的损伤及化生过程中, 目前的研究中, 胆汁酸可能参与到更多的损伤机制中[8,9].
高脂饮食与BE呈正相关, 长期高脂饮食明显诱发肥胖和血脂紊乱, 研究显示[10], 脱氧胆酸与高脂饮食结合, 会明显增强炎症的严重程度和化生长度. 高脂饮食明显诱发肥胖和血脂紊乱, 肥胖状态下会打破抗炎分子和促炎分子的平衡状态, 促进炎症的发生; 同时分泌的瘦素增多, 及肥胖所导致的胰岛素抵抗会激活促进细胞的增殖的信号传导通路, 使细胞异常增殖[10,11]. 胃泌素与CCK2受体结合可发挥促进细胞增殖的作用, 当胃泌素与受体结合时, 会诱导环氧化酶COX-2的表达, 促使BE细胞增殖, 进而改变了细胞原本的分化进程[12]. 与正常食管黏膜相比, BE生物菌群发生改变, 革兰氏阴性菌相对丰度升高, 相对的革兰氏阳性菌减少. 其中, 浮霉菌门和泉古菌门在BE中显著减少, 且不受其它因素影响, 可能作为BE的潜在生物标志物. 革兰性阴性菌的脂多糖与食管上皮细胞相关受体结合, 会激活NF-κB炎症通路, 为BE的发生创造条件; 另外脂多糖也可影响环氧化酶的活性, 使胃排空发生延迟, 干扰食管下括约肌功能, 促进反流症状增加食管受损的可能. 某些细菌可分泌基因毒素, 如细胞致死性膨胀毒素, 可引起基因组损伤, 增加细胞癌变的风险[13-15].
食管黏膜从正常的鳞状上皮转化为BE的机制仍处于深入研究阶段, 这一复杂过程涉及多种信号分子通路的参与, 以下是对信号通路的总结.
Milano等[16]通过研究患者活检组织及构建BE大鼠模型, 发现BMP-4在食管炎及BE组织中高度表达, 经BMP-4处理的正常食管黏膜, 其角蛋白及基因组的表达也趋向于柱状上皮, 这表明BMP-4通路在促进鳞状上皮向柱状上皮的转化中起到重要作用. 在此基础上, 后续的许多研究也逐渐证实BMP-4通路在BE中扮演重要角色, CDX2作为肠化生的重要标志, 已有研究证实CDX2基因位于BMP-4/Smad通路下游, CDX2与BMP-4通路共同作用, 促进BE发生肠化生, 促进BE向食管腺癌转化[17]. 在BE向食管腺癌的发展中, BMP通路也在不断发挥作用, BMP-4通过上调SNAIL2(一种转录阻遏蛋白), 从而下调上皮钙粘蛋白CDH1的表达, 使细胞失去细胞间及细胞外基质的连接, 获得迁移能力[18]. 现阶段的研究对BMP-4于BE发展过程中所扮演的角色有着更为透彻的认知, BMP-4对于BE的病理改变起着举足轻重的作用, 精准干预BMP-4通路, 可更有效的预防BE恶化. 有研究人员使用骆驼源BMP-2/4抗体抑制BMP-2及BMP-4, 有效的减少柱状上皮数量, 促进鳞状上皮生长, 为BE的预防提供了极具潜力的新思路[19]. 后续也可在此基础上, 优化干预手段, 同时深入挖掘BMP通路在BE中的机制, 提供更为坚实的理论基础.
NOTCH信号通路在BE的发生发展中起到了重要的作用, NOTCH通路被抑制具有促进鳞状细胞转化为柱状细胞的作用, 这表现为腺黏蛋白(MUC2)表达增加和鳞状角蛋白(K13)表达降低. 有学者发现[20], 在胆汁酸存在的情况下, CDX2与NOTCH通路之间存在相关转录网, 反流物如胆汁酸会促进CDX2的表达, 抑制NOTCH通路, 使Hes1(NOTCH通路的关键分子)表达下降, ATOH-1被激活, 促进食管细胞发生肠化[21]. 还有研究表明[22], 抑制Notch信号也会激活KLF4基因表达, 它能够促使细胞表达柱状角蛋白和黏蛋白基因, 推动细胞向肠样细胞的转分化. 而在BE发展的后期, 有学者发现NOTCH信号通路被异常激活, 一方面诱导细胞去分化, 使一些细胞失去原本的分化方向, 另一方面促进细胞增殖, 使隐窝分裂增强(肠道细胞增殖的一种方式), 促进BE不断发展, 并有一定可能向腺癌转化[23]. 目前对于NOTCH通路的具体机制还尚不清楚, 根据目前的文献来看, NOTCH通路被抑制从而参与BE的形成是普遍被认同的, 但关于BE向腺癌的转化的研究中, NOTCH通路又是被异常激活的情况, 故在BE的发展过程中, NOTCH通路在什么样的节点上被激活还尚不明确, 若要达成深度探索, 还需投入更多研究精力.
目前Hedgehog通路(HH通路)已被证实在BE的发展过程中具有重要作用. 在酸和胆汁刺激的环境下, HH通路被激活, 一方面可以诱导靶基因FOXA2激活, 刺激AGR2(AGR2是一种与BE化生相关且为MUC2蛋白加工所必需的蛋白质)与MUC2表达上调, 促进细胞的肠化, 这属于HH通路的直接诱导作用[24]. HH还有一种导致肠化的间接诱导作用, 在HH激活的状态下, HH配体向周围间质细胞发出信号, 使靶基因BMP4表达上调, 在角质形成细胞中激活pSMAD1/5/8, 诱导SOX9的表达, 激活DMBT1(诱导向柱状上皮分化的基因), 启动柱状转录[25]. 目前有关HH通路与BE发生机制关系的相关文献还有限, 但此方向具有很大的研究潜力, HH通路相关抑制剂很可能成为未来临床研究的热点.
WNT信号通路在各种组织的发育和体内平衡中起重要作用, 研究显示[26,27], 在BE的发展过程中, 该通路异常激活. WNT信号通路的关键介质是β-连环蛋白, 正常情况下β-连环蛋白被磷酸化而水解, 当WNT通路被异常激活时, 会抑制β-连环蛋白的磷酸化, 使β-连环蛋白进入细胞核中与Tcf4等Tcf/LEF家族蛋白结合, 促进下游基因的转录, 进而影响CDX2的表达, 调节细胞的增殖分化过程. SFRP1作为WNT信号通路的拮抗剂, 可参与调节WNT信号通路维持细胞的正常分化和增殖平衡, 然而在BE中, 由于启动子甲基化导致其表达受抑制, SFRP1失去其原本功能导致WNT被异常激活, 干扰了细胞正常分化程序, 导致正常鳞状上皮被化生柱状上皮取代, 进而引发BE的发生[26-28]. 目前有关WNT在BE的具体机制还存在一些争议, 有学者认为[29], WNT与有异型增生的BE关系密切, 但与化生联系尚浅. 但也有学者认为[30], 在非异型增生的BE中WNT也有适度激活, 与正常鳞状上皮相比, BE化生中β连环蛋白活性升高, WNT可通过激活BMP信号诱导细胞柱状分化. 关于WNT信号通路目前的研究更聚焦于BE向腺癌转化的机制研究, 对于WNT是否参与细胞化生目前还存在争议, 需要更多的研究去探讨机制.
NF-κB通路的激活从正常上皮通过化生, 异型增生到腺癌逐渐发展. GERD病通过其反流物的刺激, 诱导HIF-2α稳定化、与HIF反应元件结合, 触发促炎因子的合成与释放, 激活NF-κB通路, 导致炎症反应及细胞增殖. 其中, 酸会诱导NADPH氧化酶NOX5-S增加, 从而激活NF-κB, 使其与COX2基因启动子结合位点结合, 诱导COX2产生, 使PGE2增加, 促进细胞增殖. 脱氧胆酸会通过激活NF-κB通路, 使抗凋亡蛋白Bcl-2表达升高, 使细胞在面对如DNA损伤的情况下仍能存活[31]. NF-κB还可以上调DNMT1, 从而导致异常甲基化使肿瘤抑癌基因沉默或使癌基因激活, 还能激活基质细胞与上皮细胞之间相互作用, 重塑肿瘤微环境, 使BE向EAC转化[32,33]. 还有学者发现[34], NF-κB通路的激活程度在GERD与BE中存在个体差异, 某些个体的鳞状上皮在反流物的刺激下, NF-κB的激活程度足以使CDX2表达, 这种个体往往易转化为BE, 这也解释了为什么有些GERD患者可以转化为BE, 但有些却不能. NF-κB在BE的发展过程中影响甚广, 无论是炎症损伤方面还是促进细胞增殖方面, NF-κB通路的研究价值都很高, NF-κB在BE研究中具有重要的潜在价值与广阔的研究前景.
IL-6/STAT3信号通路的激活在BE中较为常见, 在GERD病患者中, 由于食管远端长期处于低PH环境并且在胆汁酸的刺激下发生氧化应激, 使IL-6增高, 诱导STAT3磷酸化, 使细胞合成抗凋亡蛋白, 这一过程贯穿BE的起始及发展阶段, 在BE向腺癌演变过程中更不容忽视[35,36]. Bhat等[37]通过细胞实验, 蛋白及基因检测等方法, 发现了另一条与BE相关新通路, 即APE1-EGFR-STAT3信号轴, 实验证明了APE1在酸性胆汁酸的刺激下, 刺激STAT3的多个靶基因的上调, 与反流诱导的Barrett食管和食管腺癌的病因密切相关. 此信号轴也为抑制BE的发展及食管腺癌的产生提供新靶点.
综上所述, BE的发生与BMP-4/Smad、NOTCH、Hedgehog、WNT、NF-κB、IL-6/STAT3等信号通路异常激活密切相关. 这些通路通过调控细胞增殖及化生, 在食管黏膜鳞状上皮向柱状上皮转化中起关键作用, 形成了一个复杂的调控网络(图1).
BE是食管腺癌的一种癌前病变, 其发病机制与病理演变过程备受关注, 这些异常上皮细胞在胃酸、胆汁等多种因素的持续刺激下, 极易发生肠化及不典型增生, 逐渐发展为恶性程度更高的食管腺癌. 本文首次系统整合了致病因素与信号转导通路的交互作用网络, 相较于传统研究仅聚焦单一因素, 本文的优势在于建立了"损伤刺激-信号激活-细胞转化"的三维致病模型. 巴雷特管向腺癌的转化呈现出阶梯式、渐进性的特点, 这一过程往往持续数年甚至数十年, 我们可以在其发展为腺癌之前就对其进行治疗, 提高患者的生存质量. 针对于BE的治疗, 一方面可以通过减少致病的因素, 减少患者患BE的风险. 另一方面可以阻断BE所涉及到的分子信号通路, 通过对信号通路的全面分析, 可以发现一些潜在的治疗靶点, 研究靶向治疗药物, 精准地作用于异常的信号通路靶点, 阻断病变的发展, 提高治愈率. 在目前已有的研究中, 针对BMP-4的骆驼源抗体已在动物模型中证实可促进鳞状上皮再生, 提示该通路抑制剂可能成为逆转化生的突破性药物, 而APE1-EGFR-STAT3信号轴的发现, 也提供了新靶点. 值得期待的是, 随着对BE的探索, 未来可绘制BE信号通路图谱, 实现更精准的治疗模式, 这不仅能显著提升化学预防的效率, 更有望在食管腺癌前病变阶段阻断疾病进展, 为消化道肿瘤的早期干预开辟全新路径.
学科分类: 胃肠病学和肝病学
手稿来源地: 天津市
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): B, B
C级 (良好): C
D级 (一般): D
E级 (差): 0
科学编辑: 刘继红 制作编辑:张砚梁
| 1. | Eusebi LH, Cirota GG, Zagari RM, Ford AC. Global prevalence of Barrett's oesophagus and oesophageal cancer in individuals with gastro-oesophageal reflux: a systematic review and meta-analysis. Gut. 2021;70:456-463. [PubMed] [DOI] |
| 2. | Di J, Sharma N, Pérez LKM, Zhang J, Ho KY. Surveillance strategy of Barrett's esophagus in the Asian region with particular reference to its locoregional epidemiology. JGH Open. 2020;4:565-568. [PubMed] [DOI] |
| 3. | Thrift AP. Global burden and epidemiology of Barrett oesophagus and oesophageal cancer. Nat Rev Gastroenterol Hepatol. 2021;18:432-443. [PubMed] [DOI] |
| 4. | Amano Y, Ishimura N, Ishihara S. Is Malignant Potential of Barrett's Esophagus Predictable by Endoscopy Findings? Life (Basel). 2020;10:244. [PubMed] [DOI] |
| 5. | Kong J, Whelan KA, Laczkó D, Dang B, Caro Monroig A, Soroush A, Falcone J, Amaravadi RK, Rustgi AK, Ginsberg GG, Falk GW, Nakagawa H, Lynch JP. Autophagy levels are elevated in barrett's esophagus and promote cell survival from acid and oxidative stress. Mol Carcinog. 2016;55:1526-1541. [PubMed] [DOI] |
| 6. | Jiangang S, Nayoung K, Hongfang W, Junda L, Li C, Xuefeng B, Mingsong L. COX-2 strengthens the effects of acid and bile salts on human esophageal cells and Barrett esophageal cells. BMC Mol Cell Biol. 2022;23:19. [PubMed] [DOI] |
| 7. | Dosedělová V, Laštovičková M, Ayala-Cabrera JF, Dolina J, Konečný Š, Schmitz OJ, Kubáň P. Quantification and identification of bile acids in saliva by liquid chromatography-mass spectrometry: Possible non-invasive diagnostics of Barrett's esophagus? J Chromatogr A. 2022;1676:463287. [PubMed] [DOI] |
| 8. | Sun D, Wang X, Gai Z, Song X, Jia X, Tian H. Bile acids but not acidic acids induce Barrett's esophagus. Int J Clin Exp Pathol. 2015;8:1384-1392. [PubMed] |
| 9. | Quante M, Bhagat G, Abrams JA, Marache F, Good P, Lee MD, Lee Y, Friedman R, Asfaha S, Dubeykovskaya Z, Mahmood U, Figueiredo JL, Kitajewski J, Shawber C, Lightdale CJ, Rustgi AK, Wang TC. Bile acid and inflammation activate gastric cardia stem cells in a mouse model of Barrett-like metaplasia. Cancer Cell. 2012;21:36-51. [PubMed] [DOI] |
| 10. | Molendijk J, Nguyen TM, Brown I, Mohamed A, Lim Y, Barclay J, Hodson MP, Hennessy TP, Krause L, Morrison M, Hill MM. Chronic High-Fat Diet Induces Early Barrett's Esophagus in Mice through Lipidome Remodeling. Biomolecules. 2020;10:776. [PubMed] [DOI] |
| 11. | Hassan MS, Johnson C, Ponna S, Scofield D, Awasthi N, von Holzen U. Inhibition of Insulin-like Growth Factor 1 Receptor/Insulin Receptor Signaling by Small-Molecule Inhibitor BMS-754807 Leads to Improved Survival in Experimental Esophageal Adenocarcinoma. Cancers (Basel). 2024;16:3175. [PubMed] [DOI] |
| 12. | Chueca E, Lanas A, Piazuelo E. Role of gastrin-peptides in Barrett's and colorectal carcinogenesis. World J Gastroenterol. 2012;18:6560-6570. [PubMed] [DOI] |
| 13. | Lv J, Guo L, Liu JJ, Zhao HP, Zhang J, Wang JH. Alteration of the esophageal microbiota in Barrett's esophagus and esophageal adenocarcinoma. World J Gastroenterol. 2019;25:2149-2161. [PubMed] [DOI] |
| 14. | Peter S, Pendergraft A, VanDerPol W, Wilcox CM, Kyanam Kabir Baig KR, Morrow C, Izard J, Mannon PJ. Mucosa-Associated Microbiota in Barrett's Esophagus, Dysplasia, and Esophageal Adenocarcinoma Differ Similarly Compared With Healthy Controls. Clin Transl Gastroenterol. 2020;11:e00199. [PubMed] [DOI] |
| 15. | Snider EJ, Freedberg DE, Abrams JA. Potential Role of the Microbiome in Barrett's Esophagus and Esophageal Adenocarcinoma. Dig Dis Sci. 2016;61:2217-2225. [PubMed] [DOI] |
| 16. | Milano F, van Baal JW, Buttar NS, Rygiel AM, de Kort F, DeMars CJ, Rosmolen WD, Bergman JJ, VAn Marle J, Wang KK, Peppelenbosch MP, Krishnadath KK. Bone morphogenetic protein 4 expressed in esophagitis induces a columnar phenotype in esophageal squamous cells. Gastroenterology. 2007;132:2412-2421. [PubMed] [DOI] |
| 17. | Castillo D, Puig S, Iglesias M, Seoane A, de Bolós C, Munitiz V, Parrilla P, Comerma L, Poulsom R, Krishnadath KK, Grande L, Pera M. Activation of the BMP4 pathway and early expression of CDX2 characterize non-specialized columnar metaplasia in a human model of Barrett's esophagus. J Gastrointest Surg. 2012;16:227-37; discussion 237. [PubMed] [DOI] |
| 18. | Kestens C, Siersema PD, Offerhaus GJ, van Baal JW. BMP4 Signaling Is Able to Induce an Epithelial-Mesenchymal Transition-Like Phenotype in Barrett's Esophagus and Esophageal Adenocarcinoma through Induction of SNAIL2. PLoS One. 2016;11:e0155754. [PubMed] [DOI] |
| 19. | Correia ACP, Straub D, Read M, Hoefnagel SJM, Romero-Pinedo S, Abadía-Molina AC, Clemons NJ, Wang K, Calpe S, Phillips W, Krishnadath KK. Inhibition of BMP2 and BMP4 Represses Barrett's Esophagus While Enhancing the Regeneration of Squamous Epithelium in Preclinical Models. Cell Mol Gastroenterol Hepatol. 2023;15:1199-1217. [PubMed] [DOI] |
| 20. | Wang YC, Wang ZQ, Yuan Y, Ren T, Ni PZ, Chen LQ. Notch Signaling Pathway Is Inhibited in the Development of Barrett's Esophagus: An In Vivo and In Vitro Study. Can J Gastroenterol Hepatol. 2018;2018:4149317. [PubMed] [DOI] |
| 21. | Tamagawa Y, Ishimura N, Uno G, Yuki T, Kazumori H, Ishihara S, Amano Y, Kinoshita Y. Notch signaling pathway and Cdx2 expression in the development of Barrett's esophagus. Lab Invest. 2012;92:896-909. [PubMed] [DOI] |
| 22. | Vega ME, Giroux V, Natsuizaka M, Liu M, Klein-Szanto AJ, Stairs DB, Nakagawa H, Wang KK, Wang TC, Lynch JP, Rustgi AK. Inhibition of Notch signaling enhances transdifferentiation of the esophageal squamous epithelium towards a Barrett's-like metaplasia via KLF4. Cell Cycle. 2014;13:3857-3866. [PubMed] [DOI] |
| 23. | Kunze B, Wein F, Fang HY, Anand A, Baumeister T, Strangmann J, Gerland S, Ingermann J, Münch NS, Wiethaler M, Sahm V, Hidalgo-Sastre A, Lange S, Lightdale CJ, Bokhari A, Falk GW, Friedman RA, Ginsberg GG, Iyer PG, Jin Z, Nakagawa H, Shawber CJ, Nguyen T, Raab WJ, Dalerba P, Rustgi AK, Sepulveda AR, Wang KK, Schmid RM, Wang TC, Abrams JA, Quante M. Notch Signaling Mediates Differentiation in Barrett's Esophagus and Promotes Progression to Adenocarcinoma. Gastroenterology. 2020;159:575-590. [PubMed] [DOI] |
| 24. | Maslenkina K, Mikhaleva L, Naumenko M, Vandysheva R, Gushchin M, Atiakshin D, Buchwalow I, Tiemann M. Signaling Pathways in the Pathogenesis of Barrett's Esophagus and Esophageal Adenocarcinoma. Int J Mol Sci. 2023;24:9304. [PubMed] [DOI] |
| 25. | Wang DH, Clemons NJ, Miyashita T, Dupuy AJ, Zhang W, Szczepny A, Corcoran-Schwartz IM, Wilburn DL, Montgomery EA, Wang JS, Jenkins NA, Copeland NA, Harmon JW, Phillips WA, Watkins DN. Aberrant epithelial-mesenchymal Hedgehog signaling characterizes Barrett's metaplasia. Gastroenterology. 2010;138:1810-1822. [PubMed] [DOI] |
| 26. | Clément G, Braunschweig R, Pasquier N, Bosman FT, Benhattar J. Alterations of the Wnt signaling pathway during the neoplastic progression of Barrett's esophagus. Oncogene. 2006;25:3084-3092. [PubMed] [DOI] |
| 27. | Chen X, Jiang K, Fan Z, Liu Z, Zhang P, Zheng L, Peng N, Tong J, Ji G. Aberrant expression of Wnt and Notch signal pathways in Barrett's esophagus. Clin Res Hepatol Gastroenterol. 2012;36:473-483. [PubMed] [DOI] |
| 28. | Clément G, Guilleret I, He B, Yagui-Beltrán A, Lin YC, You L, Xu Z, Shi Y, Okamoto J, Benhattar J, Jablons D. Epigenetic alteration of the Wnt inhibitory factor-1 promoter occurs early in the carcinogenesis of Barrett's esophagus. Cancer Sci. 2008;99:46-53. [PubMed] [DOI] |
| 29. | Moyes LH, McEwan H, Radulescu S, Pawlikowski J, Lamm CG, Nixon C, Sansom OJ, Going JJ, Fullarton GM, Adams PD. Activation of Wnt signalling promotes development of dysplasia in Barrett's oesophagus. J Pathol. 2012;228:99-112. [PubMed] [DOI] |
| 30. | Lyros O, Rafiee P, Nie L, Medda R, Jovanovic N, Otterson MF, Behmaram B, Gockel I, Mackinnon A, Shaker R. Wnt/β-Catenin Signaling Activation beyond Robust Nuclear β-Catenin Accumulation in Nondysplastic Barrett's Esophagus: Regulation via Dickkopf-1. Neoplasia. 2015;17:598-611. [PubMed] [DOI] |
| 31. | Si J, Fu X, Behar J, Wands J, Beer DG, Souza RF, Spechler SJ, Lambeth D, Cao W. NADPH oxidase NOX5-S mediates acid-induced cyclooxygenase-2 expression via activation of NF-kappaB in Barrett's esophageal adenocarcinoma cells. J Biol Chem. 2007;282:16244-16255. [PubMed] [DOI] |
| 32. | Huo X, Juergens S, Zhang X, Rezaei D, Yu C, Strauch ED, Wang JY, Cheng E, Meyer F, Wang DH, Zhang Q, Spechler SJ, Souza RF. Deoxycholic acid causes DNA damage while inducing apoptotic resistance through NF-κB activation in benign Barrett's epithelial cells. Am J Physiol Gastrointest Liver Physiol. 2011;301:G278-G286. [PubMed] [DOI] |
| 33. | Anand A, Fang HY, Mohammad-Shahi D, Ingermann J, Baumeister T, Strangmann J, Schmid RM, Wang TC, Quante M. Elimination of NF-κB signaling in Vimentin+ stromal cells attenuates tumorigenesis in a mouse model of Barrett's Esophagus. Carcinogenesis. 2021;42:405-413. [PubMed] [DOI] |
| 34. | Huo X, Zhang X, Yu C, Cheng E, Zhang Q, Dunbar KB, Pham TH, Lynch JP, Wang DH, Bresalier RS, Spechler SJ, Souza RF. Aspirin prevents NF-κB activation and CDX2 expression stimulated by acid and bile salts in oesophageal squamous cells of patients with Barrett's oesophagus. Gut. 2018;67:606-615. [PubMed] [DOI] |
| 35. | Lauricella M, Di Liberto D. Special Issue: "Inflammatory Signaling Pathways Involved in Gastrointestinal Diseases". Int J Mol Sci. 2024;25:1287. [PubMed] [DOI] |
| 36. | Dvorak K, Dvorak B. Role of interleukin-6 in Barrett's esophagus pathogenesis. World J Gastroenterol. 2013;19:2307-2312. [PubMed] [DOI] |