修回日期: 2025-04-23
接受日期: 2025-06-13
在线出版日期: 2025-06-28
2型糖尿病(type 2 diabetes mellitus, T2DM)患者早期肾损害发生率高, 严重影响患者预后, 肠道菌群在糖代谢及慢性炎症调控中发挥关键作用, 推测肠道菌群结构及功能改变可能参与T2DM早期肾损害发生发展过程.
探讨T2DM患者肠道菌群与早期肾损害的关系, 以期为临床早期评估肾脏损伤风险、针对性给予干预治疗提供参考依据.
选取2018-01/2023-12我院130例T2DM合并早期肾损害患者作为观察组, 另根据1:1配对原则选取同期收治130例单纯T2DM患者作为对照组. 比较两组基线资料及肠道菌群, Pearson分析肠道菌群与血糖[空腹血糖(fasting plasma glucose, FPG)、糖化血红蛋白(hemoglobin A1c, HbAlc)]水平的相关性, Logistic回归分析肠道菌群与T2DM早期肾损害的关系, 基于限制性立方条样模型分析肠道菌群与T2DM早期肾损害关联强度的剂量反应性.
观察组FPG、HbAlc、粪肠球菌、大肠埃希菌、链球菌均高于对照组, 乳酸杆菌及双歧杆菌低于对照组, 差异有统计学意义(P<0.05); T2DM合并早期肾损害患者乳酸杆菌、双歧杆菌与FPG、HbAlc呈负相关; 大肠埃希菌、粪肠球菌、链球菌与FPG、HbAlc呈正相关(P<0.05); Logistic回归分析显示, 未调整任何混杂因素、调整部分混杂因素及调整全部混杂因素, 乳酸杆菌、双歧杆菌、大肠埃希菌、粪肠球菌、链球菌均与T2DM早期肾损害有关(P<0.05); 限制性立方条样模型结果显示, 乳酸杆菌、双歧杆菌、大肠埃希菌、粪肠球菌、链球菌均与T2DM早期肾损害风险关联强度之间存在非线性剂量关系(P<0.05); 乳酸杆菌、双歧杆菌连续变化与T2DM早期肾损害风险呈负相关, 当乳酸杆菌、双歧杆菌分别<5.76 lgCFU/g、5.89 lgCFU/g, T2DM早期肾损害风险随其下降而升高, 大肠埃希菌、粪肠球菌、链球菌>6.24 lgCFU/g、6.79 lgCFU/g、5.99 lgCFU/g, T2DM早期肾损害风险随其升高而升高.
肠道菌群与T2DM患者早期肾损伤密切相关, 为临床早期评估T2DM患者肾损伤发生风险提供一定参考, 以针对性制定相应干预方案.
核心提要: 2型糖尿病(type 2 diabetes mellitus, T2DM)合并早期肾脏损害患者肠道菌群发生明显变化, 且肠道菌群与患者血糖水平相关, 肠道菌群变化为T2DM患者早期肾损害的影响因素, 可通过肠道菌群变化辅助评估T2DM患者早期深损害风险.
引文著录: 周斌. 2型糖尿病患者肠道菌群与早期肾损害的关系探讨. 世界华人消化杂志 2025; 33(6): 499-506
Revised: April 23, 2025
Accepted: June 13, 2025
Published online: June 28, 2025
Patients with type 2 diabetes mellitus (T2DM) have a high incidence of early renal damage, which seriously affects their prognosis. Intestinal flora plays a key role in glucose metabolism and chronic inflammation regulation. It is speculated that changes in the structure and function of bowel microbiota may be involved in the occurrence and development of early renal damage in T2DM patients.
To explore the relationship between intestinal flora and early kidney damage in patients with T2DM, with an aim to provide a reference for early clinical assessment of kidney damage risk and development of targeted intervention therapy.
A total of 130 patients with T2DM and early kidney damage in our hospital from January 2018 to December 2023 were selected as an observation group. In addition, 130 patients with T2DM alone during the same period were selected as a control group based on the principle of 1:1 matching. Baseline data and intestinal flora were compared between the two groups. Pearson correlation analysis was used to analyze the correlation between intestinal flora and blood glucose levels [fasting plasma glucose (FPG), hemoglobin A1c (HbAlc)]. Logistic regression analysis was used to investigate the relationship between intestinal flora and early kidney damage in T2DM. Based on the restricted cubic spline model, the dose-response relationship between intestinal flora and early kidney damage in T2DM patients was analyzed.
FPG, HbAlc, Escherichia coli, Enterococcus faecalis, and Streptococcus in the observation group were significantly higher than those of the control group, while Lactobacillus and Bifidobacterium were significantly lower than those of the control group (P < 0.05). In patients with T2DM and early kidney damage, Lactobacilli and Bifidobacterium were negatively correlated with FPG and HbAlc, while Escherichia coli, Enterococcus faecalis, and Streptococcus were positively correlated with FPG and HbAlc (P < 0.05). Logistic regression analysis showed that Lactobacillus, Bifidobacterium, Escherichia coli, Fecal enterococcus, and Streptococcus were all associated with early renal damage in T2DM, without adjusting for any confounding factors, or after adjusting for some or all confounding factors (P < 0.05). The results of the restricted cubic spline model showed that there was a significant nonlinear dose-response relationship between the risk of early kidney damage in T2DM and the presence of Lactobacillus, Bifidobacterium, Escherichia coli, Enterococcus faecalis, and Streptococcus (P < 0.05). The continuous changes of Lactobacillus and Bifidobacterium were negatively correlated with the risk of early kidney damage in T2DM. When Lactobacillus and Bifidobacterium were less than 5.76 lgCFU/g and 5.89 lgCFU/g, respectively, the risk of early kidney damage in T2DM was increased as they decreased. When Escherichia coli, Enterococcus faecalis, and Streptococcus were greater than 6.24 lgCFU/g, 6.79 lgCFU/g, and 5.99 lgCFU/g, respectively, the risk of early kidney damage in T2DM increased as they increased.
Intestinal flora is closely related to early kidney injury in patients with T2DM. This finding provides some reference for early clinical assessment of the risk of kidney injury in T2DM patients and development of targeted intervention plans.
- Citation: Zhou B. Relationship between intestinal flora and early kidney damage in patients with type 2 diabetes mellitus. Shijie Huaren Xiaohua Zazhi 2025; 33(6): 499-506
- URL: https://www.wjgnet.com/1009-3079/full/v33/i6/499.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v33.i6.499
2型糖尿病(type 2 diabetes mellitus, T2DM)为临床较为常见的慢性代谢疾病, 随病情进展可引起微血管病变, 导致肾小球内压改变及肾血流量增加, 引起慢性肾脏损伤, 严重时可导致肾衰竭, 对患者生命安全造成严重威胁[1-3]. 有研究表明[4,5], 早期评估T2DM患者肾损伤情况, 并给予针对性治疗有利于逆转肾功能损伤, 缓解病情进展, 改善生活质量、降低死亡风险. 因此, 积极探讨T2DM早期肾损害风险评估指标具有临床意义.
肠道菌群为机体生态系统的组成部分, 对于维持内环境稳态具有重要作用, 肠道菌群失调后, 可导致肠壁通透性升高, 产生肠源性内毒素血症, 释放大量炎性因子, 进而参与T2DM慢性炎症的发生发展[6,7]. 既往研究表明[8,9], T2DM患者存在典型低度炎症, 可通过肠道通透性升高所导致的细菌、细菌产物易位而加强渗漏肠道综合征, 继而影响肠道菌群. T2DM的发生发展与肠道菌群紊乱相关. 目前, 临床鲜有关于肠道菌群与T2DM患者肾损伤的相关研究. 本研究采用回顾性分析的方法, 试图寻找T2DM患者肠道菌群与早期肾损害的关系.
一般资料: 经我院伦理委员会审核批准, 选取2018-01/2023-12我院130例T2DM合并早期肾损害患者作为观察组, 另根据1:1配对原则(性别、年龄、体质指数、T2DM病程)选取同期收治130例单纯T2DM患者作为对照组. 本研究过程严格遵循加强流行病学观察性研究报告质量(STROBE)指南.
纳入标准: 均符合T2DM相关诊断标准[10]; 观察组均符合《中国糖尿病肾脏疾病临床诊疗中国指南》[11]中早期肾损害相关诊断标准; 入院前3 mo内均未使用抗生素治疗; 患者知晓本研究, 并签订同意书.
排除标准: 合并其他慢性代谢性疾病; 合并自身免疫性疾病、全身感染性疾病者; 合并胃肠道疾病影响肠道菌群者; 已接受血液透析或腹膜透析者; 合并T2DM急性并发症者; 合并严重脏器功能障碍者; 精神障碍或检查依从性较差者.
肠道菌群检测: 均采集患者新鲜粪便30 g, 采集前7 d对患者进行饮食干预, 要求患者保持相对稳定饮食, 减少外界因素对肠道菌群结构的干扰. 均于晨起采集新鲜粪便, 选取粪便不同部位, 采集量为30 g, 迅速置于无菌厌氧罐内, 将采集好的样本立即送至检验科, 将粪便样本从厌氧罐取出后, 置于无菌容器中, 缓慢加入250 mL 0.9%氯化钠注射液, 用无菌搅拌棒充分搅拌, 使粪便与氯化钠注射液完全混合, 按1:10比例将稀释液连续10倍稀释至10-8, 稀释过程中, 使用移液枪准确吸取1 mL上一浓度稀释液至9 mL无菌0.9%氯化钠注射液中, 充分混匀, 重复操作直至达到所需稀释度. 取50 μL不同稀释度稀释液, 使用无菌涂布棒均匀涂抹于不同培养基中, 不同菌群培养基均购自德国Merck公司, 将接种好的培养基置于37 ℃恒温培养箱中, 培养箱内通入含5% CO₂、85% N₂、10% H₂的混合气体, 营造严格的厌氧环境, 用于双歧杆菌、乳酸杆菌等厌氧菌的培养; 粪肠球菌、大肠埃希菌、链球菌的培养, 置于普通恒温培养箱中. 培养时间根据不同菌群生长特性控制在24-48 h, 期间定期观察菌落生长情况. 通过革兰染色、观察菌落形态等方法进行菌落计数鉴定, 记录培养基上菌落平均数, 结果采用每1 g粪便湿重的菌落形成单位的对数值表示, 即lgCFU/g.
临床资料收集: 均由医院医护人员统计收集患者临床资料, 包括性别、年龄、T2DM病程、体质量指数、吸烟史、血糖指标、饮酒史、血脂指标、肾功能指标. 其中血糖指标空腹血糖(fasting plasma glucose, FPG)采用葡萄糖氧化酶法进行检测, 糖化血红蛋白(hemoglobin A1c, HbAlc)采用高效液相色谱法进行检测; 血脂指标低密度脂蛋白胆固醇、甘油三酯、总胆固醇、高密度脂蛋白胆固醇(high-density lipoprotein cholesterol, HDL-C)采用西门子ADVIA 2400型全自动生化分析仪通过免疫比浊法进行检测; 肾功能指标尿素氮(blood urea nitrogen, BUN)采用脲酶法进行检测, 肌酐(screatinine, Scr)采用苦味酸法进行检测.
(1)比较两组基线资料及肠道菌群; (2)分析肠道菌群(大肠埃希菌、粪肠球菌、链球菌、乳酸杆菌、双歧杆菌)与血糖(FPG、HbAlc)水平的相关性; (3)Logistic回归分析肠道菌群与T2DM早期肾损害的关系; (4)基于限制性立方条样模型分析肠道菌群与T2DM早期肾损害关联强度的剂量反应性.
统计学处理 采用SPSS 28.0软件处理分析相关数据, 符合正态分布的计量资料用(mean±SD)表示, 组间比较采用t检验, 计数资料用n(%)表示, 两组间比较行χ2检验, Spearman行相关性分析, Logistic回归方程分析相关影响因素, 基于限制性立方条样模型分析关联强度的剂量反应性, 默认双侧检验, P<0.05表示差异有统计学意义.
观察组FPG、HbAlc、BUN、Scr均高于对照组, 差异有统计学意义(P<0.05). 见表1.
| 项目 | 观察组(n = 130) | 对照组(n = 130) | t/χ2 | P值 |
| 性别 | 0.577 | 0.448 | ||
| 男 | 81(62.31) | 75(57.69) | ||
| 女 | 49(37.69) | 55(42.31) | ||
| 年龄(岁) | 58.42±9.14 | 56.79±7.25 | 1.593 | 0.112 |
| 体质指数(kg/m2) | 23.59±2.17 | 23.14±1.79 | 1.824 | 0.069 |
| T2DM病程(年) | 3.64±0.65 | 3.52±0.70 | 1.432 | 0.153 |
| 吸烟史 | 56(43.08) | 50(38.46) | 0.573 | 0.449 |
| 饮酒史 | 53(40.77) | 56(43.08) | 0.142 | 0.706 |
| FPG(mmol/L) | 8.47±1.32 | 7.98±1.25 | 3.073 | 0.002 |
| HbAlc(%) | 9.17±1.43 | 8.57±1.33 | 3.503 | 0.001 |
| TG(mmol/L) | 1.61±0.27 | 1.58±0.25 | 0.930 | 0.353 |
| TC(mmol/L) | 5.68±1.23 | 5.52±0.98 | 1.160 | 0.247 |
| LDL-C(mmol/L) | 2.72±0.43 | 2.69±0.37 | 0.603 | 0.547 |
| HDL-C(mmol/L) | 1.08±0.19 | 1.12±0.23 | 1.529 | 0.128 |
| BUN(mmol/L) | 6.45±1.83 | 5.57±1.62 | ||
| Scr(μmol/L) | 97.83±20.15 | 84.74±14.37 |
观察组大肠埃希菌、粪肠球菌、链球菌均高于对照组, 乳酸杆菌及双歧杆菌低于对照组, 差异有统计学意义(P<0.05). 见表2.
| 组别 | 例数 | 乳酸杆菌 | 双歧杆菌 | 大肠埃希菌 | 粪肠球菌 | 链球菌 |
| 观察组 | 130 | 5.47±1.12 | 5.84±1.45 | 6.72±1.43 | 7.59±1.54 | 6.64±1.32 |
| 对照组 | 130 | 6.37±1.42 | 6.59±1.56 | 5.88±1.52 | 6.47±1.32 | 5.19±0.97 |
| t | 5.674 | 4.015 | 4.589 | 6.296 | 10.093 | |
| P值 | <0.001 | <0.001 | <0.001 | <0.001 | <0.001 |
T2DM合并早期肾损害患者乳酸杆菌、双歧杆菌与FPG、HbAlc、BUN、Scr呈负相关, 大肠埃希菌、粪肠球菌、链球菌与FPG、HbAlc、BUN、Scr呈正相关(P<0.05). 见表3.
| 项目 | 乳酸杆菌 | 双歧杆菌 | 大肠埃希菌 | 粪肠球菌 | 链球菌 | |
| FPG | r | -0.502 | -0.511 | 0.491 | 0.499 | 0.502 |
| P值 | <0.001 | <0.001 | <0.001 | <0.001 | <0.001 | |
| HbAlc | r | -0.498 | -0.507 | 0.478 | 0.483 | 0.495 |
| P值 | <0.001 | <0.001 | <0.001 | <0.001 | <0.001 | |
| BUN | r | -0.574 | -0.592 | 0.522 | 0.537 | 0.547 |
| P值 | <0.001 | <0.001 | <0.001 | <0.001 | <0.001 | |
| Scr | r | -0.541 | -0.578 | 0.509 | 0.509 | 0.512 |
| P值 | <0.001 | <0.001 | <0.001 | <0.001 | <0.001 | |
Logistic回归分析显示, 未调整任何混杂因素、调整部分混杂因素及调整全部混杂因素, 乳酸杆菌、双歧杆菌、大肠埃希菌、粪肠球菌、链球菌均与T2DM早期肾损害有关(P<0.05). 见表4. 采用Bootstrap分析(1000次重复抽样)表明, OR估计值在重抽样数据集中保持稳定, 乳酸杆菌、双歧杆菌、大肠埃希菌、粪肠球菌、链球菌经Bootstrap法计算的95%CI, 与原模型估计值高度一致.
| 因素 | β | SE | Wald χ2 | P值 | OR | 95%CI |
| 模型1 | ||||||
| 乳酸杆菌 | -0.133 | 0.049 | 7.388 | <0.001 | 0.875 | 0.785-0.976 |
| 双歧杆菌 | -0.137 | 0.047 | 8.471 | <0.001 | 0.872 | 0.794-0.958 |
| 大肠埃希菌 | 0.467 | 0.166 | 7.915 | <0.001 | 1.595 | 1.224-2.079 |
| 粪肠球菌 | 0.482 | 0.158 | 9.322 | <0.001 | 1.620 | 1.305-2.011 |
| 链球菌 | 0.472 | 0.147 | 10.294 | <0.001 | 1.603 | 1.219-2.107 |
| 模型2 | ||||||
| 乳酸杆菌 | -0.155 | 0.052 | 8.911 | <0.001 | 0.856 | 0.790-0.928 |
| 双歧杆菌 | -0.153 | 0.056 | 7.422 | <0.001 | 0.859 | 0.802-0.919 |
| 大肠埃希菌 | 0.473 | 0.172 | 7.566 | <0.001 | 1.605 | 1.229-2.096 |
| 粪肠球菌 | 0.495 | 0.160 | 9.582 | <0.001 | 1.641 | 1.345-2.002 |
| 链球菌 | 0.487 | 0.159 | 9.364 | <0.001 | 1.627 | 1.274-2.077 |
| 模型3 | ||||||
| 乳酸杆菌 | -0.156 | 0.057 | 7.460 | <0.001 | 0.856 | 0.804-0.911 |
| 双歧杆菌 | -0.152 | 0.060 | 6.393 | <0.001 | 0.859 | 0.814-0.907 |
| 大肠埃希菌 | 0.431 | 0.170 | 6.434 | <0.001 | 1.539 | 1.194-1.984 |
| 粪肠球菌 | 0.471 | 0.162 | 8.442 | <0.001 | 1.601 | 1.285-1.995 |
| 链球菌 | 0.443 | 0.160 | 7.662 | <0.001 | 1.557 | 1.207-2.009 |
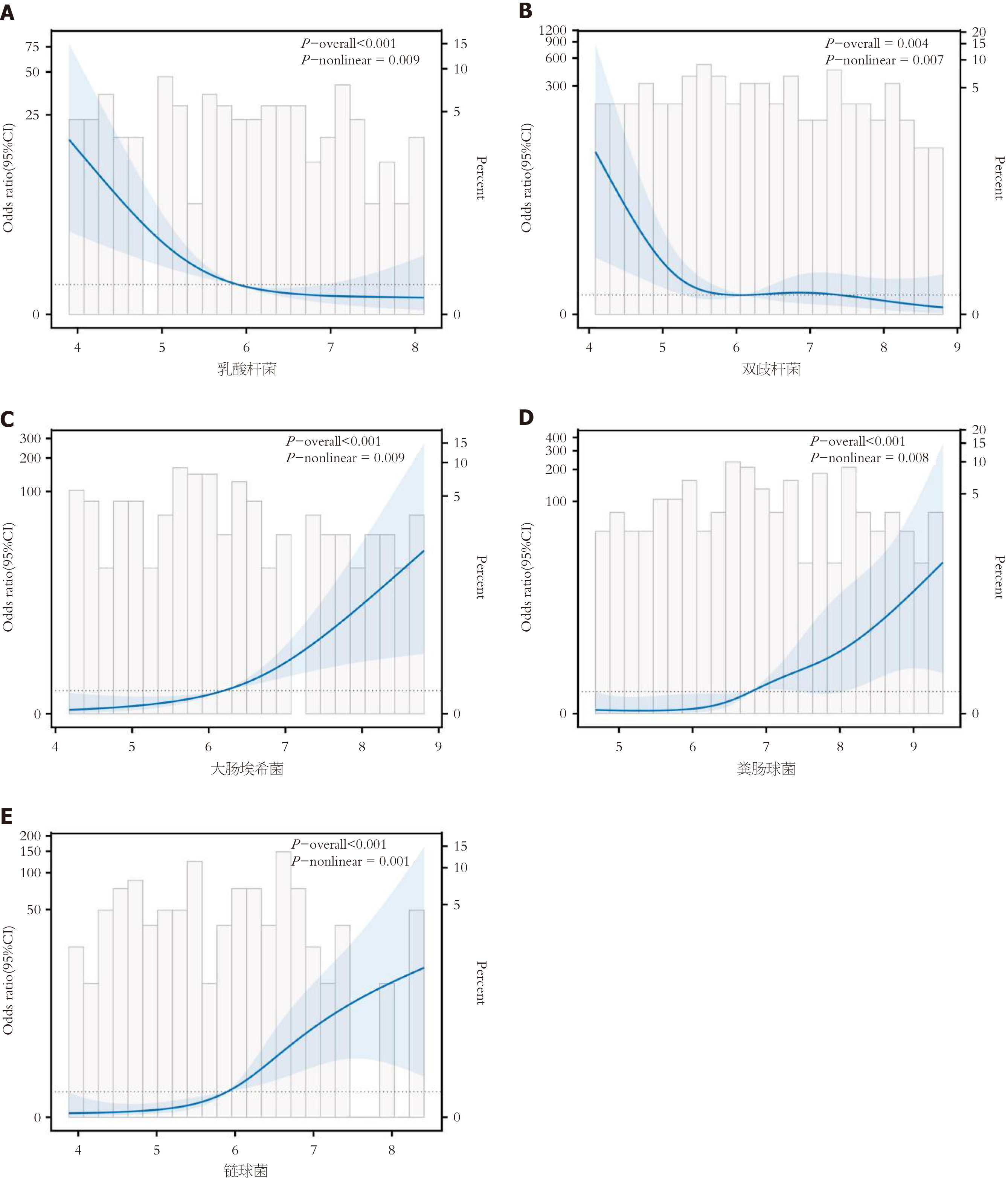
限制性立方条样模型结果显示, 乳酸杆菌、双歧杆菌、大肠埃希菌、粪肠球菌、链球菌连续变化均与T2DM早期肾损害的关联强度之间存在非线性剂量关系(P<0.05).
乳酸杆菌与T2DM早期肾损害呈负相关, 当乳酸杆菌<5.76 lgCFU/g时, 随着乳酸杆菌下降, T2DM早期肾损害风险显著升高. 见图1A.
双歧杆菌与T2DM早期肾损害呈负相关, 当双歧杆菌<5.89 lgCFU/g时, 随着乳酸杆菌下降, T2DM早期肾损害风险显著升高. 见图1B.
大肠埃希菌与T2DM早期肾损害呈正相关, 当大肠埃希菌>6.24 lgCFU/g lgCFU/g时, 随着大肠埃希菌升高, T2DM早期肾损害风险明显升高. 见图1C.
粪肠球菌与T2DM早期肾损害呈正相关, 当粪肠球菌>6.79 lgCFU/g时, 随着粪肠球菌升高, T2DM早期肾损害风险明显升高. 见图1D.
链球菌与T2DM早期肾损害呈正相关, 当链球菌>5.99 lgCFU/g时, 随着链球菌升高, T2DM早期肾损害风险明显升高. 见图1E.
T2DM为临床较为常见代谢性疾病, 多由胰岛β细胞分泌不足、胰岛素抵抗引起, 长期高血糖可损伤肾脏小血管, 导致肾脏过滤能力下降, 从而诱发早期肾损伤, 且T2DM患者多伴随高血压, 可加剧肾脏小血管损伤程度, 加速肾损伤程度, 如未得到及时有效干预, 可严重威胁患者预后恢复[12-14]. 因此, 早期评估T2DM患者肾损伤风险, 针对性给予干预具有重大意义.
本研究结果显示, 两组肠道菌群存在明显差异, 且肠道菌群与血糖水平具有相关性, 说明肠道菌群可能与T2DM患者病情及早期肾损伤存在一定联系. 肠道菌群为人体重要微生态系统, 正常情况下可帮助消化、吸收各类营养物质, 能促进肠道上皮黏膜细胞分化, 维持肠道局部免疫屏障, 参与了人体重要营养物质代谢, 维持肠道环境稳态, 且可诱导免疫系统成熟及免疫耐受等[15,16]. 由于肠道菌群对于肠道内pH及环境变化敏感, T2DM因长期糖代谢异常可导致肠道黏膜中糖基化毒性产物增加, 引起肠道内环境改变, 因此T2DM患者可出现肠道菌群紊乱[17,18]. 乳酸杆菌、双歧杆菌为人体肠道内常见益生菌, 具有抑制致病菌生长、维持肠道菌群稳定等作用, 而粪肠球菌、大肠埃希菌、链球菌为肠道内常见致病菌[19]. 有研究表明[20,21], T2DM患者肠道菌群失调后革兰氏阴性菌比例增加, 可通过TLR4激活NF-κB, 诱发炎症反应, 大量炎性因子释放后可引起胰岛β细胞结构、功能受损, 导致胰岛素抵抗、糖尿量异常加重, 促进T2DM病情进展, 从而提高肾损伤等并发症发生风险. T2DM患者发生肾损伤后, 由于机体代谢紊乱和内环境改变, 肠道菌群种类、数量、组成均可发生一定改变, 且由于肾脏对体内代谢产物的排泄功能下降, 肠道菌群需承担更多代谢负担, 其代谢途径、产物也发生相应改变. 另有报道显示[22], 肠道内益生菌可通过蛋白水解, 释放活性肽类物质, 抑制血管紧张素Ⅱ生成发挥降压效果, 而T2DM肠道菌群失调可导致白介素-17等炎性因子水平升高, 通过炎症反应可促使血管内皮功能障碍, 诱导RAAS系统激活, 诱发高血压, 而高血压可引起肾脏小血管损伤, 为T2DM患者发生肾损伤的主要危险因素之一. 因此, 肠道菌群失调与T2DM患者早期肾损伤相关.
本研究通过限制性立方条样模型分析肠道菌群与T2DM早期肾损害关联强度的剂量反应性, 结果显示上述肠道菌群均与T2DM早期肾损害风险关联强度之间存在非线性剂量关系, 当乳酸杆菌、双歧杆菌连续变化与T2DM早期肾损害风险呈负相关, 当乳酸杆菌、双歧杆菌分别<5.76 lgCFU/g、5.89 lgCFU/g, T2DM早期肾损害风险随其下降而升高, 大肠埃希菌、粪肠球菌、链球菌>6.24 lgCFU/g、6.79 lgCFU/g、5.99 lgCFU/g, T2DM早期肾损害风险随其升高而升高, 进一步证实肠道菌群与T2DM患者肾损伤的关系. 目前临床评估生化指标与T2DM患者肾损伤关系时多通过相关性进行分析, 但其仅可评估其相关程度的强弱, 无法明确该指标与发生肾损伤的非线性关系, 而剂量反应性分析可明确指标变化与发生肾损伤之间的具体关系, 且可分析具体指标阈值评估其发生风险. 肠道菌群生成的短链脂肪酸可维持肠道内皮屏障、抑制血管炎症, 有助于延缓微血管病变, 当肠道菌群失调后, 可增大肠壁渗透性, 导致菌群分泌脂多糖进入血液, 生成大量内毒素, 激活血管炎症, 诱发微血管病变, 促进早期肾损伤发生[23,24]. 有学者表明[25], T2DM肾损伤患者随肾小球滤过率降低, 多种有害代谢产物由于无法通过肾脏排泄而聚集于结肠内, 可引起或加剧肠道菌群紊乱, 而肠道菌群紊乱可导致血管、肠黏膜受损, 导致菌群代谢产物转运至血液中, 激活炎症反应, 进一步损伤肾脏. 因此, 肠道菌群与T2DM早期肾损伤密切相关.
综上所述, 肠道菌群与T2DM患者早期肾损伤密切相关, 为临床早期评估患者肾损伤风险、针对性制定干预方案提供参考依据. 但本研究仍存在一定局限性, 如本研究总样本量仍较少, 为单中心研究, 结果可能存在一定偏倚, 且未分析肠道菌群变化对早期肾损伤的预测价值, 未来还需进一步扩大样本量进行分析, 以为临床提供更可靠依据.
2型糖尿病(type 2 diabetes mellitus, T2DM)患者早期肾损害发生率高且严重影响预后, 而肠道菌群在糖代谢和慢性炎症调控中起关键作用, 有研究表明T2DM与肠道菌群紊乱相关, 但肠道菌群在T2DM早期肾损害中的作用机制尚不明确, 因此探讨两者关联可为临床早期防治提供新方向.
本研究旨在分析T2DM患者肠道菌群与早期肾损害的关系, 解决以下问题: (1)肠道菌群结构在T2DM合并早期肾损害患者中的变化; (2)肠道菌群与血糖水平的相关性及其对肾损害的影响; (3)肠道菌群作为早期肾损害风险评估指标的可行性.
(1)比较T2DM合并早期肾损害患者与单纯T2DM患者的肠道菌群差异; (2)分析肠道菌群与血糖、肾功能指标的相关性; (3)验证肠道菌群是否为T2DM早期肾损害的独立影响因素; (4)明确肠道菌群丰度与肾损害风险的剂量反应关系.
采用1:1配对的病例对照设计, 纳入260例T2DM患者(130例合并早期肾损害, 130例单纯T2DM), 通过粪便微生物培养计数检测肠道菌群(乳酸杆菌、双歧杆菌、大肠埃希菌等), 测定血糖、血脂、肾功能指标. Pearson相关性分析、Logistic回归及限制性立方条样模型, 从相关性、独立影响及剂量反应关系三个系统分析数据. 该方法整合了临床指标检测与多维度统计模型, 创新性地通过剂量反应关系明确菌群丰度阈值, 提升了研究结果的临床指导价值.
T2DM合并早期肾损害患者的大肠埃希菌、粪肠球菌、链球菌丰度显著升高, 而乳酸杆菌、双歧杆菌显著降低, 且菌群丰度与血糖及肾功能指标呈显著相关性. Logistic回归分析显示, 上述菌群均为早期肾损害的独立影响因素(调整混杂因素后仍显著). 限制性立方条样模型进一步揭示, 乳酸杆菌<5.76 lgCFU/g、双歧杆菌<5.89 lgCFU/g或大肠埃希菌>6.24 lgCFU/g等阈值时, 肾损害风险显著升高. 阐明了肠道菌群与T2DM早期肾损害的非线性剂量关系, 为风险分层提供了量化依据.
T2DM早期肾损害患者存在特征性肠道菌群紊乱, 益生菌(乳酸杆菌、双歧杆菌)减少与致病菌(大肠埃希菌等)增多共同参与肾损害进程, 调节肠道菌群可能成为T2DM早期肾损害的干预途径, 为临床治疗提供方向.
本研究为单中心、回顾性设计, 样本量有限且未探讨菌群代谢产物的作用机制. 未来需开展多中心、大样本前瞻性研究, 进一步验证菌群阈值的预测效能, 并深入解析菌群-代谢-肾损伤的分子通路.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C
D级 (一般): D, D
E级 (差): 0
科学编辑: 刘继红 制作编辑:郑晓梅
| 1. | Sanz-Cánovas J, López-Sampalo A, Cobos-Palacios L, Ricci M, Hernández-Negrín H, Mancebo-Sevilla JJ, Álvarez-Recio E, López-Carmona MD, Pérez-Belmonte LM, Gómez-Huelgas R, Bernal-López MR. Management of Type 2 Diabetes Mellitus in Elderly Patients with Frailty and/or Sarcopenia. Int J Environ Res Public Health. 2022;19. [PubMed] [DOI] |
| 2. | Ma CX, Ma XN, Guan CH, Li YD, Mauricio D, Fu SB. Cardiovascular disease in type 2 diabetes mellitus: progress toward personalized management. Cardiovasc Diabetol. 2022;21:74. [PubMed] [DOI] |
| 3. | Li X, Lu L, Hou W, Huang T, Chen X, Qi J, Zhao Y, Zhu M. Epigenetics in the pathogenesis of diabetic nephropathy. Acta Biochim Biophys Sin (Shanghai). 2022;54:163-172. [PubMed] [DOI] |
| 4. | Huang TS, Wu T, Wu YD, Li XH, Tan J, Shen CH, Xiong SJ, Feng ZQ, Gao SF, Li H, Cai WB. Long-term statins administration exacerbates diabetic nephropathy via ectopic fat deposition in diabetic mice. Nat Commun. 2023;14:390. [PubMed] [DOI] |
| 5. | Liu XJ, Hu XK, Yang H, Gui LM, Cai ZX, Qi MS, Dai CM. A Review of Traditional Chinese Medicine on Treatment of Diabetic Nephropathy and the Involved Mechanisms. Am J Chin Med. 2022;50:1739-1779. [PubMed] [DOI] |
| 6. | Guo X, Okpara ES, Hu W, Yan C, Wang Y, Liang Q, Chiang JYL, Han S. Interactive Relationships between Intestinal Flora and Bile Acids. Int J Mol Sci. 2022;23. [PubMed] [DOI] |
| 7. | Huang S, Li F, Quan C, Jin D. Intestinal flora: a potential pathogenesis mechanism and treatment strategy for type 1 diabetes mellitus. Gut Microbes. 2024;16:2423024. [PubMed] [DOI] |
| 8. | Deng X, Niu L, Xiao J, Guo Q, Liang J, Tang J, Liu X, Xiao C. Involvement of intestinal flora and miRNA into the mechanism of coarse grains improving type 2 diabetes: an overview. J Sci Food Agric. 2023;103:4257-4267. [PubMed] [DOI] |
| 9. | Cheng X, Zhang Z, Dong W. Characteristics of intestinal flora in patients with cerebral infarction complicated with Type 2 diabetes mellitus. Journal of Central South University (Medical Sciences). 2023;48:1163-1175. [DOI] |
| 12. | Yang M, Chen W, He L, Liu D, Zhao L, Wang X. Intermittent Fasting-A Healthy Dietary Pattern for Diabetic Nephropathy. Nutrients. 2022;14. [PubMed] [DOI] |
| 13. | Luo Y, Zhang W, Qin G. Metabolomics in diabetic nephropathy: Unveiling novel biomarkers for diagnosis (Review). Mol Med Rep. 2024;30. [PubMed] [DOI] |
| 14. | Kaushik M, Kaushik A, Chaudhary J, Jain A. Terpenoids in Diabetic Nephropathy: Advances and Therapeutic Opportunities. Endocr Metab Immune Disord Drug Targets. 2024;24:13-30. [PubMed] [DOI] |
| 15. | Jiang X, Shi T, Han D, Chen J. Exenatide and Metformin Improve Serum Indices and Intestinal Flora in patients with Type 2 Diabetes Mellitus and Non-Alcoholic Fatty Liver Disease. J Pak Med Assoc. 2024;74:138-140. [PubMed] [DOI] |
| 16. | He SY, Qiu XM, Wang YQ, Su ZQ, Zhang BY, Wen Z, Yang YF, Xing BF, Hong M, Liao R. Intervention effect of Potentilla discolor-Euonymus alatus on intestinal flora of type 2 diabetes mellitus rats. Eur Rev Med Pharmacol Sci. 2022;26:9062-9071. [PubMed] [DOI] |
| 17. | 高 玉婷, 赵 天奕, 刘 诗璇, 律 娜, 袁 涛, 高 俊祥, 朱 宝利, 赵 维纲. 2型糖尿病合并非酒精性脂肪性肝病患者肠道菌群的特征分析. 中华临床营养杂志. 2024;32:80-89. [DOI] |
| 21. | Araj-Khodaei M, Ayati MH, Azizi Zeinalhajlou A, Novinbahador T, Yousefi M, Shiri M, Mahmoodpoor A, Shamekh A, Namazi N, Sanaie S. Berberine-induced glucagon-like peptide-1 and its mechanism for controlling type 2 diabetes mellitus: a comprehensive pathway review. Arch Physiol Biochem. 2024;130:678-685. [PubMed] [DOI] |
| 22. | Kusunoki M, Hisano F, Matsuda SI, Kusunoki A, Wakazono N, Tsutsumi K, Miyata T. Effects of SGLT2 inhibitors on the intestinal bacterial flora in Japanese patients with type 2 diabetes mellitus. Drug Res (Stuttg). 2023;73:412-416. [PubMed] [DOI] |
| 23. | 郭 凤, 郝 蕊, 陈 鹏德, 韩 雪, 姚 蓝. 基于肠道菌群和肠黏膜屏障探讨玉液汤防治气阴两虚证糖尿病肾病大鼠的作用研究. 世界科学技术-中医药现代化. 2024;26:1308-1319. [DOI] |