修回日期: 2025-04-21
接受日期: 2025-06-04
在线出版日期: 2025-06-28
内镜黏膜下剥离术(endoscopic submucosal dissection, ESD)用于胃肠道疾病治疗, 但手术复杂、时间长, 易致疼痛和氧化应激, 影响恢复. 常用麻醉药丙泊酚镇痛不足且有并发症风险, 而右美托咪定镇痛镇静效果好. 本研究对比舒芬太尼联合丙泊酚或右美托咪定对ESD患者氧化应激的影响, 为临床麻醉提供参考.
探讨舒芬太尼联合丙泊酚或右美托咪定对肠道ESD患者围术期氧化应激的影响.
前瞻性选取2022-04/2024-12浙江省金华市中心医院120例拟行肠道ESD患者进入研究, 采用随机数字表法分为舒芬太尼配合丙泊酚(sufentanil combined with Propofol, SP)组、舒芬太尼配合右美托咪定(sufentanil combined with dexmedetomidine, SD)组, 各60例. 全部患者术前5 min给予0.2 μg/kg舒芬太尼, SP组术前2 min给予1.5 mg/kg丙泊酚, 随后以4 mg/(kg·h)维持; SD组术前10 min给予1.0 μg/kg右美托咪定, 随后以0.6 μg/(kg·h)维持. 比较两组术前(T0)、麻醉诱导即刻(T1)、内窥镜入喉时(T2)、黏膜下切除时(T3)、手术结束时(T4)时间点血流动力学[心率、平均动脉压(mean arterial pressure, MAP)、脉搏血氧饱和度(pulse oxygen saturation, SpO2)]、镇痛指数(pain threshold index, PTi)、麻醉深度[小波指数(wavelet index, WLi)], T0、麻醉后30 min(T5)、手术结束后1 h(T6)氧化-抗氧化系统指标[过氧化氢酶(catalase, CAT)、丙二醛(malondialdehyde, MDA)、超氧化物歧化酶(superoxide dismutase, SOD)]、手术相关指标(手术时间、麻醉诱导时间、苏醒时间)及不良反应.
SP组麻醉诱导时间短于SD组, 苏醒时间长于SD组(P<0.05), SD组手术时间与SP组比较无显著差异(P>0.05); SP组T1-T3时心率明显低于SD组, SP组T2、T3时MAP明显高于SD组(P<0.05), SP组T1-T4时SpO2与SD组比较无显著差异(P>0.05); SP组T2-T4时PTi、WLi高于SD组(P<0.05); T0、T5、T6时SP组CAT、MDA、SOD水平与SP组比较无显著差异(P>0.05); SP组注射痛、呼吸抑制发生率高于SD组, 体动发生率低于SD组(P<0.05), SP组恶心呕吐发生率与SP组比较无显著差异(P>0.05).
ESD中舒芬太尼配合右美托咪定血流动力学稳定、苏醒快、注射痛及呼吸抑制发生率低, 舒芬太尼配合丙泊酚麻醉诱导快、体动发生率低, 但对患者氧化应激作用相似, 临床可根据具体情况选择合适麻醉方案.
核心提要: 本研究尝试探讨舒芬太尼分别配合右美托咪定、丙泊酚对患者氧化应激的影响, 以期为临床提供麻醉参考.
引文著录: 毛云, 唐智豪, 陈慧兰, 郑小娟. 舒芬太尼联合丙泊酚或右美托咪定对ESD患者围术期氧化应激的影响: 一项随机对照研究. 世界华人消化杂志 2025; 33(6): 466-474
Revised: April 21, 2025
Accepted: June 4, 2025
Published online: June 28, 2025
Endoscopic submucosal dissection (ESD) is used for the treatment of gastrointestinal diseases, but the surgery is complex and time-consuming, which can cause pain and oxidative stress, affecting recovery. The commonly used anesthetic propofol has insufficient analgesic effects and carries risks of complications, while dexmedetomidine has good analgesic and sedative effects. This study compared the effects of sufentanil combined with propofol or dexmedetomidine on oxidative stress in ESD patients undergoing ESD, with an aim to provide a reference for clinical anesthesia.
To investigate the effect of sufentanil combined with propofol or dexmedetomidine on perioperative oxidative stress in patients undergoing ESD.
A prospective study was conducted to select 120 patients who were scheduled to undergo ESD at Jinhua Central Hospital, Zhejiang Province from April 2022 to December 2024. The patients were randomly divided into either a sufentanil combined with propofol (SP) group or a sufentanil combined with dexmedetomidine (SD) group using the random number table method, with 60 cases in each group. All patients were given 0.2 μg/kg sufentanil at 5 minutes before surgery. The SP group was given 1.5 mg/kg propofol at 2 minutes before surgery, followed by maintenance at 4 mg/(kg·h); the SD group received 1.0 μg/kg dexmedetomidine at 10 minutes before surgery, followed by maintenance at 0.6 μg/(kg·h). Hemodynamic parameters [heart rate, mean arterial pressure (MAP), pulse oxygen saturation (SpO2)], pain threshold index (PTi), and depth of anesthesia [wavelet index (WLi)] were compared between the two groups at the time points of preoperation (T0), immediate induction of anesthesia (T1), entry of the endoscope into the throat (T2), submucosal resection (T3), and end of the surgery (T4). Oxidative-antioxidant indicators [catalase (CAT), malondialdehyde (MDA), superoxide dismutase (SOD)] and surgery-related indicators (operation time, time to induction, time to recovery) at T0, 30 minutes after anesthesia (T5), and 1 hour after the end of surgery (T6), and adverse reactions were also compared.
Time to anesthesia induction in the SP group was shorter than that of the SD group, time to recovery was longer than that of the SD group (P < 0.05), and there was no significant difference in the operation time between the two groups (P > 0.05). The heart rate of the SP group was significantly lower than that of the SD group at T1-T3, while the MAP of the SP group was significantly higher than that of the SD group at T2 and T3 (P < 0.05), though there was no significant difference in SpO2 between the two groups at T1-T4 (P > 0.05). PTi and WLi in the SP group were higher than those of the SD group at T2-T4 (P < 0.05). There were no significant differences in the levels of CAT, MDA, and SOD between the two groups at T0, T5, and T6 (P > 0.05). The incidence of injection pain and respiratory depression in the SP group was higher than that of the SD group, the incidence of body movement was lower than that of the SD group (P < 0.05), and there was no significant difference in the incidence of nausea and vomiting between the two groups (P > 0.05).
In ESD, sufentanil combined with dexmedetomidine is associated with stable hemodynamics, rapid recovery, and low incidence of injection pain and respiratory depression, while sufentanil combined with propofol is associated with fast induction of anesthesia and low incidence of body movement. The effect on patients' oxidative stress is similar between the two regimens. Therefore, appropriate anesthesia regimen should be selected according to the specific situation in clinical practice.
- Citation: Mao Y, Tang ZH, Chen HL, Zheng XJ. Effect of sufentanil combined with propofol or dexmedetomidine on perioperative oxidative stress in patients undergoing endoscopic submucosal dissection: A randomized controlled study. Shijie Huaren Xiaohua Zazhi 2025; 33(6): 466-474
- URL: https://www.wjgnet.com/1009-3079/full/v33/i6/466.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v33.i6.466
内镜黏膜下剥离术(endoscopic submucosal dissection, ESD)是一种新颖且高效的内镜微创技术, 因其创伤小、术后恢复快等优点被广泛用于胃肠道疾病的治疗中, 能完整剥离切除黏膜下的病变组织, 但ESD手术操作精细且复杂, 手术时间较长, 术中一系列操作易刺激交感神经兴奋, 导致患者产生疼痛与不适, 影响手术顺利进行[1,2]. 研究发现, 手术创伤能诱发氧化应激, 导致中性粒细胞炎性浸润, 继而影响患者术后恢复[3]. 因此, 临床应积极寻找安全有效的麻醉方案, 以提高手术成功率、降低并发症发生率. 丙泊酚是临床较为常用的麻醉药物, 具有镇静遗忘、苏醒快等特点, 但其镇痛效果差, 且呼吸抑制、低氧血症、注射痛等并发症发生风险较高[4]. 近年来, 右美托咪定因其良好的镇痛镇静作用而备受关注, 研究表明, 右美托咪定不仅能有效减少丙泊酚用量, 降低呼吸抑制等麻醉相关并发症发生率, 还能抑制胃肠蠕动, 这对于成功进行ESD手术具有重要意义[5,6]. 然而临床关于右美托咪定和丙泊酚在肠道ESD中的对比研究报道相对较少, 鉴于此, 本研究尝试探讨舒芬太尼分别配合右美托咪定、丙泊酚对患者氧化应激的影响, 以期为临床提供麻醉参考. 分析如下.
选取2022-04/2024-12浙江省金华市中心医院120例拟行肠道ESD患者进行前瞻性研究. 样本量计算: 以围术期丙二醛(malondialdehyde, MDA)变化率为主要终点, 根据前期小样本预试验结果, 预期丙泊酚(sufentanil combined with propofol, SP)组MDA升高幅度为35%, 右美托咪定(sufentanil combined with dexmedetomidine, SD)组MDA升高幅度为30%, 设α = 0.05, 1-β = 0.80, 两组研究对象数量相等, 利用PASS 15.0软件计算得每组需53例患者, 考虑10%的脱落率, 最终确定每组纳入60例, 共计120例. 纳入标准: 符合肠道ESD指征[7], 择期进行手术; 年龄>18岁; 美国麻醉医师协会(ASA)分级均为Ⅰ-Ⅲ级; 患者对研究知情同意. 排除标准: 凝血功能障碍者; 患者神经功能障碍或认知功能障碍; 急性消化道出血活动期; 严重高血压未控制者; 严重肥胖; 具有严重肝肾心肺疾病; 药物过敏者; 呼吸道梗阻或困难气道者; 长期服用镇痛类药物. 采用随机数字表法分为SP组、SD组, 各60例. 两组患者的一般资料均衡可比(P>0.05), 见表1. 本研究经我院伦理委员会审批通过[(研)20251230101].
| 组别 | SD组(n = 60) | SP组(n = 60) | t/χ2/u | P值 |
| 性别 | 0.136 | 0.713 | ||
| 男 | 33(55.00) | 35(58.33) | ||
| 女 | 27(45.00) | 25(41.67) | ||
| 年龄(岁) | 64.25±6.98 | 63.76±7.25 | 0.377 | 0.707 |
| 体质量指数(kg/m2) | 22.54±2.63 | 22.26±2.48 | 0.600 | 0.550 |
| ASA分级 | 0.390 | 0.697 | ||
| Ⅰ级 | 8(13.33) | 9(15.00) | ||
| Ⅱ级 | 36(60.00) | 37(61.67) | ||
| Ⅲ级 | 16(26.67) | 14(23.33) | ||
| 疾病类型 | 0.137 | 0.934 | ||
| 胃肠道息肉 | 24(40.00) | 26(43.33) | ||
| 黏膜层病变 | 19(31.67) | 18(30.00) | ||
| 消化道早期癌症 | 17(28.33) | 16(26.67) |
全部患者术前禁食8 h、禁饮4 h行肠道准备, 术前给予丁卡因凝胶(国药准字H20123292; 规格:1.5 g:70 mg; 真奥金银花药业)喷喉实施表面麻醉, 抵达手术室前不再给予任何其他药物. 入室后, 留置静脉通道, 给予鼻导管吸氧(3 L/min), 连接心电监护、脑电双频指数电极, 监测血压、脉搏血氧饱和度(pulse oxygen saturation, SpO2)、心率等. 所有患者术前5 min给予0.2 μg/kg舒芬太尼(国药准字H20203651; 规格: 2 mL:100 μg; 江苏恩华药业), 静脉注射. SP组术前2 min给予1.5 mg/kg丙泊酚(国药准字HJ20150661; 50 mL:0.5 g; 北京费森尤斯卡比医药)诱导麻醉, 随后以4 mg/(kg·h)维持麻醉; SD组术前10 min 给予1.0 μg/kg右美托咪定(国药准字H20130027; 规格: 2 mL:0.2 mg; 山东辰欣药业)诱导麻醉, 随后以0.6 μg/(kg·h)维持麻醉. 维持脑电双频指数值在65-75. 待患者小波指数(wavelet index, WLi)<69时开始在内镜下进行肠道ESD操作, 术中若患者出现体动, 则追加舒芬太尼0.1 μg/(kg·次), 手术结束, 退镜时停止输注麻醉药物, 随后送至麻醉监测室. 全部流程由同一组医师进行操作.
(1)手术相关指标: 记录比较两组麻醉诱导时间、手术时间、苏醒时间; (2)血流动力学: 记录比较两组术前(T0)、麻醉诱导即刻(T1)、内窥镜入喉时(T2)、黏膜下切除时(T3)、手术结束时(T4)时间点心率、平均动脉压(mean arterial pressure, MAP)、SpO2等指标变化; (3)镇痛指数、麻醉深度: 记录比较两组T1、T2、T3、T4时间点镇痛指数(pain threshold index, PTi)与WLi, 其中PTi范围0-100, <40为镇痛偏深, 40-60为镇痛适度, 61-80为镇痛不足, >80为疼痛; WLi范围0-100, <35为麻醉过深, 35-69为麻醉状态, 70-89为浅麻/睡眠状态, ≥90为清醒状态; (4)氧化-抗氧化系统指标: 分别于T0、麻醉后30 min(T5)、手术结束后1 h(T6)时间点采集患者外周3 mL空腹静脉血分离血清, 采用放射免疫法检测血清MDA、过氧化氢酶(catalase, CAT)、超氧化物歧化酶(superoxide dismutase, SOD)水平; (5)不良反应: 记录比较两组手术期间出现的不良反应.
统计学处理 应用SPSS 25.0软件对数据进行分析. 计量资料以均数±标准差(mean±SD)表示, 采用t检验; 不同时间、组间、交互作用测量数据采用重复测量方差分析. 计数资料例(%)表示, 采用χ2检验; 等级资料采用Ridit分析. 以P<0.05为差异有统计学意义.
SD组麻醉诱导时间、苏醒时间长于SP组(P<0.05), SP组手术时间与SD组比较无显著差异(P>0.05), 见表2.
| 组别 | 例数 | 麻醉诱导时间 | 手术时间 | 苏醒时间 |
| SP组 | 60 | 0.95±0.12 | 45.06±5.52 | 4.82±1.06 |
| SD组 | 60 | 5.65±0.86 | 43.85±5.26 | 8.56±1.48 |
| t | -41.926 | -1.229 | -15.914 | |
| P值 | 0.000 | 0.221 | 0.000 |
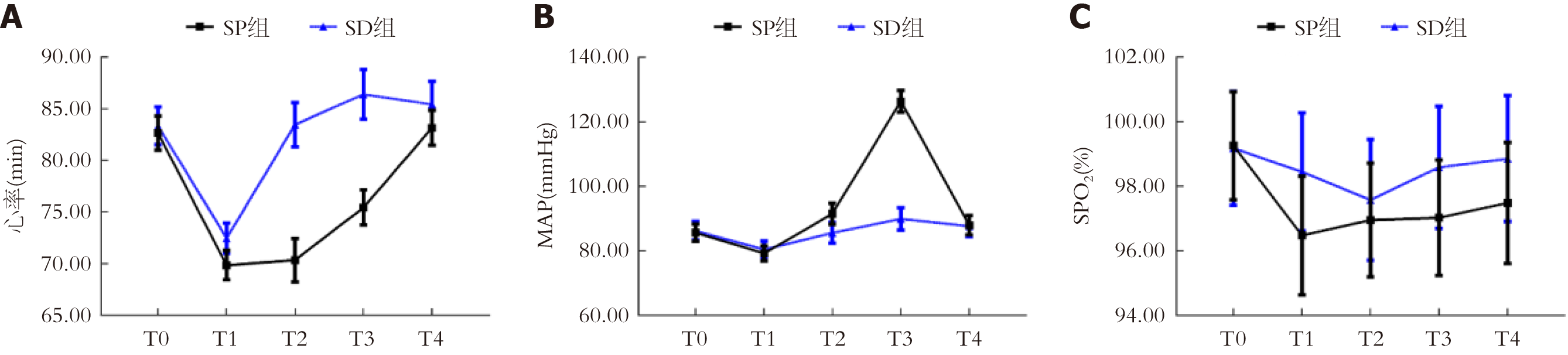
两组心率、MAP存在组间-时间交互效应(P<0.05), SpO2不存在组间-时间交互效应(P>0.05). 两组心率均呈先下降后回升趋势, SP组T1-T3时心率明显低于T0、SD组, SD组T1时低于T0(P<0.05); 两组MAP均呈先下降后升高趋势, 两组T1时MAP明显低于T0, SP组T2、T3时MAP明显高于T0、SD组, SD组T3时MAP明显高于T0(P<0.05); 两组各时间点SpO2比较无显著差异(P>0.05). 见表3、图1.
| 指标 | 组别 | 例数 | T0 | T1 | T2 | T3 | T4 |
| 心率(min) | SP组 | 60 | 82.66±6.42 | 69.85±5.54 | 70.35±8.16 | 75.43±6.58 | 83.15±6.52 |
| SD组 | 60 | 83.35±7.13 | 72.46±5.69 | 83.46±8.25 | 86.40±9.35 | 85.42±8.54 | |
| F | F时间 = 8.042, F组间 = 5.669, F交互 = 3.725 | ||||||
| P值 | P时间<0.001, P组间<0.001, P交互 = 0.009 | ||||||
| MAP(mmHg) | SP组 | 60 | 85.69±10.26 | 79.25±9.19 | 91.54±12.53 | 126.45±13.18 | 87.98±11.46 |
| SD组 | 60 | 86.24±11.05 | 80.46±10.33 | 85.63±12.46 | 89.95±13.20 | 87.73±12.42 | |
| F | F时间 = 6.495, F组间 = 2.640, F交互 = 2.009 | ||||||
| P值 | P时间<0.001, P组间 = 0.012, P交互 = 0.028 | ||||||
| SpO2(%) | SP组 | 60 | 99.26±6.48 | 96.48±7.12 | 96.96±6.83 | 97.03±6.95 | 97.48±7.26 |
| SD组 | 60 | 99.18±6.83 | 98.45±7.06 | 97.58±7.24 | 98.59±7.32 | 98.86±7.54 | |
| F | F时间 = 0.784, F组间 = 0.650, F交互 = 0.679 | ||||||
| P值 | P时间 = 0.129, P组间 = 0.264, P交互 = 0.205 | ||||||
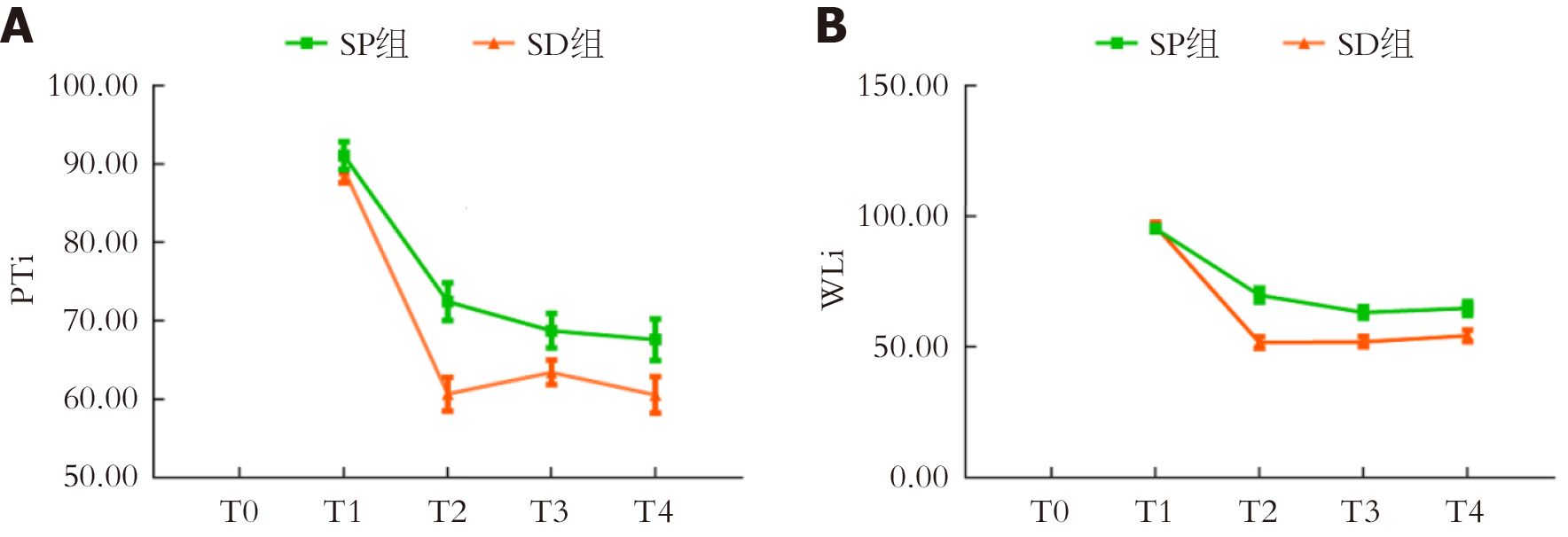
两组PTi、WLi存在组间-时间交互效应(P<0.05). T2、T3、T4时两组PTi、WLi均低于T0时(P<0.05); SP组T2、T3、T4时PTi、WLi高于SD组(P<0.05). 见表4、图2.
| 指标 | 组别 | 例数 | T0 | T1 | T2 | T3 | T4 |
| PTi | SP组 | 60 | - | 91.05±6.84 | 72.45±9.38 | 68.74±8.45 | 67.59±10.29 |
| SD组 | 60 | - | 89.25±6.24 | 60.67±8.25 | 63.42±5.96 | 60.58±9.04 | |
| F | F时间 = 35.491, F组间 = 3.985, F交互 = 2.013 | ||||||
| P值 | P时间<0.001, P组间 = 0.002, P交互 = 0.026 | ||||||
| WLi | SP组 | 60 | - | 95.26±4.45 | 68.84±10.36 | 63.21±8.54 | 64.76±10.35 |
| SD组 | 60 | - | 96.20±6.29 | 51.65±8.26 | 51.98±7.45 | 54.29±8.46 | |
| F | F时间 = 24.035, F组间 = 16.358, F交互 = 3.746 | ||||||
| P值 | P时间<0.001, P组间<0.001, P交互 = 0.008 | ||||||
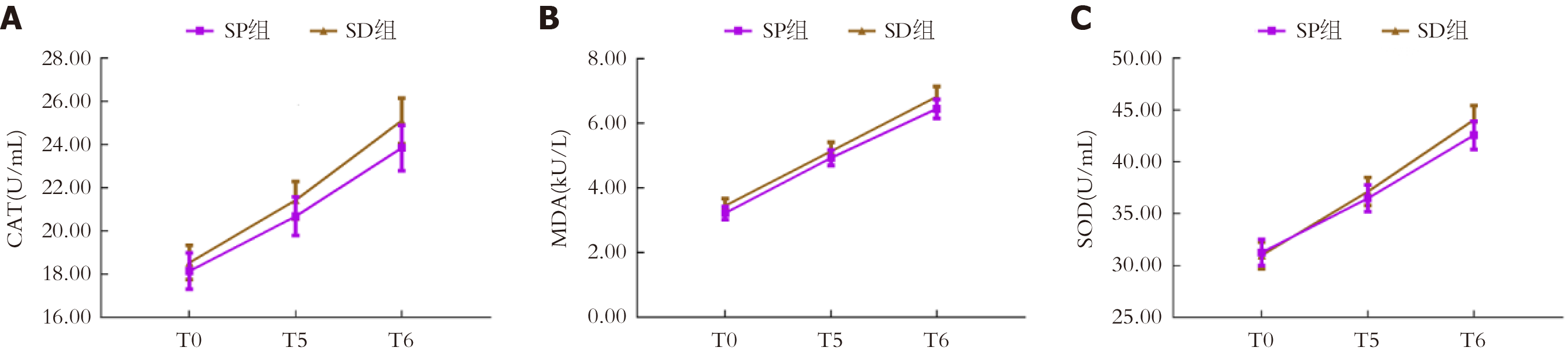
两组CAT、MDA、SOD水平不存在组间-时间交互效应(P>0.05). T5、T6时两组CAT、MDA、SOD水平均高于T0时(P<0.05); 两组各时间点CAT、MDA、SOD水平比较无显著差异(P>0.05). 见表5、图3.
| 指标 | 组别 | 例数 | T0 | T5 | T6 |
| CAT(U/mL) | SP组 | 60 | 18.15±3.26 | 20.68±3.45 | 23.84±4.06 |
| SD组 | 60 | 18.54±3.08 | 21.42±3.39 | 25.10±4.06 | |
| F | F时间 = 6.459, F组间 = 2.452, F交互 = 1.988 | ||||
| P值 | P时间<0.001, P组间 = 0.082, P交互 = 0.125 | ||||
| MDA(kU/L) | SP组 | 60 | 3.22±0.80 | 4.93±0.92 | 6.45±1.14 |
| SD组 | 60 | 3.45±0.86 | 5.14±1.05 | 6.82±1.26 | |
| F | F时间 = 9.245, F组间 = 1.958, F交互 = 1.462 | ||||
| P值 | P时间<0.001, P组间 = 0.132, P交互 = 0.186 | ||||
| SOD(U/mL) | SP组 | 60 | 31.26±4.84 | 36.49±5.03 | 42.58±5.25 |
| SD组 | 60 | 30.98±5.05 | 37.14±5.21 | 44.06±5.34 | |
| F | F时间 = 16.482, F组间 = 0.958, F交互 = 1.036 | ||||
| P值 | P时间<0.001, P组间 = 0.684, P交互 = 0.214 | ||||
肠道ESD属于微创手术, 相较于传统的开腹手术, 肠道ESD创伤小、恢复快、能保留完整器官结构和功能, 在胃肠道疾病的诊断与治疗中具有重要作用. 然而, 由于ESD具有侵入性和刺激性, 而患者多饮食不佳、体质虚弱, 在术中易出现体动、咽部不适等不良反应, 还可导致患者机体氧化-抗氧化失衡、血流动力学波动, 甚至危及患者生命安全[8]. 因此, 寻找合适的麻醉方案具有重要意义.
本研究结果发现, SP组麻醉诱导时间、苏醒时间短于SD组, 其与丙泊酚起效快、能快速诱导、易苏醒有关. 但丙泊酚存在明显呼吸抑制, 且不具备镇痛效果, 故多与其他药物联用[9]. 舒芬太尼是强效阿片类镇痛药, 可通过激活中枢神经系统和周围神经系统中的阿片受体, 能弥补丙泊酚镇痛方面的不足, 但舒芬太尼与丙泊酚联用可能会加剧呼吸抑制效应, 导致镇痛与呼吸维持之间产生冲突, 影响麻醉安全, 必要时需建立人工气道以确保患者呼吸通畅[10,11]. 右美托咪定是高选择性的α2肾上腺素受体激动剂, 能特异性与α2受体结合, 有效阻断神经元信号传递, 并通过抑制中枢交感神经的活动来实现镇静与镇痛的效果, 且其对α2受体具有强大的亲和力, 因此其镇静作用显著, 机制类似于自然睡眠状态, 因而患者在接受治疗后易被唤醒且能迅速恢复意识[12]. 右美托咪定与舒芬太尼联用, 可显著增强镇痛效果, 有助于减少手术过程中的体动反应, 从而提高手术的顺利进行[13]. 此外, 右美托咪定呼吸抑制作用相对较弱, 对呼吸功能影响较小, 且能减少阿片类镇痛药用量, 有助于维持血流动力学稳定, 降低低血压发生风险[14]. 本研究结果显示, T1时两组心率、MAP均明显下降, 其可能原因是麻醉药物的迅速作用导致心血管系统抑制, 引起心率减缓及血压下降. T2-T4时SD组MAP相对稳定, 而SP组仍波动较大, 提示右美托咪定联合舒芬太尼对血流动力学影响相对较小. T1-T3时SP组心率明显低于SD组, 其可能与丙泊酚加剧迷走神经的刺激有关, 因而术中应用丙泊酚需密切监测患者心率变化. T0-T4时两组SpO2均处于正常范围, 表明舒芬太尼联合丙泊酚或右美托咪定均能有效保证患者的血氧饱和度, 避免因麻醉药物导致的低氧血症.
PTi是评估患者大脑皮质对疼痛刺激反应程度的综合脑电参数, 有利于医师调整镇痛药物用量, 与传统的经验判断或根据镇静深度判断相比, PTi更具客观性, 能提高临床麻醉质量[15]. WLi是根据脑电小波变换分析的麻醉深度监测指标, 可客观评估患者镇静深度[16]. 本研究发现, T2-T4时两组PTi均处于60-80, 表明使用1.5 mg/kg丙泊酚或1.0 μg/kg右美托咪定均无法完全抑制伤害性刺激对患者的影响, 仍存在镇痛不足的情况. 但SD组T2-T4时PTi低于SP组, 也能说明右美托咪定镇痛效果优于丙泊酚. T2-T4两组WLi均处于35-69, 可见两种药物均可达到理想麻醉深度. 安全性分析发现, SD组呼吸抑制、注射痛发生率低于SP组, 表明右美托咪注射痛、呼吸抑制发生率较低, 但SD组体动反应发生率高于SP组, 体动发生的常见原因为镇静不足, 但本研究SD组镇静深度较为理想, 猜测其可能是因为右美托咪定对伤害性刺激的抑制作用较弱有关.
既往研究表明[17,18], 手术造成的失血、组织损伤等可引起触发机体产生大量的活性氧自由基和活性氮自由基, 导致细胞结构和功能损伤, 从而影响患者术后恢复. MDA是脂质过氧化标志性产物, 其水平升高表示细胞或组织氧化损伤程度加重[19]. SOD是抗氧化酶之一, 能催化超氧阴离子自由基歧化生成氧和过氧化氢, 从而清除体内的超氧阴离子自由基, 防止其对细胞造成损伤, CAT是其下游酶类物质, 能催化过氧化氢分解为无害的水和氧气[20,21]. 相关研究发现[22,23], ROS能激活NF-κB等促炎通路, 促进残余肿瘤细胞增殖, MDA可增强肿瘤细胞侵袭转移能力. Yao等[24]发现, 丙泊酚可通过调节miR-363-3p/CREB轴减少ROS的生成. 而尹顺花等[25]研究表明, 右美托咪定可能通过激活PI3K/mTOR/ULK1通路发挥抗氧化应激作用. 分析本研究结果发现, T5、T6时两组MDA水平高于T0时, 表明手术创伤对患者机体造成了氧化应激损伤, 而CAT、SOD水平升高, 则反映机体为应对手术应激而做出的抗氧化防御反应. 但两组间比较发现, T0、T5、T6时两组CAT、MDA、SOD水平比较无显著差异, 这提示丙泊酚和右美托咪定对患者氧化-抗氧化系统的影响效果可能相似, 但无法准确判断两种药物抗氧化作用的优劣, 其可能与样本量小、未能完全排除混杂因素有关.
综上所述, 舒芬太尼配合右美托咪定用于ESD具有循环稳定、注射痛及呼吸抑制发生率低等优势, 舒芬太尼配合丙泊酚具有麻醉诱导快、苏醒快、体动发生率低等优势, 但两种方案抗氧化效果相当. 但本研究存在明显缺陷, 如未设置空白对照、单中心小样本、未评估长期预后, 后续研究还需增设空白对照, 以明确药物作用, 开展多中心、大样本随机对照试验, 并延长随访时间, 以提高统计效力、减少个体差异, 更准确地评估两种药物的抗氧化效果. 此外, 本研究纳入患者年龄差异较大, 老年患者多合并基础疾病, 耐受性较差, 氧化应激反应可能更为显著, 研究时应重点关注老年群体, 或后续研究可尝试采用舒芬太尼联合新型抗氧化药物(如依达拉奉)、麻醉辅助剂(如褪黑素), 以进一步优化麻醉方案, 减轻氧化应激损伤, 改善患者预后.
本研究聚焦于肠道内镜黏膜下剥离术(endoscopic submucosal dissection, ESD)的麻醉管理. ESD作为一种微创技术, 虽创伤小、恢复快, 但手术复杂、时间长, 易刺激交感神经, 导致患者疼痛和不适, 甚至影响手术顺利进行. 此外, 手术创伤可诱发氧化应激, 进而影响术后恢复. 因此, 寻找安全有效的麻醉方案以优化手术效果和患者预后具有重要的临床意义.
目前, 丙泊酚和右美托咪定是常用的麻醉药物, 但两者在临床应用中各有优缺点. 丙泊酚镇静效果好但镇痛不足且有呼吸抑制风险, 而右美托咪定镇痛镇静效果显著但麻醉诱导时间较长. 然而, 关于这两种药物在肠道ESD手术中的对比研究较少. 因此, 本研究旨在通过对比舒芬太尼联合丙泊酚或右美托咪定的麻醉方案, 探讨其对患者围术期氧化应激的影响, 为临床麻醉方案的选择提供科学依据.
本研究旨在明确舒芬太尼联合丙泊酚或右美托咪定在肠道ESD手术中的麻醉效果, 重点关注其对患者围术期氧化应激的影响. 通过对比两组患者的血流动力学、镇痛指数、麻醉深度、氧化-抗氧化系统指标以及手术相关指标和不良反应, 评估两种麻醉方案的优劣, 为临床提供更优化的麻醉选择.
本研究前瞻性选取2022-04/2024-12在浙江省舟山医院拟行肠道ESD手术的120例患者, 随机分为舒芬太尼联合丙泊酚(sufentanil combined with propofol, SP)组和舒芬太尼联合右美托咪定(sufentanil combined with dexmedetomidine, SD)组, 每组60例. 所有患者术前5 min给予0.2 μg/kg舒芬太尼, SP组术前2 min给予1.5 mg/kg丙泊酚并以4 mg/(kg·h)维持, SD组术前10分钟给予1.0 μg/kg右美托咪定并以0.6 μg/(kg·h)维持. 研究记录了两组患者在不同时间点的血流动力学指标、镇痛指数、麻醉深度、氧化-抗氧化系统指标以及手术相关指标和不良反应.
结果显示, SP组麻醉诱导时间短于SD组, 但苏醒时间长于SD组. 在血流动力学方面, SP组在麻醉诱导即刻至黏膜下切除时的心率明显低于SD组, 而平均动脉压在内窥镜入喉时和黏膜下切除时明显高于SD组. 镇痛指数和麻醉深度方面, SP组在内窥镜入喉时至手术结束时均高于SD组. 氧化-抗氧化系统指标显示, 两组在术前、麻醉后30 min及手术结束后1 h的过氧化氢酶、丙二醛、超氧化物歧化酶水平无显著差异. 不良反应方面, SP组注射痛和呼吸抑制发生率高于SD组, 而体动发生率低于SD组.
本研究表明, 舒芬太尼联合右美托咪定在ESD手术中具有血流动力学稳定、苏醒快、注射痛及呼吸抑制发生率低等优势, 而舒芬太尼联合丙泊酚则具有麻醉诱导快、体动发生率低的特点. 两种方案对患者氧化应激的影响相似. 临床可根据具体手术需求和患者情况选择合适的麻醉方案.
尽管本研究为临床麻醉方案的选择提供了有价值的参考, 但仍存在局限性, 如单中心小样本、未设置空白对照等. 未来研究应开展多中心、大样本的随机对照试验, 并延长随访时间, 以进一步验证两种麻醉方案的长期效果. 此外, 可探索新型抗氧化药物或麻醉辅助剂与舒芬太尼的联合应用, 以进一步优化麻醉方案, 减轻氧化应激损伤, 改善患者预后.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): C, C
D级 (一般): 0
E级 (差): 0
科学编辑: 刘继红 制作编辑:郑晓梅
| 1. | Chang JI, Kim TJ, Hwang NY, Sohn I, Min YW, Lee H, Min BH, Lee JH, Rhee PL, Kim JJ. Clinical Outcomes and Adverse Events of Gastric Endoscopic Submucosal Dissection of the Mid to Upper Stomach under General Anesthesia and Monitored Anesthetic Care. Clin Endosc. 2022;55:77-85. [PubMed] [DOI] |
| 3. | Akyuva Y, Nur G, Deveci HA, Guler SK. Oxidative Stress and Biochemical Alterations in Patients with Head and Multiple Organ Traumas. Turk Neurosurg. 2023;33:855-861. [PubMed] [DOI] |
| 5. | Poon WH, Ling RR, Yang IX, Luo H, Kofidis T, MacLaren G, Tham C, Teoh KLK, Ramanathan K. Dexmedetomidine for adult cardiac surgery: a systematic review, meta-analysis and trial sequential analysis. Anaesthesia. 2023;78:371-380. [PubMed] [DOI] |
| 6. | Hughes CG, Mailloux PT, Devlin JW, Swan JT, Sanders RD, Anzueto A, Jackson JC, Hoskins AS, Pun BT, Orun OM, Raman R, Stollings JL, Kiehl AL, Duprey MS, Bui LN, O'Neal HR, Snyder A, Gropper MA, Guntupalli KK, Stashenko GJ, Patel MB, Brummel NE, Girard TD, Dittus RS, Bernard GR, Ely EW, Pandharipande PP; MENDS2 Study Investigators. Dexmedetomidine or Propofol for Sedation in Mechanically Ventilated Adults with Sepsis. N Engl J Med. 2021;384:1424-1436. [PubMed] [DOI] |
| 7. | Tanaka S, Kashida H, Saito Y, Yahagi N, Yamano H, Saito S, Hisabe T, Yao T, Watanabe M, Yoshida M, Kudo SE, Tsuruta O, Sugihara KI, Watanabe T, Saitoh Y, Igarashi M, Toyonaga T, Ajioka Y, Ichinose M, Matsui T, Sugita A, Sugano K, Fujimoto K, Tajiri H. JGES guidelines for colorectal endoscopic submucosal dissection/endoscopic mucosal resection. Dig Endosc. 2015;27:417-434. [PubMed] [DOI] |
| 8. | 朱 伟波, 于 建民, 王 建越, 付 艳红, 秦 海艳, 高 娜. 不同剂量甲苯磺酸瑞马唑仑对经肠道内镜黏膜下剥离术者抗感染效果分析. 临床和实验医学杂志. 2022;21:2462-2464. |
| 9. | Zhao MJ, Hu HF, Li XL, Li XM, Wang DC, Kuang MJ. The safety and efficacy between remimazolam and propofol in intravenous anesthesia of endoscopy operation: a systematic review and meta-analysis. Int J Surg. 2023;109:3566-3577. [PubMed] [DOI] |
| 10. | Xiao X, Xiao N, Zeng F, Chen H, Zhang L, He X. Gastroscopy sedation: clinical trial comparing propofol and sufentanil with or without remimazolam. Minerva Anestesiol. 2022;88:223-229. [PubMed] [DOI] |
| 11. | Miao Y, Zheng M, Li Q, Xiong L, Feng J, Liu X, Fan G, Chaturvedi R, Zhang F, Yin N. Comparison of propofol-esketamine versus propofol-sufentanil for deep sedation and analgesia in children with autism: A randomized double-blind clinical trial. Autism Res. 2024;17:1356-1364. [PubMed] [DOI] |
| 12. | Kirkham EM, Hoi K, Melendez JB, Henderson LM, Leis AM, Puglia MP 2nd, Chervin RD. Propofol versus dexmedetomidine during drug-induced sleep endoscopy (DISE) for pediatric obstructive sleep apnea. Sleep Breath. 2021;25:757-765. [PubMed] [DOI] |
| 13. | Fan M, Li J, Cao R, Hu L, Lu S. Efficacy and safety of dexmedetomidine-ropivacaine versus sufentanil-ropivacaine for epidural labor analgesia: a randomized controlled trial. Ann Palliat Med. 2022;11:1410-1420. [PubMed] [DOI] |
| 14. | Karimi M, Alipour M, Jalaeian Taghaddomi R, Tavakolian A. Effects of the Sufentanil and Dexmedetomidine Combination on Spinal Anesthesia in Patients Undergoing Lower Abdominal or Lower Extremity Surgery: A Double-Blind Randomized Controlled Trial. Iran J Med Sci. 2021;46:263-271. [PubMed] [DOI] |
| 17. | Oldman AH, Martin DS, Feelisch M, Grocott MPW, Cumpstey AF. Effects of perioperative oxygen concentration on oxidative stress in adult surgical patients: a systematic review. Br J Anaesth. 2021;126:622-632. [PubMed] [DOI] |
| 18. | Elgouhary SM, Elmazar HF, Naguib MI, Bayomy NR. Role of oxidative stress and vascular endothelial growth factor expression in pterygium pathogenesis and prevention of pterygium recurrence after surgical excision. Int Ophthalmol. 2020;40:2593-2606. [PubMed] [DOI] |
| 19. | 马 荷荷, 王 宇, 赵 慧玲, 党 庆庆, 艾 伦, 陈 小春. 舒芬太尼复合丙泊酚靶控输注对宫颈癌根治术患者Th17/Treg及氧化抗氧化系统的影响. 药物评价研究. 2023;46:396-400. |
| 20. | Zhao X, Luo J, Huang Y, Mu L, Chen J, Liang Z, Yin Z, Chu D, Han Y, Guo B. Injectable Antiswelling and High-Strength Bioactive Hydrogels with a Wet Adhesion and Rapid Gelling Process to Promote Sutureless Wound Closure and Scar-free Repair of Infectious Wounds. ACS Nano. 2023;17:22015-22034. [PubMed] [DOI] |
| 21. | Dymanowska-Dyjak I, Frankowska K, Abramiuk M, Polak G. Oxidative Imbalance in Endometriosis-Related Infertility-The Therapeutic Role of Antioxidants. Int J Mol Sci. 2024;25. [PubMed] [DOI] |
| 22. | Yu Y, Wu Y, Zhang Y, Lu M, Su X. Oxidative stress in the tumor microenvironment in gastric cancer and its potential role in immunotherapy. FEBS Open Bio. 2023;13:1238-1252. [PubMed] [DOI] |
| 23. | Martin-Perez M, Urdiroz-Urricelqui U, Bigas C, Benitah SA. The role of lipids in cancer progression and metastasis. Cell Metab. 2022;34:1675-1699. [PubMed] [DOI] |
| 24. | Yao Y, Zhang JJ. Propofol induces oxidative stress and apoptosis in vitro via regulating miR-363-3p/CREB signalling axis. Cell Biochem Funct. 2020;38:1119-1128. [PubMed] [DOI] |