修回日期: 2025-04-25
接受日期: 2025-05-19
在线出版日期: 2025-05-28
代谢相关脂肪性肝炎(metabolic dysfunction-associated steatohepatitis, MASH)正迅速成为全球健康领域的一个重大挑战. 线粒体功能障碍在其病理进程中发挥核心作用, 损伤的线粒体可以释放线粒体DNA(mitochondrial DNA, mtDNA)至胞质或胞外. mtDNA作为一种损伤相关分子模式(damage-associated molecular patterns, DAMPs), 通过激活先天免疫信号通路, 如cGAS-STING信号轴、NLR家族含Pyrin结构域蛋白3炎性小体和Toll样受体9(Toll-like receptor 9, TLR9)通路, 放大无菌性炎症. 此外, mtDNA的突变和甲基化修饰与肝脏代谢紊乱密切相关. 释放至胞质或胞外的mtDNA通过参与免疫和炎症信号通路, 促进炎症反应、代谢紊乱及纤维化进程. 本文从mtDNA的DAMPs作用、突变和甲基化修饰、释放机制及相关信号通路四个方面总结了其在MASH中的功能和作用机制.
核心提要: 代谢相关脂肪性肝炎(metabolic dysfunction-associated steatohepatitis, MASH)正迅速成为全球健康领域的一个重大挑战. 本文从线粒体DNA的损伤相关分子模式作用、突变和甲基化修饰、释放机制及相关信号通路四个方面总结了其在MASH中的功能和作用机制.
引文著录: 刘莹, 胡杨, 单兆良. 线粒体DNA释放通过激活炎症通路介导代谢相关脂肪性肝炎的研究. 世界华人消化杂志 2025; 33(5): 344-360
Revised: April 25, 2025
Accepted: May 19, 2025
Published online: May 28, 2025
Metabolic dysfunction-associated steatohepatitis is rapidly emerging as a global health challenge. Mitochondrial dysfunction plays a central role in its pathogenesis, whereby damaged mitochondria release mitochondrial DNA (mtDNA) into the cytosol or extracellular space. As a damage-associated molecular pattern (DAMP), mtDNA amplifies sterile inflammation by activating innate immune signaling pathways, including the cGAS-STING axis, NOD-like receptor family pyrin domain containing 3 inflammasome, and Toll-like receptor 9. Furthermore, mtDNA mutations and methylation modifications are closely associated with hepatic metabolic dysregulation. Released mtDNA exacerbates inflammatory responses, metabolic disturbances, and fibrotic progression through its engagement with immune and inflammatory cascades. This review summarizes the roles and mechanisms of mtDNA in MASH pathogenesis from four perspectives: Its function as a DAMP, its mutations and methylation modifications, its release mechanisms, and the associated signaling pathways.
- Citation: Liu Y, Hu Y, Shan ZL. Mitochondrial DNA release mediates metabolic-associated steatohepatitis via activation of inflammatory pathways. Shijie Huaren Xiaohua Zazhi 2025; 33(5): 344-360
- URL: https://www.wjgnet.com/1009-3079/full/v33/i5/344.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v33.i5.344
代谢功能障碍相关脂肪性肝病(metabolic dysfunction-associated steatotic liver disease, MASLD)是目前全球最常见的肝病之一, 患病率约为30%, 并且呈逐年增长的趋势. 值得关注的是, 其中约20%的患者会进一步发展为更为严重的代谢功能障碍相关脂肪性肝炎(metabolic dysfunction-associated steatohepatitis, MASH)[1].
MASH作为MASLD的进展性阶段, 不仅与肝脏炎症和纤维化密切相关, 还被认为是肥胖和2型糖尿病等代谢性疾病的重要关联因素. 它与代谢综合征的疾病谱紧密相连, 包括胰岛素抵抗(insulin resistance, IR)、血脂异常以及心血管疾病等[2]. 根据一项全国性匹配队列研究, 在接受肝脏活检并随访的患者中, 与MASH相关的死亡率持续居高不下[3], 这种高死亡率与多因素密切相关, 包括久坐少动的生活方式、高热量饮食习惯以及遗传易感性等[4]. 深入研究MASH的机制, 对于全面理解疾病进展和制定精准治疗策略至关重要.
MASH作为一种进行性疾病, 伴有脂肪变性、肝细胞损伤和炎症, 伴或无纤维化. 虽然临床沉默, 但随着时间MASH可进展为肝硬化、终末期肝病或需要进行肝移植[5]. 在无继发性原因时, MASH的肝脏脂肪变性, 以甘油三酯的形式积聚在5%以上的肝细胞中[6], 由脂肪酸(fatty acid, FA)转运和代谢紊乱引起的脂肪积累[7]. 本质上是脂质获取和脂质处理之间的不平衡, 其主要调节途径包括: 循环脂质的摄取、de novo脂肪生成、脂肪酸氧化和极低密度脂蛋白中脂质的输出[8]. MASH的发病机制复杂[9,10], 涉及到胰岛素抵抗、氧化应激、脂质代谢紊乱、炎症反应、肠道菌群失调和线粒体功能障碍等多个方面[11,12].
线粒体功能障碍是导致MASH病理特征的关键致病因素. 其损害肝脏脂肪平衡, 过度生产活性氧(reactive oxygen species, ROS)[13-17]. 其中线粒体呼吸链是ROS的主要细胞来源, 可能会损害线粒体DNA(mitochondrial DNA, mtDNA). 当受损的线粒体无法清除过度产生的ROS时, 就会发生氧化应激, 会在细胞水平上造成损害, 如细胞坏死和凋[18-20], 促炎细胞因子表达, 肝星状细胞激活和纤维生成[15,21,22]. 已有证据表明, 由于肥胖、高甘油三酯血症、胰岛素抵抗综合征引起的MASH患者表现出线粒体超微结构病变[23,24], 呼吸链复合物的活性降低[25], 肝脏ATP水平较低, 最后可能会发展出氧化应激介导的mtDNA的缺失[26]. 而mtDNA作为一种mtDAMP[27], 在各种刺激下与MASH的发展显著相关. 在252个MASLD/MASH患者的肝脏标本中, MASH与更高的MT-CYB方差有关, 肝脏mtDNA损伤与晚期疾病和炎症有关[28]. 较高的mtDNA拷贝数也揭示了线粒体的数量或质量, 它与导致炎症的氧化应激之间的强烈关联, 从而强调了mtDNA改变与肝损伤严重程度之间的相关性[29].
MASH的发生也与多种遗传和表观遗传因素密切相关[30]. DNA作为遗传信息的载体, 其不同存在形式和功能(如核DNA、胞外游离DNA以及mtDNA等)通过调控代谢、炎症和细胞稳态, 在MASH的病理进程中发挥多层次作用. 其中, 核DNA中的多种遗传变异与脂质代谢紊乱和炎症反应密切相关[31]; 胞外游离DNA水平反映了肝细胞损伤程度, 具有潜在的生物标志物价值. 并且, 队列研究表明循环DNA水平与MASH患者的肝病严重程度密切相关, 尤其是在肝硬化患者中, 循环DNA水平显著降低, 可作为MASH进展的潜在筛查工具[32].
相比之下, mtDNA不仅在维持细胞代谢稳态中发挥核心作用, 更因其对氧化损伤高度敏感, 成为连接代谢紊乱与慢性炎症的重要桥梁. 在众多DNA分子中, mtDNA因其独特的生物学特性及与能量代谢的核心关联, 逐渐成为理解MASH病理机制的关键突破口. 因此, 本文将聚焦于mtDNA在MASH中的作用机制, 探讨其在疾病发生、进展及潜在干预中的关键价值. 我们总结了mtDNA释放的可能机制以及MASH中mtDNA的致病机制.
线粒体是双膜结合细胞器, 拥有其基因组(mtDNA), 编码电子传递链复合物Ⅰ-Ⅴ和ATP合成的核心蛋白质亚基[33]. 它不仅产生绝大多数细胞内ATP, 而且还接收和解码应激的细胞器外源信号, 因此一直被认为是危险信号的主要调节因子. 而位于人体内线粒体基质中的mtDNA作为线粒体的遗传物质, 包含16.5 kb缺乏内含子的环状dsDNA, 编码22个tRNA、2个rRNA和13个mRNA, 这些mRNA编码必需氧化磷酸化(oxidative phosphorylation, OXPHOS)蛋白亚基[34].
当线粒体发生损伤或功能障碍时, mtDNA可以从线粒体释放到细胞质中. 游离的mtDNA作为一种损伤相关分子模式(damage-associated molecular patterns, DAMPs)在疾病中发挥着重要作用. mtDNA突变与多种人类疾病有关, 包括糖尿病、急性肺损伤和癌症等[35]. 而在mtDNA复制, 转录和修复酶诱导中, 线粒体转录因子A(transcription factor A, TFAM)发挥重要调节作用[36]. 破坏TFAM可能会损害mtDNA编码的呼吸链亚基的功能. 当游离FA可用性提高时, 增强了这些亚基对氧化损伤的易感性, 这意味着错误的mtDNA和基因表达可以进一步放大线粒体损伤, 因此mtDNA的健康与功能直接影响肝脏细胞的生存与代谢平衡[37,38].
此外, mtDNA的释放可能通过免疫受体[如TLR9、干扰素基因刺激因子(stimulator of interferon genes, STING)等]激活脂肪组织中巨噬细胞的浸润等炎症反应, 损害胰岛β细胞的功能, 减少胰岛素的分泌, 进而加重胰岛素抵抗, 影响糖代谢[39,40]. 它还能够促进肿瘤坏死因子α(tumor necrosis factor-alpha, TNF-α)、白细胞介素-1β(interleukin-1 beta, IL-1β)等促炎因子的释放[41,42], 这些细胞因子直接作用于胰岛β细胞. 并且, mtDNA的释放导致的炎症反应增强, 可能导致脂肪细胞的肥大和脂肪组织的代谢功能紊乱[43], 从而加剧肥胖相关的代谢性疾病(如糖尿病、脂肪肝等)的进展[44,45].
因此, mtDNA在MASH及其他代谢性疾病的发病机制中具有关键作用. mtDNA损伤及其释放通过多种免疫信号通路引发系统性炎症反应, 从而促进MASH的发生与进展. 深入探讨mtDNA在MASH中的作用机制, 有望为该疾病的早期诊断和治疗提供潜在的靶点和新的治疗策略.
与核DNA相比, mtDNA容易受到ROS攻击, 并且由于缺乏对组蛋白和DNA修复系统的保护而容易发生突变, 尤其是在氧化应激水平较高的病理环境下, 如MASH中[46]. 突变的累积不仅会加剧氧化应激[47], 还会影响线粒体基因的稳定性, 破坏线粒体的核心功能, 破坏线粒体呼吸链和能量代谢, 从而促进肝脏疾病的发病机制[48].
当ROS生成较低时, 它可以用作生理信号分子或响应低水平的细胞应激, 但是, 当ROS生成变得太大时, ROS会出现病理后果, 包括信号凋亡. 某些mtDNA改变, 例如与线粒体蛋白质合成减少相关的改变(例如tRNA突变或缺失)通常与OXPHOS复合物稳态水平降低和ROS降低有关[49]. 不同的mtDNA缺陷具有不同的下游后果, 影响OXPHOS活性、OXPHOS蛋白水平、ATP产生、膜电位和ROS生成. 除此之外, 可能由母系遗传或体细胞突变引起的mtDNA本身的突变, 包括点突变、缺失和插入, 这些突变会导致线粒体编码的关键蛋白功能异常, 影响电子传递链复合物的正常运行, 从而引发能量代谢紊乱[50].
最近的研究强调, 与健康人相比, MASLD患者的肝脏mtDNA的突变率更[51]. 对已识别的mtDNA突变和多态位点的表达分析表明, OXPHOS是其主要目标. 在晚期纤维化患者中, mtDNA的一种编码基因 mtCYB发现了破坏性的体细胞突[51]. 肝脏和血液mtDNA突变的相似性表明, 它们可以从母亲那里遗传. 另有细胞色素b是线粒体呼吸酶体的关键成分, Pirola等[28]报告说, 肝组织细胞色素b区域的mtDNA突变在晚期MASH和严重肥胖患者中更常见, 他们有严重的肝氧化损伤和代谢功能受损.
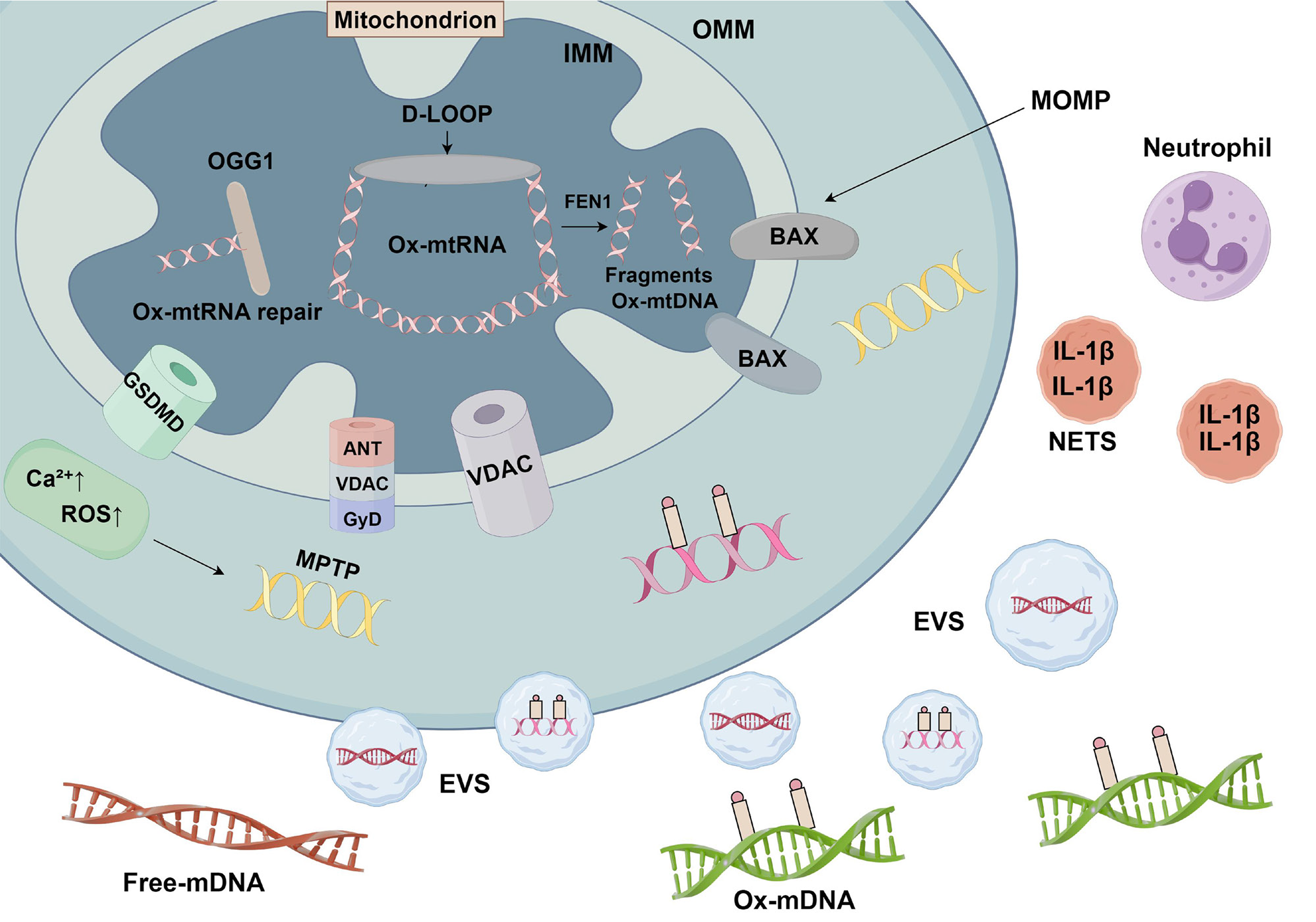
mtDNA是由富含鸟嘌呤核苷酸的重链、富含胞嘧啶的轻链和包含线粒体基因组主要非编码区的控制区组成的环状双链分子[34]. mtDNA分子的非编码区也被称为位移环(D-loop), 它包含DNA复制和转录所必需的元件[52]. D-loop易发生氧化损伤, 尤其是以8-羟基-2-脱氧鸟苷(8-oxoG)的形式存在. 事实上, 最常见的DNA突变类型是由ROS驱动的鸟嘌呤(G)修饰, 导致8-oxoG的形成. 当mtDNA复制过程中D-loop扩张时, ox-mtDNA的形成增加. 线粒体氧化损伤的一个主要修复机制是通过8-OxoG糖基化酶1(8-oxoguanine, 8-oxoG) DNA glycosylase 1, OGG1)发生的. OGG1功能受损导致mtDNA中8-oxoG含量升高[53]. 线粒体功能障碍也会导致OGG1介导的修复效率低下, 从而导致ox-mtDNA生成增加. 研究表明[54], OGG1的线粒体靶向对饮食诱导的肥胖和IR具有显着保护作用, 即使在完全不存在核OGG1的情况下也是如此. 这些数据首次证明线粒体修复氧化DNA损伤足以保护动物免受长期高脂肪饮食的不良后果. 值得注意的是, 在这个OGG1线粒体过表达模型中, 多个代谢参数主要影响白色脂肪组织[54]. 这伴随着这些转基因小鼠脂肪组织中8-oxoG水平的降低, 表明OGG1的DNA修复活性可能介导了在这些小鼠中观察到的代谢保护. 此外, 氧化的DNA成为Flap核酸内切酶-1(flap endonuclease 1, FEN1)切割的靶点, 与ox-mtDNA和ROS的产生共同产生线粒体DAMPs. FEN1切割氧化的DNA, 产生500-650bp的ox-mtDNA片段, 可穿过线粒体膜的孔道进入细胞胞质, 产生炎症信号[55]. 积累的大量证据表明, 在MASH的发育过程中, mtDNA甲基化的表观遗传变异可能会发生[56,57]. 人类mtDNA由435个CpG位点和4747个非CpG位点的胞嘧啶残基组成. CpG位点的胞嘧啶和非CpG位点的胞嘧啶都可以被甲基化, 尽管发生的频率不同[34,58].
在氧化应激条件下, DNA甲基转移酶1(DNA methyltransferase 1, DNMT1)通过PGC1α和NRF-1[59,60]的表达而上调. DNMT1表达的增加通过其基因的甲基化抑制ND6的表达, 而ND1则上调[59]. 虽然ND1和ND6(complexIsubunit6, 复合物I亚基6)相反调控的意义尚不清楚, 但已提出的机制中DNMT1的一种亚型靶向mtDNA, 负责CpG二核苷酸中碳-5位置(5mC)的mtDNA甲基化, 涉及MTERF1(线粒体终止因子1)与CpG二核苷酸中的5-甲基胞嘧啶的相互作用和/或其与mtDNA结合的mtDNMT1的相互作用. mtDNA甲基化是非随机的, DNMT1与线粒体基因组发生在特定的点, 这样反向调节线粒体功能和基因转录[61]. 由于线粒体是ROS的主要来源和直接靶点, mtDNMT1蛋白水平的快速升高对适应氧化应激至关重要. 此外, 线粒体编码的NADH脱氢酶6(MT-ND6)基因是MASLD/MASH中线粒体甲基化的靶点[5]. 据报道[5], MT-ND6高度甲基化(P<0.05), MASH患者MT-ND6 mRNA的表达比单纯肥胖患者少得多. 再者发现MT-ND6的肝脏甲基化与MASH的严重程度有关, 这表明mtDNA的表观遗传修饰在MASH的疾病进展和发病机制中起着关键作用.
肝脏细胞中过氧化物酶体增殖物激活受体(peroxisome proliferator-activated receptors, PPARs)有助于肝脂肪变性[62]. PPARα和PPARγ活性的平衡与脂肪酸的合成和氧化有关. 结果表明PPARγ调节分化和细胞因子的产生, 并被发现可以减少促炎细胞因子的表达. 肝脏PPARγ共激活剂1α和TFAM的甲基化水平与空腹胰岛素和IR的稳态模型评估有关. mtDNA的肝脏水平在正常肝脏中比在MASLD肝脏中高得多, 并被发现与PGC1α甲基化、空腹胰岛素和HOMA-IR成反比[63].
mtDNA的释放可以通过几种不同的机制发生, 包括通过外线粒体膜(outer mitochondrial membrane, OMM)上的Bcl-2同源拮抗剂杀伤因子(Bcl-2 homologous antagonist/killer, BAK)和Bcl-2相关X蛋白(Bcl-2-associated X protein, BAX)孔道的内线粒体膜(inner mitochondrial membrane, IMM)膨出[64], 或者通过线粒体通透性转换孔(mitochondrial permeability transition pore, mPTP)和电压依赖性阴离子通道(Voltage-Dependent Anion Channel, VDAC)孔道的逃逸[65]. 已有研究表明, 释放的mtDNA可以是完整的核苷酸形式(通过BAK/BAX)或片段形式(通过VDAC), 且非氧化型和氧化型mtDNA具有不同的信号传导特性[66,67].
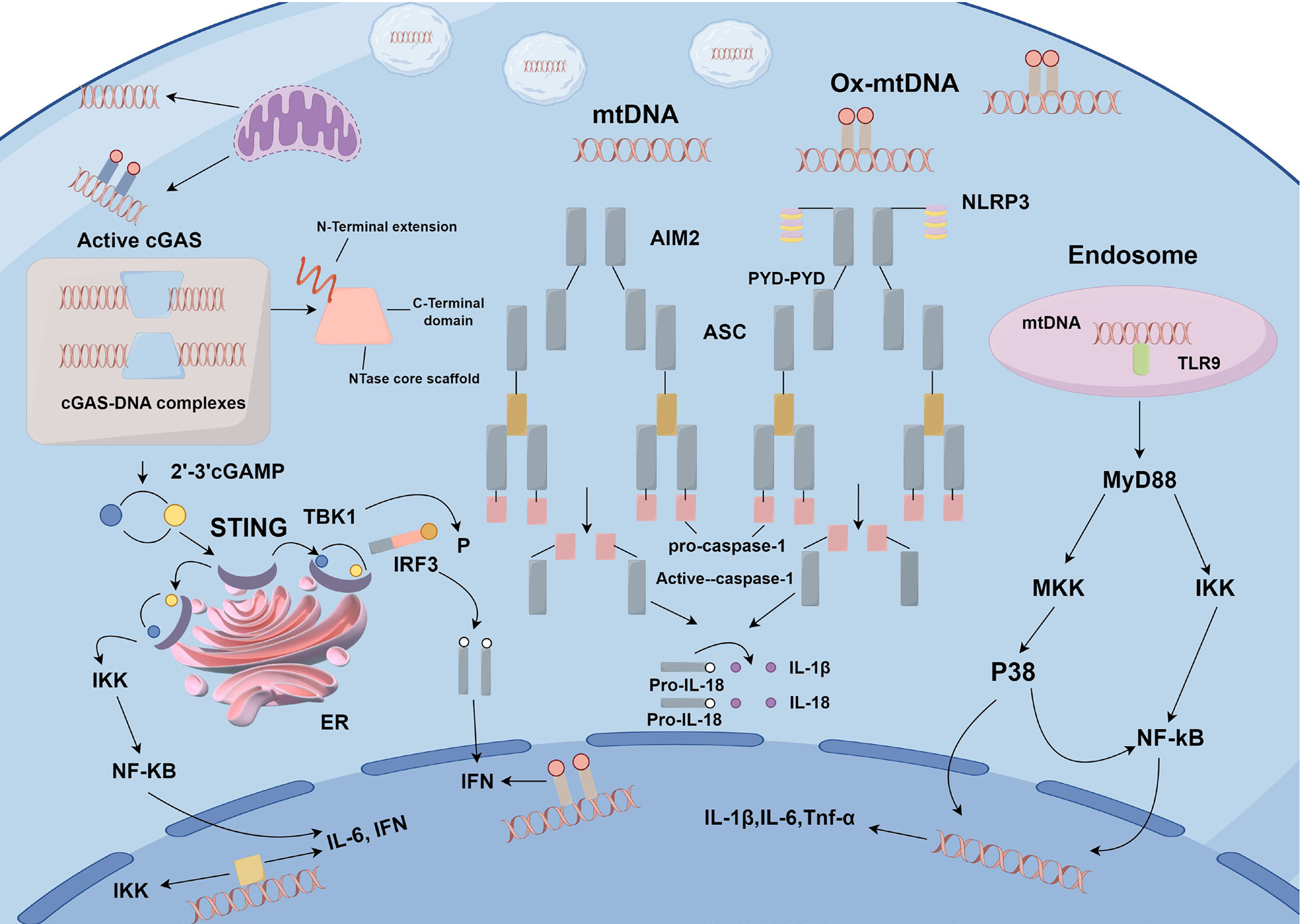
细胞质中的mtDNA能够激活多种天然免疫感受器, 包括对低甲基化CpG DNA(包括mtDNA)具有一定特异性的TLR9、环状GMP-AMP合成酶(Cyclic GMP-AMP Synthase, cGAS)、Z-DNA结合蛋白1、NLR家族含Pyrin结构域蛋白3(NOD-like receptor family pyrin domain containing 3, NLRP3)以及黑色素瘤缺失基因2(absent in melanoma 2, AIM2)炎症体[68-72]. 这些不同感受器的激活可以触发广泛的下游信号传导结果, 包括但不限于干扰素刺激基因、Ⅰ型干扰素(type Ⅰ interferons, IFN-1)、核因子κB(nuclear factor kappa-light-chain-enhancer of activated B cells, NF-κB)以及IL-1β和白细胞介素-18(interleukin-18, IL-18)的分泌[73-76]. 因此, mtDNA释放的机制、释放的mtDNA类型(如图1)以及由mtDNA诱导的炎症通路均具有高度的多样性, 并且可能相互作用.
2.2.1 MOMP介导的mtDNA释放: 线粒体外膜透化(mitochondrial outer membrane permeabilization, MOMP)导致线粒体膜间空间蛋白的释放, 包括细胞色素c, 激活酪蛋白酶蛋白酶, 导致细胞凋亡. 在稳态条件下, 抗凋亡BCL-2家庭成员(例如BCL-2、BCL-xL、MCL-1)阻止BAX和BAK的亲凋亡行为. 在细胞凋亡触发后, BAX和BAK被激活, 导致它们在线粒体外膜渗透(MOMP)和MOMP中的寡聚化[77,78]. 以时间的方式, 发现在MOMP之后, BAX/BAK介导的线粒体外膜孔逐渐变宽. 这允许线粒体内膜挤出到细胞质中, 从而渗透, 允许mtDNA释放. 因此, 内膜渗透性支撑了酪蛋白酶无关细胞死亡的免疫原效应.
如果酪蛋白酶活性在MOMP后被阻断, 细胞死亡仍会发生, 但随后会出现IFN反应和NF-κB激活[79-81]. 这导致促炎细胞因子的产生和对死亡细胞的免疫反应[81]. MOMP激活炎症和IFN-1反应的能力需要细胞质cGAS-STING DNA传感通路识别mtDNA. 另一方面, mtDNA可以以氧化的和未氧化的mtDNA片段的形式存在[82]. 一般来说, 氧化的DNA成为FEN1裂解的靶点, 它与ox-mtDNA和ROS的产生一起产生线粒体DAMP. FEN1对氧化DNA的裂解产生500-650 bp的ox-mtDNA片段, 这些片段可以通过线粒体膜的孔隙排出并进入细胞质, 产生炎症信号[55]. mtDNA的未氧化核素由BAK/BAX孔隙释放, 而ox-mtDNA释放在氧化应激下通过IMM上的PTP和OMM上的VDAC孔隙介导[83]. mPTP的确切成分尚不清楚, 而参与mtDNA释放过程的VDAC孔似乎涉及VDAC1和VDAC3的纯或混合寡聚体. 值得注意的是, VDAC磷酸化水平与患者脂肪变性的严重程度相关. 游离脂肪酸(free fatty acids, FFA)处理引发的线粒体损伤模型在ob/ob小鼠、高脂饲料诱导的小鼠及体外脂毒性模型中表现出与MASH患者肝细胞相似的病理特征, 包括线粒体形态改变、钙稳态失衡及VDAC磷酸化水平的降低. 这种一致性进一步表明FFA介导的mtDNA释放可能是MASH发病的重要机制之一[84].
研究表明, MAFLD小鼠肝脏中Bax促凋亡蛋白表达增加[85]. 并且, 通过铁死亡抑制剂liproxstatin-1或SGLT-2抑制剂(恩格列净)处理, 增加Bcl2/Bax比率并抑制CASPASE-8切割, 可以减少肝细胞凋亡[85,86]. 在小鼠中不仅可以改善新陈代谢和炎症进展, 还可以通过抑制肝细胞凋亡过程来减轻MASLD/MASH.
2.2.2 mPTP介导的mtDNA释放: 据报道, 少数IMM衍生的隔间有膜断裂, 这可能解释了mtDNA如何逃逸, 一旦进入膜间空间, mtDNA通过临界賴氨酸和精氨酸残基与VDAC的N端结合, 并促进VDAC寡聚化和mtDNA释放[65]. 然而, 在炎症体激动剂刺激的巨噬细胞中, mPTP激活和VDAC寡聚化可以独立于mtDNA结合和ROS介导的氧化[87].
在线粒体钙和ROS超载的情况下, MD增加继而与Ca2+相关的参与复合体样孔隙-mPTP的激活, 诱导线粒体内膜渗透性的丧失[88]. PTP的生物架构似乎是ox-mtDNA通过IMM运输的适应性溢出功能[89]. 一旦被激活, ox-mtDNA通过PTP和VDAC的开放转移到细胞质中[87]. 因此, mPTP的激活被认为是脂肪肝疾病发病机制的一个重要因素, 在MASLD的动物模型中, 对mPTP开放的易感性显著增加[53,90,91]. 而其他人则认为, 在酪蛋白酶抑制细胞凋亡下, IMM对小离子的渗透性更强[92]. mPTP可以通过渗透性过渡孔复合物(permeability transition pore complex, PTPC)的非特异性打开在线粒体膜上启动. 这两种致命的级联都可以由抗凋亡BCL-2蛋白控制, 这些蛋白不仅与原凋亡的BCL-2蛋白物理结合形成抑制, 而且还与各种PTPC成分结合. 或者, mPTP与线粒体跨膜电位(Δψm)的消失同步, 它与细胞质适配器APAF-1一起, 产生被称为"凋亡体"的caspase-9激活平台[27].
在MASH中, 高脂肪饮食引起的生化变化导致钙吸收增加, 线粒体钙浓度的突然增加对线粒体ATP的产生有害[93,94]. 高水平的游脱钙通过钠/钙交换器调节钠流入线粒体基质. 钠水平升高与IMM内叶中的磷脂相互作用, 降低其流动性, 从而降低IMM流动性[95].
2.2.3 通过EV将mtDNA释放到细胞外: 细胞外囊泡(extracellular vesicles, EVs)是各种细胞释放的纳米级囊泡, 将生物活性分子输送到靶细胞, 从而介导各种过程, 包括MASH的发展. 最近的研究表明, EV在调节损伤、放大炎症和促进MASH的肝纤维化方面起着重要作用[96-98].
作为膜衍生囊泡, EV由各种细胞类型释放, 包括肝细胞、肝星状细胞和正常或病理条件下的免疫细胞. EV可以携带脂质、蛋白质、编码和非编码RNA以及mtDNA, 导致受体细胞的改变, 作为细胞-细胞通信(自动、副、并列甚至内分泌)的细胞间介质. Garcia-Martinez等[99]发现, 小鼠和MASH患者的EV中mtDNA水平更高, 同时激活TLR9的肝细胞特异性标记增加. TLR9的激活将导致巨噬细胞中NF-κB依赖性促炎细胞因子的下游激活[99,100]. 在脂质过载下, 受损肝细胞释放的mtDNA通过TLR9诱导巨噬细胞中白介素-33(interleukin-33, IL-33)表达的上调, 并增强脂多糖(lipopolysaccharide, LPS)诱导的炎症细胞因子产生[101].
此外, 脂毒性肝细胞释放还含有mtDNA和氧化DNA以及完整的线粒体的微颗粒. mtDNA被骨髓细胞内切体中表达的TLR9识别, 触发促炎细胞因子的分泌, 如TNF-α和IL-1β, 可以进一步增强肝脏损伤[102]. 并且, 大多数血浆mtDNA包含在肝细胞起源的微颗粒(microparticle, MP)中, 从血浆中去除这些MP会导致TLR9激活能力大幅下降[99].
在MASH中, 肝脏细胞中会积累有毒脂类和其下游介质(如氧化脂质、游离脂肪酸等), 这些介质增加了肝细胞形成和释放不同类型的EV的能力[103,104]. PA棕榈酸处理的肝细胞激活肌醇需求酶1α, 可能促进脂肪性肝细胞分泌富含神经酰胺的EV, 从而可能促进巨噬细胞向肝脏募集[105]. 肝细胞的脂毒性treatment通过MLK3信号通路促进富含C-X-C基序配体10(C-X-C motif chemokine ligand 10, CXCL10)的EV的释放[53]. 用非酯化脂肪酸对肝细胞进行体外treatment, 会引起含有许多分子的EV的释放, 包括CXCL10、mtDNA和肿瘤坏死因子相关凋亡诱导配体[96]. 这些分子可以通过多种机制放大炎症, 如巨噬细胞激活和单核细胞趋化性, 以及炎症体激活和调节靶细胞中的NF-κB途径[106,107]. 如前所述, EV可以通过不同的机制释放, 包括caspase-3依赖机制或激活肝细胞中的死亡受体5[104]. 肝细胞衍生的EV能够诱导促炎细胞因子的表达, 并促进肝巨噬细胞的M1极化, 从而促进MASH疾病的发生发展[103,108].
2.2.4 通过ET将mtDNA释放到细胞外: mtDNA的释放通过细胞外陷阱(extracellular traps, ETs)在细胞外发挥重要作用, 参与多种疾病的炎症反应和免疫调节[109-112]. 这一过程中, 中性粒细胞胞外陷阱(neutrophil extracellular traps, NETs)因其与炎症和免疫反应的广泛联系, 成为研究的热点. NETs是一种由染色质解聚和扩散形成的DNA结构, 占据了细胞原本染色质体积的3到5倍. 1996年, Takei等[113]发现NETs是不同于细胞凋亡和坏死的一种独特的细胞死亡途径-Netosis. 在Netosis形成的过程中, 炎性小体的激活在中性粒细胞或巨噬细胞中起到了关键作用. 炎性小体的激活导致gasdermin-D裂解, 从而诱导细胞膜孔的形成, 释放促炎细胞因子(如IL-1β和IL-18)[76,114], 最终引发细胞焦亡或NETs的形成.
mtDNA不仅通过激活免疫细胞促进促炎细胞因子的释放, 还可以直接促进NETs的形成, 并延长中性粒细胞的寿命[115]. 实验中与对照组相比, 用纯化的细菌或mtDNA刺激的中性粒细胞表现出更高的活力[116].
Kaikkonen等[117]表明, 血清氧化的低密度脂蛋白(oxLDL)水平升高会增加人类患脂肪肝的风险. 最近的另一项研究[118]表明, oxLDL在MASLD患者的门静脉中积累, 并与活化的巨噬细胞共定位. 并且, 高度氧化的低密度脂蛋白(HoxLDL)能够引发外周巨噬细胞和库普弗细胞的表型转变, 促使它们向M4样促炎表型转化[53,119,120], 增加中性粒细胞的募集并诱导NET形成, 这将导致内皮损伤. M4巨噬细胞还会降低其吞噬活性, 可能允许内毒素和微生物积累. 这些事件的组合可能导致肝星状细胞(hepatic stellate cells, HSC)激活, 从而导致肝细胞损伤和纤维化进展[121]. 暴露于HoxLDL的外周巨噬细胞和库普弗细胞转变为M4样表型并获得可能影响MASLD进展的新功能[121]. 此外, 这些细胞的促炎趋化因子-8持续高表达, 进一步促进了中性粒细胞的招募[122].
在MASH的早期阶段, 中性粒细胞的招募和NETosis是肝脏炎症加剧的重要驱动因素, 进而促进了MASH的进展以及肝细胞癌的发生[123,124].
目前已知释放到细胞质、细胞外或细胞外环境中的mtDNA激活了几种天然免疫信号通路[69,83](如图2).
2.3.1 cGAS-STING通路: cGAS是一种细胞质蛋白, 一个长长的α螺旋与DNA接触, 在结构上包含3个dsDNA结合位点. 最小活性复合物是一个2:2的单位, 即两个cGAS副本与两个DNA螺旋结合18来识别dsDNA, 通常形成一个寡聚复合物, 其中多个副本的cGAS与DNA结合形成蛋白质-DNA阶梯, 导致cGAS的激活[68]. cGAS可以感知任何类型的dsDNA. 19,20°cGAS不仅识别来自病原体的外源DNA, 还敏锐地感知来自各种不同亚细胞定位的自DNA, 如细胞质染色质、微核和线粒体[80,87,125-128].
最近发现的新型细胞质DNA传感器cGAS通过催化环状GMP-AMP的合成, 即催化第二个信使环鸟苷酸-腺苷酸(cyclic GMP-AMP, cGAMP), 激活STING的下游适配器蛋白刺激剂. 而后通过TANK结合激酶1(TANK-binding kinase 1, TBK1)和转录因子干扰素调节因子3(interferon regulatory factor 3, IRF3)的磷酸化介导IFN刺激基因(interferon-stimulated gene, ISG)和IFN-1的转录[69,129,130]. 释放各种细胞因子, 引发了先天免疫反应[131]. 更具体地说, 与cGAMP结合后, STING聚合并易位到高尔基. 然后, STING上的PTM稳定聚合物, 这是后续干扰素生产的关键步骤. 激活的STING招募并磷酸化TBK1和IκB激酶复合体(IκB Kinase complex, IKK), 这一事件引发IRF3和IκBα的磷酸化. 然后, IRF3二聚体并易位到细胞核, 在那里它刺激IFN-1和其他炎症细胞因子的合成和分泌[132]. 磷酸化IκBα招募NF-κB, 并启动编码促炎细胞因子的基因转录[133].
FA代谢可能是mtDNA触发cGAS-STING激活的关键调节剂. 棕榈酸过载和脂毒性促进mtDNA释放和cGAS-STING信号[134], mtDNA-STING驱动的炎症有助于多种高脂肪饮食的病理生理学[83,135]. 在LPS处理后, 由mtDNA释放引发的STING信号在Kupffer细胞中明显激活. LPS增加了与动力素相关的蛋白质1-依赖性线粒体裂变, 从而增加线粒体ROS的生成, 这导致mtDNA泄漏到细胞质中, 并随后的STING信号激活[136,137].
在MASH患者中, 肝脏STING的表达已被证明是上调的. STING-IRF3轴参与了MASH中凋亡途径的激活, 上调炎症途径并诱导糖脂代谢紊乱. MASH中的肝细胞不仅是坏死炎症的目标, 而且还积极地协调和放大免疫反应. 炎症的恶性循环是由肝细胞的脂毒性和库弗细胞对肝细胞和/或其他肝外组织释放的压力或损伤信号的反应引起的. 然后, 库珀细胞激活炎症过程, 并通过释放趋化因子来招募单核细胞衍生的巨噬细胞. 随后MASH中细胞外OX-mtDNA引起的cGAS-STING和NLPR3炎症体信号驱动炎症巨噬细胞激活以及HSC转分化的纤维生成反应[118,138]. 所有这些都有助于MASH的进一步传播[139-141].
此外, cGAS-STING信号通过其他机制, 如自噬和代谢, 影响肝脏炎症的进展[133]. cGAS表达因氧化应激/ROS产生而增加, cGAS在诱导自噬和自噬体的初始形成中很重要[142]. cGAS-STING不仅诱导自噬, 作为细胞自主防御机制, 相反, 它也受到自噬成分的调节.
例如, 在肝脏缺血再灌注损伤中STING的激活导致NF-κB的激活, 并通过非规范的自噬机制形成LC3+囊泡(自噬体). 最后, 自噬体内的STING和从高尔基流到溶酶体的STING, 在那里发生STING降解. 不仅依赖ULK复合物和TBK1的规范自噬与STING介导的自噬囊泡形成的控制有关, 同时STING的激活也可以触发非规范自噬反应, 细胞因子的产生分别导致脂肪沉积和纤维化[143-146]. 这些发现表明了cGAS-STING信号在MASH中的重要地位, 并阐明了先天免疫调节与无菌性炎症和代谢紊乱之间更广泛的潜在联系.
2.3.2 TLR9信号: TLR9是一种模式识别受体, 能够识别低甲基化CpG DNA片段, 其内源性分子的主要来源是mtDNA[147]. 当细胞受到应激或损伤时, mtDNA从线粒体中排出并进入细胞周围环境, 激活TLR9作为危险或应激的旁分泌或内分泌信号. TLR9主要定位于内质网(Endoplasmic Reticulum, ER). 在受到低甲基化CpG DNA或mtDNA刺激后, TLR9通过Golgi体转位至内体, 完成二聚化过程[148]. 在这一过程中, mtDNA从受损线粒体中释放并与TLR9结合. TLR9募集信号转导蛋白M髓样分化因子88, 分别导致JNK和IKK激活, 促进NF-κB转录因子的核转位[131,149], 这些转录因子诱导各种炎性细胞因子(TNFα、IL-1β、IL-6)和趋化因子的表达, 同时通过MAPK通路激活, 从而诱导炎症因子的释放[150,151]. ER应激反应与肝细胞凋亡之间的因果关系已在广泛的肝脏疾病中建立, 包括病毒感染[152]、细菌毒素中毒[153]、IR损伤[154]移植[155]、MASLD/MASH[156].
TLR9激活后, TLR9上调炎性细胞因子, 包括白细胞介素IL-1β, 这有助于肝细胞中的脂质积累、炎症、细胞凋亡和纤维化[157,158]. TLR9的衰减导致几种实验动物模型中MASH的缓解[159,160]. 在MASH的人和小鼠血浆中发现了大量能够激活TLR9的mtDNA[131]. 在炎症状态下, 脂肪组织和肝脏中的TLR激活导致代谢相关基因的下调[161]. 而代谢功能障碍患者中循环mtDNA水平的升高在生物学上是有意义的. 研究表明, 经活检确认的MASH患者循环mtDNA水平升高[162,163], 这可能与IL-1β水平有关[163]. 局部炎症反应可能取决于mtDNA与TLR9的相互作用, 并且可能与浸润巨噬细胞有关, 这些巨噬细胞可以通过TLR9-p38MAPK信号转导途径被mtDNA暴露激活[164]. 研究显示, TLR9缺失可以减少巨噬细胞的浸润, 降低MCP-1和TNF-α等炎症因子的表达[165,166], 从而改善胰岛素抵抗[53].
并且, mtDNA与LPS共同刺激骨髓衍生的巨噬细胞时显著增加IL-33的分泌, 而TLR9寡核苷酸拮抗剂或TLR9 siRNA干预均可减少IL-33的释放量, 进一步支持TLR9在炎症中的调控作用[101]. TLR9通过多种信号通路参与炎症、自噬及免疫调控, 可能参与到多种MASH发病机制当中.
TLR9在MASH患者T细胞中的活化促进IFN-γ产生, 影响促炎巨噬细胞分化. TLR9表达降低与肝脏炎症和纤维化减轻相关, 可能通过限制IFN-γ产生发挥保护作用, 有利于抗炎Kupffer细胞分化. MASH患者可能存在TLR9表达下调机制的缺陷[167]. TLR9缺失还会减少肝脏中的浆细胞样树突状细胞数量, 从而改善IR[168]. TLR9不仅通过局部炎症反应在肝脏和脂肪组织内发挥作用, 还通过影响免疫细胞在不同器官之间的迁移与信号传递, 调节MASH的全身性免疫环境.
mtDNA的释放和TLR9的激活形成了一个重要的免疫反应环路, 推动了MASH的炎症反应和组织损伤. mtDNA作为TLR9的天然配体, 在肝脏的免疫激活和疾病进展中发挥着重要作用.
2.3.3 炎症小体的激活: 模式识别受体(pattern recognition receptors, PRRs)是一组生殖系编码的传感器, 为宿主提供对传染性病原体和生理扰动的防御[169]. PRRs识别被称为病原体相关分子模式(pathogen-associated molecular patterns, PAMP)的微生物, 包括LPS、鞭毛蛋白、微生物DNA、RNA. 他们还检测从受损的宿主细胞释放的DAMP, 包括ATP和宿主源性DNA.
DNA是PAMP和DAMP的来源. PAMP和DAMP都与模式识别受体结合, PRR可以是膜结合(Toll样受体和C型凝集素受体)或细胞质(核苷酸和寡聚结构域、富含亮氨酸重复的蛋白质、RIG-I样受体和AIM2样受体)[170]. 当细胞损伤时可能导致核或mtDNA的释放, 并激活细胞质DNA传感器[171-173].
在DNA传感的背景下, NLRP3激活剂ATP和黑菌素可以诱导线粒体释放氧化DNA. 氧化mtDNA与NLRP3相关联, 并部分诱导NLRP3依赖性IL-1β分泌[172]. 这一发现提供了一些证据, 证明氧化的mtDNA可能是NLRP3炎症体的潜在激活剂. 除了NLRs外, 其他炎症体传感器蛋白还含有PYD结构域, 如AIM2、干扰素可介素蛋白16或吡啶[174]. AIM2作为细胞质DNA受体, 在检测到dsDNA后, 与适配器分子细胞凋亡相关的斑点样蛋白质相连, 该蛋白在其吡啶域内包含酪蛋白酶激活和招募域[175]. 然后, AIM2形成炎症体/pyroptosome, 以激活NF-κB和酪蛋白酶-1.
细胞质DNA传感器的激活还导致IFN-1、促炎细胞因子和其他宿主防御基因的转录上调, 大分子信号机制的组装, 以及程序细胞死亡的诱导. 胞浆ox-mtDNA或mtDNA介导的天然免疫信号触发NLRP3炎症小体和DNA感知的cGAS的激活, 进而激活STING是驱动Ⅰ型IFN信号通路响应细胞质DNA的重要组件[176-178].
过量产生ROS可以通过增加OX-mtDNA的产生来激活炎症体[179]. 但细胞内和细胞外线粒体参与促进NLRP3炎症体激活: 细胞内mtDNA作为NLPR3的直接激活配体, 细胞外mtDNA作为参与炎症启动和激活的DAMP[180]. 在前一种情况下, ox-mtDNA与NLRP3直接相关联, NLRP3的PYD结构域可能会通过纯合PYD-PYD结合吸引ASC. ASC的羧基末端CARD随后可以与酪蛋白酶1的CARD结构域结合并激活它. 酪蛋白酶1自裂解导致NLRP3-ASC-酪蛋白酶1炎症复合物的形成[180].
在肝脏中, NLRP3在巨噬细胞和单核细胞中高度表达, 而巨噬细胞在红外后在脂肪肝中显示上调的线粒体Ca2+积累. 此外, 通过TUDCA治疗抑制ER应激显著降低了线粒体Ca2+在肝脏巨噬细胞中的积累, 表明ER应激诱导的线粒体钙过载激活巨噬细胞NLRP3通过线粒体活性氧种在IR后在脂肪肝中产生. 但肝细胞和星状细胞在较低水平中表达NLRP3[181-183]. 在MASH中, 已经证明肝脏免疫细胞和实质细胞都参与NLRP3炎症体激活. Pan和同事[184]证明, 来自MCD饮食的小鼠的Kupffer细胞会产生大量的IL-1β, 这取决于棕榈酸刺激后释放的mtDNA的NLRP3激活. 此外, Csak等[185]证明, 棕榈酸在肝细胞中增强了LPS诱导的酪蛋白酶-1激活和IL-1β释放. 实验证实在LPS和ATP刺激下, 线粒体ROS和线粒体膜渗透性明显增加, 导致mtDNA释放到细胞质中. 转移的mtDNA需要NLRP3的激活, 并可以直接诱导酪蛋白酶-1的下游激活, 以响应LPS和ATP的治疗, 以增强IL-1β和IL-18的产生[131,179].
据报道, 还有几种条件可以抑制mtDNA释放介导的NLRP3激活, 所有这些都表明直接或通过抑制OXPHOS作为抑制原因来减少线粒体ROS, 与ox-mtDNA作为激活信号一致[186-190]. 大多数慢性肝病的发病机制涉及肝脏的促炎级联激活和由先天性免疫细胞驱动的循环. 虽然有不同类型的炎症体, 但迄今为止, 大多数研究在ALD、MASLD/MASH和纤维化的发病机制中都关注NLRP3.
对于MASH的发生发展, 越来越多的证据表明, 线粒体功能障碍不仅与代谢紊乱密切相关, 还通过诱导炎症和肝细胞损伤, 推动了疾病的进展. 作为一种重要的DAMP, mtDNA的突变、甲基化改变以及释放机制在MASH的病理过程中发挥了核心作用. 探讨了其通过MOMP、mPTP、EVs和ETs等多种机制释放到胞质和胞外的过程. 特别是, 受损线粒体释放的mtDNA及其氧化形式, 不仅显著关联于MASH的严重程度, 还通过激活多个免疫信号通路(如cGAS-STING、TLR9、NLRP3炎性小体等)促进了炎症因子释放和肝纤维化的发生.
考虑MASH的复杂性和潜在的物种差异, 我们发现细胞mtDNA可以从细胞中释放出来, 并作为循环无细胞线粒体DNA(circulating cell-free mitochondrial DNA, ccf mtDNA)在细胞外液中持续存在. ccf mtDNA可以被识别为损伤相关分子模式(DAMP), 因为它与细菌DNA相似, 它激活了先天的免疫反应, 并作为各种疾病的潜在生物标志物[191]. 值得注意的是, 近年来越来越多临床研究证实了mtDNA相关异常与MASH进展之间的关联, 为基础研究成果向临床转化提供了关键支撑. 与非MASLD对照相比, MASLD患者外周血单核细胞中的线粒体呼吸能力显着降低. 对于MASLD治疗, 指南建议改变行为和饮食以减轻体重. 最近一项为期12个月的临床试验表明, 通过提高对地中海饮食的依从性和鼓励体育锻炼来改善患者的生活方式会导致MASLD缓解或消退[192], 并改善线粒体功能障碍[193]. 近一半患者的脂肪变性严重程度降低, 约20%的病例实现了脂肪变性缓解, 大多数在基线时表现为较轻的脂肪变性[194]. 这些结果强调了靶向线粒体功能恢复的现实可行性, 并为后续基于mtDNA调控的治疗策略提供了基础.
基于mtDNA在MASH中的关键作用, 针对mtDNA释放的干预(如减少线粒体损伤、阻断mtDNA相关免疫通路或清除ox-mtDNA)已显示出潜在的治疗效果. 在靶向mtDNA释放通路的药物干预研究领域, 有研究表明使用MOMP的药理抑制剂抑制mtDNA的释放. 例如小分子BAX抑制剂BAI1, 它抑制了BAX激活的构象事件, 防止了BAX线粒体易位和寡聚化[195,196]. 以及FDA批准的药物eltrombopag, 通过与BAI1不同的机制直接抑制BAX治疗衰老成纤维细胞. 另一些研究中, 抑制线粒体内膜中的mPTP开放, 减少Ca2+通过VDAC的流入[197]来抑制mtDNA的释放. 如mPTP抑制剂环孢菌素A[198], 以及VDAC抑制剂VBIT-4, 它阻止线粒体外膜的VDAC-1孔隙释放mtDNA进入细胞质, 从而减少由cGAS-STING或其他先天免疫途径介导的ISG或促炎基因表达. 此外, 激活的GsdmD通过形成跨膜孔, 而后释放mtDNA和炎症细胞因子来触发炎症反应, 调节脂肪肝炎中的脂肪生成和NF-κB信号通路[199]. 目前, 没有批准治疗脂肪性肝炎的药物, GsdmD是一个潜在的药物靶点. 最后, 肝细胞衍生的EV包裹mtDNA会引发炎症或先天免疫反应和肝恒星细胞激活, 并促进肝脏的肝细胞损伤和纤维化. 四甲基吡嗪通过防止EVs释放mtDNA来保护肝脏免受纤维化[200]. 未来, 深入的临床研究将是验证这些策略疗效及安全性的关键步骤, 尤其是在MASH患者异质性较大的背景下, 更需依赖真实世界数据和临床试验来确立其广泛适用性.
结合目前mtDNA在MASH发病机制中作用的研究, 在常见研究方向外梳理了两类不同研究发现: 其一, mtDNA功能完整性具有重要意义, 有临床研究通过线粒体靶向测序发现, 30%的MASH患者存在核基因编码的线粒体蛋白(如TFB1M、POLG)突变, 提示核基因组异常可能独立于mtDNA损伤引发线粒体功能障碍[201]. 其二, 替代信号通路假说介绍了内质网应激-UPRmt通路[202]和溶酶体功能异常理论[203], 阐述了这些机制如何在脂肪肝发生中与mtDNA损伤通路形成交互作用或独立致病. 另外, MASH发生发展过程中, mtDNA损伤作用可能在MASH不同病理阶段(如脂肪变性期和纤维化期)存在差异, 引用肝脏活检组织的单细胞测序数据[204], 显示晚期纤维化区域mtDNA拷贝数反而升高的矛盾现象, 提示存在代偿性线粒体增殖机制. mtDNA也可能受基因和环境交互作用的影响, 其中mtDNA甲基化修饰(如D-loop区CpG岛甲基化)受高脂饮食、肠道菌群代谢物调控, 形成独立于序列突变的功能异常[205]. 当前研究关于mtDNA作用的, 恰恰反映了MASH发病机制的复杂性和多维度特征.
综上所述, 尽管目前关于MASH中mtDNA介导通路及其与肝脏微环境之间相互作用的研究尚不完全, 但已有的证据为揭示其病理机制提供了重要线索. mtDNA在MASH的发病机制中具有核心地位, 其介导的免疫激活和肝脏损伤过程为新型干预策略提供了靶点. 推进临床研究、加强多中心验证, 将有望推动mtDNA靶向治疗从机制研究向临床实践的转化, 最终实现更精准的疾病管理和更优的患者预后. 靶向mtDNA的治疗策略或将成为MASH精准治疗领域的重要突破点, 为患者带来更为积极的预后改善和临床获益.
学科分类: 胃肠病学和肝病学
手稿来源地: 江西省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): B, B
C级 (良好): C
D级 (一般): 0
E级 (差): 0
科学编辑: 刘继红 制作编辑:郑晓梅
| 1. | Lee J, Kim Y, Friso S, Choi SW. Epigenetics in non-alcoholic fatty liver disease. Mol Aspects Med. 2017;54:78-88. [PubMed] [DOI] |
| 2. | Dongiovanni P, Paolini E, Corsini A, Sirtori CR, Ruscica M. Nonalcoholic fatty liver disease or metabolic dysfunction-associated fatty liver disease diagnoses and cardiovascular diseases: From epidemiology to drug approaches. Eur J Clin Invest. 2021;51:e13519. [PubMed] [DOI] |
| 3. | Simon TG, Roelstraete B, Khalili H, Hagström H, Ludvigsson JF. Mortality in biopsy-confirmed nonalcoholic fatty liver disease: results from a nationwide cohort. Gut. 2021;70:1375-1382. [PubMed] [DOI] |
| 4. | Fujii H, Kawada N, Japan Study Group Of Nafld Jsg-Nafld. The Role of Insulin Resistance and Diabetes in Nonalcoholic Fatty Liver Disease. Int J Mol Sci. 2020;21. [PubMed] [DOI] |
| 5. | Pirola CJ, Gianotti TF, Burgueño AL, Rey-Funes M, Loidl CF, Mallardi P, Martino JS, Castaño GO, Sookoian S. Epigenetic modification of liver mitochondrial DNA is associated with histological severity of nonalcoholic fatty liver disease. Gut. 2013;62:1356-1363. [PubMed] [DOI] |
| 6. | Banini BA, Sanyal AJ. Nonalcoholic Fatty Liver Disease: Epidemiology, Pathogenesis, Natural History, Diagnosis, and Current Treatment Options. Clin Med Insights Ther. 2016;8:75-84. [PubMed] [DOI] |
| 7. | Ma C, Zhang Q, Greten TF. Nonalcoholic fatty liver disease promotes hepatocellular carcinoma through direct and indirect effects on hepatocytes. FEBS J. 2018;285:752-762. [PubMed] [DOI] |
| 8. | Ipsen DH, Lykkesfeldt J, Tveden-Nyborg P. Molecular mechanisms of hepatic lipid accumulation in non-alcoholic fatty liver disease. Cell Mol Life Sci. 2018;75:3313-3327. [PubMed] [DOI] |
| 9. | Day CP, James OF. Steatohepatitis: a tale of two "hits"? Gastroenterology. 1998;114:842-845. [PubMed] [DOI] |
| 10. | Podrini C, Borghesan M, Greco A, Pazienza V, Mazzoccoli G, Vinciguerra M. Redox homeostasis and epigenetics in non-alcoholic fatty liver disease (NAFLD). Curr Pharm Des. 2013;19:2737-2746. [PubMed] [DOI] |
| 11. | Feng D, Youn DY, Zhao X, Gao Y, Quinn WJ, Xiaoli AM, Sun Y, Birnbaum MJ, Pessin JE, Yang F. mTORC1 Down-Regulates Cyclin-Dependent Kinase 8 (CDK8) and Cyclin C (CycC). PLoS One. 2015;10:e0126240. [PubMed] [DOI] |
| 12. | Tacke F, Luedde T, Trautwein C. Inflammatory pathways in liver homeostasis and liver injury. Clin Rev Allergy Immunol. 2009;36:4-12. [PubMed] [DOI] |
| 13. | Mantena SK, King AL, Andringa KK, Eccleston HB, Bailey SM. Mitochondrial dysfunction and oxidative stress in the pathogenesis of alcohol- and obesity-induced fatty liver diseases. Free Radic Biol Med. 2008;44:1259-1272. [PubMed] [DOI] |
| 14. | Rolo AP, Teodoro JS, Palmeira CM. Role of oxidative stress in the pathogenesis of nonalcoholic steatohepatitis. Free Radic Biol Med. 2012;52:59-69. [PubMed] [DOI] |
| 15. | Begriche K, Massart J, Robin MA, Bonnet F, Fromenty B. Mitochondrial adaptations and dysfunctions in nonalcoholic fatty liver disease. Hepatology. 2013;58:1497-1507. [PubMed] [DOI] |
| 16. | García-Ruiz C, Baulies A, Mari M, García-Rovés PM, Fernandez-Checa JC. Mitochondrial dysfunction in non-alcoholic fatty liver disease and insulin resistance: cause or consequence? Free Radic Res. 2013;47:854-868. [PubMed] [DOI] |
| 17. | Wei Y, Rector RS, Thyfault JP, Ibdah JA. Nonalcoholic fatty liver disease and mitochondrial dysfunction. World J Gastroenterol. 2008;14:193-199. [PubMed] [DOI] |
| 18. | Malassagne B, Ferret PJ, Hammoud R, Tulliez M, Bedda S, Trébéden H, Jaffray P, Calmus Y, Weill B, Batteux F. The superoxide dismutase mimetic MnTBAP prevents Fas-induced acute liver failure in the mouse. Gastroenterology. 2001;121:1451-1459. [PubMed] [DOI] |
| 19. | Alkhouri N, Carter-Kent C, Feldstein AE. Apoptosis in nonalcoholic fatty liver disease: diagnostic and therapeutic implications. Expert Rev Gastroenterol Hepatol. 2011;5:201-212. [PubMed] [DOI] |
| 20. | Syn WK, Choi SS, Diehl AM. Apoptosis and cytokines in non-alcoholic steatohepatitis. Clin Liver Dis. 2009;13:565-580. [PubMed] [DOI] |
| 21. | Chitturi S, Farrell GC. Etiopathogenesis of nonalcoholic steatohepatitis. Semin Liver Dis. 2001;21:27-41. [PubMed] [DOI] |
| 22. | Begriche K, Igoudjil A, Pessayre D, Fromenty B. Mitochondrial dysfunction in NASH: causes, consequences and possible means to prevent it. Mitochondrion. 2006;6:1-28. [PubMed] [DOI] |
| 23. | Pessayre D, Mansouri A, Fromenty B. Nonalcoholic steatosis and steatohepatitis. V. Mitochondrial dysfunction in steatohepatitis. Am J Physiol Gastrointest Liver Physiol. 2002;282:G193-G199. [PubMed] [DOI] |
| 24. | Sanyal AJ, Campbell-Sargent C, Mirshahi F, Rizzo WB, Contos MJ, Sterling RK, Luketic VA, Shiffman ML, Clore JN. Nonalcoholic steatohepatitis: association of insulin resistance and mitochondrial abnormalities. Gastroenterology. 2001;120:1183-1192. [PubMed] [DOI] |
| 25. | Sun Z, Lu P, Gail MH, Pee D, Zhang Q, Ming L, Wang J, Wu Y, Liu G, Wu Y, Zhu Y. Increased risk of hepatocellular carcinoma in male hepatitis B surface antigen carriers with chronic hepatitis who have detectable urinary aflatoxin metabolite M1. Hepatology. 1999;30:379-383. [PubMed] [DOI] |
| 26. | Prasun P, Ginevic I, Oishi K. Mitochondrial dysfunction in nonalcoholic fatty liver disease and alcohol related liver disease. Transl Gastroenterol Hepatol. 2021;5:4. [PubMed] [DOI] |
| 27. | Brenner C, Galluzzi L, Kepp O, Kroemer G. Decoding cell death signals in liver inflammation. J Hepatol. 2013;59:583-594. [PubMed] [DOI] |
| 28. | Pirola CJ, Garaycoechea M, Flichman D, Castaño GO, Sookoian S. Liver mitochondrial DNA damage and genetic variability of Cytochrome b - a key component of the respirasome - drive the severity of fatty liver disease. J Intern Med. 2021;289:84-96. [PubMed] [DOI] |
| 29. | Ma C, Liu Y, He S, Zeng J, Li P, Ma C, Ping F, Zhang H, Xu L, Li W, Li Y. Association Between Leukocyte Mitochondrial DNA Copy Number and Non-alcoholic Fatty Liver Disease in a Chinese Population Is Mediated by 8-Oxo-2'-Deoxyguanosine. Front Med (Lausanne). 2020;7:536. [PubMed] [DOI] |
| 30. | Zhang Y, Ding R, Hu L, Liu E, Qu P. Epigenetics in metabolic dysfunction-associated steatohepatitis. Cell Signal. 2025;130:111684. [PubMed] [DOI] |
| 31. | Puengel T, Liu H, Guillot A, Heymann F, Tacke F, Peiseler M. Nuclear Receptors Linking Metabolism, Inflammation, and Fibrosis in Nonalcoholic Fatty Liver Disease. Int J Mol Sci. 2022;23. [PubMed] [DOI] |
| 32. | Chrysavgis L, Papatheodoridi A, Cholongitas E, Koutsilieris M, Papatheodoridis G, Chatzigeorgiou A. Significance of Circulating Cell-Free DNA Species in Non-Alcoholic Fatty Liver Disease. Int J Mol Sci. 2021;22. [PubMed] [DOI] |
| 33. | Middleton P, Vergis N. Mitochondrial dysfunction and liver disease: role, relevance, and potential for therapeutic modulation. Therap Adv Gastroenterol. 2021;14:17562848211031394. [PubMed] [DOI] |
| 34. | Anderson S, Bankier AT, Barrell BG, de Bruijn MH, Coulson AR, Drouin J, Eperon IC, Nierlich DP, Roe BA, Sanger F, Schreier PH, Smith AJ, Staden R, Young IG. Sequence and organization of the human mitochondrial genome. Nature. 1981;290:457-465. [PubMed] [DOI] |
| 35. | Ballinger SW, Shoffner JM, Hedaya EV, Trounce I, Polak MA, Koontz DA, Wallace DC. Maternally transmitted diabetes and deafness associated with a 10.4 kb mitochondrial DNA deletion. Nat Genet. 1992;1:11-15. [PubMed] [DOI] |
| 36. | Mansouri A, Gattolliat CH, Asselah T. Mitochondrial Dysfunction and Signaling in Chronic Liver Diseases. Gastroenterology. 2018;155:629-647. [PubMed] [DOI] |
| 37. | Aharoni-Simon M, Hann-Obercyger M, Pen S, Madar Z, Tirosh O. Fatty liver is associated with impaired activity of PPARγ-coactivator 1α (PGC1α) and mitochondrial biogenesis in mice. Lab Invest. 2011;91:1018-1028. [PubMed] [DOI] |
| 38. | Pérez-Carreras M, Del Hoyo P, Martín MA, Rubio JC, Martín A, Castellano G, Colina F, Arenas J, Solis-Herruzo JA. Defective hepatic mitochondrial respiratory chain in patients with nonalcoholic steatohepatitis. Hepatology. 2003;38:999-1007. [PubMed] [DOI] |
| 39. | Huang Y, Zhou JH, Zhang H, Canfran-Duque A, Singh AK, Perry RJ, Shulman GI, Fernandez-Hernando C, Min W. Brown adipose TRX2 deficiency activates mtDNA-NLRP3 to impair thermogenesis and protect against diet-induced insulin resistance. J Clin Invest. 2022;132. [PubMed] [DOI] |
| 40. | Koppenol WH, Bounds PL, Dang CV. Otto Warburg's contributions to current concepts of cancer metabolism. Nat Rev Cancer. 2011;11:325-337. [PubMed] [DOI] |
| 41. | Willemsen J, Neuhoff MT, Hoyler T, Noir E, Tessier C, Sarret S, Thorsen TN, Littlewood-Evans A, Zhang J, Hasan M, Rush JS, Guerini D, Siegel RM. TNF leads to mtDNA release and cGAS/STING-dependent interferon responses that support inflammatory arthritis. Cell Rep. 2021;37:109977. [PubMed] [DOI] |
| 42. | Liu H, Fan H, He P, Zhuang H, Liu X, Chen M, Zhong W, Zhang Y, Zhen C, Li Y, Jiang H, Meng T, Xu Y, Zhao G, Feng D. Prohibitin 1 regulates mtDNA release and downstream inflammatory responses. EMBO J. 2022;41:e111173. [PubMed] [DOI] |
| 43. | Wu H, Wang Y, Li W, Chen H, Du L, Liu D, Wang X, Xu T, Liu L, Chen Q. Deficiency of mitophagy receptor FUNDC1 impairs mitochondrial quality and aggravates dietary-induced obesity and metabolic syndrome. Autophagy. 2019;15:1882-1898. [PubMed] [DOI] |
| 44. | Yadav H, Quijano C, Kamaraju AK, Gavrilova O, Malek R, Chen W, Zerfas P, Zhigang D, Wright EC, Stuelten C, Sun P, Lonning S, Skarulis M, Sumner AE, Finkel T, Rane SG. Protection from obesity and diabetes by blockade of TGF-β/Smad3 signaling. Cell Metab. 2011;14:67-79. [PubMed] [DOI] |
| 45. | Reyad-Ul-Ferdous M, Song Y. Baicalein modulates mitochondrial function by upregulating mitochondrial uncoupling protein-1 (UCP1) expression in brown adipocytes, cytotoxicity, and computational studies. Int J Biol Macromol. 2022;222:1963-1973. [PubMed] [DOI] |
| 46. | Chen P, Yao L, Yuan M, Wang Z, Zhang Q, Jiang Y, Li L. Mitochondrial dysfunction: A promising therapeutic target for liver diseases. Genes Dis. 2024;11:101115. [PubMed] [DOI] |
| 47. | Kujoth GC, Hiona A, Pugh TD, Someya S, Panzer K, Wohlgemuth SE, Hofer T, Seo AY, Sullivan R, Jobling WA, Morrow JD, Van Remmen H, Sedivy JM, Yamasoba T, Tanokura M, Weindruch R, Leeuwenburgh C, Prolla TA. Mitochondrial DNA mutations, oxidative stress, and apoptosis in mammalian aging. Science. 2005;309:481-484. [PubMed] [DOI] |
| 48. | Prieto I, Monsalve M. ROS homeostasis, a key determinant in liver ischemic-preconditioning. Redox Biol. 2017;12:1020-1025. [PubMed] [DOI] |
| 49. | Nissanka N, Moraes CT. Mitochondrial DNA damage and reactive oxygen species in neurodegenerative disease. FEBS Lett. 2018;592:728-742. [PubMed] [DOI] |
| 50. | Wallace DC. Mitochondrial DNA variation in human radiation and disease. Cell. 2015;163:33-38. [PubMed] [DOI] |
| 51. | Sookoian S, Flichman D, Scian R, Rohr C, Dopazo H, Gianotti TF, Martino JS, Castaño GO, Pirola CJ. Mitochondrial genome architecture in non-alcoholic fatty liver disease. J Pathol. 2016;240:437-449. [PubMed] [DOI] |
| 52. | Lang BF, Gray MW, Burger G. Mitochondrial genome evolution and the origin of eukaryotes. Annu Rev Genet. 1999;33:351-397. [PubMed] [DOI] |
| 53. | Oka S, Leon J, Sakumi K, Abolhassani N, Sheng Z, Tsuchimoto D, LaFerla FM, Nakabeppu Y. MTH1 and OGG1 maintain a low level of 8-oxoguanine in Alzheimer's brain, and prevent the progression of Alzheimer's pathogenesis. Sci Rep. 2021;11:5819. [PubMed] [DOI] |
| 54. | Komakula SSB, Tumova J, Kumaraswamy D, Burchat N, Vartanian V, Ye H, Dobrzyn A, Lloyd RS, Sampath H. The DNA Repair Protein OGG1 Protects Against Obesity by Altering Mitochondrial Energetics in White Adipose Tissue. Sci Rep. 2018;8:14886. [PubMed] [DOI] |
| 55. | Nesci S, Spagnoletta A, Oppedisano F. Inflammation, Mitochondria and Natural Compounds Together in the Circle of Trust. Int J Mol Sci. 2023;24. [PubMed] [DOI] |
| 56. | Chen G, Broséus J, Hergalant S, Donnart A, Chevalier C, Bolaños-Jiménez F, Guéant JL, Houlgatte R. Identification of master genes involved in liver key functions through transcriptomics and epigenomics of methyl donor deficiency in rat: relevance to nonalcoholic liver disease. Mol Nutr Food Res. 2015;59:293-302. [PubMed] [DOI] |
| 57. | Carabelli J, Burgueño AL, Rosselli MS, Gianotti TF, Lago NR, Pirola CJ, Sookoian S. High fat diet-induced liver steatosis promotes an increase in liver mitochondrial biogenesis in response to hypoxia. J Cell Mol Med. 2011;15:1329-1338. [PubMed] [DOI] |
| 58. | James SJ, Melnyk S, Pogribna M, Pogribny IP, Caudill MA. Elevation in S-adenosylhomocysteine and DNA hypomethylation: potential epigenetic mechanism for homocysteine-related pathology. J Nutr. 2002;132:2361S-2366S. [PubMed] [DOI] |
| 59. | Shock LS, Thakkar PV, Peterson EJ, Moran RG, Taylor SM. DNA methyltransferase 1, cytosine methylation, and cytosine hydroxymethylation in mammalian mitochondria. Proc Natl Acad Sci USA. 2011;108:3630-3635. [PubMed] [DOI] |
| 60. | Scarpulla RC. Transcriptional activators and coactivators in the nuclear control of mitochondrial function in mammalian cells. Gene. 2002;286:81-89. [PubMed] [DOI] |
| 61. | Infantino V, Castegna A, Iacobazzi F, Spera I, Scala I, Andria G, Iacobazzi V. Impairment of methyl cycle affects mitochondrial methyl availability and glutathione level in Down's syndrome. Mol Genet Metab. 2011;102:378-382. [PubMed] [DOI] |
| 62. | Gavrilova O, Haluzik M, Matsusue K, Cutson JJ, Johnson L, Dietz KR, Nicol CJ, Vinson C, Gonzalez FJ, Reitman ML. Liver peroxisome proliferator-activated receptor gamma contributes to hepatic steatosis, triglyceride clearance, and regulation of body fat mass. J Biol Chem. 2003;278:34268-34276. [PubMed] [DOI] |
| 63. | Sookoian S, Rosselli MS, Gemma C, Burgueño AL, Fernández Gianotti T, Castaño GO, Pirola CJ. Epigenetic regulation of insulin resistance in nonalcoholic fatty liver disease: impact of liver methylation of the peroxisome proliferator-activated receptor γ coactivator 1α promoter. Hepatology. 2010;52:1992-2000. [PubMed] [DOI] |
| 64. | McArthur K, Whitehead LW, Heddleston JM, Li L, Padman BS, Oorschot V, Geoghegan ND, Chappaz S, Davidson S, San Chin H, Lane RM, Dramicanin M, Saunders TL, Sugiana C, Lessene R, Osellame LD, Chew TL, Dewson G, Lazarou M, Ramm G, Lessene G, Ryan MT, Rogers KL, van Delft MF, Kile BT. BAK/BAX macropores facilitate mitochondrial herniation and mtDNA efflux during apoptosis. Science. 2018;359. [PubMed] [DOI] |
| 65. | Kim J, Gupta R, Blanco LP, Yang S, Shteinfer-Kuzmine A, Wang K, Zhu J, Yoon HE, Wang X, Kerkhofs M, Kang H, Brown AL, Park SJ, Xu X, Zandee van Rilland E, Kim MK, Cohen JI, Kaplan MJ, Shoshan-Barmatz V, Chung JH. VDAC oligomers form mitochondrial pores to release mtDNA fragments and promote lupus-like disease. Science. 2019;366:1531-1536. [PubMed] [DOI] |
| 66. | García N, Chávez E. Mitochondrial DNA fragments released through the permeability transition pore correspond to specific gene size. Life Sci. 2007;81:1160-1166. [PubMed] [DOI] |
| 67. | Wang LQ, Liu T, Yang S, Sun L, Zhao ZY, Li LY, She YC, Zheng YY, Ye XY, Bao Q, Dong GH, Li CW, Cui J. Perfluoroalkyl substance pollutants activate the innate immune system through the AIM2 inflammasome. Nat Commun. 2021;12:2915. [PubMed] [DOI] |
| 68. | De Gaetano A, Solodka K, Zanini G, Selleri V, Mattioli AV, Nasi M, Pinti M. Molecular Mechanisms of mtDNA-Mediated Inflammation. Cells. 2021;10. [PubMed] [DOI] |
| 69. | Riley JS, Tait SW. Mitochondrial DNA in inflammation and immunity. EMBO Rep. 2020;21:e49799. [PubMed] [DOI] |
| 70. | Kerur N, Fukuda S, Banerjee D, Kim Y, Fu D, Apicella I, Varshney A, Yasuma R, Fowler BJ, Baghdasaryan E, Marion KM, Huang X, Yasuma T, Hirano Y, Serbulea V, Ambati M, Ambati VL, Kajiwara Y, Ambati K, Hirahara S, Bastos-Carvalho A, Ogura Y, Terasaki H, Oshika T, Kim KB, Hinton DR, Leitinger N, Cambier JC, Buxbaum JD, Kenney MC, Jazwinski SM, Nagai H, Hara I, West AP, Fitzgerald KA, Sadda SR, Gelfand BD, Ambati J. cGAS drives noncanonical-inflammasome activation in age-related macular degeneration. Nat Med. 2018;24:50-61. [PubMed] [DOI] |
| 71. | Man SM, Kanneganti TD. Converging roles of caspases in inflammasome activation, cell death and innate immunity. Nat Rev Immunol. 2016;16:7-21. [PubMed] [DOI] |
| 72. | Wu KKL, Long K, Lin H, Siu PMF, Hoo RLC, Ye D, Xu A, Cheng KKY. The APPL1-Rab5 axis restricts NLRP3 inflammasome activation through early endosomal-dependent mitophagy in macrophages. Nat Commun. 2021;12:6637. [PubMed] [DOI] |
| 73. | Lei Y, Guerra Martinez C, Torres-Odio S, Bell SL, Birdwell CE, Bryant JD, Tong CW, Watson RO, West LC, West AP. Elevated type I interferon responses potentiate metabolic dysfunction, inflammation, and accelerated aging in mtDNA mutator mice. Sci Adv. 2021;7. [PubMed] [DOI] |
| 74. | Jing R, Hu ZK, Lin F, He S, Zhang SS, Ge WY, Dai HJ, Du XK, Lin JY, Pan LH. Mitophagy-Mediated mtDNA Release Aggravates Stretching-Induced Inflammation and Lung Epithelial Cell Injury via the TLR9/MyD88/NF-κB Pathway. Front Cell Dev Biol. 2020;8:819. [PubMed] [DOI] |
| 75. | Hua KF, Chou JC, Ka SM, Tasi YL, Chen A, Wu SH, Chiu HW, Wong WT, Wang YF, Tsai CL, Ho CL, Lin CH. Cyclooxygenase-2 regulates NLRP3 inflammasome-derived IL-1β production. J Cell Physiol. 2015;230:863-874. [PubMed] [DOI] |
| 76. | Swanson KV, Deng M, Ting JP. The NLRP3 inflammasome: molecular activation and regulation to therapeutics. Nat Rev Immunol. 2019;19:477-489. [PubMed] [DOI] |
| 77. | Wei MC, Zong WX, Cheng EH, Lindsten T, Panoutsakopoulou V, Ross AJ, Roth KA, MacGregor GR, Thompson CB, Korsmeyer SJ. Proapoptotic BAX and BAK: a requisite gateway to mitochondrial dysfunction and death. Science. 2001;292:727-730. [PubMed] [DOI] |
| 78. | Cosentino K, García-Sáez AJ. Bax and Bak Pores: Are We Closing the Circle? Trends Cell Biol. 2017;27:266-275. [PubMed] [DOI] |
| 79. | Rongvaux A, Jackson R, Harman CC, Li T, West AP, de Zoete MR, Wu Y, Yordy B, Lakhani SA, Kuan CY, Taniguchi T, Shadel GS, Chen ZJ, Iwasaki A, Flavell RA. Apoptotic caspases prevent the induction of type I interferons by mitochondrial DNA. Cell. 2014;159:1563-1577. [PubMed] [DOI] |
| 80. | White MJ, McArthur K, Metcalf D, Lane RM, Cambier JC, Herold MJ, van Delft MF, Bedoui S, Lessene G, Ritchie ME, Huang DC, Kile BT. Apoptotic caspases suppress mtDNA-induced STING-mediated type I IFN production. Cell. 2014;159:1549-1562. [PubMed] [DOI] |
| 81. | Giampazolias E, Zunino B, Dhayade S, Bock F, Cloix C, Cao K, Roca A, Lopez J, Ichim G, Proïcs E, Rubio-Patiño C, Fort L, Yatim N, Woodham E, Orozco S, Taraborrelli L, Peltzer N, Lecis D, Machesky L, Walczak H, Albert ML, Milling S, Oberst A, Ricci JE, Ryan KM, Blyth K, Tait SWG. Mitochondrial permeabilization engages NF-κB-dependent anti-tumour activity under caspase deficiency. Nat Cell Biol. 2017;19:1116-1129. [PubMed] [DOI] |
| 82. | Wree A, Marra F. The inflammasome in liver disease. J Hepatol. 2016;65:1055-1056. [PubMed] [DOI] |
| 83. | Newman LE, Shadel GS. Mitochondrial DNA Release in Innate Immune Signaling. Annu Rev Biochem. 2023;92:299-332. [PubMed] [DOI] |
| 84. | Martel C, Allouche M, Esposti DD, Fanelli E, Boursier C, Henry C, Chopineau J, Calamita G, Kroemer G, Lemoine A, Brenner C. Glycogen synthase kinase 3-mediated voltage-dependent anion channel phosphorylation controls outer mitochondrial membrane permeability during lipid accumulation. Hepatology. 2013;57:93-102. [PubMed] [DOI] |
| 85. | Tong J, Lan XT, Zhang Z, Liu Y, Sun DY, Wang XJ, Ou-Yang SX, Zhuang CL, Shen FM, Wang P, Li DJ. Ferroptosis inhibitor liproxstatin-1 alleviates metabolic dysfunction-associated fatty liver disease in mice: potential involvement of PANoptosis. Acta Pharmacol Sin. 2023;44:1014-1028. [PubMed] [DOI] |
| 86. | Nasiri-Ansari N, Nikolopoulou C, Papoutsi K, Kyrou I, Mantzoros CS, Kyriakopoulos G, Chatzigeorgiou A, Kalotychou V, Randeva MS, Chatha K, Kontzoglou K, Kaltsas G, Papavassiliou AG, Randeva HS, Kassi E. Empagliflozin Attenuates Non-Alcoholic Fatty Liver Disease (NAFLD) in High Fat Diet Fed ApoE((-/-)) Mice by Activating Autophagy and Reducing ER Stress and Apoptosis. Int J Mol Sci. 2021;22. [PubMed] [DOI] |
| 87. | Xian H, Watari K, Sanchez-Lopez E, Offenberger J, Onyuru J, Sampath H, Ying W, Hoffman HM, Shadel GS, Karin M. Oxidized DNA fragments exit mitochondria via mPTP- and VDAC-dependent channels to activate NLRP3 inflammasome and interferon signaling. Immunity. 2022;55:1370-1385.e8. [PubMed] [DOI] |
| 88. | Izzo V, Bravo-San Pedro JM, Sica V, Kroemer G, Galluzzi L. Mitochondrial Permeability Transition: New Findings and Persisting Uncertainties. Trends Cell Biol. 2016;26:655-667. [PubMed] [DOI] |
| 89. | Nesci S. The mitochondrial permeability transition pore in cell death: A promising drug binding bioarchitecture. Med Res Rev. 2020;40:811-817. [PubMed] [DOI] |
| 90. | Gonçalves IO, Passos E, Diogo CV, Rocha-Rodrigues S, Santos-Alves E, Oliveira PJ, Ascensão A, Magalhães J. Exercise mitigates mitochondrial permeability transition pore and quality control mechanisms alterations in nonalcoholic steatohepatitis. Appl Physiol Nutr Metab. 2016;41:298-306. [PubMed] [DOI] |
| 91. | Teodoro JS, Rolo AP, Duarte FV, Simões AM, Palmeira CM. Differential alterations in mitochondrial function induced by a choline-deficient diet: understanding fatty liver disease progression. Mitochondrion. 2008;8:367-376. [PubMed] [DOI] |
| 92. | Riley JS, Quarato G, Cloix C, Lopez J, O'Prey J, Pearson M, Chapman J, Sesaki H, Carlin LM, Passos JF, Wheeler AP, Oberst A, Ryan KM, Tait SW. Mitochondrial inner membrane permeabilisation enables mtDNA release during apoptosis. EMBO J. 2018;37. [PubMed] [DOI] |
| 93. | Shum M, Ngo J, Shirihai OS, Liesa M. Mitochondrial oxidative function in NAFLD: Friend or foe? Mol Metab. 2021;50:101134. [PubMed] [DOI] |
| 94. | Arruda AP, Pers BM, Parlakgül G, Güney E, Inouye K, Hotamisligil GS. Chronic enrichment of hepatic endoplasmic reticulum-mitochondria contact leads to mitochondrial dysfunction in obesity. Nat Med. 2014;20:1427-1435. [PubMed] [DOI] |
| 95. | Hernansanz-Agustín P, Choya-Foces C, Carregal-Romero S, Ramos E, Oliva T, Villa-Piña T, Moreno L, Izquierdo-Álvarez A, Cabrera-García JD, Cortés A, Lechuga-Vieco AV, Jadiya P, Navarro E, Parada E, Palomino-Antolín A, Tello D, Acín-Pérez R, Rodríguez-Aguilera JC, Navas P, Cogolludo Á, López-Montero I, Martínez-Del-Pozo Á, Egea J, López MG, Elrod JW, Ruíz-Cabello J, Bogdanova A, Enríquez JA, Martínez-Ruiz A. Na(+) controls hypoxic signalling by the mitochondrial respiratory chain. Nature. 2020;586:287-291. [PubMed] [DOI] |
| 96. | Malhi H. Emerging role of extracellular vesicles in liver diseases. Am J Physiol Gastrointest Liver Physiol. 2019;317:G739-G749. [PubMed] [DOI] |
| 97. | Eguchi A, Lazaro RG, Wang J, Kim J, Povero D, Willliams B, Ho SB, Stärkel P, Schnabl B, Ohno-Machado L, Tsukamoto H, Feldstein AE. Extracellular vesicles released by hepatocytes from gastric infusion model of alcoholic liver disease contain a MicroRNA barcode that can be detected in blood. Hepatology. 2017;65:475-490. [PubMed] [DOI] |
| 98. | Povero D, Eguchi A, Li H, Johnson CD, Papouchado BG, Wree A, Messer K, Feldstein AE. Circulating extracellular vesicles with specific proteome and liver microRNAs are potential biomarkers for liver injury in experimental fatty liver disease. PLoS One. 2014;9:e113651. [PubMed] [DOI] |
| 99. | Garcia-Martinez I, Santoro N, Chen Y, Hoque R, Ouyang X, Caprio S, Shlomchik MJ, Coffman RL, Candia A, Mehal WZ. Hepatocyte mitochondrial DNA drives nonalcoholic steatohepatitis by activation of TLR9. J Clin Invest. 2016;126:859-864. [PubMed] [DOI] |
| 100. | Sasai M, Linehan MM, Iwasaki A. Bifurcation of Toll-like receptor 9 signaling by adaptor protein 3. Science. 2010;329:1530-1534. [PubMed] [DOI] |
| 101. | Gao Y, Wang Y, Liu H, Liu Z, Zhao J. Mitochondrial DNA from hepatocytes induces upregulation of interleukin-33 expression of macrophages in nonalcoholic steatohepatitis. Dig Liver Dis. 2020;52:637-643. [PubMed] [DOI] |
| 102. | Inzaugarat ME, Wree A, Feldstein AE. Hepatocyte mitochondrial DNA released in microparticles and toll-like receptor 9 activation: A link between lipotoxicity and inflammation during nonalcoholic steatohepatitis. Hepatology. 2016;64:669-671. [PubMed] [DOI] |
| 103. | Hirsova P, Ibrahim SH, Krishnan A, Verma VK, Bronk SF, Werneburg NW, Charlton MR, Shah VH, Malhi H, Gores GJ. Lipid-Induced Signaling Causes Release of Inflammatory Extracellular Vesicles From Hepatocytes. Gastroenterology. 2016;150:956-967. [PubMed] [DOI] |
| 104. | Povero D, Eguchi A, Niesman IR, Andronikou N, de Mollerat du Jeu X, Mulya A, Berk M, Lazic M, Thapaliya S, Parola M, Patel HH, Feldstein AE. Lipid-induced toxicity stimulates hepatocytes to release angiogenic microparticles that require Vanin-1 for uptake by endothelial cells. Sci Signal. 2013;6:ra88. [PubMed] [DOI] |
| 105. | Kakazu E, Mauer AS, Yin M, Malhi H. Hepatocytes release ceramide-enriched pro-inflammatory extracellular vesicles in an IRE1α-dependent manner. J Lipid Res. 2016;57:233-245. [PubMed] [DOI] |
| 106. | Ibrahim SH, Hirsova P, Tomita K, Bronk SF, Werneburg NW, Harrison SA, Goodfellow VS, Malhi H, Gores GJ. Mixed lineage kinase 3 mediates release of C-X-C motif ligand 10-bearing chemotactic extracellular vesicles from lipotoxic hepatocytes. Hepatology. 2016;63:731-744. [PubMed] [DOI] |
| 107. | Cannito S, Morello E, Bocca C, Foglia B, Benetti E, Novo E, Chiazza F, Rogazzo M, Fantozzi R, Povero D, Sutti S, Bugianesi E, Feldstein AE, Albano E, Collino M, Parola M. Microvesicles released from fat-laden cells promote activation of hepatocellular NLRP3 inflammasome: A pro-inflammatory link between lipotoxicity and non-alcoholic steatohepatitis. PLoS One. 2017;12:e0172575. [PubMed] [DOI] |
| 108. | Liu XL, Pan Q, Cao HX, Xin FZ, Zhao ZH, Yang RX, Zeng J, Zhou H, Fan JG. Lipotoxic Hepatocyte-Derived Exosomal MicroRNA 192-5p Activates Macrophages Through Rictor/Akt/Forkhead Box Transcription Factor O1 Signaling in Nonalcoholic Fatty Liver Disease. Hepatology. 2020;72:454-469. [PubMed] [DOI] |
| 109. | Tohme S, Yazdani HO, Al-Khafaji AB, Chidi AP, Loughran P, Mowen K, Wang Y, Simmons RL, Huang H, Tsung A. Neutrophil Extracellular Traps Promote the Development and Progression of Liver Metastases after Surgical Stress. Cancer Res. 2016;76:1367-1380. [PubMed] [DOI] |
| 110. | Hu Q, Ren H, Li G, Wang D, Zhou Q, Wu J, Zheng J, Huang J, Slade DA, Wu X, Ren J. STING-mediated intestinal barrier dysfunction contributes to lethal sepsis. EBioMedicine. 2019;41:497-508. [PubMed] [DOI] |
| 111. | Yang K, Gao R, Chen H, Hu J, Zhang P, Wei X, Shi J, Chen Y, Zhang L, Chen J, Lyu Y, Dong Z, Wei W, Hu K, Guo Y, Ge J, Sun A. Myocardial reperfusion injury exacerbation due to ALDH2 deficiency is mediated by neutrophil extracellular traps and prevented by leukotriene C4 inhibition. Eur Heart J. 2024;45:1662-1680. [PubMed] [DOI] |
| 112. | Cristinziano L, Modestino L, Antonelli A, Marone G, Simon HU, Varricchi G, Galdiero MR. Neutrophil extracellular traps in cancer. Semin Cancer Biol. 2022;79:91-104. [PubMed] [DOI] |
| 113. | Takei H, Araki A, Watanabe H, Ichinose A, Sendo F. Rapid killing of human neutrophils by the potent activator phorbol 12-myristate 13-acetate (PMA) accompanied by changes different from typical apoptosis or necrosis. J Leukoc Biol. 1996;59:229-240. [PubMed] [DOI] |
| 114. | Paget C, Doz-Deblauwe E, Winter N, Briard B. Specific NLRP3 Inflammasome Assembling and Regulation in Neutrophils: Relevance in Inflammatory and Infectious Diseases. Cells. 2022;11. [PubMed] [DOI] |
| 115. | Denning NL, Aziz M, Gurien SD, Wang P. DAMPs and NETs in Sepsis. Front Immunol. 2019;10:2536. [PubMed] [DOI] |
| 116. | Bhagirath VC, Dwivedi DJ, Liaw PC. Comparison of the Proinflammatory and Procoagulant Properties of Nuclear, Mitochondrial, and Bacterial DNA. Shock. 2015;44:265-271. [PubMed] [DOI] |
| 117. | Kaikkonen JE, Kresanov P, Ahotupa M, Jula A, Mikkilä V, Viikari JS, Juonala M, Hutri-Kähönen N, Kähönen M, Lehtimäki T, Kangas AJ, Soininen P, Ala-Korpela M, Raitakari OT. Longitudinal study of circulating oxidized LDL and HDL and fatty liver: the Cardiovascular Risk in Young Finns Study. Free Radic Res. 2016;50:396-404. [PubMed] [DOI] |
| 118. | Ho CM, Ho SL, Jeng YM, Lai YS, Chen YH, Lu SC, Chen HL, Chang PY, Hu RH, Lee PH. Accumulation of free cholesterol and oxidized low-density lipoprotein is associated with portal inflammation and fibrosis in nonalcoholic fatty liver disease. J Inflamm (Lond). 2019;16:7. [PubMed] [DOI] |
| 119. | Gouwy M, Ruytinx P, Radice E, Claudi F, Van Raemdonck K, Bonecchi R, Locati M, Struyf S. CXCL4 and CXCL4L1 Differentially Affect Monocyte Survival and Dendritic Cell Differentiation and Phagocytosis. PLoS One. 2016;11:e0166006. [PubMed] [DOI] |
| 120. | Ruytinx P, Proost P, Van Damme J, Struyf S. Chemokine-Induced Macrophage Polarization in Inflammatory Conditions. Front Immunol. 2018;9:1930. [PubMed] [DOI] |
| 121. | Maretti-Mira AC, Golden-Mason L, Salomon MP, Kaplan MJ, Rosen HR. Cholesterol-Induced M4-Like Macrophages Recruit Neutrophils and Induce NETosis. Front Immunol. 2021;12:671073. [PubMed] [DOI] |
| 122. | Gao J, Liu J, Lu J, Zhang X, Zhang W, Li Q, Cai J, Li M, Gan Y, Tang Y, Wu S. SKAP1 Expression in Cancer Cells Enhances Colon Tumor Growth and Impairs Cytotoxic Immunity by Promoting Neutrophil Extracellular Trap Formation via the NFATc1/CXCL8 Axis. Adv Sci (Weinh). 2024;11:e2403430. [PubMed] [DOI] |
| 123. | Zhao X, Yang L, Chang N, Hou L, Zhou X, Yang L, Li L. Neutrophils undergo switch of apoptosis to NETosis during murine fatty liver injury via S1P receptor 2 signaling. Cell Death Dis. 2020;11:379. [PubMed] [DOI] |
| 124. | van der Windt DJ, Sud V, Zhang H, Varley PR, Goswami J, Yazdani HO, Tohme S, Loughran P, O'Doherty RM, Minervini MI, Huang H, Simmons RL, Tsung A. Neutrophil extracellular traps promote inflammation and development of hepatocellular carcinoma in nonalcoholic steatohepatitis. Hepatology. 2018;68:1347-1360. [PubMed] [DOI] |
| 125. | Heijink AM, Talens F, Jae LT, van Gijn SE, Fehrmann RSN, Brummelkamp TR, van Vugt MATM. BRCA2 deficiency instigates cGAS-mediated inflammatory signaling and confers sensitivity to tumor necrosis factor-alpha-mediated cytotoxicity. Nat Commun. 2019;10:100. [PubMed] [DOI] |
| 126. | Glück S, Guey B, Gulen MF, Wolter K, Kang TW, Schmacke NA, Bridgeman A, Rehwinkel J, Zender L, Ablasser A. Innate immune sensing of cytosolic chromatin fragments through cGAS promotes senescence. Nat Cell Biol. 2017;19:1061-1070. [PubMed] [DOI] |
| 127. | West AP, Khoury-Hanold W, Staron M, Tal MC, Pineda CM, Lang SM, Bestwick M, Duguay BA, Raimundo N, MacDuff DA, Kaech SM, Smiley JR, Means RE, Iwasaki A, Shadel GS. Mitochondrial DNA stress primes the antiviral innate immune response. Nature. 2015;520:553-557. [PubMed] [DOI] |
| 128. | Barber GN. STING: infection, inflammation and cancer. Nat Rev Immunol. 2015;15:760-770. [PubMed] [DOI] |
| 129. | Khan S, Godfrey V, Zaki MH. Cytosolic Nucleic Acid Sensors in Inflammatory and Autoimmune Disorders. Int Rev Cell Mol Biol. 2019;344:215-253. [PubMed] [DOI] |
| 130. | Decout A, Katz JD, Venkatraman S, Ablasser A. The cGAS-STING pathway as a therapeutic target in inflammatory diseases. Nat Rev Immunol. 2021;21:548-569. [PubMed] [DOI] |
| 131. | Myint M, Oppedisano F, De Giorgi V, Kim BM, Marincola FM, Alter HJ, Nesci S. Inflammatory signaling in NASH driven by hepatocyte mitochondrial dysfunctions. J Transl Med. 2023;21:757. [PubMed] [DOI] |
| 132. | Ritchie C, Carozza JA, Li L. Biochemistry, Cell Biology, and Pathophysiology of the Innate Immune cGAS-cGAMP-STING Pathway. Annu Rev Biochem. 2022;91:599-628. [PubMed] [DOI] |
| 133. | Chen R, Du J, Zhu H, Ling Q. The role of cGAS-STING signalling in liver diseases. JHEP Rep. 2021;3:100324. [PubMed] [DOI] |
| 134. | Yuan L, Mao Y, Luo W, Wu W, Xu H, Wang XL, Shen YH. Palmitic acid dysregulates the Hippo-YAP pathway and inhibits angiogenesis by inducing mitochondrial damage and activating the cytosolic DNA sensor cGAS-STING-IRF3 signaling mechanism. J Biol Chem. 2017;292:15002-15015. [PubMed] [DOI] |
| 135. | Bai J, Cervantes C, He S, He J, Plasko GR, Wen J, Li Z, Yin D, Zhang C, Liu M, Dong LQ, Liu F. Mitochondrial stress-activated cGAS-STING pathway inhibits thermogenic program and contributes to overnutrition-induced obesity in mice. Commun Biol. 2020;3:257. [PubMed] [DOI] |
| 136. | Zhang Q, Wei J, Liu Z, Huang X, Sun M, Lai W, Chen Z, Wu J, Chen Y, Guo X, Huang Q. STING signaling sensing of DRP1-dependent mtDNA release in kupffer cells contributes to lipopolysaccharide-induced liver injury in mice. Redox Biol. 2022;54:102367. [PubMed] [DOI] |
| 137. | Zhang Z, Zhang Y, Xia S, Kong Q, Li S, Liu X, Junqueira C, Meza-Sosa KF, Mok TMY, Ansara J, Sengupta S, Yao Y, Wu H, Lieberman J. Gasdermin E suppresses tumour growth by activating anti-tumour immunity. Nature. 2020;579:415-420. [PubMed] [DOI] |
| 138. | Carter JK, Friedman SL. Hepatic Stellate Cell-Immune Interactions in NASH. Front Endocrinol (Lausanne). 2022;13:867940. [PubMed] [DOI] |
| 139. | Verrier ER, Yim SA, Heydmann L, El Saghire H, Bach C, Turon-Lagot V, Mailly L, Durand SC, Lucifora J, Durantel D, Pessaux P, Manel N, Hirsch I, Zeisel MB, Pochet N, Schuster C, Baumert TF. Hepatitis B Virus Evasion From Cyclic Guanosine Monophosphate-Adenosine Monophosphate Synthase Sensing in Human Hepatocytes. Hepatology. 2018;68:1695-1709. [PubMed] [DOI] |
| 140. | Luo X, Li H, Ma L, Zhou J, Guo X, Woo SL, Pei Y, Knight LR, Deveau M, Chen Y, Qian X, Xiao X, Li Q, Chen X, Huo Y, McDaniel K, Francis H, Glaser S, Meng F, Alpini G, Wu C. Expression of STING Is Increased in Liver Tissues From Patients With NAFLD and Promotes Macrophage-Mediated Hepatic Inflammation and Fibrosis in Mice. Gastroenterology. 2018;155:1971-1984.e4. [PubMed] [DOI] |
| 141. | Du S, Chen G, Yuan B, Hu Y, Yang P, Chen Y, Zhao Q, Zhou J, Fan J, Zeng Z. DNA sensing and associated type 1 interferon signaling contributes to progression of radiation-induced liver injury. Cell Mol Immunol. 2021;18:1718-1728. [PubMed] [DOI] |
| 142. | Lei Z, Deng M, Yi Z, Sun Q, Shapiro RA, Xu H, Li T, Loughran PA, Griepentrog JE, Huang H, Scott MJ, Huang F, Billiar TR. cGAS-mediated autophagy protects the liver from ischemia-reperfusion injury independently of STING. Am J Physiol Gastrointest Liver Physiol. 2018;314:G655-G667. [PubMed] [DOI] |
| 143. | Gui X, Yang H, Li T, Tan X, Shi P, Li M, Du F, Chen ZJ. Autophagy induction via STING trafficking is a primordial function of the cGAS pathway. Nature. 2019;567:262-266. [PubMed] [DOI] |
| 144. | Konno H, Konno K, Barber GN. Cyclic dinucleotides trigger ULK1 (ATG1) phosphorylation of STING to prevent sustained innate immune signaling. Cell. 2013;155:688-698. [PubMed] [DOI] |
| 145. | Prabakaran T, Bodda C, Krapp C, Zhang BC, Christensen MH, Sun C, Reinert L, Cai Y, Jensen SB, Skouboe MK, Nyengaard JR, Thompson CB, Lebbink RJ, Sen GC, van Loo G, Nielsen R, Komatsu M, Nejsum LN, Jakobsen MR, Gyrd-Hansen M, Paludan SR. Attenuation of cGAS-STING signaling is mediated by a p62/SQSTM1-dependent autophagy pathway activated by TBK1. EMBO J. 2018;37. [PubMed] [DOI] |
| 146. | Liu D, Wu H, Wang C, Li Y, Tian H, Siraj S, Sehgal SA, Wang X, Wang J, Shang Y, Jiang Z, Liu L, Chen Q. STING directly activates autophagy to tune the innate immune response. Cell Death Differ. 2019;26:1735-1749. [PubMed] [DOI] |
| 147. | Saber MM, Monir N, Awad AS, Elsherbiny ME, Zaki HF. TLR9: A friend or a foe. Life Sci. 2022;307:120874. [PubMed] [DOI] |
| 148. | Latz E, Schoenemeyer A, Visintin A, Fitzgerald KA, Monks BG, Knetter CF, Lien E, Nilsen NJ, Espevik T, Golenbock DT. TLR9 signals after translocating from the ER to CpG DNA in the lysosome. Nat Immunol. 2004;5:190-198. [PubMed] [DOI] |
| 149. | Wu HM, Shen QY, Fang L, Zhang SH, Shen PT, Liu YJ, Liu RY. JNK-TLR9 signal pathway mediates allergic airway inflammation through suppressing melatonin biosynthesis. J Pineal Res. 2016;60:415-423. [PubMed] [DOI] |
| 150. | Niu Z, Bao L, Chen J. Upregulation of TLR9 may contribute to activation of microglia and painful diabetic neuropathy via the p38 MAPK pathway in rats. Histol Histopathol. 2022;37:81-91. [PubMed] [DOI] |
| 151. | Heinz LX, Lee J, Kapoor U, Kartnig F, Sedlyarov V, Papakostas K, César-Razquin A, Essletzbichler P, Goldmann U, Stefanovic A, Bigenzahn JW, Scorzoni S, Pizzagalli MD, Bensimon A, Müller AC, King FJ, Li J, Girardi E, Mbow ML, Whitehurst CE, Rebsamen M, Superti-Furga G. TASL is the SLC15A4-associated adaptor for IRF5 activation by TLR7-9. Nature. 2020;581:316-322. [PubMed] [DOI] |
| 152. | Merquiol E, Uzi D, Mueller T, Goldenberg D, Nahmias Y, Xavier RJ, Tirosh B, Shibolet O. HCV causes chronic endoplasmic reticulum stress leading to adaptation and interference with the unfolded protein response. PLoS One. 2011;6:e24660. [PubMed] [DOI] |
| 153. | Kozlov AV, Duvigneau JC, Miller I, Nürnberger S, Gesslbauer B, Kungl A, Ohlinger W, Hartl RT, Gille L, Staniek K, Gregor W, Haindl S, Redl H. Endotoxin causes functional endoplasmic reticulum failure, possibly mediated by mitochondria. Biochim Biophys Acta. 2009;1792:521-530. [PubMed] [DOI] |
| 154. | Peralta C, Brenner C. Endoplasmic reticulum stress inhibition enhances liver tolerance to ischemia/reperfusion. Curr Med Chem. 2011;18:2016-2024. [PubMed] [DOI] |
| 155. | Liu J, Ren F, Cheng Q, Bai L, Shen X, Gao F, Busuttil RW, Kupiec-Weglinski JW, Zhai Y. Endoplasmic reticulum stress modulates liver inflammatory immune response in the pathogenesis of liver ischemia and reperfusion injury. Transplantation. 2012;94:211-217. [PubMed] [DOI] |
| 156. | Ben Mosbah I, Alfany-Fernández I, Martel C, Zaouali MA, Bintanel-Morcillo M, Rimola A, Rodés J, Brenner C, Roselló-Catafau J, Peralta C. Endoplasmic reticulum stress inhibition protects steatotic and non-steatotic livers in partial hepatectomy under ischemia-reperfusion. Cell Death Dis. 2010;1:e52. [PubMed] [DOI] |
| 157. | Miura K, Kodama Y, Inokuchi S, Schnabl B, Aoyama T, Ohnishi H, Olefsky JM, Brenner DA, Seki E. Toll-like receptor 9 promotes steatohepatitis by induction of interleukin-1beta in mice. Gastroenterology. 2010;139:323-34.e7. [PubMed] [DOI] |
| 158. | Su T, He Y, Wang M, Zhou H, Huang Y, Ye M, Guo Q, Xiao Y, Cai G, Zhao M, Wang J, Luo X. Macrophage-Hepatocyte Circuits Mediated by Grancalcin Aggravate the Progression of Metabolic Dysfunction Associated Steatohepatitis. Adv Sci (Weinh). 2024;11:e2406500. [PubMed] [DOI] |
| 159. | Arrese M, Cabrera D, Kalergis AM, Feldstein AE. Innate Immunity and Inflammation in NAFLD/NASH. Dig Dis Sci. 2016;61:1294-1303. [PubMed] [DOI] |
| 160. | Ganz M, Szabo G. Immune and inflammatory pathways in NASH. Hepatol Int. 2013;7 Suppl 2:771-781. [PubMed] [DOI] |
| 161. | Feingold KR, Moser A, Shigenaga JK, Grunfeld C. Inflammation inhibits the expression of phosphoenolpyruvate carboxykinase in liver and adipose tissue. Innate Immun. 2012;18:231-240. [PubMed] [DOI] |
| 162. | Bae JH, Jo SI, Kim SJ, Lee JM, Jeong JH, Kang JS, Cho NJ, Kim SS, Lee EY, Moon JS. Circulating Cell-Free mtDNA Contributes to AIM2 Inflammasome-Mediated Chronic Inflammation in Patients with Type 2 Diabetes. Cells. 2019;8. [PubMed] [DOI] |
| 163. | Cataño Cañizales YG, Uresti Rivera EE, García Jacobo RE, Portales Perez DP, Yadira B, Rodriguez Rivera JG, Amaro RG, Enciso Moreno JA, García Hernández MH. Increased Levels of AIM2 and Circulating Mitochondrial DNA in Type 2 Diabetes. Iran J Immunol. 2018;15:142-155. [PubMed] |
| 164. | Gu X, Wu G, Yao Y, Zeng J, Shi D, Lv T, Luo L, Song Y. Intratracheal administration of mitochondrial DNA directly provokes lung inflammation through the TLR9-p38 MAPK pathway. Free Radic Biol Med. 2015;83:149-158. [PubMed] [DOI] |
| 165. | Nishimoto S, Fukuda D, Higashikuni Y, Tanaka K, Hirata Y, Murata C, Kim-Kaneyama JR, Sato F, Bando M, Yagi S, Soeki T, Hayashi T, Imoto I, Sakaue H, Shimabukuro M, Sata M. Obesity-induced DNA released from adipocytes stimulates chronic adipose tissue inflammation and insulin resistance. Sci Adv. 2016;2:e1501332. [PubMed] [DOI] |
| 166. | Mridha AR, Haczeyni F, Yeh MM, Haigh WG, Ioannou GN, Barn V, Ajamieh H, Adams L, Hamdorf JM, Teoh NC, Farrell GC. TLR9 is up-regulated in human and murine NASH: pivotal role in inflammatory recruitment and cell survival. Clin Sci (Lond). 2017;131:2145-2159. [PubMed] [DOI] |
| 167. | Trujillo G, Meneghin A, Flaherty KR, Sholl LM, Myers JL, Kazerooni EA, Gross BH, Oak SR, Coelho AL, Evanoff H, Day E, Toews GB, Joshi AD, Schaller MA, Waters B, Jarai G, Westwick J, Kunkel SL, Martinez FJ, Hogaboam CM. TLR9 differentiates rapidly from slowly progressing forms of idiopathic pulmonary fibrosis. Sci Transl Med. 2010;2:57ra82. [PubMed] [DOI] |
| 168. | Revelo XS, Ghazarian M, Chng MH, Luck H, Kim JH, Zeng K, Shi SY, Tsai S, Lei H, Kenkel J, Liu CL, Tangsombatvisit S, Tsui H, Sima C, Xiao C, Shen L, Li X, Jin T, Lewis GF, Woo M, Utz PJ, Glogauer M, Engleman E, Winer S, Winer DA. Nucleic Acid-Targeting Pathways Promote Inflammation in Obesity-Related Insulin Resistance. Cell Rep. 2016;16:717-730. [PubMed] [DOI] |
| 169. | Takeuchi O, Akira S. Pattern recognition receptors and inflammation. Cell. 2010;140:805-820. [PubMed] [DOI] |
| 170. | Man SM, Karki R, Kanneganti TD. DNA-sensing inflammasomes: regulation of bacterial host defense and the gut microbiota. Pathog Dis. 2016;74:ftw028. [PubMed] [DOI] |
| 171. | Muruve DA, Pétrilli V, Zaiss AK, White LR, Clark SA, Ross PJ, Parks RJ, Tschopp J. The inflammasome recognizes cytosolic microbial and host DNA and triggers an innate immune response. Nature. 2008;452:103-107. [PubMed] [DOI] |
| 172. | Shimada K, Crother TR, Karlin J, Dagvadorj J, Chiba N, Chen S, Ramanujan VK, Wolf AJ, Vergnes L, Ojcius DM, Rentsendorj A, Vargas M, Guerrero C, Wang Y, Fitzgerald KA, Underhill DM, Town T, Arditi M. Oxidized mitochondrial DNA activates the NLRP3 inflammasome during apoptosis. Immunity. 2012;36:401-414. [PubMed] [DOI] |
| 173. | de Carvalho Ribeiro M, Szabo G. Role of the Inflammasome in Liver Disease. Annu Rev Pathol. 2022;17:345-365. [PubMed] [DOI] |
| 174. | Broz P, Dixit VM. Inflammasomes: mechanism of assembly, regulation and signalling. Nat Rev Immunol. 2016;16:407-420. [PubMed] [DOI] |
| 175. | Hornung V, Ablasser A, Charrel-Dennis M, Bauernfeind F, Horvath G, Caffrey DR, Latz E, Fitzgerald KA. AIM2 recognizes cytosolic dsDNA and forms a caspase-1-activating inflammasome with ASC. Nature. 2009;458:514-518. [PubMed] [DOI] |
| 176. | Ablasser A, Goldeck M, Cavlar T, Deimling T, Witte G, Röhl I, Hopfner KP, Ludwig J, Hornung V. cGAS produces a 2'-5'-linked cyclic dinucleotide second messenger that activates STING. Nature. 2013;498:380-384. [PubMed] [DOI] |
| 177. | Sun L, Wu J, Du F, Chen X, Chen ZJ. Cyclic GMP-AMP synthase is a cytosolic DNA sensor that activates the type I interferon pathway. Science. 2013;339:786-791. [PubMed] [DOI] |
| 178. | Wu J, Sun L, Chen X, Du F, Shi H, Chen C, Chen ZJ. Cyclic GMP-AMP is an endogenous second messenger in innate immune signaling by cytosolic DNA. Science. 2013;339:826-830. [PubMed] [DOI] |
| 179. | Nakahira K, Haspel JA, Rathinam VA, Lee SJ, Dolinay T, Lam HC, Englert JA, Rabinovitch M, Cernadas M, Kim HP, Fitzgerald KA, Ryter SW, Choi AM. Autophagy proteins regulate innate immune responses by inhibiting the release of mitochondrial DNA mediated by the NALP3 inflammasome. Nat Immunol. 2011;12:222-230. [PubMed] [DOI] |
| 180. | Qiu Y, Huang Y, Chen M, Yang Y, Li X, Zhang W. Mitochondrial DNA in NLRP3 inflammasome activation. Int Immunopharmacol. 2022;108:108719. [PubMed] [DOI] |
| 181. | Vandanmagsar B, Youm YH, Ravussin A, Galgani JE, Stadler K, Mynatt RL, Ravussin E, Stephens JM, Dixit VD. The NLRP3 inflammasome instigates obesity-induced inflammation and insulin resistance. Nat Med. 2011;17:179-188. [PubMed] [DOI] |
| 182. | Lamkanfi M, Dixit VM. Inflammasomes: guardians of cytosolic sanctity. Immunol Rev. 2009;227:95-105. [PubMed] [DOI] |
| 183. | Cani PD, Amar J, Iglesias MA, Poggi M, Knauf C, Bastelica D, Neyrinck AM, Fava F, Tuohy KM, Chabo C, Waget A, Delmée E, Cousin B, Sulpice T, Chamontin B, Ferrières J, Tanti JF, Gibson GR, Casteilla L, Delzenne NM, Alessi MC, Burcelin R. Metabolic endotoxemia initiates obesity and insulin resistance. Diabetes. 2007;56:1761-1772. [PubMed] [DOI] |
| 184. | Pan J, Ou Z, Cai C, Li P, Gong J, Ruan XZ, He K. Fatty acid activates NLRP3 inflammasomes in mouse Kupffer cells through mitochondrial DNA release. Cell Immunol. 2018;332:111-120. [PubMed] [DOI] |
| 185. | Csak T, Ganz M, Pespisa J, Kodys K, Dolganiuc A, Szabo G. Fatty acid and endotoxin activate inflammasomes in mouse hepatocytes that release danger signals to stimulate immune cells. Hepatology. 2011;54:133-144. [PubMed] [DOI] |
| 186. | Ren JD, Wu XB, Jiang R, Hao DP, Liu Y. Molecular hydrogen inhibits lipopolysaccharide-triggered NLRP3 inflammasome activation in macrophages by targeting the mitochondrial reactive oxygen species. Biochim Biophys Acta. 2016;1863:50-55. [PubMed] [DOI] |
| 187. | Jung SS, Moon JS, Xu JF, Ifedigbo E, Ryter SW, Choi AM, Nakahira K. Carbon monoxide negatively regulates NLRP3 inflammasome activation in macrophages. Am J Physiol Lung Cell Mol Physiol. 2015;308:L1058-L1067. [PubMed] [DOI] |
| 188. | Li S, Liang F, Kwan K, Tang Y, Wang X, Tang Y, Li J, Yang H, Chavan SS, Wang H, Andersson U, Lu B, Tracey KJ. Identification of ethyl pyruvate as a NLRP3 inflammasome inhibitor that preserves mitochondrial integrity. Mol Med. 2018;24:8. [PubMed] [DOI] |
| 189. | Liu X, Zhou W, Zhang X, Lu P, Du Q, Tao L, Ding Y, Wang Y, Hu R. Dimethyl fumarate ameliorates dextran sulfate sodium-induced murine experimental colitis by activating Nrf2 and suppressing NLRP3 inflammasome activation. Biochem Pharmacol. 2016;112:37-49. [PubMed] [DOI] |
| 190. | Xian H, Liu Y, Rundberg Nilsson A, Gatchalian R, Crother TR, Tourtellotte WG, Zhang Y, Aleman-Muench GR, Lewis G, Chen W, Kang S, Luevanos M, Trudler D, Lipton SA, Soroosh P, Teijaro J, de la Torre JC, Arditi M, Karin M, Sanchez-Lopez E. Metformin inhibition of mitochondrial ATP and DNA synthesis abrogates NLRP3 inflammasome activation and pulmonary inflammation. Immunity. 2021;54:1463-1477.e11. [PubMed] [DOI] |
| 191. | Wu S, Yang T, Ma M, Fan L, Ren L, Liu G, Wang Y, Cheng B, Xia J, Hao Z. Extracellular vesicles meet mitochondria: Potential roles in regenerative medicine. Pharmacol Res. 2024;206:107307. [PubMed] [DOI] |
| 192. | Segala A, Vezzoli M, Vetturi A, Garrafa E, Zanini B, Bottani E, Marullo M, Marconi S, Ricci C, Valerio A. A Mediterranean Diet-Oriented Intervention Rescues Impaired Blood Cell Bioenergetics in Patients with Metabolic Dysfunction-Associated Steatotic Liver Disease. Diagnostics (Basel). 2024;14. [PubMed] [DOI] |
| 193. | Kyriazis ID, Vassi E, Alvanou M, Angelakis C, Skaperda Z, Tekos F, Garikipati VNS, Spandidos DA, Kouretas D. The impact of diet upon mitochondrial physiology (Review). Int J Mol Med. 2022;50. [PubMed] [DOI] |
| 194. | Zanini B, Benini F, Marullo M, Simonetto A, Rossi A, Cavagnoli P, Bonalumi A, Marconi S, Pigozzi MG, Gilioli G, Valerio A, Donato F, Castellano M, Ricci C. Mediterranean-Oriented Dietary Intervention Is Effective to Reduce Liver Steatosis in Patients with Nonalcoholic Fatty Liver Disease: Results from an Italian Clinical Trial. Int J Clin Pract. 2024;2024:8861126. [PubMed] [DOI] |
| 195. | Garner TP, Amgalan D, Reyna DE, Li S, Kitsis RN, Gavathiotis E. Small-molecule allosteric inhibitors of BAX. Nat Chem Biol. 2019;15:322-330. [PubMed] [DOI] |
| 196. | Amgalan D, Garner TP, Pekson R, Jia XF, Yanamandala M, Paulino V, Liang FG, Corbalan JJ, Lee J, Chen Y, Karagiannis GS, Sanchez LR, Liang H, Narayanagari SR, Mitchell K, Lopez A, Margulets V, Scarlata M, Santulli G, Asnani A, Peterson RT, Hazan RB, Condeelis JS, Oktay MH, Steidl U, Kirshenbaum LA, Gavathiotis E, Kitsis RN. A small-molecule allosteric inhibitor of BAX protects against doxorubicin-induced cardiomyopathy. Nat Cancer. 2020;1:315-328. [PubMed] [DOI] |
| 197. | Baines CP, Kaiser RA, Sheiko T, Craigen WJ, Molkentin JD. Voltage-dependent anion channels are dispensable for mitochondrial-dependent cell death. Nat Cell Biol. 2007;9:550-555. [PubMed] [DOI] |
| 198. | Liu JC, Liu J, Holmström KM, Menazza S, Parks RJ, Fergusson MM, Yu ZX, Springer DA, Halsey C, Liu C, Murphy E, Finkel T. MICU1 Serves as a Molecular Gatekeeper to Prevent In Vivo Mitochondrial Calcium Overload. Cell Rep. 2016;16:1561-1573. [PubMed] [DOI] |
| 199. | Xu B, Jiang M, Chu Y, Wang W, Chen D, Li X, Zhang Z, Zhang D, Fan D, Nie Y, Shao F, Wu K, Liang J. Gasdermin D plays a key role as a pyroptosis executor of non-alcoholic steatohepatitis in humans and mice. J Hepatol. 2018;68:773-782. [PubMed] [DOI] |
| 200. | Li YJ, Liu RP, Ding MN, Zheng Q, Wu JZ, Xue XY, Gu YQ, Ma BN, Cai YJ, Li S, Lin S, Zhang LY, Li X. Tetramethylpyrazine prevents liver fibrotic injury in mice by targeting hepatocyte-derived and mitochondrial DNA-enriched extracellular vesicles. Acta Pharmacol Sin. 2022;43:2026-2041. [PubMed] [DOI] |
| 201. | Tinguely C, Paulméry M, Terrettaz C, Gonzalez D. Diurnal cycles drive rhythmic physiology and promote survival in facultative phototrophic bacteria. ISME Commun. 2023;3:125. [PubMed] [DOI] |
| 202. | Jiang C, Liu X, Yang Z, Li G. Chromosome Rearrangement in Elymus dahuricus Revealed by ND-FISH and Oligo-FISH Painting. Plants (Basel). 2023;12. [PubMed] [DOI] |
| 203. | Battaglini M, Marino A, Montorsi M, Carmignani A, Ceccarelli MC, Ciofani G. Nanomaterials as Microglia Modulators in the Treatment of Central Nervous System Disorders. Adv Healthc Mater. 2024;13:e2304180. [PubMed] [DOI] |
| 204. | Shevelev OB, Cherkasova OP, Razumov IA, Zavjalov EL. In vivo MRS study of long-term effects of traumatic intracranial injection of a culture medium in mice. Vavilovskii Zhurnal Genet Selektsii. 2023;27:633-640. [PubMed] [DOI] |
| 205. | Ferro-Flores G, Ancira-Cortez A, Ocampo-García B, Meléndez-Alafort L. Molecularly Targeted Lanthanide Nanoparticles for Cancer Theranostic Applications. Nanomaterials (Basel). 2024;14. [PubMed] [DOI] |