修回日期: 2023-11-08
接受日期: 2023-11-27
在线出版日期: 2023-12-08
越来越多的长非编码RNA与微小RNA被发现在肿瘤的发生和发展中表达量变化显著, 能够影响抑癌基因或者癌基因的表达, 在癌细胞的增殖、转移中发挥了重要的作用.
探究结肠癌组织长链非编码RNA母系印记基因3(LncRNA MEG3)、微小RNA(miR)-302b-3p表达与临床分期的相关性及对手术治疗预后的指导价值.
选取2017-01/2022-03金华市中医医院97例结肠癌患者, 观察比较不同组织LncRNA MEG3、miR-302b-3p表达, 分析LncRNA MEG3、miR-302b-3p表达与临床病理特征的相关性; 比较不同LncRNA MEG3、miR-302b-3p表达患者复发情况, 分析结肠癌术后复发影响因素, 并分析LncRNA MEG3、miR-302b-3p交互作用对结肠癌复发的影响, 评价LncRNA MEG3、miR-302b-3p表达对结肠癌术后复发的预测价值.
结肠癌组织LncRNA MEG3、miR-302b-3p表达均低于癌旁组织(P<0.05); 结肠癌组织LncRNA MEG3、miR-302b-3p表达与性别、年龄、肿瘤大小无关(P>0.05), 与分化程度、临床分期及淋巴结转移有关(P<0.05); 结肠癌组织中LncRNA MEG3、miR-302b-3p高表达组1年内复发率低于LncRNA MEG3、miR-302b-3p低表达组(P<0.05); 分化程度、临床分期、淋巴结转移均为结肠癌复发危险因素, 癌组织LncRNA MEG3、miR-302b-3p表达均为结肠癌复发保护因素(P<0.05); 交互作用分析显示, LncRNA MEG3、miR-302b-3p同时暴露的协同效应是LncRNA MEG3或miR-302b-3p单纯暴露产生效应的15.888倍, 且二者同时暴露时, 结肠癌复发风险中有56.98%归因于二者协同作用; LncRNA MEG3、miR-302b-3p预测结肠癌患者预后的曲线下面积(area under the curve, AUC)(95%CI)分别为0.720(0.620-0.807)、0.767(0.670-0.847), 二者联合预测AUC(95%CI)为0.892(0.813-0.946), 明显高于LncRNA MEG3、miR-302b-3p单独预测, 最佳敏感度及特异度分别为92.31%、83.33%.
结肠癌患者癌组织LncRNA MEG3、miR-302b-3p表达下调, 与临床分期有关, 临床检测其表达可用于明确肿瘤恶性程度、预测手术治疗预后, 为临床后续治疗方案调整提供参考依据.
核心提要: LncRNA MEG3与miR-302b-3p在结直肠癌中的协同表达与临床分期和手术治疗的预后有较强的关系, 为结直肠癌的进展诊断和预后干预提供新的指标.
引文著录: 孙兵, 岳世国. 结肠癌组织LncRNA MEG3、miR-302b-3p表达与临床分期的相关性及对手术治疗预后的指导价值探究. 世界华人消化杂志 2023; 31(23): 981-988
Revised: November 8, 2023
Accepted: November 27, 2023
Published online: December 8, 2023
More and more long non-coding RNAs and microRNAs have been found to have significant changes in expression levels during the occurrence and development of tumors, which can affect the expression of tumor suppressor genes or oncogenes and play an important role in the proliferation and metastasis of cancer cells.
To investigate the correlation between the expression of long non-coding RNA maternal imprinted gene 3 (LncRNA MEG3) and microRNA (miR)-302b-3p in colon cancer and clinical stage and analyze their value in predicting the prognosis after surgical treatment.
A total of 97 patients with colon cancer treated at Jinhua Hospital of TCM from January 2017 to March 2022 were selected to compare the expression of LncRNA MEG3 and miR-302b-3p in different tissues, analyze the correlation between the expression of LncRNA MEG3 and miR-302b-3p and clinical pathological characteristics, compare the recurrence in patients with different LncRNA MEG3 and miR-302b-3p expression, analyze the factors affecting the recurrence of colon cancer after surgery, and analyze the impact of the interaction between LncRNA MEG3 and miR-302b-3p on the recurrence of colon cancer. The predictive value of LncRNA MEG3 and miR-302b-3p expression for the recurrence of colon cancer after surgery was evaluated.
The expression of LncRNA MEG3 and miR-302b-3p in colon cancer tissues was lower than that in tumor-adjacent tissues (P < 0.05). The expression of LncRNA MEG3 and miR-302b-3p in colon cancer tissues was not correlated with sex, age, or tumor size (P > 0.05), but was correlated with tumor differentiation, clinical stage, and lymph node metastasis (P < 0.05). In colon cancer tissues, the recurrence rate in patients with high LncRNA MEG3 and miR-302b-3p expression was lower than that of patients with lower LncRNA MEG3 and miR-302b-3p expression (P < 0.05). Tumor differentiation degree, clinical stage, and lymph node metastasis were all identified to be risk factors for colon cancer recurrence, and LncRNA MEG3 and miR-302b-3p expression were protective factors for colon cancer recurrence (P < 0.05). The interaction analysis showed that the synergistic effect of simultaneous exposure to LncRNA MEG3 and miR-302b-3p was 15.888 times greater than the effect of exposure to either LncRNA MEG3 or miR-302b-3p alone, and when simultaneously exposing to both, 56.98% of the risk of colon cancer recurrence was attributed to their synergistic effect. The area under the curve (AUC) (95% confidence interval [CI]) of LncRNA MEG3 and miR-302b-3p in predicting the prognosis of colon cancer patients was 0.720 (0.620-0.807) and 0.767 (0.670-0.847), respectively, and that of the combined prediction was 0.892 (0.813-0.946), with a sensitivity and specificity of 92.31% and 83.33%, respectively, which were significantly higher than those of either LncRNA MEG3 or miR-302b-3p alone.
The down-regulated expression of LncRNA MEG3 and miR-302b-3p in colon cancer is related to clinical stage. Clinical detection of their expression can be used to determine the malignant degree of tumor and predict the prognosis of surgical treatment, thus providing reference for adjustment of clinical treatment plan.
- Citation: Sun B, Yue SG. Expression of long noncoding RNA MEG3 and microRNA-302b-3p in colon cancer: Correlation with clinical stage and value in predicing prognosis after surgical treatment. Shijie Huaren Xiaohua Zazhi 2023; 31(23): 981-988
- URL: https://www.wjgnet.com/1009-3079/full/v31/i23/981.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v31.i23.981
结肠癌为临床常见消化系统恶性肿瘤之一, 近年来, 受人口老龄化趋势、国民饮食习惯及结构改变等影响, 其发病率不断攀高, 且以每年4.2%速率递增[1-3]. 结肠癌恶性程度较高, 病理特征是影响其治疗决策及预后的重要因素[4,5], 因此, 探究影响结肠癌病理特征的分子标志物尤为关键. 微小RNA(miRNA)作为一类内源性非编码小分子RNA, 不仅在正常细胞生物学行为中发挥重要作用, 还参与调控肿瘤细胞增殖、分化及凋亡等过程[6-8]. 相关研究指出, miR-302b-3p在结肠癌中表达过低, 可能扮演抑癌基因角色[9], 但关于其与病理特征及预后关系的研究并不常见. 长链非编码RNA(LncRNA)是近年来发现的一类RNA分子, 可作为分子海绵体与染色质修饰因子或miRNA相结合, 调控靶基因表达[10,11]. 研究指出, LncRNA母系印记基因3(MEG3)在卵巢癌、胰腺癌及肾上腺癌等多种肿瘤细胞中表达缺失, 可能发挥抑癌基因功能[12,13]. LncRNA MEG3、miR-302b-3p均为抑癌基因, 关于二者在恶性肿瘤中是否存在协同效应尚无研究. 基于此, 本研究观察结肠癌组织LncRNA MEG3、miR-302b-3p表达, 探究其与临床分期的关系及对预后的指导价值, 并分析其交互作用对结肠癌复发的影响, 旨在为结肠癌治疗提供参考.
选取2017-01/2022-03金华市中医医院97例结肠癌患者, 其中男55例, 女42例, 年龄43-77(62.87±5.25)岁. 入组标准: 纳入标准: 均符合结肠癌诊断标准[14], 并经术后病理学证实; 年龄>18岁, 既往无肿瘤相关治疗史; 知情、同意本研究. 排除标准: 合并其他恶性肿瘤者; 转移性结肠癌者; 结肠多原发癌或息肉、结肠转移癌、腺瘤样结肠癌者; 伴有心、肾或肝等重要器官功能障碍者; 合并免疫或血液系统疾病者; 伴有溃疡性结肠炎、克罗恩病等结肠疾病者; 合并新冠肺炎者; 因疫情封控或其他原因中断随访者.
LncRNA MEG3、miR-302b-3p检测: 取术中切除结肠癌组织及癌旁组织标本, 以荧光定量PCR法检测, Trizol法提取细胞总RNA, 反转获取cDNA, 上机进行PCR检测, 反应条件设置为: 预变性95 ℃、2 min, 变性95 ℃、30 s, 退火60 ℃、30 s, 延伸72 ℃、30 s, 循环40次. 比较阈值法定量分析数据, LncRNA MEG3、miR-302b-3p分别以GAPDH、U6为内参基因, 检测基因相对表达量 = 2-ΔΔCt.
结肠癌治疗及预后: 97例结肠癌患者均接受根治性手术治疗, 并进行为期1年随访, 随访方式为门诊复查, 3个月/次, 随访终点为肿瘤复发, 针对疑似复发肿瘤进行穿刺活检, 确认是否复发. 根据结肠癌患者1年内复发情况判定预后.
观察比较不同组织LncRNA MEG3、miR-302b-3p表达, 分析LncRNA MEG3、miR-302b-3p表达与临床病理特征的相关性; 比较不同LncRNA MEG3、miR-302b-3p表达患者复发情况, 分析结肠癌术后复发影响因素, 评价LncRNA MEG3、miR-302b-3p表达对结肠癌术后复发的预测价值.
统计学处理 SPSS 23.0分析, 计量资料用(mean±SD)表示, t检验, 多组间比较用单因素方差分析, 两两比较用LSD-t检验, 计数资料用n(%)表示, 卡方检验, 卡普兰-迈耶曲线(K-M)比较不同LncRNA MEG3、miR-302b-3p表达患者复发情况, 采用Cox回归模型分析复发影响因素, 相乘、相加模型分析LncRNA MEG3、miR-302b-3p交互作用对结肠癌复发的影响, 绘制受试者工作特征(receiver operating characteristic, ROC)曲线分析LncRNA MEG3、miR-302b-3p表达对结肠癌术后复发的预测价值. P<0.05表示差异有统计学意义.
结肠癌组织LncRNA MEG3、miR-302b-3p表达均低于癌旁组织(P<0.05). 表1.
| 组织 | 例数 | LncRNA MEG3 | miR-302b-3p |
| 癌组织 | 97 | 7.75±1.23 | 0.35±0.12 |
| 癌旁组织 | 97 | 9.38±1.54 | 1.02±0.17 |
| t值 | 8.145 | 31.711 | |
| P值 | <0.001 | <0.001 |
对LncRNA MEG3、miR-302b-3p表达与临床病理特征进行相关性分析显示, 结肠癌组织LncRNA MEG3、miR-302b-3p表达与性别、年龄、肿瘤大小无关(P>0.05), 与分化程度、临床分期及淋巴结转移有关(P<0.05). 表2.
| 病理特征 | 例数 | LncRNA MEG3 | miR-302b-3p | ||||
| 表达量 | F/t/P值 | r/P值 | 表达量 | F/t/P值 | r/P值 | ||
| 性别 | |||||||
| 男 | 55 | 7.78±1.30 | 0.267/0.790 | 0.125/0.985 | 0.34±0.14 | 0.741/0.461 | 0.142/0.779 |
| 女 | 42 | 7.71±1.25 | 0.36±0.12 | ||||
| 年龄 | |||||||
| <60岁 | 45 | 7.82±1.29 | 0.489/0.626 | 0.139/0.874 | 0.37±0.15 | 1.407/0.163 | 0.150/0.674 |
| ≥60岁 | 52 | 7.69±1.32 | 0.33±0.13 | ||||
| 肿瘤大小 | |||||||
| <5 cm | 48 | 7.98±1.41 | 1.641/0.104 | 0.145/0.792 | 0.37±0.17 | 1.229/0.222 | 0.148/0.785 |
| ≥5 cm | 49 | 7.52±1.35 | 0.33±0.15 | ||||
| 分化程度 | |||||||
| 高 | 26 | 8.75±1.23 | 23.358/<0.001 | 0.685<0.001 | 0.42±0.14 | 9.327/<0.001 | 0.624<0.001 |
| 中 | 49 | 7.76±1.10 | 0.35±0.12 | ||||
| 低 | 22 | 6.55±0.98 | 0.27±0.09 | ||||
| 临床分期 | |||||||
| Ⅰ期 | 24 | 8.57±1.35 | 12.093/<0.001 | 0.631<0.001 | 0.49±0.14 | 30.863/<0.001 | 0.692<0.001 |
| Ⅱ期 | 55 | 7.69±1.09 | 0.33±0.11 | ||||
| Ⅲ期 | 18 | 6.84±0.95 | 0.22±0.08 | ||||
| 淋巴结转移 | |||||||
| 是 | 18 | 6.94±1.12 | 2.966/0.004 | 0.574<0.001 | 0.29±0.07 | 2.812/0.006 | 0.569<0.001 |
| 否 | 79 | 7.93±1.31 | 0.36±0.10 | ||||
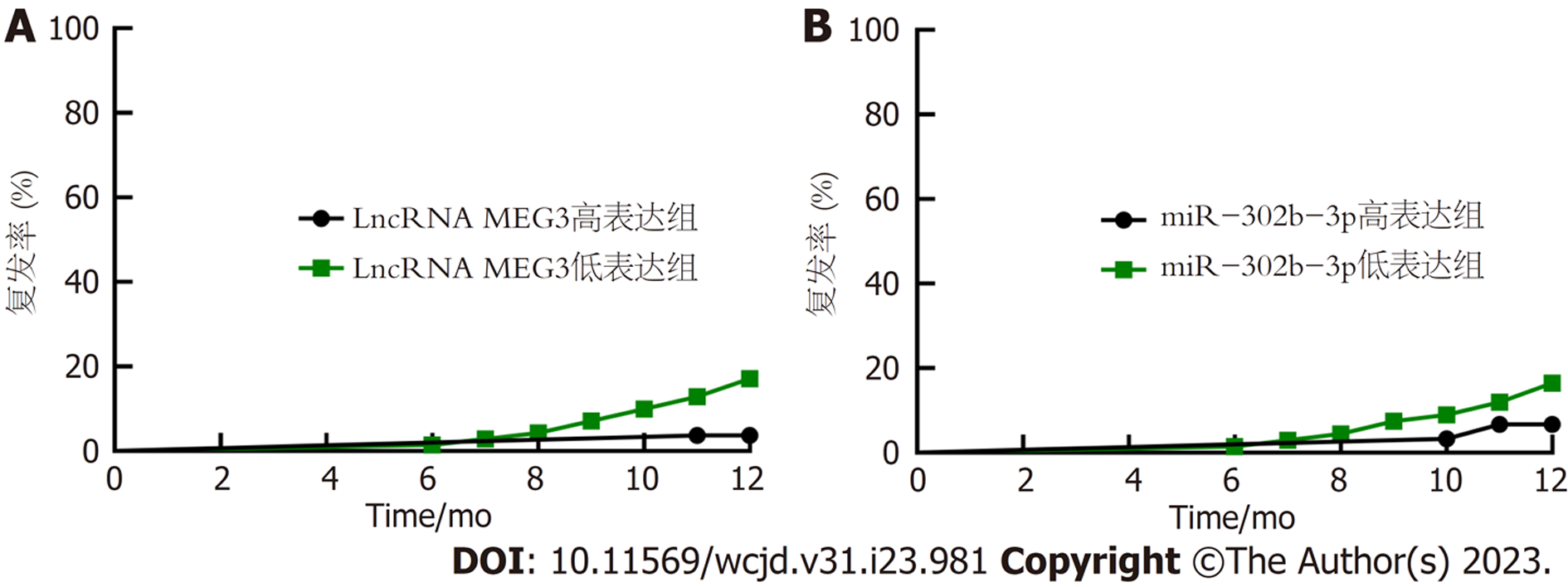
结肠癌患者以中位值为界, 分为高表达组与低表达组, 结肠癌组织中LncRNA MEG3、miR-302b-3p高表达组1年内复发率分别为2.70%(1/37)、5.00%(2/40), 分别低于LncRNA MEG3、miR-302b-3p低表达组20.00%(12/60)、19.30%(11/57), 差异有统计学意义(P<0.05). 图1.
以结肠癌患者1年内复发为因变量, 分化程度、临床分期、淋巴结转移及癌组织LncRNA MEG3、miR-302b-3p表达为自变量, 赋值(表3), 进行Cox回归分析, 结果显示, 分化程度、临床分期、淋巴结转移均为结肠癌复发危险因素, 癌组织LncRNA MEG3、miR-302b-3p表达均为结肠癌复发保护因素(P<0.05). 表4.
| 变量 | 序号 | 赋值 |
| 分化程度 | X1 | 高分化 = 1, 中分化 = 2, 低分化 = 3 |
| 临床分期 | X2 | Ⅰ期 = 1, Ⅱ期 = 2, Ⅲ期 = 3 |
| 淋巴结转移 | X3 | 否 = 0, 是 = 1 |
| LncRNA MEG3 | X4 | 连续变量, 纳入实测值 |
| miR-302b-3p | X5 | 连续变量, 纳入实测值 |
| 复发情况 | Y | 未复发 = 0, 复发 = 1 |
| 因素 | β | S.E. | Wald χ2 | RR | 95%CI | P值 |
| 分化程度 | 1.884 | 0.474 | 15.798 | 6.580 | 2.374-18.236 | <0.001 |
| 临床分期 | 2.534 | 0.491 | 26.625 | 12.598 | 5.078-31.255 | <0.001 |
| 淋巴结转移 | 2.971 | 0.455 | 42.648 | 19.519 | 7.274-52.378 | <0.001 |
| LncRNA MEG3 | -0.249 | 0.074 | 11.278 | 0.780 | 0.682-0.892 | <0.001 |
| miR-302b-3p | -0.222 | 0.070 | 10.095 | 0.801 | 0.709-0.904 | <0.001 |
2.5.1 LncRNA MEG3、miR-302b-3p交互作用对结肠癌复发的影响: 以结肠癌复发为因变量, 将LncRNA MEG3、miR-302b-3p及二者乘积作为自变量纳入回归方程, 构建模型1、模型2. 校正混杂因素后发现, LncRNA MEG3、miR-302b-3p均对结肠癌复发有影响(P<0.05); LncRNA MEG3与miR-302b-3p间并无相乘交互效应, 差异无统计学意义(P>0.05). 表5.
| 自变量 | 模型1 | 模型2 | ||
| OR(95%CI) | P值 | OR(95%CI) | P值 | |
| LncRNA MEG3 | 0.592(0.478-0.733) | <0.001 | 0.588(0.502-0.689) | <0.001 |
| miR-302b-3p | 0.555(0.374-0.825) | <0.001 | 0.551(0.452-0.671) | <0.001 |
| 二者乘积 | 1.558(0.755-3.214) | >0.05 | 1.206(0.927-1.569) | >0.05 |
2.5.2 LncRNA MEG3、miR-302b-3p交互作用对结肠癌复发的影响: 以LncRNA MEG3<中位值、miR-302b-3p<中位值为暴露, 否则为非暴露. LncRNA MEG3、miR-302b-3p同时暴露的协同效应是LncRNA MEG3或miR-302b-3p单纯暴露产生效应的15.888倍, 且二者同时暴露时, 结肠癌复发风险中有56.98%归因于二者协同作用. 表6.
| 交互项 | 复发(n = 13) | 未复发(n = 84) | 模型1 | 模型2 | ||
| OR(95%CI) | P值 | OR(95%CI) | P值 | |||
| 低LncRNA MEG3/低miR-302b-3p | ||||||
| -/- | 1 | 37 | 1.000 | 1.000 | ||
| -/+ | 2 | 24 | 1.026(0.572-1.839) | >0.05 | 1.006(0.636-1.194) | >0.05 |
| +/- | 4 | 18 | 1.285(0.694-2.378) | >0.05 | 1.263(0.802-1.989) | >0.05 |
| +/+ | 6 | 5 | 4.242(2.138-8.415) | <0.001 | 5.274(3.015-9.226) | <0.001 |
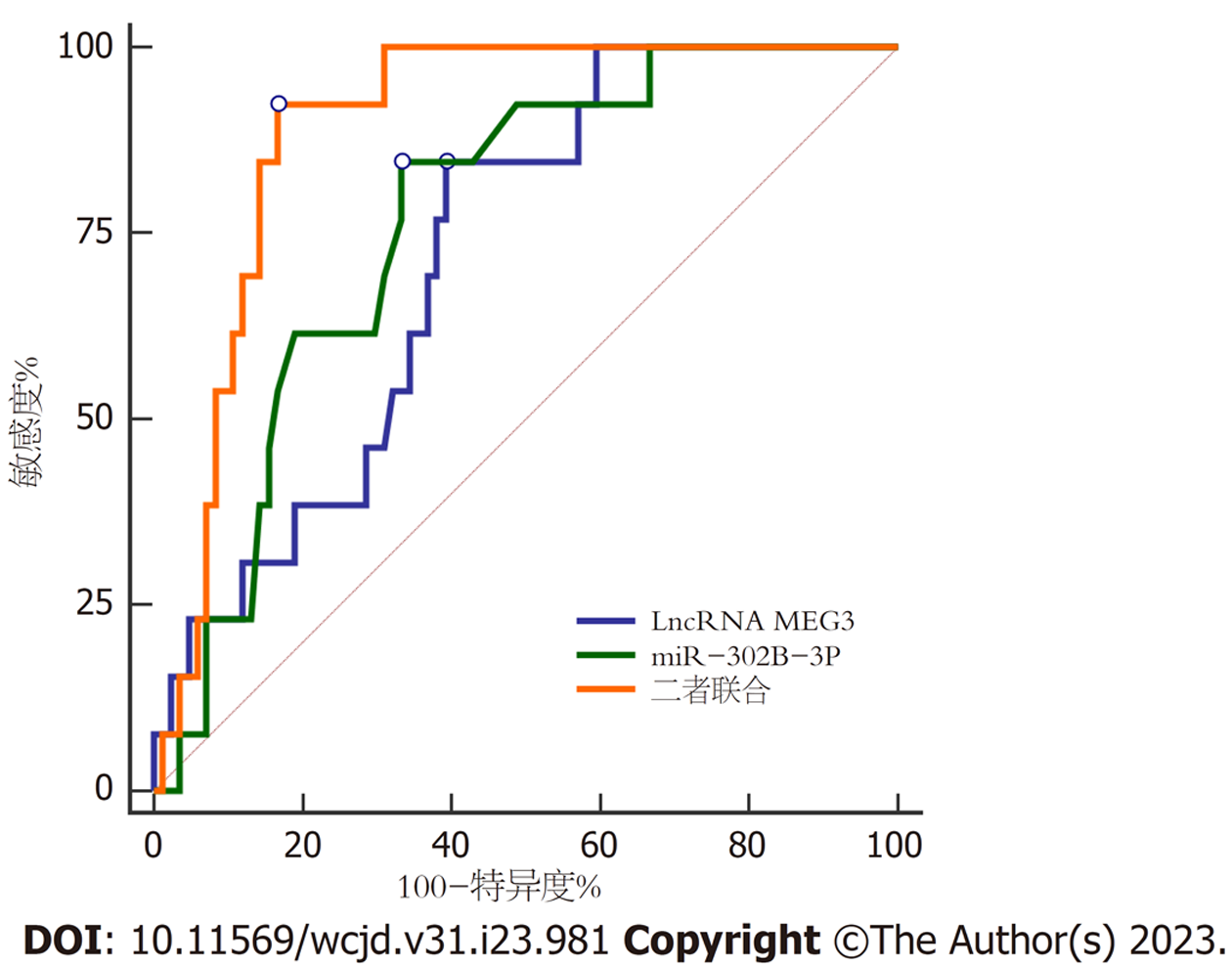
以癌组织LncRNA MEG3、miR-302b-3p表达为源数据, 结肠癌患者术后1年内复发为阳性, 未复发为阴性, 绘制ROC曲线, 结果显示, LncRNA MEG3、miR-302b-3p预测结肠癌患者复发的曲线下面积(area under the curve, AUC)(95%CI)分别为0.720(0.620-0.807)、0.767(0.670-0.847), 二者联合预测AUC(95%CI)为0.892(0.813-0.946), 明显高于LncRNA MEG3、miR-302b-3p单独预测, 最佳敏感度及特异度分别为92.31%、83.33%. 图2.
miRNA表达异常可诱发肿瘤等多种疾病, 随着生物信息技术不断优化, miRNA成为肿瘤治疗靶点. 迄今为止, 已发现500多个人类基因组中的miRNA广泛参与恶性肿瘤发生、肿瘤细胞增殖及凋亡等病理生理过程[15,16]. 研究显示, 部分miRNA发挥抑癌基因作用, 其在肿瘤细胞或组织中表达缺失或低表达, 调控miRNA表达为肿瘤治疗新方向[17,18]. 本研究中结肠癌组织miR-302b-3p表达低于癌旁组织, 提示miR-302b-3p可能为结肠癌抑癌基因. 相关功能学分析指出, miR-302b-3p可通过与ERBB4的3'-非编码区域结合, 致使ERBB4表达下调, 从而影响细胞增殖、侵袭, 并加速凋亡进程, 发挥抑癌基因作用[19,20]. 在一项miR-302b在结肠癌组织的研究中显示, miR-302b在低分化、有淋巴结转移及远处转移的结肠癌患者中表达显著低于分化较好、无淋巴结转移及远处转移患者[21]. 进一步研究显示, miR-302b-3p表达与分化程度、临床分期及淋巴结转移有关(P<0.05), 提示结肠癌患者癌组织miR-302b-3p表达与病理特征有关, miR-302b-3p表达下调预示着更强的肿瘤侵袭性, 推测可作为结肠癌预后预测指标.
LncRNA作为继miRNA后发现的非编码RNA, 同样在人类疾病中发挥至关重要作用, 尤其是在肿瘤发生、演变过程中扮演重要角色[22]. LncRNA调控基因表达涉及表观遗传、转录及转录后三个层面, 主要通过转录激活、染色体修饰及干扰等方式调控[23,24]. 作为首个被发现具有肿瘤抑制作用的LncRNA, MEG3在人体正常组织中表达较高, 特别是在脑垂体中表达最高, 但在多种肿瘤细胞系中表达较少或缺乏[25]. 既往文献表明, LncRNA MEG3可促使细胞循环停滞, 对肿瘤细胞增殖及侵袭行为发挥抑制作用, 并可促进肿瘤细胞凋亡, 阻碍肿瘤的发生[26]. 现阶段, 临床认为LncRNA MEG3发挥抑癌作用的途径较多, 其中DNA甲基化、影响血管新生、p53途径及Rb途径等已经研究证实, 致使LncRNA MEG3基因沉默或表达下调, 造成正常细胞增殖异常发生癌变[27,28]. 有学者指出, 结肠癌患者癌组织LncRNA MEG3表达明显下调[29,30], 与本研究结果一致, 充分说明其在结肠癌中发挥抑癌基因作用, 且本研究中LncRNA MEG3表达与分化程度、临床分期及淋巴结转移有关(P<0.05), 提示LncRNA MEG3表达与结肠癌患者病理特征有关, 而病理特征是影响患者预后的重要因素, 因此, 本研究认为LncRNA MEG3表达可能与结肠癌患者预后有关.
本研究中结肠癌组织中LncRNA MEG3、miR-302b-3p高表达组1年内复发率分别低于LncRNA MEG3、miR-302b-3p低表达组, 且Cox回归分析显示, 癌组织LncRNA MEG3、miR-302b-3p表达均为结肠癌复发保护因素, 提示LncRNA MEG3、miR-302b-3p可能是结肠癌复发的重要预测指标. 此外, 本研究还显示, LncRNA MEG3与miR-302b-3p存在交互作用, 可增加结肠癌术后复发风险, 推测LncRNA MEG3可通过miR-302b-3p促进结肠癌增殖、侵袭和迁移, 从而参与结肠癌发生发展过程, 但其具体机制不明, 有待临床进一步研究证实. 基于LncRNA MEG3、miR-302b-3p对结肠癌预后的交互作用, 以癌组织LncRNA MEG3、miR-302b-3p表达为源数据, 结肠癌患者术后1年内复发为阳性, 未复发为阴性, 绘制ROC曲线, 结果显示二者联合预测AUC最大, 为0.892, 最佳敏感度及特异度分别为92.31%、83.33%, 具有良好预测效能.
综上所述, 结肠癌患者癌组织LncRNA MEG3、miR-302b-3p表达下调, 与临床分期有关, 临床检测其表达可用于明确肿瘤恶性程度、预测手术治疗预后, 为临床后续治疗方案调整提供参考依据. 但本研究尚存在一定不足, 受限于科研经费等问题, 未进行长期随访, 且缺乏细胞实验、动物实验, 有待临床日后延长随访时间, 增设细胞实验及动物实验, 进一步证实二者协同效应对预后的影响.
结直肠癌发病率高, 病程恶化快, 仅通过常规筛查较难早发现早治疗, 长非编码RNA与微小RNA在肿瘤的不同时期都会发生表达变化, 适宜早发现, 对患者的治疗和预后均有一定影响.
在结肠癌中miR-302b-3p表达较低, LncRNA母系印记基因3(MEG3)在卵巢癌、胰腺癌及肾上腺癌等多种肿瘤细胞中表达缺失, 表明这两种RNA与癌症的发生与发展有着一定的联系.
miR-302b-3p与LncRNA MEG3均与癌症的抑制有较大的关系, 但是在结直肠癌的不同临床分期以及手术预后中是否存在差异性, 且二者是否在结直肠癌中表现出协同效应, 对结直肠癌患者的诊断具有重要意义.
通过经典的分子检测方法对癌症患者的组织样本进行核酸提取和检测, 分析表达的差异性, 并对术后患者进行定期随访, 了解预后情况.
结肠癌组织LncRNA MEG3、miR-302b-3p表达均低于癌旁组织, 结肠癌组织LncRNA MEG3、miR-302b-3p表达与分化程度、临床分期及淋巴结转移有关, 二者联合预测曲线下面积(95%CI)明显高于LncRNA MEG3、miR-302b-3p单独预测.
结肠癌患者癌的LncRNA MEG3、miR-302b-3p表达, 与临床分期有一定的关系,可作为判断癌症恶性进展和预测手术治疗预后的检测标志物, 为临床的治疗提供参考.
LncRNA MEG3、miR-302b-3p在结直肠癌患者中同时检测可以更灵敏发现临床分期. 但是本研究仍存在一定的缺陷, 如长期随访时间较短, 缺少临床前实验的支持等. 接下来重点补充临床前实验的事实和数据, 以期更好地验证说明LncRNA MEG3、miR-302b-3p在结直肠癌分期检测中的重要性.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C, C
D级 (一般): D
E级 (差): 0
科学编辑: 张砚梁 制作编辑:张砚梁
| 2. | Liu M, Fu X, Jiang L, Ma J, Zheng X, Wang S, Guo H, Tian T, Nan K, Wang W. Colon cancer cells secreted CXCL11 via RBP-Jκ to facilitated tumour-associated macrophage-induced cancer metastasis. J Cell Mol Med. 2021;25:10575-10590. [PubMed] [DOI] |
| 3. | Chong W, Shang L, Liu J, Fang Z, Du F, Wu H, Liu Y, Wang Z, Chen Y, Jia S, Chen L, Li L, Chen H. m(6)A regulator-based methylation modification patterns characterized by distinct tumor microenvironment immune profiles in colon cancer. Theranostics. 2021;11:2201-2217. [PubMed] [DOI] |
| 4. | Vogel JD, Felder SI, Bhama AR, Hawkins AT, Langenfeld SJ, Shaffer VO, Thorsen AJ, Weiser MR, Chang GJ, Lightner AL, Feingold DL, Paquette IM. The American Society of Colon and Rectal Surgeons Clinical Practice Guidelines for the Management of Colon Cancer. Dis Colon Rectum. 2022;65:148-177. [PubMed] [DOI] |
| 5. | Khan FA, Albalawi R, Pottoo FH. Trends in targeted delivery of nanomaterials in colon cancer diagnosis and treatment. Med Res Rev. 2022;42:227-258. [PubMed] [DOI] |
| 6. | Ji H, Kim TW, Lee WJ, Jeong SD, Cho YB, Kim HH. Two circPPFIA1s negatively regulate liver metastasis of colon cancer via miR-155-5p/CDX1 and HuR/RAB36. Mol Cancer. 2022;21:197. [PubMed] [DOI] |
| 7. | 陈 文霞, 刘 艳红, 肖 兴国, 张 磊, 王 琳, 吴 慧丽. 结肠癌患者血清miR-17-5p、miR-25-3p的表达水平及临床意义. 中国老年学杂志. 2022;42:2099-21023. [DOI] |
| 8. | Ma J, Wang P, Huang L, Qiao J, Li J. Bioinformatic analysis reveals an exosomal miRNA-mRNA network in colorectal cancer. BMC Med Genomics. 2021;14:60. [PubMed] [DOI] |
| 9. | Li C, Zhu Z, Hou Q, Wang B, Zou L, Liu L, Gong W, Guo H. Revealing potential immunotherapy targets through analysis of a ceRNA network in human colon adenocarcinoma. Transl Cancer Res. 2021;10:5319-5336. [PubMed] [DOI] |
| 10. | Luo Y, Huang S, Wei J, Zhou H, Wang W, Yang J, Deng Q, Wang H, Fu Z. Long noncoding RNA LINC01606 protects colon cancer cells from ferroptotic cell death and promotes stemness by SCD1-Wnt/β-catenin-TFE3 feedback loop signalling. Clin Transl Med. 2022;12:e752. [PubMed] [DOI] |
| 11. | Li Q, Sun H, Luo D, Gan L, Mo S, Dai W, Liang L, Yang Y, Xu M, Li J, Zheng P, Li X, Li Y, Wang Z. Lnc-RP11-536 K7.3/SOX2/HIF-1α signaling axis regulates oxaliplatin resistance in patient-derived colorectal cancer organoids. J Exp Clin Cancer Res. 2021;40:348. [PubMed] [DOI] |
| 15. | Wang D, Wang X, Song Y, Si M, Sun Y, Liu X, Cui S, Qu X, Yu X. Exosomal miR-146a-5p and miR-155-5p promote CXCL12/CXCR7-induced metastasis of colorectal cancer by crosstalk with cancer-associated fibroblasts. Cell Death Dis. 2022;13:380. [PubMed] [DOI] |
| 16. | Sampath SS, Venkatabalasubramanian S, Ramalingam S. Role of MicroRNAs in the Progression and Metastasis of Colon Cancer. Endocr Metab Immune Disord Drug Targets. 2021;21:35-46. [PubMed] [DOI] |
| 18. | 刘 翼, 祝 琳, 康 敏. miR-302b-3p对食管癌EC-109细胞增殖和凋亡的影响及其机制. 吉林大学学报(医学版). 2019;45:1346-1352. [DOI] |
| 19. | Wang D, Jiang X, Liu Y, Cao G, Zhang X, Kuang Y. Circular RNA circ_HN1 facilitates gastric cancer progression through modulation of the miR-302b-3p/ROCK2 axis. Mol Cell Biochem. 2021;476:199-212. [PubMed] [DOI] |
| 20. | Xu H, Miao X, Li X, Chen H, Zhang B, Zhou W. LncRNA SNHG16 contributes to tumor progression via the miR-302b-3p/SLC2A4 axis in pancreatic adenocarcinoma. Cancer Cell Int. 2021;21:51. [PubMed] [DOI] |
| 21. | Hu F, Li M, Mo L, Xiao Y, Wang X, Xie B. SOX-17 is involved in invasion and apoptosis of colorectal cancer cells through regulating miR-302b-3p expression. Cell Biol Int. 2021;45:1296-1305. [PubMed] [DOI] |
| 22. | Wang Y, Huang X, Chen S, Jiang H, Rao H, Lu L, Wen F, Pei J. In Silico Identification and Validation of Cuproptosis-Related LncRNA Signature as a Novel Prognostic Model and Immune Function Analysis in Colon Adenocarcinoma. Curr Oncol. 2022;29:6573-6593. [PubMed] [DOI] |
| 23. | Huang T, Wu Z, Zhu S. The roles and mechanisms of the lncRNA-miRNA axis in the progression of esophageal cancer: a narrative review. J Thorac Dis. 2022;14:4545-4559. [PubMed] [DOI] |
| 24. | Carlevaro-Fita J, Lanzós A, Feuerbach L, Hong C, Mas-Ponte D, Pedersen JS; PCAWG Drivers and Functional Interpretation Group, Johnson R; PCAWG Consortium. Author Correction: Cancer LncRNA Census reveals evidence for deep functional conservation of long noncoding RNAs in tumorigenesis. Commun Biol. 2022;5:1347. [PubMed] [DOI] |
| 25. | Yang Z, Wang Z, Duan Y. LncRNA MEG3 inhibits non-small cell lung cancer via interaction with DKC1 protein. Oncol Lett. 2020;20:2183-2190. [PubMed] [DOI] |
| 26. | 贾 旻蕾, 刘 瑞丽, 李 兰军. 胃癌组织lncRNA MEG3、miR-7-5p表达水平变化及与患者临床分期和预后的关系. 国际检验医学杂志. 2022;43:2857-2862. [DOI] |
| 28. | 张 艳, 李 封, 徐 婉, 张 莉, 段 亚亭, 余 作琼. lncRNA MEG3通过miR-9-5p/SOCS5轴对宫颈癌细胞恶性生物学行为的影响. 中国肿瘤生物治疗杂志. 2020;27:725-734. [DOI] |
| 29. | 赵 芝, 张 刚, 李 哲丽, 刘 玉凤, 郑 少华, 刘 楠. 结直肠癌组织LncRNA MEG3、miR-31表达及与病理特征的相关性. 解放军医药杂志. 2022;34:39-43. [DOI] |
| 30. | 司 君利, 孟 菲菲, 崔 京远, 亓 玉琴, 吴 健婷. 结肠癌中MEG3和GAS5的表达及与预后的关系. 中国现代普通外科进展. 2017;20:673-676. [DOI] |