修回日期: 2023-09-19
接受日期: 2023-09-26
在线出版日期: 2023-10-08
糖皮质激素在治疗重度溃疡性结肠炎时可抑制细胞免疫功能从而引发单核细胞增生李斯特菌机会性感染. 溃疡性结肠炎合并李斯特菌脑膜炎在临床上少见, 易造成误诊.
患者第一次主因"腹泻、粘液脓血便1个月, 间断发热20余天"入我院治疗, 确诊为溃疡性结肠炎, 给予糖皮质激素后病情逐渐缓解, 在院外口服激素过程中, 进食可疑污染食物, 造成病情反复, 并合并李斯特菌脑膜炎, 给予氨苄西林抗感染及脑室钻孔引流术后, 患者病情仍危重, 家属因经济原因签字离院, 后随访患者死亡.
糖皮质激素被广泛用于重度溃疡性结肠炎的治疗, 同时也易造成细胞免疫抑制, 是引起机会性感染的高危因素之一. 而单核细胞增生李斯特菌通常在人类肠道中处于携带状态, 免疫功能低下可促进其通过受损的肠道黏膜入侵机体, 造成各个系统的感染, 由于李斯特菌主要侵袭中枢神经系统, 在应用大剂量糖皮质激素治疗溃疡性结肠炎过程中, 需要警惕李斯特菌感染, 及时发现头痛, 意识改变和脑膜炎体征, 完善血培养和脑脊液培养后尽早使用能通过血脑屏障, 对李斯特菌敏感的抗生素, 以降低死亡率.
核心提要: 使用糖皮质激素治疗溃疡性结肠炎过程中易造成免疫功能抑制, 由此引起的单核细胞增生李斯特菌性脑膜炎易引起误诊, 因此在使用激素治疗过程中, 要警惕患者神经系统变化, 及时送检确诊, 尽早选择敏感抗生素抗感染治疗.
引文著录: 任璐, 刘娜, 刘广阔, 张晓伟. 溃疡性结肠炎合并李斯特菌脑膜炎1例. 世界华人消化杂志 2023; 31(19): 830-836
Revised: September 19, 2023
Accepted: September 26, 2023
Published online: October 8, 2023
Listeria monocytogenes, as an intracellular Gram-positive rod bacterium, is usually transmitted by contaminated food, which mainly affects the central nervous system in immunocompromised patients. Listeria monocytogenes infection in a setting of an ulcerative colitis (UC) flare is clinically rare.
We report a 55-year-old man with UC flare-up complicated with Listeria meningitis. It was immunosuppression caused by high-dose steroid therapy that induced his infection.
Clinicians must remain vigilant with invasive Listeria infection in patients diagnosed with ulcerative colitis receiving high-dose steroid. Early recognition and prescription of specific antibiotics can decrease the risk of exacerbation.
- Citation: Ren L, Liu N, Liu GK, Zhang XW. Ulcerative colitis complicated with Listeria meningitis: A case report. Shijie Huaren Xiaohua Zazhi 2023; 31(19): 830-836
- URL: https://www.wjgnet.com/1009-3079/full/v31/i19/830.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v31.i19.830
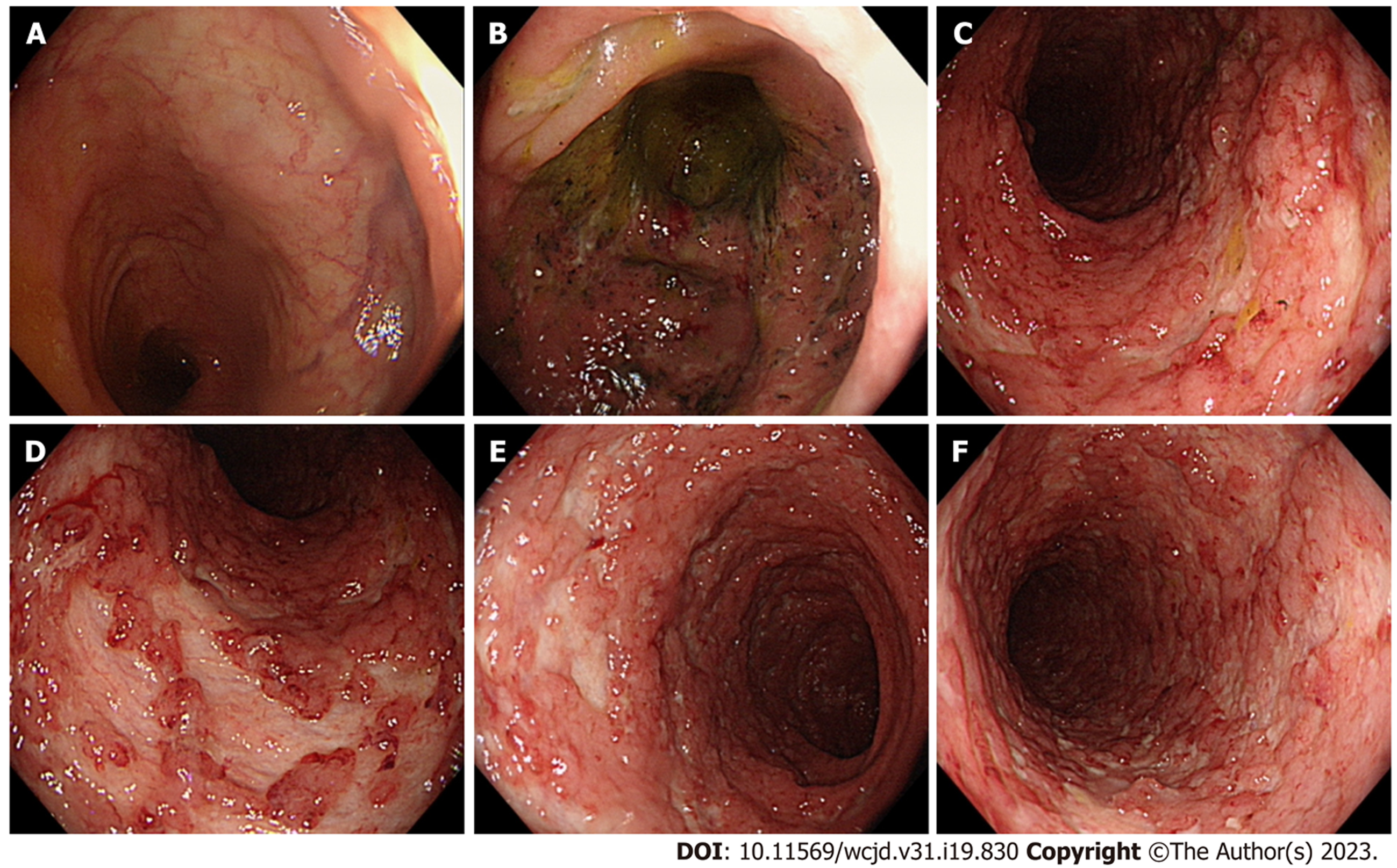
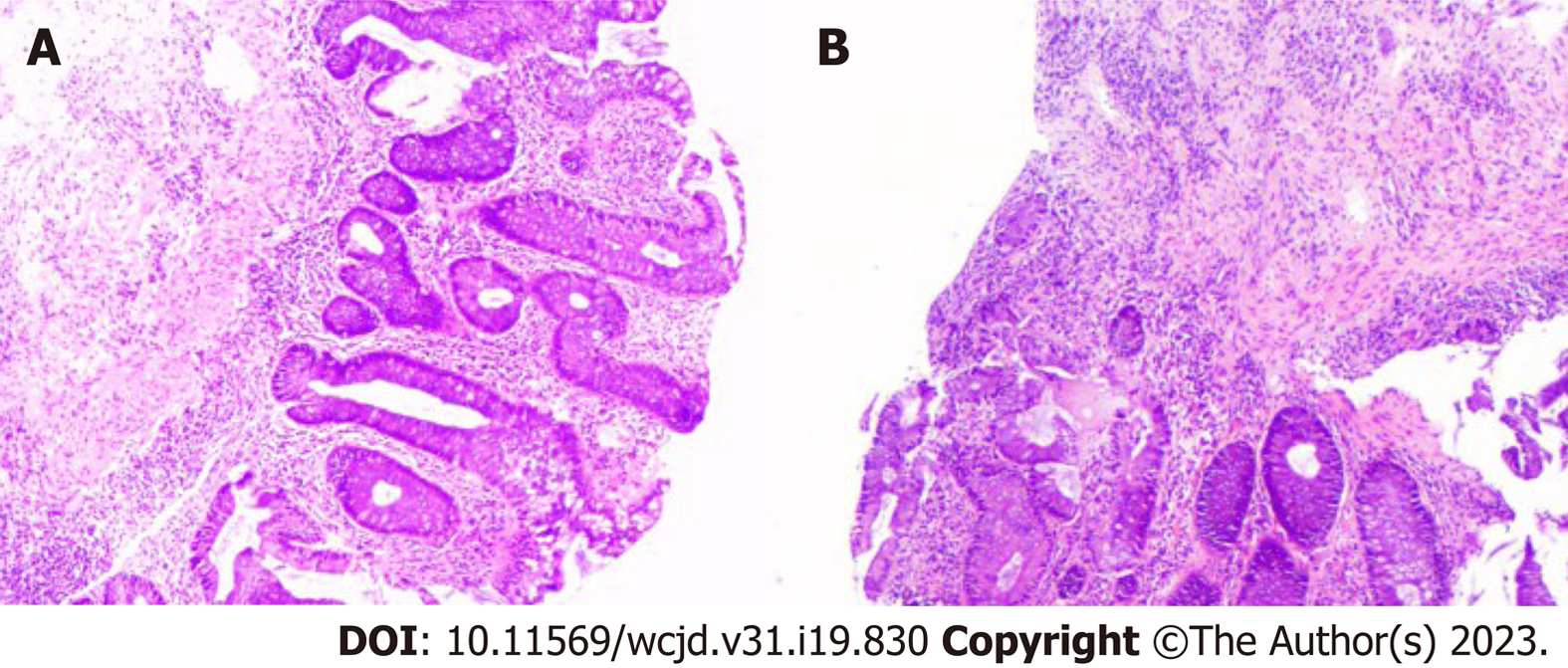
患者男, 55岁, 主因"粘液脓血便1个月, 间断发热20余天"于2022-09-09第一次来我科住院. 患者1 mo前无明显诱因出现粘液脓血便, 每日3-4次, 20 d前出现间断发热, 体温最高可达38.9 ℃, 无畏寒、寒战, 就诊于当地县医院, 查结肠镜示直肠至横结肠黏膜弥漫充血水肿, 考虑溃疡性结肠炎, 给予头孢他啶、美沙拉嗪等药物治疗8 d症状无明显缓解, 体重较前减少10 kg. 为求进一步诊治来我院. 既往吸烟30余年, 已戒烟1 mo; 无饮酒史. 婚育史、家族史无特殊. 入院查体: 体温37.9 ℃, 脉搏109次/分, 呼吸18次/分, 血压130/89 mmHg(1 mmHg = 0.133 kPa). 神志清, 精神差, 心肺查体无异常. 腹软, 无压痛、反跳痛、肌紧张, 肝脾未触及, 肠鸣音5次/分, 双下肢无水肿. 入院后辅助检查: 血常规白细胞: 19.30×109/L, 中性粒细胞76.70%, 血红蛋白97g/L, 血小板438×109/L; 便常规: 隐血阳性; C反应蛋白66.4 mg/L;血细胞沉降率25 mm/h;降钙素原0.153 ng/mL. 生化: 白蛋白24.4 g/L, 空腹血糖4.5 mmol/L, 钾2.9 mmol/L, 钙1.8 mmol/L; 凝血功能无异常, D二聚体2.32 mg/L; 癌胚抗原22.78 ng/mL; 术前八项阴性; 三次便培养未见致病菌生长, EB病毒及巨细胞病毒阴性; 艰难梭菌及毒素基因检测无明显异常. 腹部CT平扫+增强: 全结直肠肠壁弥漫增厚, 明显强化, 结肠带消失, 周围脂肪间隙模糊, 考虑炎性病变. 结肠镜(图1): 结肠、直肠黏膜水肿, 弥漫分布不规则浅溃疡, 黏膜质脆, 病变呈连续性分布, 结肠带消失(E3, Mayo 3分). 病理回报(图2): 直肠、结肠、回肠末端黏膜重度慢性活动性炎症, 可见隐窝炎及隐窝脓肿, 间质灶状淋巴组织增生. 诊断: 溃疡性结肠炎(初发型, E3, 活动期, 重度). 给予口服美沙拉嗪肠溶片1 g, 4次/d, 静脉滴注甲泼尼龙60 mg/d, 3 d后, 大便次数减少, 仍有发热, 体温最高可达37.8 ℃, 下午明显, 调整为氢化可的松早200 mg, 晚100 mg静点, 患者排便次数明显减少, 未再发热, 应用8 d后改为口服泼尼松早30 mg, 晚20 mg, 患者症状好转, 排便每日1-2次, 大便成形, 无腹痛发热. 共住院25 d, 于2022-10-04出院. 出院后规律口服美沙拉嗪肠溶片1 g, 4次/d, 泼尼松片40 mg早一次, 美沙拉嗪灌肠液60 mL(4 g)灌肠1/晚. 患者病情平稳, 无腹痛腹胀, 排便1-2次/日.
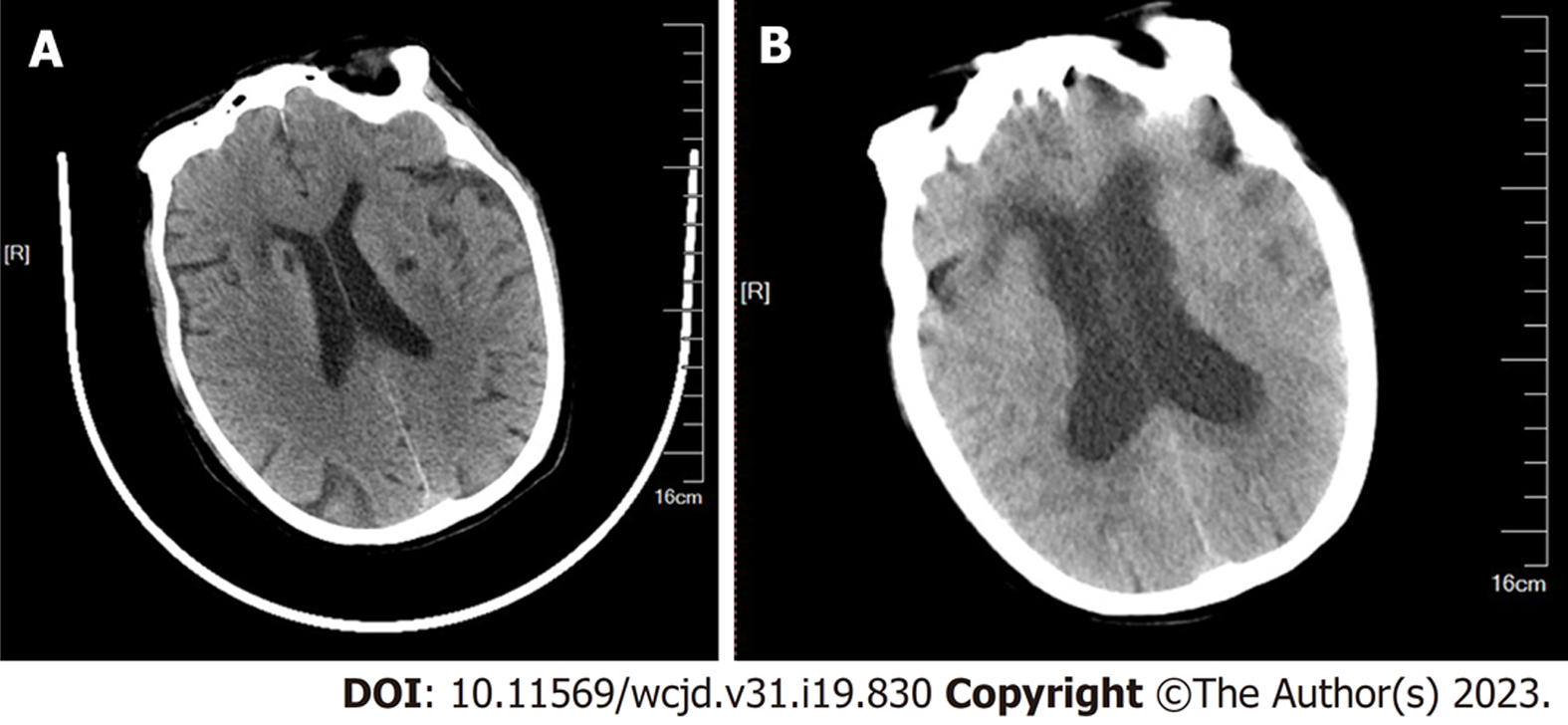
出院后第11天, 患者进食剩饭后出现发热(最高达40 ℃)、头痛、大便次数增多(每日4次)、脓血便来我院急诊科, 查白细胞10.4×109/L, 中性粒细胞65.2%, 血红蛋白108.63 g/L, C反应蛋白79.55 mg/L, 考虑溃疡性结肠炎活动期. 2022-10-15 T14:59第二次于我科住院, 查体: 体温37.9 ℃, 脉搏120次/分, 呼吸20次/分, 血压136/109 mmHg. 精神欠佳, 入院1.5 h后患者突然出现意识不清, 呼之不应, 心率140次/分, 呼吸30次/分, 血氧饱和度90%, 血压153/89 mmHg, 瞳孔对光反射灵敏, 病理征阴性. 急查头颅(图2)及胸腹部CT: 双侧基底节区腔隙性脑梗死, 右肺中下叶炎症, 结肠肠壁弥漫性增厚, 周围间隙脂肪模糊.考虑脓毒症休克, 紧急转至ICU, 应用哌拉西林他唑巴坦(4.5 g q8h)抗感染治疗, 23:00血压降至85/45 mmHg, 血红蛋白74 g/L, 乳酸4.27 mmol/L, 给予补液升压, 联合输血、免疫球蛋白提高免疫力. 入院第4天血培养结果回报单核细胞增多李斯特菌, 粪便产毒艰难梭菌及B毒素基因检测阳性, 巨细胞病毒PCR和EB病毒核酸定量检测均阴性, 在哌拉西林他唑巴坦基础上加用万古霉素(125 mg q6h)鼻饲和甲硝唑(0.5 g q8h)静点, 患者意识稍好转, 仍嗜睡, 可自主睁眼, 简单交流, 完成指令动作, 体温下降, 排便次数减少, 炎症指标较前好转.
住院第7天, 患者突然出现昏迷, 颈项强直, Babinski's征阳性, 腰椎穿刺示淡黄色液体, 脑脊液压力85 mmH2O(1 mmH2O = 0.00981 kPa), 脑脊液常规和生化: 白细胞544×106/L, 氯113 mmol/L, 总蛋白6.25 g/L, 葡萄糖6.25 mmol/L. 考虑颅内感染, 复查头颅(图3)和胸部CT: 幕上脑室扩张积水, 双肺炎症较前范围增大. 头颅磁共振弥散成像未见明显异常.继续给予上述抗生素抗感染、肠外营养、调节肠道菌群治疗, 并补充人血白蛋白减轻脑水肿、人免疫球蛋白(15 g×3 d)增强免疫力.再次行脑脊液检查并外送二代基因测序. 第10天患者意识障碍进行性加重, 双侧瞳孔直径约3.0 mm, 对光反射迟钝, 颈硬, 有抵抗, 四肢肌力肌张力查体不合作, 双侧Babinski's征阳性, 脑脊液宏基因组学检测提示单核细胞增生李斯特菌感染. 内科保守治疗效果不明显, 神经外科会诊考虑颅内感染, 交通性脑积水, 给予全麻下右侧脑室钻孔引流术, 并调整抗生素为氨苄西林(3 g q6h)抗感染治疗. 术后复查脑脊液示白细胞、总蛋白、糖明显均下降, 但患者仍呈昏迷状态, 家属因经济原因签字后办理出院, 后电话随访患者死亡.
诊断溃疡性结肠炎36 d, 加重伴发热3 d.
患者主因"粘液脓血便1个月, 间断发热20余天"于2022-09-09第一次来我科住院, 入院完善结肠镜及病理活检, 结合症状、体征和实验室检查, 诊断为"溃疡性结肠炎", 给予美沙拉嗪和糖皮质激素治疗后, 病情好转于2022-10-4出院. 出院后口服美沙拉嗪和激素维持(激素逐渐减量), 进食可疑污染食物后出现发热, 最高体温可达40 ℃, 伴畏寒、寒战, 为进一步治疗于2022-10-15入院.
车祸外伤史3月余, 保守治疗. 否认高血压、冠心病、糖尿病等慢性病史, 否认肝炎、结核、伤寒等传染病史, 否认手术史、输血史, 预防接种史不详, 自诉对"左氧氟沙星"过敏.
吸烟30余年, 每日20支, 已戒烟1 mo; 无嗜酒史, 无冶游史, 无放射性物质、毒物接触史. 家族中无传染病及遗传病等病史.
T38.1 ℃, P133次/分, R34次/分, BP151/86 mmHg, 神志模糊, 不能言语, 不能遵嘱完成指令动作, 持续蓄氧面罩吸氧, 双侧瞳孔正大等圆, 直径约3 mm, 双侧对光反射存在, 胸廓对称, 双肺呼吸音粗, 未闻及干湿性啰音, 心律齐, 心音可, 各瓣膜区未闻及病理性杂音, 腹软, 肝脾未触及, 肝肾区叩痛查体不配合, 腹部查体可见痛苦表情, 无反跳痛及肌紧张, 肠鸣音弱. 双下肢无水肿, 病理征未引出.
血气分析: pH值: 7.49; 二氧化碳分压: 26.1 mmHg; 氧分压: 82.92 mmHg; 血氧饱和度97.47%; 钠离子浓度: 129.75 mmol/L;钾离子浓度: 3.59 mmol/L; 葡萄糖: 12.80 mmol/L; 实际碳酸氢盐19.20 mmol/L; 乳酸: 3.19 mmol/L; 氧合指数: 138.20; 血培养: 单核细胞增多李斯特菌; 粪便产毒艰难梭菌及B毒素基因检测阳性; 巨细胞病毒PCR和EB病毒核酸定量检测均阴性; 脑脊液常规及生化: 淡黄色, 清晰, 白细胞544×106/L, 氯113 mmol/L, 总蛋白6.25 g/L, 葡萄糖6.25 mmol/L脑脊液宏基因组学检测提示单核细胞增生李斯特菌感染.
头颅及胸腹部CT(2022-10-15): 双侧基底节区可见多发小片低密度影, 边界清晰或欠清, 双侧侧脑室周围脑白质可见对称性密度减低, 无占位效应. 右肺中下叶炎症. 结肠肠壁弥漫性增厚, 周围脂肪间隙模糊, 考虑炎性改变.
头颅及胸部CT(2022-10-22): 幕上脑室系统扩张积水, 脑室周围见轮缘状低密度影, 双额深、双侧基底节区多发腔隙性脑梗死、小软化灶. 双侧侧脑室周围可见片状稍低密度影, 边界欠清. 双肺炎症较前范围增大. (2022-10-22). 头颅磁共振弥散成像未见明显异常.
(1)溃疡性结肠炎(慢性复发型, E3, 活动期, 重度); (2)血流感染(单核细胞增生李斯特菌); (3)颅内感染; (4)脑积水; (5)肺部感染.
补液、升压、输血、肠外营养、调节肠道菌群.
补充人血白蛋白、输注免疫球蛋白.
哌拉西林他唑巴坦(4.5 g q8h)、万古霉素(125 mg q6h)鼻饲和甲硝唑(0.5 g q8h)、右侧脑室钻孔引流术、氨苄西林(3 g q6h).
患者昏迷, 意识状态较前无明显改善, 双侧瞳孔直径约2.5 mm, 对光反射未引出, 颈硬, 有抵抗, 四肢肌力肌张力查体不合作, 双侧巴氏征阳性. 家属要求出院, 后随访死亡.
单核细胞增生李斯特菌(Listeria monocytogenes, LM)是一种革兰氏阳性杆菌, 是最常见的食源性胞内寄生菌之一. 它分布广泛, 常见于食物、环境、动物体内, 通常经受污染的食物如乳制品、未煮熟的肉类、冷藏的蔬菜传播致病, 患者大多数是老人、孕妇、新生儿和免疫低下的人群[1]. LM粪便携带状态很常见, 一项独立队列研究显示, 在900个健康的无症状捐赠者的人类粪便样本中, 有10%检测到LM[2]. 结肠镜检查可能加速细菌通过肠上皮细胞造成系统感染[3]. 李斯特菌感染的临床表现多种多样, 包括局部胃肠炎、心内膜炎、关节炎、肝炎等, 容易经循环系统造成中枢神经系统感染. LM是第三常见的社区获得性细菌性脑膜炎致病菌, 即使接受合适的抗生素治疗, 仍有很高的死亡率[4]. Arslan报道称[5]免疫抑制和高龄是神经侵袭性李斯特菌病的重要易患因素. 健康人群接触这些危险因素很少患病, 但高危人群容易引起机会性感染.
溃疡性结肠炎(ulcerative colitis, UC)是一种主要累及结直肠的慢性复发性炎症性疾病.在活动期, 糖皮质激素被用于氨基水杨酸制剂无效者, 尤其是病变较广泛的轻中度患者. 对重度UC, 静脉使用糖皮质激素是首选治疗. 长期或大量使用激素可影响T淋巴细胞数量和活性, 引起细胞免疫功能抑制[6]. 其他治疗药物如免疫抑制剂和抗肿瘤坏死因子制剂也可从不同机制影响细胞免疫功能.而李斯特菌作为胞内寄生菌, 体液免疫抗体对其清除无效, 需要激活的巨噬细胞和T淋巴细胞协助[7], 这可能解释了细胞免疫功能抑制易患李斯特菌感染的原因.
据目前发表的报道, 我们检索到17篇文章, 包括20名溃疡性结肠炎患者合并李斯特菌感染[8-12]. 19名患者均使用了糖皮质激素, 15名患者合用一种或多种免疫抑制剂, 其中使用英夫利昔单抗7名, 硫唑嘌呤5名, 6-巯基嘌呤、地夫可特、甲氨蝶呤各2名, 阿达木单抗、戈利木单抗、维多珠单抗各1名. 75%的患者年龄≥50岁, 3名患者接触过可疑污染食物, 12名患者在疾病活动期接受了结肠镜检查(表1). 本例患者55岁, 有摄入可疑食物和肠道黏膜损害的病史, 接受过结肠镜检查, 在长期大量静脉滴注和口服糖皮质激素后出现李斯特菌性脑膜炎. 因此, 临床上使用糖皮质激素治疗溃疡性结肠炎时, 应建议患者避免食用冷藏冷冻食物, 并需要进行粪便菌群分析, 尽早发现李斯特菌或其他致病菌, 使用肠道清污和补充益生菌防止菌群移位造成系统感染.
| 年龄 | 性别 | 溃疡性结肠炎病史 | 病变范围 | 本次发病是否行结肠镜检查 | Mayo/Matts内镜评分 | 进食可疑食物 | 李斯特菌感染前使用药物 | 感染类型 | 治疗 | 预后 |
| 51 | 女 | 4年 | 直肠和结肠 | 有 | 3 | - | 糖皮质激素、英夫利昔单抗 | 化脓性脑膜炎 | 氨苄西林 | 痊愈 |
| 62 | 男 | 10年 | 直肠和乙状结肠 | 有 | - | 有 | 硫唑嘌呤、糖皮质激素 | 菌血症 | 氨苄西林 | 痊愈 |
| 78 | 男 | - | 直肠到回肠 | 有 | 4* | - | 硫唑嘌呤、糖皮质激素 | 菌血症 | 氨苄西林 | 痊愈 |
| 53 | 男 | 11年 | 直肠和乙状结肠 | 有 | 2 | 有 | 泼尼松龙 | 细菌性脑膜炎、菌血症 | 氨苄西林 | 痊愈 |
| 80 | 男 | - | - | 有 | 3 | - | 泼尼松龙、硫唑嘌呤 | 败血症、脑膜炎 | 氨苄西林 | 痊愈 |
| 78 | 女 | - | 结肠 | 有 | - | 无 | 英夫利昔单抗、甲氨蝶呤 | 菌血症 | 氨苄西林 | 痊愈 |
| 51 | 女 | 3年 | 全结肠 | - | - | - | 泼尼松龙、英夫利昔单抗、阿达木单抗 | 菌血症 | 氨苄西林2 g/天 | 痊愈 |
| 54 | 女 | 30年 | 全结肠 | - | - | - | 泼尼松龙、6-巯基嘌呤、戈里木单抗 | 菌血症 | 氨苄西林1 g/天 | 痊愈 |
| 50 | 男 | 2年 | 回盲部、结肠·、直肠· | 有 | - | 有 | 甲泼尼龙琥珀酸钠、甲泼尼龙片 | 脓毒血症、脑膜脑炎 | 美罗培南 | 痊愈 |
| 35 | 女 | - | 回肠和结肠 | - | - | - | 糖皮质激素、地夫可特、甲氨蝶呤、 | 脑膜炎 | 氨苄西林、庆大霉素 | 痊愈 |
| 60 | 男 | - | - | - | - | - | 糖皮质激素、地夫可特、硫唑嘌呤 | 脑膜炎 | 氨苄西林、庆大霉素 | 痊愈 |
| 40 | 女 | - | - | 有 | - | - | 糖皮质激素、抗肿瘤坏死因子α制剂 | 菌血症 | 氨苄西林、庆大霉素 | 痊愈 |
| 69 | 男 | 3年 | 直肠和乙状结肠 | 有 | - | - | 糖皮质激素、硫唑嘌呤、英夫利昔单抗 | 脑膜炎、菌血症 | 氨苄西林、庆大霉素 | 痊愈 |
| 46 | 女 | - | - | - | - | - | 泼尼松龙 | 菌血症、多发性幕上和脑干脓肿 | 氨苄西林8 g/d、庆大霉素300 mg/d | 痊愈 |
| 37 | 男 | 2个月 | - | 有 | - | - | 氢化可的松、英夫利昔单抗 | 脑膜炎 | 阿莫西林1 g/日、庆大霉素80 mg/3次 | 痊愈 |
| 75 | 男 | 42年 | - | 无 | - | 无 | 泼尼松龙、氢化可的松、英夫利昔单抗 | 脓毒症、脑膜炎 | 美罗培南、利福平、庆大霉素 | 痊愈 |
| 51 | 男 | 32年 | 全结肠 | 有 | 2 | - | 维多珠单抗、泼尼松、甲泼尼龙 | 菌血症 | 庆大霉素425 mg/24 h、氨苄西林2 mg/4 h、阿莫西林1000 mg/8 h | 痊愈 |
| 17 | 男 | 3年 | - | - | - | 无 | 强的松、6-巯基嘌呤、英夫利昔单抗、甲泼尼龙 | 菌血症、脑膜炎 | 美罗培南2000 mg q8h、庆大霉素100 mg q8h、利福平600 mg/d | 痊愈 |
| 77 | 男 | 4年 | - | - | - | - | 糖皮质激素 | 菌血症 | 氨苄西林、庆大霉素、阿莫西林克拉维酸 | 痊愈 |
| 59 | 男 | - | 全结肠、直肠 | 有 | - | - | 泼尼松龙、倍他米松 | 爆发性结肠炎、菌血症 | 全结肠切除术、回肠造瘘术及乙状结肠黏膜造瘘术 | 痊愈 |
本例患者第二次来我院就诊时, 临床医生根据既往病史和脓血便初步诊断为溃疡性结肠炎活动期, 未重视头痛症状, 回顾病历可发现此时已有细菌性脑膜炎征象. 因此当溃疡性结肠炎病人出现发热、头痛、意识障碍, 查体颈项强直、Brudzinski征等脑膜刺激征阳性时, 应警惕李斯特菌性脑膜炎, 并在血培养和脑脊液培养后尽快经验性应用抗生素治疗.由于和其他细菌性脑膜炎相比, 李斯特菌性脑膜炎脑脊液生化分析大多表现为白细胞数、总蛋白浓度不高, 糖含量较低[1,4,13], 早期需要和病毒性脑膜炎相鉴别, 且对头孢菌素不敏感, 目前推荐首选氨苄西林, 它能和李斯特菌的青霉素结合蛋白3(penicillin binding protein 3, PBP3)结合, 显著抑制李斯特菌的活性, 静脉应用能在脑脊液中达到较高的浓度[14]. 如患者超过50岁, 有慢性疾病, 或合并心血管和呼吸系统损害, 排除肾功能异常后可联合庆大霉素[15], 疗程为21 d. 有的案例使用美罗培南[8]、三甲氧嘧啶/磺胺甲噁唑[16]和利福平[17]作为替代治疗, 也取得不错的效果. 但氨苄西林联合庆大霉素疗法在不同的文献中出现矛盾的效果[18], 更规范的治疗方案还需进一步的研究. 此例患者联合哌拉西林他唑巴坦、万古霉素、甲硝唑治疗LM和艰难梭菌后, 意识好转, 脓血便次数减少, 但仅2 d后再次出现昏迷, 这可能和哌拉西林他唑巴坦脑脊液渗透不稳定有关, 而脓血便减少可能是治疗艰难梭菌有效, 掩盖了病情的真实进展. 后改用氨苄西林维持时间短, 患者病情未得到有效控制. 因此建议早期选用易通过血脑屏障, 脑脊液药物浓度高, 维持时间长的抗生素.
综上所述, 在临床工作中, 对长期大量使用糖皮质激素和其他免疫抑制剂治疗溃疡性结肠炎的患者, 要注意单核细胞增生李斯特菌机会性感染, 出现中枢神经系统症状和体征时, 立即行腰椎穿刺和血、脑脊液培养明确病原体, 尽早使用氨苄西林等敏感抗生素治疗以降低死亡率.
学科分类: 胃肠病学和肝病学
手稿来源地: 河北省
同行评议报告学术质量分类
A级 (优秀): A, A
B级 (非常好): 0
C级 (良好): C
D级 (一般): D, D
E级 (差): 0
科学编辑: 张砚梁 制作编辑:张砚梁
| 1. | Schlech WF. Epidemiology and Clinical Manifestations of Listeria monocytogenes Infection. Microbiol Spectr. 2019;7. [PubMed] [DOI] |
| 2. | Hafner L, Pichon M, Burucoa C, Nusser SHA, Moura A, Garcia-Garcera M, Lecuit M. Listeria monocytogenes faecal carriage is common and depends on the gut microbiota. Nat Commun. 2021;12:6826. [PubMed] [DOI] |
| 3. | Minami M, Hasegawa T, Ando T, Maeda O, Ohkura T, Ohta M, Goto H. Post-colonoscopic Listeria septicemia in ulcerative colitis during immunosuppressive therapy. Intern Med. 2007;46:2023-2027. [PubMed] [DOI] |
| 4. | Amaya-Villar R, García-Cabrera E, Sulleiro-Igual E, Fernández-Viladrich P, Fontanals-Aymerich D, Catalán-Alonso P, Rodrigo-Gonzalo de Liria C, Coloma-Conde A, Grill-Díaz F, Guerrero-Espejo A, Pachón J, Prats-Pastor G. Three-year multicenter surveillance of community-acquired Listeria monocytogenes meningitis in adults. BMC Infect Dis. 2010;10:324. [PubMed] [DOI] |
| 5. | Arslan F, Meynet E, Sunbul M, Sipahi OR, Kurtaran B, Kaya S, Inkaya AC, Pagliano P, Sengoz G, Batirel A, Kayaaslan B, Yıldız O, Güven T, Türker N, Midi I, Parlak E, Tosun S, Erol S, Inan A, Oztoprak N, Balkan I, Aksoy Y, Ceylan B, Yılmaz M, Mert A. The clinical features, diagnosis, treatment, and prognosis of neuroinvasive listeriosis: a multinational study. Eur J Clin Microbiol Infect Dis. 2015;34:1213-1221. [PubMed] [DOI] |
| 6. | Lionakis MS, Kontoyiannis DP. Glucocorticoids and invasive fungal infections. Lancet. 2003;362:1828-1838. [PubMed] [DOI] |
| 7. | Vázquez-Boland JA, Kuhn M, Berche P, Chakraborty T, Domínguez-Bernal G, Goebel W, González-Zorn B, Wehland J, Kreft J. Listeria pathogenesis and molecular virulence determinants. Clin Microbiol Rev. 2001;14:584-640. [PubMed] [DOI] |
| 9. | Asaeda K, Okuyama Y, Nakatsugawa Y, Doi T, Yamada S, Nishimura K, Fujii H, Tomatsuri N, Satoh H, Kimura H. [A case of Listeria meningitis with active ulcerative colitis and a review of literature in the Japanese cases]. Nihon Shokakibyo Gakkai Zasshi. 2021;118:148-153. [PubMed] [DOI] |
| 10. | Parihar V, Maguire S, Shahin A, Ahmed Z, O'Sullivan M, Kennedy M, Smyth C, Farrell R. Listeria meningitis complicating a patient with ulcerative colitis on concomitant infliximab and hydrocortisone. Ir J Med Sci. 2016;185:965-967. [PubMed] [DOI] |
| 11. | Seraphin MJ, Isern R, Maclean AK, Heli CM, Shaw MB. Listeria Monocytogenes Septicemia in the Setting of an Ulcerative Colitis Flare. Cureus. 2022;14:e28638. [PubMed] [DOI] |
| 12. | Horigome R, Sato H, Honma T, Terai S. Septicemic listeriosis during adalimumab- and golimumab-based treatment for ulcerative colitis: case presentation and literature review. Clin J Gastroenterol. 2020;13:22-25. [PubMed] [DOI] |
| 13. | Paciorek M, Bienkowski C, Bednarska A, Kowalczyk M, Krogulec D, Makowiecki M, Bursa D, Pula J, Raczynska J, Porowski D, Skrzat-Klapaczynska A, Zielenkiewicz M, Radkowski M, Laskus T, Horban A. The clinical course and outcome of Listeria monocytogenes meningitis: A retrospective single center study. Neuro Endocrinol Lett. 2019;40:79-84. [PubMed] |
| 14. | Sullins AK, Abdel-Rahman SM. Pharmacokinetics of antibacterial agents in the CSF of children and adolescents. Paediatr Drugs. 2013;15:93-117. [PubMed] [DOI] |
| 15. | Temple ME, Nahata MC. Treatment of listeriosis. Ann Pharmacother. 2000;34:656-661. [PubMed] [DOI] |
| 16. | Willson KJ, Jacob A, Shetti MP, Bhatia R, Yee K, Osler W. Listeria monocytogenes infection in Crohn's disease treated with adalimumab. Med J Aust. 2012;197:466-467. [PubMed] [DOI] |
| 17. | Chuang MH, Singh J, Ashouri N, Katz MH, Arrieta AC. Listeria meningitis after infliximab treatment of ulcerative colitis. J Pediatr Gastroenterol Nutr. 2010;50:337-339. [PubMed] [DOI] |