修回日期: 2023-09-16
接受日期: 2023-09-21
在线出版日期: 2023-09-28
四氯化碳(carbon tetrachloride, CCl4)中毒是化工从业人员常见的中毒类型, 但目前尚无特效的临床药物能治疗此类中毒导致的肝、肾、肠损伤.
探索连续性血液透析滤过(continuous blood purification, CBP)对口服CCl4中毒大鼠肝、肾、肠功能的保护作用及其潜在干预机制.
将斯泼累格·多雷大鼠分为对照组、模型组(CCl4)和CBP治疗组(CCl4+CBP), 利用CCl4灌胃建立大鼠模型. 收集外周血用于检测白细胞和中性粒细胞数以及血清尿素氮(blood urea nitrogen, BUN)、肌酐(creatinine, Cr)、C反应蛋白(C-reactive protein, CRP)、谷丙转氨酶(alanine aminotransferase, ALT)、谷草转氨酶(alanine aminotransferase, AST)、D-乳酸(D-lactic acid, D-LA)、肠性脂肪酸结合蛋白(intestinal fatty acid binding protein, I-FABP)和降钙素(procalcitonin, PCT)的水平. 将收集的肝肾肠组织进行相关病理检测, 免疫组化法和免疫印迹法检测核转录因子(nuclear transcription factor-κB, NF-κB)通路的相对表达水平.
CBP处理可显著降低CCl4引起的白细胞和中性粒细胞增多(P<0.05)以及血清BUN、Cr、CRP、ALT、AST、D-LA、I-FABP和PCT的水平的增高(P<0.05), 并降低肾脏组织中损伤标记物中性粒细胞明胶酶相关脂质运载蛋白的表达以及肝、肾、肠相关病理形态改变. 免疫组化和免疫印迹法检测显示, CBP处理能降低CCl4引起的NF-κB通路激活(P<0.05).
CBP对CCl4引起的肝、肾、肠损伤具有保护效果, 其可能通过降低CCl4引起NF-κB通路激活从而改善肝、肾、肠损伤的症状.
核心提要: 在四氯化碳中毒模型大鼠中, 连续性血液透析滤过能减轻肝、肾、肠损伤, 其作用机制可能与其抑制核转录因子通路有关.
引文著录: 包美美, 许盼盼, 吴春丽. 连续性血液透析滤过对四氯化碳模型大鼠肝肾肠功能的保护作用. 世界华人消化杂志 2023; 31(18): 766-772
Revised: September 16, 2023
Accepted: September 21, 2023
Published online: September 28, 2023
Carbon tetrachloride (CCl4) poisoning is a common type of poisoning in chemical workers, but there is no specific clinical drug available to treat liver, kidney, and intestinal injuries caused by this kind of poisoning.
To explore the protective effect of continuous blood purification (CBP) on liver, kidney, and intestinal function in rats with oral CCl4 poisoning and the potential mechanism involved.
Sprague-Dawley rats were divided into control group, model group (CCl4), and CBP treatment group (CCl4 + CBP). The rat model was established by gavage of CCl4. Peripheral blood samples were collected to detect the number of white blood cells and neutrophils, and the levels of blood urea nitrogen (BUN), creatinine (Cr), C-reactive protein (CRP), alanine aminotransferase (ALT), aspartate aminotransferase (AST), D-lactic acid (D-LA), intestinal fatty acid binding protein (I-FABP), and procalcitonin (PCT). Liver, kidney, and intestinal tissues were collected for pathological examination, and the relative protein expression level of nuclear transcription factor-κB (NF-κB) pathway molecules was detected by immunohistochemistry and Western blot.
CBP treatment significantly reduced the increase of white blood cell and neutrophil counts (P < 0.05) and the increase of serum BUN, Cr, CRP, ALT, AST, D-LA, I-FABP and PCT (P < 0.05) induced by CCl4. CBP treatment also reduced the expression of neutrophil gelatinase-associated lipocalin in kidney tissue and the pathological changes in the liver, kidney, and intestine. Immunohistochemistry and Western blot showed that CBP treatment could reduce the activation of the NF-κB pathway induced by CCl4 (P < 0.05).
CBP has a protective effect against liver, kidney, and intestinal injuries induced by CCl4, and it may improve the symptoms of liver, kidney, and intestinal injuries by reducing the activation of the NF-κB pathway induced by CCl4.
- Citation: Bao MM, Xu PP, Wu CL. Protective effect of continuous blood purification on liver, kidney, and intestinal function in rats with oral carbon tetrachloride poisoning. Shijie Huaren Xiaohua Zazhi 2023; 31(18): 766-772
- URL: https://www.wjgnet.com/1009-3079/full/v31/i18/766.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v31.i18.766
肾功能损伤通常由化学毒素、药物过量等毒性因素引起[1]. 四氯化碳(carbon tetrachloride, CCl4)为常见的一种工业溶剂, 是公认的肝毒素[2]. 肝脏并不是CCl4唯一的毒靶器官, 其还在如肾、肠、肺、睾丸、脑和血液等其它器官或组织中诱发自由基的生成并造成损害[3]. 目前已有证据表明接触或误服CCl4可诱发急性和慢性的肝、肾、肠损伤[4], 由此引起的肝、肾、肠功能下降可导致严重的并发症, 严重威胁人类健康. 目前针对此类疾病尚无特异的干预措施. 目前已建立成熟的口服CCl4中毒的相关动物模型, 此可为理解CCl4中毒导致的相关肝、肾、肠等器官损伤的病理生理学机制及开发相关疗法提供极好的模型方法.
Kramer等[5]人于1977年报道了连续动静脉血液滤过作为急性肾衰竭患者的治疗方案. 此后, 源自此策略的一系列治疗模式被命名为连续性肾脏替代疗法, 也称为连续性血液净化或连续性血液透析滤过(continuous blood purification, CBP)[6]. 近年来, CBP在清除重大疾病中的炎症介质中的应用一直是危重病医学研究的热点. 口服CCl4中毒诱导器官损伤的动物模型可模拟临床中常见的急性肝、肾、肠损伤疾病模型. 在本研究中, 我们探究了CBP对CCl4引起的肝、肾、肠损伤的潜在保护作用.
核转录因子(nuclear transcription factor-κB, NF-κB)p65(A2547)和中性粒细胞明胶酶相关脂质运载蛋白(neutrophil gelatinase-associated lipocalin, NGAL)抗体(A3176)购自武汉爱博泰克生物科技有限公司; 甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase, GAPDH)(AF1186)抗体、辣根过氧化物酶(horseradish peroxidase,HRP)标记山羊抗兔二抗(A0208)、花青素3(cyanine 3, Cy3)缀合的山羊抗兔二抗(A0516)、蛋白裂解液(P0013C)、考马斯亮蓝法蛋白测定试剂盒(P0006C)和BeyoECL增强发光试剂盒(P0018S)购自上海碧云天生物技术有限公司; 血尿素氮(blood urea nitrogen, BUN)(C013-2-1)、C反应蛋白(C-reactive protein, CRP)(H126-1-2)、肌酐(creatinine, Cr)(C011-2-1)、谷丙转氨酶(alanine transaminase, ALT)(C009-3-1)、谷草转氨酶(aspartate transaminase, AST)(C010-3-1)、D-乳酸(D-lactic acid, D-LA)(A019-2-1)、肠性脂肪酸结合蛋白(intestinal fatty acid-binding protein, I-FABP)(H265-1-1)和降钙素(procalcitonin, PCT)(H153)检测试剂盒购自南京建成生物工程研究所; 免疫组化链霉菌抗生物素蛋白-过氧化物酶连结(streptavidin-perosidase, SP)法检测试剂盒(SP0021)购自北京索莱宝科技有限公司.
1.2.1 实验动物及分组处理: 18只雄性7 wk龄斯泼累格·多雷(Sprague Dawley, SD)大鼠(200 g-230 g)购自杭州启真实验动物科技有限公司(SCXK(浙)2022-0005), 在维持22 ℃-25 ℃和保持12 h/12 h的光/暗循环的屏障环境中饲养, 自由进食和饮水. 在实验中, 将大鼠随机分为三组: 对照组、模型组(CCl4)和CBP治疗组(CCl4+CBP), 每组纳入6只SD大鼠. 对照组大鼠灌胃生理盐水, CCl4组和CCl4+CBP组给大鼠灌胃CCl4(溶于11%橄榄油), 剂量为1 mL/kg. CBP治疗方法参照文献[7], 通过右颈内静脉插入双向留置导管, 形成体外循环系统, 用稀释法以200 mL/min的流速注入替代液, 在连接导管前, 用肝素-生理盐水(5000 U/L)循环冲洗右颈内静脉30 min, 治疗期间用1500 U/h的肝素持续抗凝, 透析处理持续24 h. 实验第3天, 收集大鼠眼眶静脉血2.5 mL, 麻醉后处死大鼠, 立即取出肝脏、肾脏和肠, 用生理盐水冲洗3次以去除血液, 然后分为俩部分, 一部分用石蜡包埋用于后续病理研究, 另一部分储存在80 ℃下用于蛋白免疫印迹检测. 实验程序按照实验动物管理和使用的指导原则进行.
1.2.2 血生化测定: 每只大鼠取0.3 mL静脉血用EDTA-K2抗凝后, 用VH20型血细胞分析仪(深圳市锦瑞生物科技股份有限公司)对血中白细胞(white blood cell, WBC)和中性粒细胞(neutrophil, NEU)计数. 剩余外周静脉血以2500 rpm离心5 min, 收集血清, 并根据试剂盒说明书步骤检测血清中BUN、CRP、Cr、ALT、AST、D-LA、I-FABP和PCT水平.
1.2.3 苏木精-伊红(hematoxylin-eosin, HE)染色组织病理学: 将石蜡包埋的肝、肾和肠组织切为6 μm厚的切片. 将切片用二甲苯脱蜡, 然后在从高到低不同浓度的酒精中对组织进行再水合. 组织切片行HE染色. 在CX23型光学显微镜(日本Olympus公司)下观察.
1.2.4 免疫荧光和免疫组化染色: 将不同分组的组织切片按上述方法进行脱蜡水合后, 分别进行免疫荧光和免疫组化染色. 对于免疫荧光染色, 肾组织切片用10%山羊血清室温封闭1 h, 滴加抗NGAL抗体(1:500)在4 ℃下孵育过夜, 洗片后, 用Cy3缀合的山羊抗兔二抗(1:500)在37 ℃下避光孵育60 min, 切片用4',6-二脒基-2-苯基吲哚(4',6-diamidino-2-phenylindole, DAPI)复染, 在BX53M型荧光显微镜(日本Olympus公司)下观察. 对于免疫组化染色, 按免疫组化SP法检测试剂盒说明书步骤, 组织切片经3%双氧水处理和10%山羊血清室温封闭后, 滴加NF-κB p65抗体(1:300)在4 ℃下孵育过夜, 按SP法进行免疫组化, 二氨基联苯胺(diaminobenzidine, DAB)显色, 在CX23型光学显微镜下观察.
1.2.5 蛋白质免疫印迹检测: 分别将肝、肾和肠组织切成大小大致相同的小块, 以150-250 μL/20 mg组织的比例加入蛋白质裂解缓冲液(含1%蛋白酶磷酸酶抑制剂), 匀浆, 在冰上裂解30 min以完全溶解组织. 在4 ℃下裂解的样品以12000 rpm离心10 min. 用考马斯亮蓝法蛋白测定试剂盒测量上清液中的蛋白浓度. 取含等量蛋白的裂解上清液通过10%十二烷基硫酸钠聚丙烯酰氨凝胶电泳分离目标蛋白, 并转印到聚偏二氟乙烯膜上. 封闭后, 加入NF-κB p65抗体(1:2000)和GAPDH抗体(1:8000)4 ℃下孵育过夜. 用0.5%吐温20缓冲液冲洗膜后, 室温下孵育HRP标记山羊抗兔二抗(1:2000)1 h. 用BeyoECL增强发光试剂盒显像, 用Image J软件量化NF-κB p65蛋白的相对表达水平.
统计学处理 用GraphPad Prism 8.0.0软件分析数据, 结果表示为均数±标准差(mean±SD). 用单因素方差分析组间差异. P<0.05的值表示差异有统计学意义.
首先通过血液生化法检测了创伤/炎性指标(WBC和NEU细胞计数、CRP和PCT水平)、肾功能指标(BUN和Cr水平)、肝功能指标(ALT和AST水平)和肠功能指标(D-LA和I-FABP水平). 表1结果所示, CCl4导致大鼠肝肾肠损伤, 表现为WBC和NEU细胞增多(P<0.05)、CRP、PCT、BUN、Cr、ALT、AST、D-LA和I-FABP水平均显著升高(均P<0.05), 而CBP能有效降低CCl4诱导的上述指标(均P<0.05).
| Group | WBC (109/L) | NEU (109/L) | CRP (mg/L) | PCT (mg/L) | BUN (mmol/L) | Cr (μmol/L) | ALT (U/L) | AST (U/L) | D-LA (mmol/L) | I-FABP (ng/L) |
| Ctrl | 7.52±0.93 | 6.24±1.25 | 5.86±0.64 | 0.13±0.02 | 3.15±0.73 | 31.43±5.89 | 46.78±7.54 | 92.43±21.34 | 0.65±0.12 | 8.78±1.35 |
| CCl4 | 25.35±4.54a | 42.18±5.26c | 47.52±6.74e | 4.54±0.82g | 12.56±1.48i | 75.62±9.41k | 302.44±56.38m | 775.73±113.51o | 1.65±0.25q | 21.44±4.56s |
| CCl4+CBP | 12.43±2.89ab | 15.59±1.83cd | 17.38±2.35ef | 0.83±0.15gh | 7.44±1.25ij | 48.14±5.25kl | 124.32±32.26mn | 223.38±54.26op | 0.86±0.17qr | 13.26±2.49st |
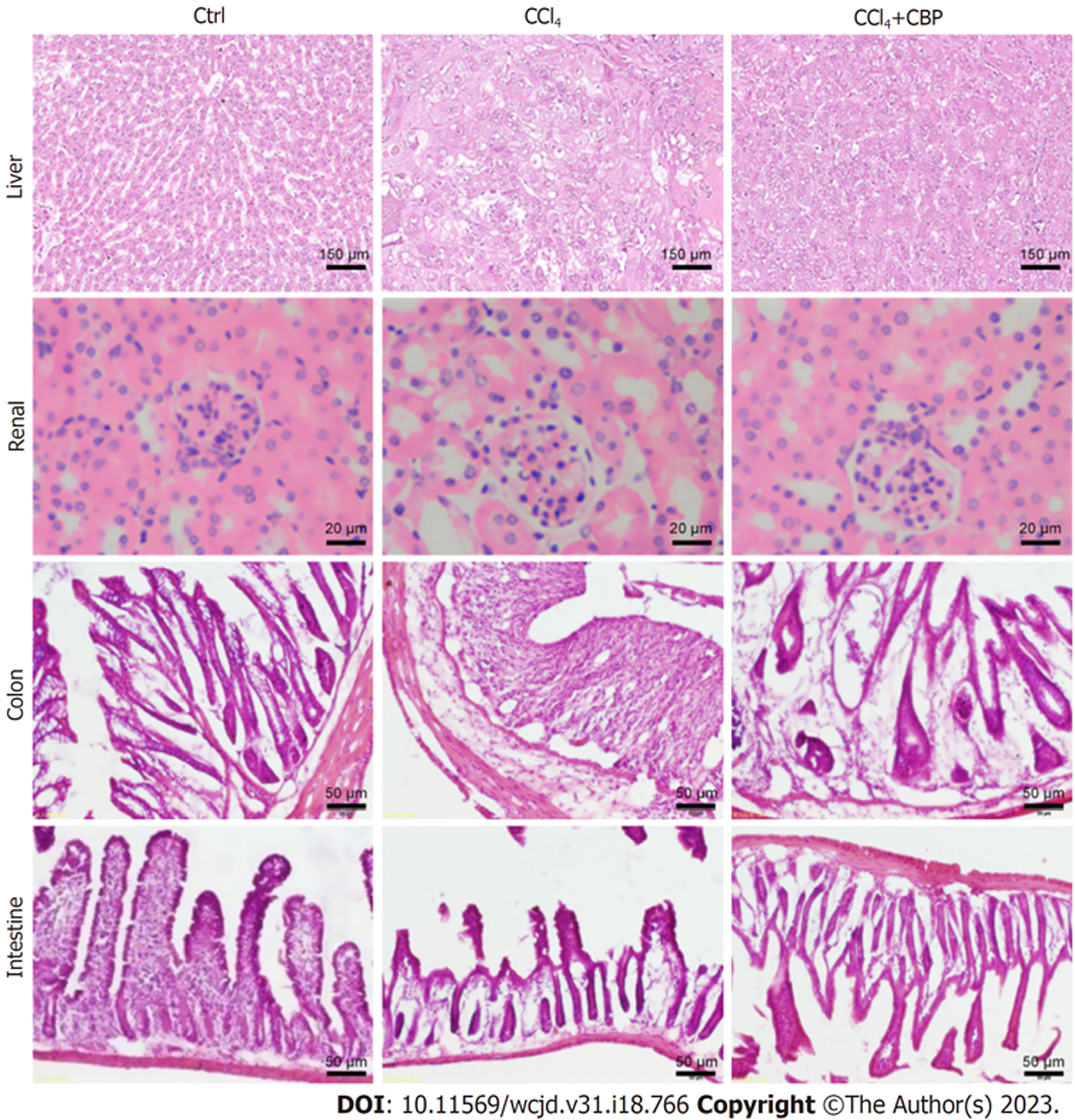
本研究对CBP参与改善CCl4模型大鼠肝、肾、肠组织病理形态表现进行了HE染色观察检测. 对照组大鼠的肝、肾、结肠和小肠的病理形态正常. CCl4组大鼠的肝、肾、肠组织病理形态学均发生了明显改变, 表现为: 肝实质肝细胞呈灶状或带状坏死、细胞凋亡和气球样变、汇管区和肝小叶内炎性细胞浸润; 肾小管部分上皮细胞空泡变性、系膜基质扩张且有明显的肾小球肥大及肾小球体积增加; 小肠和结肠组织的绒毛变短和结构不清晰、绒毛黏膜上皮层的上皮细胞受到破坏. CCl4+CBP组大鼠的肝、肾、肠组织病理形态学均较CCl4组得到明显改善. 具体见图1所示.
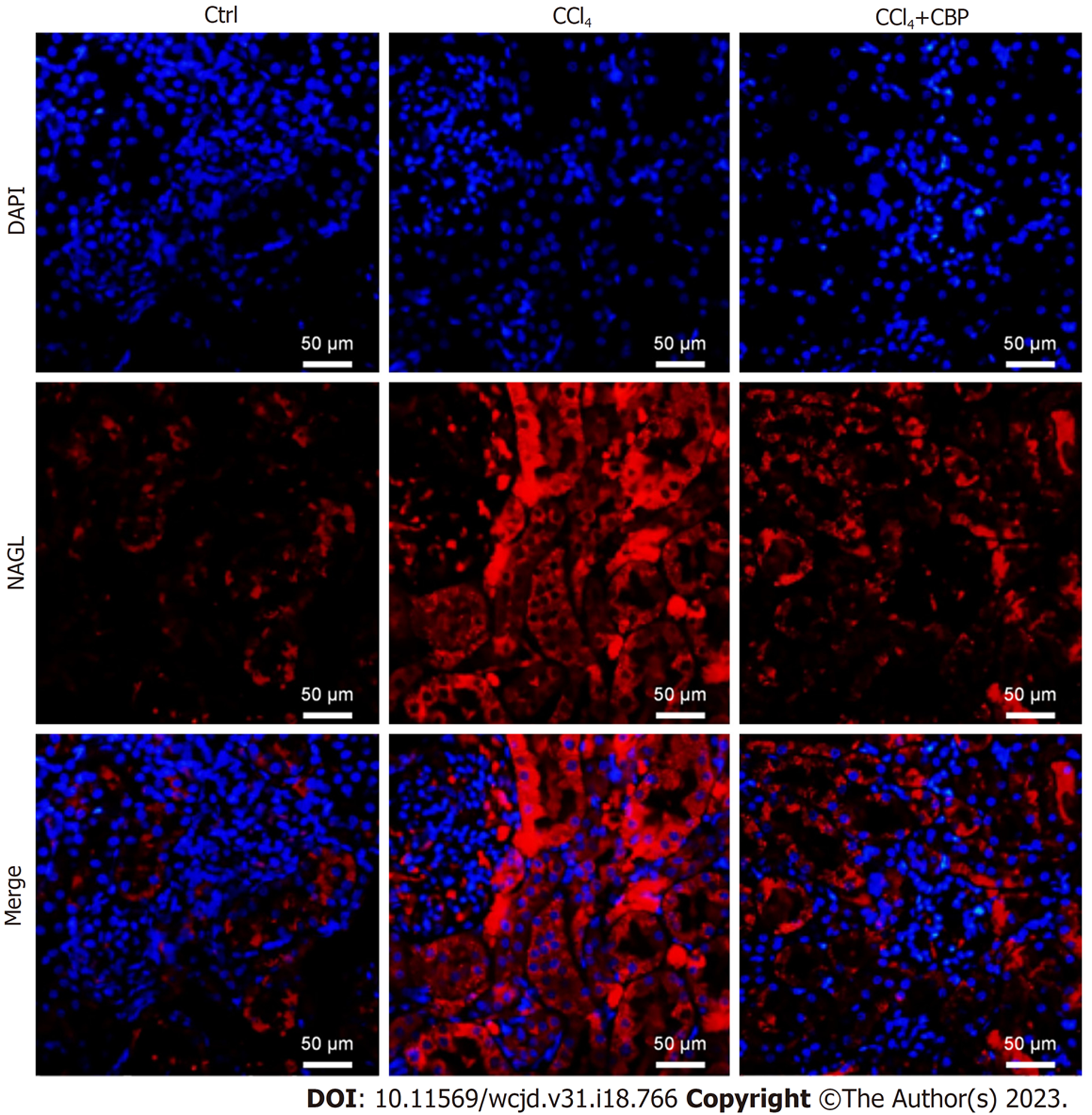
本研究进一步采用免疫荧光标记NGAL评估了CBP对CCl4模型大鼠肾损伤的影响, 荧光染色(图2)显示, CCl4组急性肾损伤的生物标志物NAGL的荧光表达丰度较对照组明显增高, 说明CCl4组大鼠发生了肾损伤; 而CCl4+CBP组肾组织中NAGL表达较CCl4组明显降低, 说明CBP能降低CCl4导致的肾损伤.
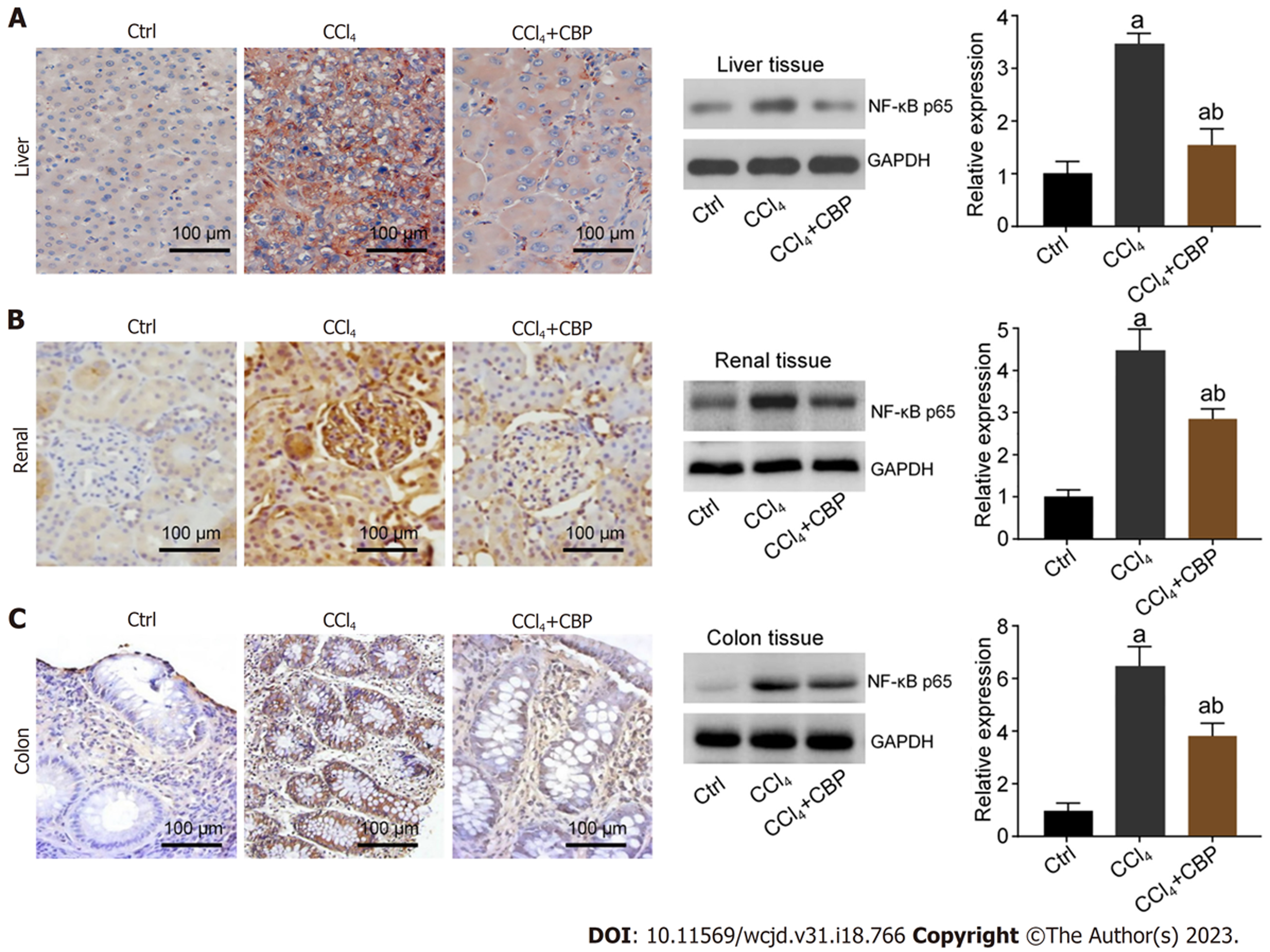
为研究CBP对CCl4诱发肝、肾、肠损伤的保护作用的机制, 本研究采用免疫组织化学法和蛋白免疫印迹法检测肝、肾、肠组织中NF-κB的表达情况, 图3结果显示, CCl4诱导了肝、肾、肠组织中NF-κB p65表达上调(P<0.05); 而CBP则有效降低了CCl4导致该通路激活, 即: NF-κB p65表达较CCl4组明显降低(P<0.05).
CCl4中毒主要见于是二氯二氟甲烷、三氯氟甲烷及氯仿等化工从业人员. 常见的CCl4中毒方式包括吸入高浓度CCl4蒸汽中毒和接触、口服CCl4中毒. 尽管CCl4中毒方式存在差异, 但CCl4最为突出的是肝脏损害, 另外肾脏也为CCl4损伤靶器官, 其还能引起胃肠功能紊乱和其他靶器官损伤[3,4,8,9], 而目前尚无特效药物对此类损伤进行干预. 近来研究认为, CBP不仅可维持机体水平衡和排泄代谢产物, 还可调节炎症和促进器官恢复, 尤其是肾衰竭相关疾病的重要治疗策略[10,11]. 另外, CBP也常用于其他急性器官损伤的治疗[12], 但其确切机制尚不清楚. 本研究通过CCl4口服(灌胃)法建立了大鼠的急性内脏损伤模型, 并在此探索了CBP对CCl4引起内脏损伤的保护性作用效果, 发现其可改善CCl4导致的大鼠肝、肾、肠损伤, 并初步揭示了其作用可能与抑制NF-κB信号活性有关.
众所周知, 过度的炎性反应是急性多器官损伤发生的关键病理学因素. 炎性介质的释放, 刺激细胞因子(如肿瘤坏死因子-α、白细胞介素-6和白细胞介素-1β等)、趋化因子和粘附分子的产生, 级联放大反应, 进一步增强了炎性损伤[13]. 另一方面, 活性氧的产生能导致氧化应激和线粒体损伤, 加剧炎性反应和细胞凋亡[14]. 因此, 抑制炎性微环境在治疗急性器官损伤中起着重要作用. 本研究显示, CBP能降低CCl4造模大鼠外周血中WBC和NEU细胞计数以及血清CRP和PCT水平, 体现了CBP能清除促炎性介质的能力. 此外, 本研究以肾功能(BUN和Cr水平)、肝功能(ALT和AST水平)和肠功能(D-LA和I-FABP水平)生化标记物、组织形态学表现以及肾组织损伤标志物水平的改变证实了CBP对CCl4造成的肝、肾、肠损伤的治疗效果.
既往研究证实了NF-κB信号通路可通过炎性反应参与调节急性器官损伤的进展[15,16]. NF-κB信号通路在组织中的改变与损伤发生及缓解密切相关, 其被认为是急性器官损伤中的细胞因子信号通路、细胞应激反应和炎症因子生成的关键中枢信号通路[15-18]. 已有研究表明, 抑制NF-κB信号通路能减轻CCl4导致的动物模型中肺、肝、肾和肠损伤[17,19-21]. 为探讨CBP对CCl4造成的内脏损伤的改善作用是否与NF-κB通路有关, 我们实验分析了各组肝、肾和肠组织中NF-κB p65表达, 发现NF-κB p65在CCl4造模大鼠中高表达, 而给予CBP治疗后其表达降低, 提示CBP可能至少通过抑制CCl4肝、肾和肠组织中NF-κB信号激活, 进而改善急性器官损伤的炎性反应以及损伤症状; 但其中涉及的具体机制仍需进一步阐明.
总之, 本研究提示CBP可改善CCl4造成的肝、肾和肠损伤, 其机制至少与抑制NF-κB信号介导的炎性反应有关, 但具有机制仍需进一步阐明. 另外, 本研究还提示了CBP治疗可能是治疗肝、肾和肠损伤尤其是肾损伤的潜在候选干预策略. 在应对器官损伤时, 应严格考虑多器官并发损伤的潜在因素, 尤其存在肾损伤可能时应及时给予CBP治疗.
四氯化碳中毒可引起肝脏、肾脏和肠等器官损伤, 而目前针对此类损伤尚无特效的干预措施.
连续性血液透析滤过是急重性内脏器官损伤的常见干预措施, 而其对四氯化碳中毒可引起肝脏、肾脏和肠等器官损伤的干预效果尚不清楚.
以灌胃法建立四氯化碳中毒模型大鼠, 观察连续性血液透析滤过是否对四氯化碳中毒大鼠的肝、肾、肠发挥器官保护作用.
收集大鼠外周血及肝、肾和肠组织, 进行血液生化检测和病理学检测. 免疫荧光法观察肾损伤标记物中性粒细胞明胶酶相关脂质运载蛋白表达, 免疫组织化学和免疫印迹法检测核转录因子p65的表达.
连续性血液透析滤过改善四氯化碳中毒大鼠的血液生化指标及肝、肾、肠组织的病理学形态, 降低肾组织中性粒细胞明胶酶相关脂质运载蛋白的表达及肝、肾、肠组织中核转录因子p65的表达.
连续性血液透析滤过能对四氯化碳中毒大鼠的肝、肾、肠发挥器官保护作用.
连续性血液透析滤过可能是四氯化碳中毒的潜在候选干预策略, 特别是存在肾损伤可能时应及时给予连续性血液透析滤过干预.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告学术质量分类
A级 (优秀): A
B级 (非常好): 0
C级 (良好): C, C, C
D级 (一般): D
E级 (差): 0
科学编辑: 张砚梁 制作编辑:张砚梁
| 4. | Nautiyal N, Maheshwari D, Tripathi DM, Kumar D, Kumari R, Gupta S, Sharma S, Mohanty S, Parasar A, Bihari C, Biswas S, Rastogi A, Maiwall R, Kumar A, Sarin SK. Establishment of a murine model of acute-on-chronic liver failure with multi-organ dysfunction. Hepatol Int. 2021;15:1389-1401. [PubMed] [DOI] |
| 5. | Kramer P, Matthias C, Matthaei D, Scheler F. Elimination of cardiac glycosides through hemofiltration. J Dial. 1977;1:689-695. [PubMed] [DOI] |
| 7. | Ling L, Wen QK, Zhang SH, Zhi LD, Li H, Li G, Zhang WJ. Continuous Blood Purification Ameliorates Multiple Organ Failure Through Inhibiting the Activation of the P38 MAPK Signaling Pathway in a Rat Model. Kidney Blood Press Res. 2018;43:938-950. [PubMed] [DOI] |
| 8. | Unsal V, Cicek M, Sabancilar İ. Toxicity of carbon tetrachloride, free radicals and role of antioxidants. Rev Environ Health. 2021;36:279-295. [PubMed] [DOI] |
| 9. | Zheng Y, Cui B, Sun W, Wang S, Huang X, Gao H, Gao F, Cheng Q, Lu L, An Y, Li X, Sun N. Potential Crosstalk between Liver and Extra-liver Organs in Mouse Models of Acute Liver Injury. Int J Biol Sci. 2020;16:1166-1179. [PubMed] [DOI] |
| 12. | 王 建文, 彭 佑铭, 陈 星, 吴 鸿. 连续性血液透析滤过在多器官功能障碍综合征治疗中的应用及疗效评价. 中国中西医结合肾病杂志. 2005;6:523-525. [DOI] |
| 13. | 吴 莲凤, 陆 红, 洪 炜龙, 张 行, 刘 乐平, 白 永恒. M1/M2型巨噬细胞极化参与肾组织炎症损伤和修复进程. 中国病理生理杂志. 2017;33:2245-2251. [DOI] |
| 15. | Li ZL, Ji JL, Wen Y, Cao JY, Kharbuja N, Ni WJ, Yin D, Feng ST, Liu H, Lv LL, Liu BC, Wang B. HIF-1α is transcriptionally regulated by NF-κB in acute kidney injury. Am J Physiol Renal Physiol. 2021;321:F225-F235. [PubMed] [DOI] |
| 16. | Alharbi KS, Fuloria NK, Fuloria S, Rahman SB, Al-Malki WH, Javed Shaikh MA, Thangavelu L, Singh SK, Rama Raju Allam VS, Jha NK, Chellappan DK, Dua K, Gupta G. Nuclear factor-kappa B and its role in inflammatory lung disease. Chem Biol Interact. 2021;345:109568. [PubMed] [DOI] |
| 17. | Dai C, Li H, Wang Y, Tang S, Velkov T, Shen J. Inhibition of Oxidative Stress and ALOX12 and NF-κB Pathways Contribute to the Protective Effect of Baicalein on Carbon Tetrachloride-Induced Acute Liver Injury. Antioxidants (Basel). 2021;10. [PubMed] [DOI] |
| 18. | Ren Q, Guo F, Tao S, Huang R, Ma L, Fu P. Flavonoid fisetin alleviates kidney inflammation and apoptosis via inhibiting Src-mediated NF-κB p65 and MAPK signaling pathways in septic AKI mice. Biomed Pharmacother. 2020;122:109772. [PubMed] [DOI] |
| 19. | Ma JQ, Li Z, Xie WR, Liu CM, Liu SS. Quercetin protects mouse liver against CCl4-induced inflammation by the TLR2/4 and MAPK/NF-κB pathway. Int Immunopharmacol. 2015;28:531-539. [PubMed] [DOI] |
| 20. | Aslan A, Gok O, Beyaz S, Ağca CA, Erman O, Zerek A. Ellagic acid prevents kidney injury and oxidative damage via regulation of Nrf-2/NF-κB signaling in carbon tetrachloride induced rats. Mol Biol Rep. 2020;47:7959-7970. [PubMed] [DOI] |
| 21. | Zhang Z, Zhang L, Zhang Q, Liu B, Li F, Xin Y, Duan Z. HO-1/CO Maintains Intestinal Barrier Integrity through NF-κB/MLCK Pathway in Intestinal HO-1(-/-) Mice. Oxid Med Cell Longev. 2021;2021:6620873. [PubMed] [DOI] |