修回日期: 2022-10-31
接受日期: 2022-12-21
在线出版日期: 2023-01-08
原发性小肠淋巴瘤发病率较低, 多发于回肠末端, 与克罗恩病、肠结核、肠白塞病不易鉴别. 临床以腹痛、腹部肿块多见, 但症状缺乏特异性. 诊断主要依靠病理.
该患者因腹痛、腹泻数月伴黑便就诊, 于当地医院多次行内镜、电子计算机断层扫描及病理检查诊断为克罗恩病, 并先后予以抗炎、抑酸、营养支持, 以及生物制剂(英夫利西单抗)治疗, 但病情逐渐进展. 入院后开腹探查, 行小肠部分切除术, 根据术后病理及免疫组化结果诊断为小肠淋巴瘤.
小肠淋巴瘤和克罗恩病的临床表现、实验室检查、内镜及影像学表现相似, 有时临床诊断困难, 手术切除标本的组织病理可明确诊断. 本文对此病例误诊的原因进行分析, 旨在提高临床医生对两种疾病的认识和诊断水平, 减少类似的误诊或漏诊.
核心提要: 原发性小肠T细胞淋巴瘤与克罗恩病的临床症状、辅助检查结果相似, 临床鉴别诊断较困难, 病理学有助于明确鉴别. 本文对一例误诊为克罗恩病的小肠T细胞淋巴瘤病例进行分析, 以期提高临床医生的认知和鉴别诊断能力.
引文著录: 张冠群, 吴维, 王晓蕾, 冯砅锦, 赵玉洁. 误诊为克罗恩病的小肠T细胞淋巴瘤1例. 世界华人消化杂志 2023; 31(1): 35-40
Revised: October 31, 2022
Accepted: December 21, 2022
Published online: January 8, 2023
Primary intestinal lymphoma has a low incidence rate. It usually occurs at the end of the ileum and is thus difficult to distinguish from intestinal tuberculosis, Crohn's disease, and Behcet's disease. The common symptoms are abdominal pain and abdominal mass, but the clinical manifestations are not specific. The diagnosis mainly depends on pathological results. It is easy to cause misdiagnosis or missed diagnosis clinically.
A 43-year-old man was diagnosed as having Crohn's disease by endoscopy, abdominal computed tomography, and pathological examination at a local hospital due to abdominal pain and diarrhea for several months followed by melena for one week. He was successively treated with anti-infection therapy, acid suppression, nutritional support, and biological agents (Remicade), which finally resulted in a worse condition. After admission to our hospital, open exploration and partial resection of the small intestine were performed. According to the results of postoperative pathology and immunohistochemistry, the patient was diagnosed as having intestinal lymphoma.
Small intestinal lymphoma and Crohn's disease are similar in clinical manifestation as well as laboratory, endoscopic, and imaging findings. Sometimes it is difficult to distinguish small intestinal lymphoma from Crohn's disease and make an accurate diagnosis. The histopathological characteristics of surgical specimens can be clearly diagnosed. This paper analyzes the causes of misdiagnosis of this case, in order to improve clinicians' understanding and diagnosis of the two diseases and reduce misdiagnosis or missed diagnosis.
- Citation: Zhang GQ, Wu W, Wang XL, Feng LJ, Zhao YJ. Intestinal lymphoma misdiagnosed as Crohn's disease: A case report. Shijie Huaren Xiaohua Zazhi 2023; 31(1): 35-40
- URL: https://www.wjgnet.com/1009-3079/full/v31/i1/35.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v31.i1.35
原发性胃肠道淋巴瘤(primary gastrointestinal lymphoma, PGIL)占非霍奇金淋巴瘤的10%-15%, 是常见的结外淋巴瘤, 大多数发生于胃, 20%-30%发生于小肠. 病理上弥漫性大B细胞淋巴瘤多见, 好发于胃部; T细胞淋巴瘤较少, 多累及肠道[1], 发病率随消化道位置降低而增加[2]. 现将我院1例误诊为克罗恩病的小肠T细胞淋巴瘤报道如下.
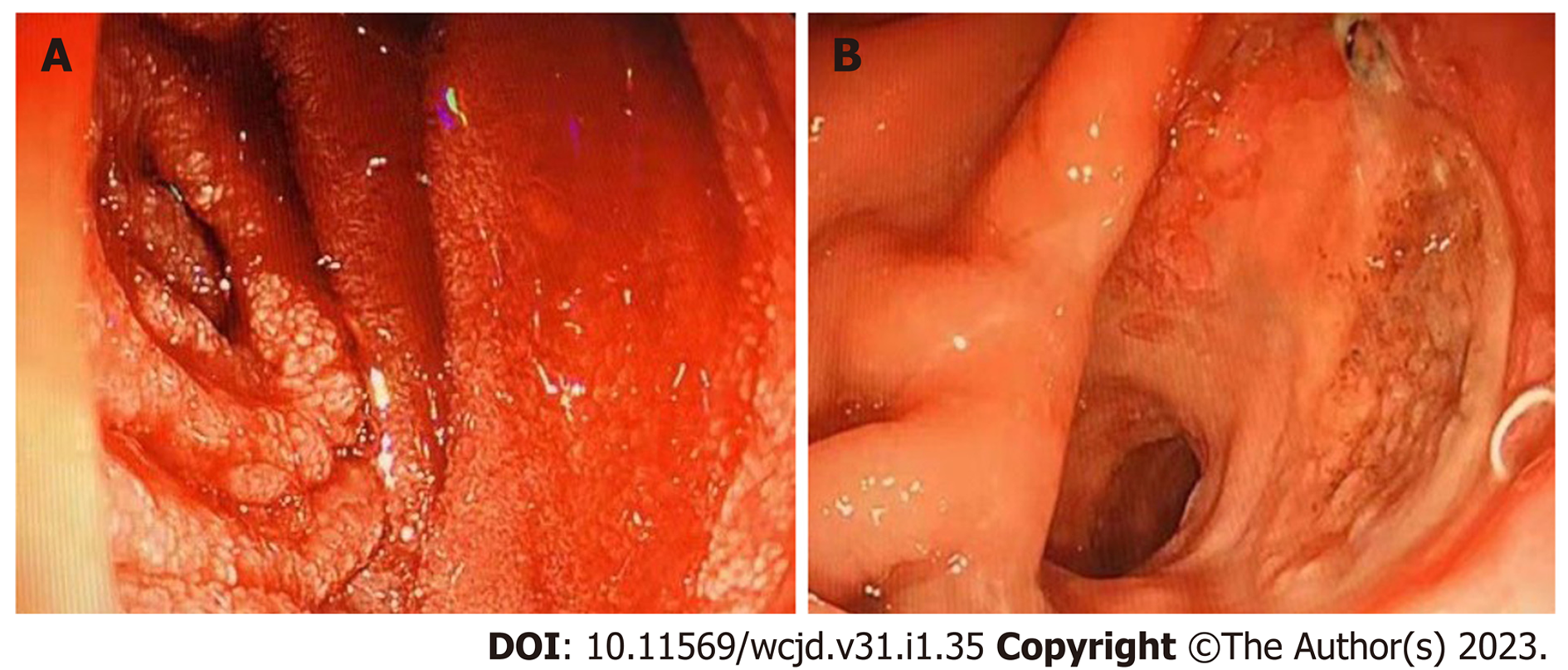
患者, 男, 43岁, 因"腹泻8月余伴腹痛, 黑便1周"于2021-08-20入我院. 患者2020-12出现腹泻, 3-4次/日, 稀水样, 无黏液脓血, 自行服用中药治疗. 2021-02无明显诱因出现左上腹痛伴腹胀, 进食后加重, 解不成形便2-3次/日, 当地医院胃镜示: 十二指肠降部多发大小不一、不规则溃疡, 上覆厚白苔, 病理提示: (十二指肠降部)急慢性炎, 大部分上皮缺失, 局灶见肉芽组织形成, 间质内稍多嗜酸性粒细胞浸润(约45个/HPF). 给予抑酸护胃等治疗症状无缓解, 遂于2021-03-02行小肠电子计算机断层扫描(computed tomography, CT)示: (第二组)近段空肠局部肠壁增厚, 周围淋巴结增大, 考虑恶性肿瘤可能, 远端肠壁考虑炎性病变, 十二指肠淤滞综合征. 进一步行小肠镜检查: 进镜至第三组小肠, 见上段空肠节段性不规则及环周深浅不一的溃疡, 有一瘘道. 病理提示: 小肠黏膜急慢性炎症, 见炎性渗出、坏死组织及肉芽组织, 血管周围微脓肿, 考虑炎症性肠病. 临床考虑克罗恩病, 给予美沙拉嗪口服结合抗炎抑酸治疗. 同月患者至当地上级医院诊治, 复查胃镜(2021-03-18)示十二指肠水平部溃疡(克罗恩病?), 病理: (十二指肠水平部)黏膜慢性活动性炎性溃疡形成, 肉芽组织增生, 间质内见嗜酸性粒细胞浸润, 可见血管炎, 炎症性肠病、白塞病待排. 上级医院排除结核后分别于03-19、04-02、04-30、05-28给予英夫利西单抗(类克)300 mg治疗, 症状略好转. 2021-05患者再次出现左上腹持续隐痛伴明显乏力, 左上腹可触及包块, 2021-06-21当地复查腹部CT示: 左腹部局部肠壁增厚并肠腔扩张, 胰头占位, 腹腔及腹膜后淋巴结肿大, 十二指肠水平段肠腔狭窄. 2021-06-23复查小肠镜见: 十二指肠狭窄扩张, 考虑内瘘可能. 病理: 十二指肠水平部溃疡面组织一块, 未见肠上皮. 次日患者腹痛加重, 消化道造影提示十二指肠穿孔, 右下主支气管显影, 考虑呛咳, 食管气管瘘待排. 遂于2021-07-05行胃空肠短路吻合术, 术后再次类克治疗. 患者营养差, 当地医院在置入空肠营养管过程中发现大量消化道出血, 当时胃镜(图1)示: 食管黏膜光滑, 胃内有少量暗红色血迹潴留, 吸尽液体后观察胃体胃底黏膜光滑. 胃窦、小肠吻合口见巨大溃疡, 大小约3 cm×2.5 cm, 上覆白苔, 可见吻合钉, 入吻合口约10 cm小肠见另一吻合钉, 旁有不规则溃疡, 所见小肠黏膜粗糙呈白色颗粒或鱼鳞状改变, 有大量暗红色血液, 但未发现明显的出血灶. 将空肠管越过吻合口约20 cm处小肠.
此后患者每日解5-8次黑色稀水样便, 血红蛋白下降至55 g/L, 为进一步诊治拟"克罗恩病"入院. 当日平车推入病房, 入院时神志清楚, 精神萎软, 重度营养不良, 体型极度消瘦. 患者否认高血压病、糖尿病、冠心病等慢性病史, 否认传染病史, 余个人史及家族史无特殊.
体格检查: 体温36.5 ℃, 脉搏108次/min, 呼吸22次/min, 血压106/60 mmHg(1 mmHg = 0.133 kPa). 空肠营养管置入中, 见胃肠减压器中有暗黑色液体, 腹部可见陈旧性手术瘢痕, 蛙状腹, 腹部触诊不满意, 全腹无明显压痛、反跳痛, 左上腹似扪及一包块, 大小约4 cm, 可活动, 质地中, 余无明显阳性体征.
实验室检查(2021-08-20): 白细胞计数4.59×109/L, 中性粒细胞百分比81.7%, 淋巴细胞11.8%, 红细胞计数1.59×1012/L, 血红蛋白50 g/L, 红细胞比积15.3%, 血小板计数163×109/L, C反应蛋白103.60 mg/L, 白蛋白18 g/L, 引流液隐血试验(++++), 粪转铁蛋白阳性. 肿瘤标志物CEA1.39 ng/mL, CA50 111.20 U/mL, CA125 124.00 U/mL, CA199 114.10 U/mL. 粪培养、粪便寄生虫阴性, 巨细胞病毒抗体、EB病毒抗体阴性, 抗核抗体阴性, 结核感染T细胞检测阴性, 余无明显异常.
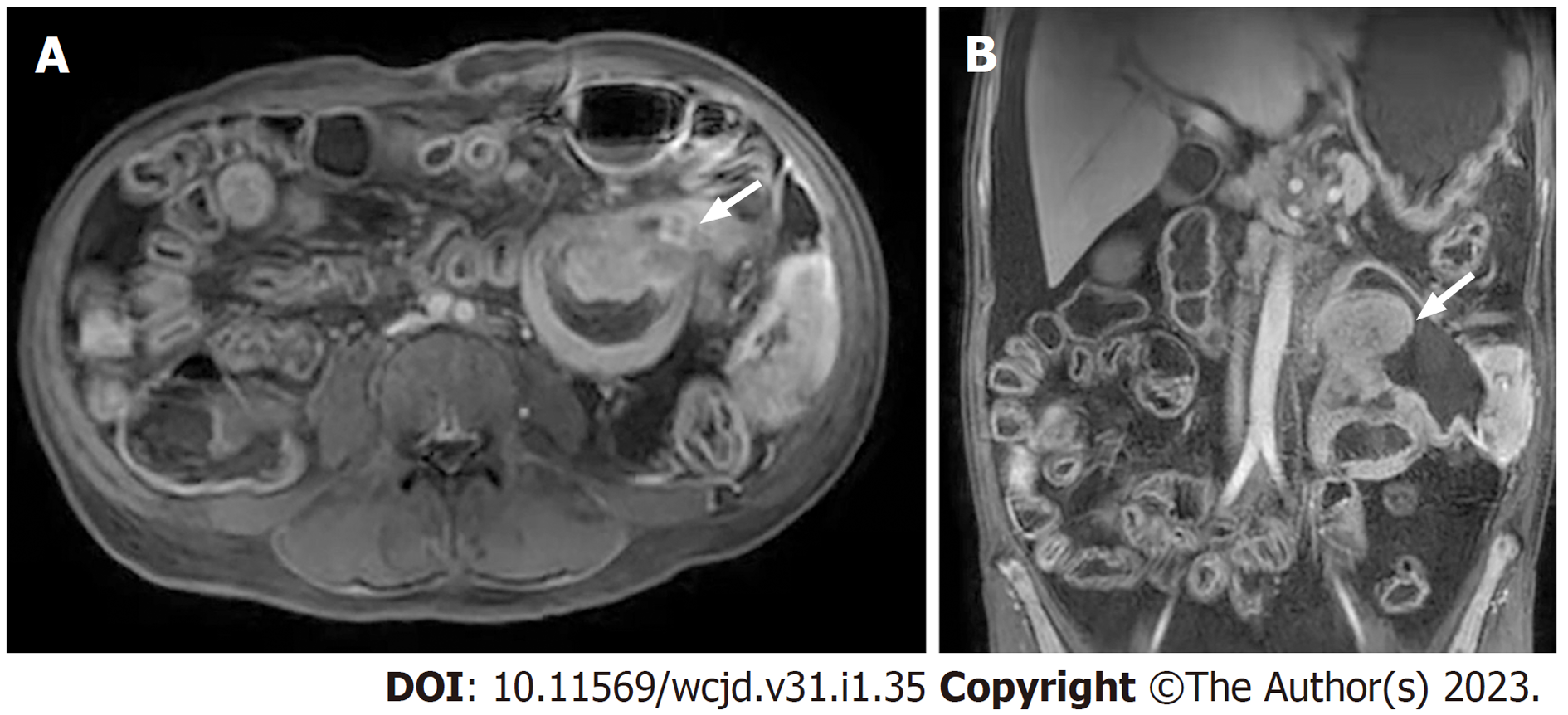
小肠磁共振成像(2021-08-26)(图2): 左中、上腹空肠占位, 腹腔脂肪间隙、后腹膜多发肿大淋巴结, 部分融合成团, 首先考虑小肠来源恶性肿瘤性病变.
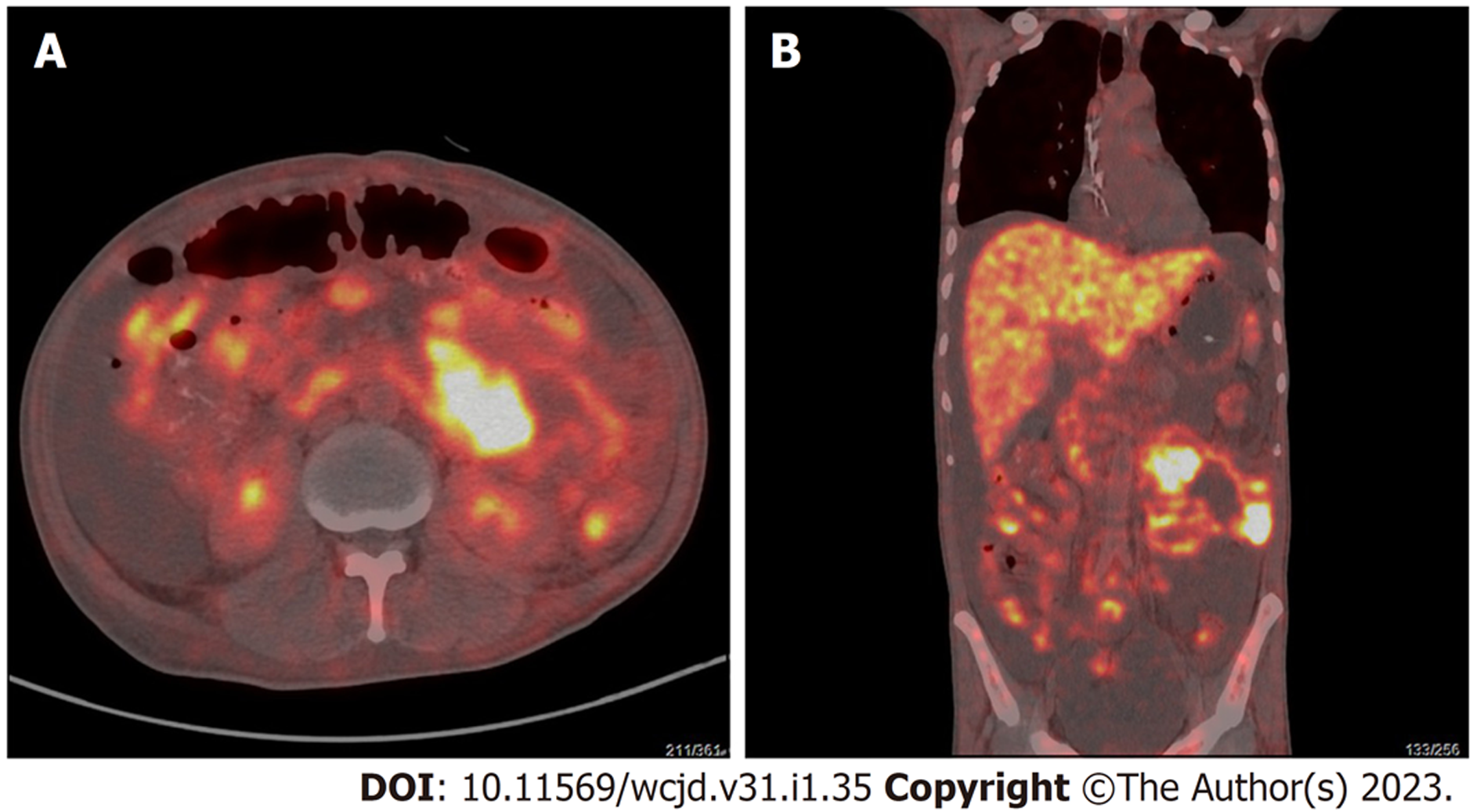
正电子发射计算机断层显像(2021-08-27)(图3): 左侧中腹部空肠肠壁不规则增厚伴肠腔扩张, 糖代谢增高, 考虑恶性肿瘤可能; 腹腔内、腹膜后及左侧髂血管走行区多发淋巴结转移, 左侧肠系膜区及左半结肠旁腹膜种植转移; 腹、盆腔大量积液. 胃空肠短路术后吻合口区糖代谢增高, 左侧前中上腹部小肠局部肠壁增厚、肠腔扩张, 糖代谢增高, 结合患者病史考虑炎性病变.
诊断及治疗: 患者入院后予以抑酸、止血、积极输血、配置三升袋加强营养、抗炎以及对症支持治疗, 但因患者存在内科药物不可控制的不明原因消化道出血、且出血量大, 结合患者的放射学表现、核医学表现, 诊断尚不能完全明确, 考虑到患者血红蛋白进行性下降, 持续性出血不能缓解可能会危及生命, 经与我院腹部疑难外科讨论后, 与家属充分沟通, 决定行剖腹探查术寻找出血部位并明确诊断. 患者于2021-08-30全麻下行"开腹探查术+小肠部分切除术", 术中见空肠起始部原穿孔处出血并形成脓腔, 予以清除并充分引流.
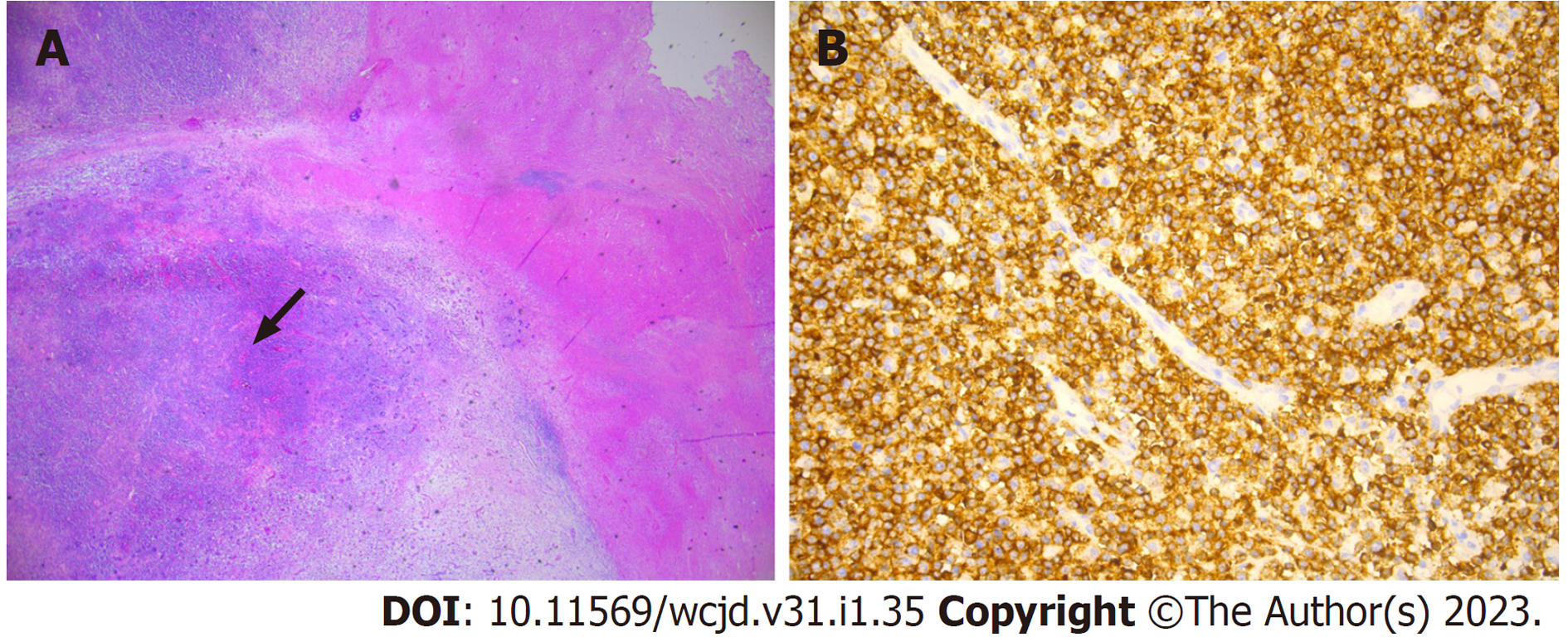
腹部疑难外科开腹探查, 术后病理结果(2021-08-31)(图4)示: 肠壁结节有小圆细胞增生, 病理示肠壁结节T细胞淋巴瘤, 肿瘤累及肠壁全层至浆膜层, 标本两侧均见少量肿瘤细胞浸润, 远端腺上皮中度不典型增生, 瘤细胞中等大小, 免疫组化显示CD2、CD3、CD4、CD7、CD56均(+), CD8(-), EBER(-). 最终病理诊断: 外周T细胞淋巴瘤(非特指型), 本例Ki67较高, 约80%. 故明确小肠T淋巴瘤诊断.
患者术后在重症监护室进一步监护及治疗, 邀血液内科会诊后认为该患者符合化疗指征,建议患者接受化疗.
患者术后一般情况差, 并发肝功能严重损害, 家属拒绝接受化疗, 要求自动出院.
原发性肠淋巴瘤(primary intestinal lymphoma, PIL)发病率较低, 好发于中老年人群, 男性多于女性, 临床表现缺乏特异性, 多发于回肠末端, 主要在黏膜固有层或黏膜下层沿小肠长轴生长, 可向腔内外侵犯造成肠壁增厚, 形成局部肿块[3], 故以腹痛、腹部肿块多见, 可伴发热、消瘦、贫血等全身表现[4].
PIL临床表现缺乏特异性, 其诊断主要依赖病理. 患者多因腹痛、腹泻、便血、发热等原因就诊, 易造成误诊或漏诊. 主要原因包括: (1)PIL起病可表现为腹痛、腹泻、腹胀等, 伴上腹部和脐周不适, 内镜表现缺乏特异性, 可见胃十二指肠部多发急慢性糜烂、溃疡性改变, 表现为溃疡基底不平、覆有污秽苔、边缘不整齐等, 也可有肠壁隆起性病变, 形成局部肿块或进展至肠腔狭窄, 上述临床表现及内镜下征象亦可见于克罗恩病(Crohn's disease, CD), 因此仅凭临床表现及内镜检查难以明确诊断; (2)PIL早期起病行CT检查均可有肠壁水肿增厚、肠腔多发狭窄征象, 超声内镜可能表现肠壁增厚、肠壁正常结构消失、弥漫性低回声, 故影像学检查提供的信息相对有限; (3)PIL与CD的实验室检查均可表现为血沉及血清C-反应蛋白浓度均明显升高, 但相比较而言没有统计学差异, 实验室检查提供的信息有限[5].
尽管PIL与CD的临床表现及病理特征有一定相似之处, 但结合本例患者的临床症状、内镜、影像学等各方面表现分析, 仍有支持PIL诊断的相关线索: (1)一般CD患者发病年龄明显低于PIL[3], 以15岁-30岁最常见, 本例患者为中年男性, 且无口腔溃疡、肛周病变、腹腔脓肿等较为支持CD的并发症[6], CD的诊断需要进行严格排除, 不能轻易确立诊断; (2)本例患者曾多次行腹部CT检查, 均见腹部局部肠壁增厚、肠腔扩张及腹膜后淋巴结增大, 这种情况不能仅考虑CD倾向; (3)本例患者病情在短短的8 mo中反复发作, 早期给予抑酸、营养支持等治疗, 当地医院诊断为CD后多次接受抗肿瘤坏死因子(tumor necrosis factor, TNF)单克隆抗体英夫利西单抗(infliximab, IFX)治疗, 但病情持续进展, 且出现了多处瘘管、消化道大出血等并发症, 这时也应思考治疗无效的原因并重新审视先前的诊断.
本例患者为原发性肠T细胞淋巴瘤(primary intestinal T-cell lymphoma, PITL), 与CD的鉴别可从临床表现、内镜及影像学特征以及病理方面开展. 在临床表现方面, PITL的临床症状多呈急性进展, 保守治疗难以控制, 往往发展成急性肠穿孔而需要外科手术处理[7], CD相对特异的表现是肛周病变及肠外并发症, 如肛瘘、肛周脓肿等. 在内镜和影像学表现上, PITL可表现为巨大不规则溃疡浸润、结肠外肿块、环状强化、肠腔扩张或息肉样病变等, 也可出现腹膜后淋巴结融合增大等征象[7,8], 而CD以纵行溃疡、鹅卵石样、铺路石改变多见, 可合并梳齿征、肠壁分层靶征和节段性病变. 在组织学特点上, PITL以隆起性病灶多见, 病理检查形态不一、背景复杂, 可见异型淋巴细胞浸润, 形态类似非干酪性肉芽肿, 常引起广泛坏死致淋巴细胞浸润征象不典型[9,10]; 而CD以溃疡性病灶多见, 可见肠壁各层和局部淋巴结非干酪性肉芽肿及肠壁各层炎症, 伴黏膜下层淋巴细胞聚集[9].
病理学诊断是CD与PIL鉴别的金标准. 患者2021-03的小肠CT怀疑存在小肠恶性肿瘤可能, 曾进一步行小肠镜并活检, 当时病理提示"炎症性肠病", 致使当地医院给出"CD"的诊断. 这种情况在临床上也不少见, 一方面与肠道T细胞淋巴瘤病变多位于黏膜下淋巴组织相关, 病变较少累及黏膜以及取材较小或表浅均会增加确诊难度; 另一方面则与病理医生的读片水平亦有一定关系. 这表明对于临床上存在疑点的患者, 我们需要尽量多点、多次取材, 特别怀疑淋巴瘤的患者一定要深挖取材, 必要时通过手术获取可用于诊断的合格组织, 避免因肿瘤早期未侵犯黏膜层而导致漏诊[11]; 免疫组织化学谱检测也有助于对其进行鉴别, 并协助判断疾病预后.
IFX是一种人/鼠嵌合型的抗TNF抑制剂(anti-tumor necrosis factor inhibitor, TNFi), 临床上广泛应用于中至重度CD患者的诱导和维持治疗, 具有起效迅速、疗效显著的优势, 但也存在潜在的安全性问题: 患者发生感染、恶性肿瘤(如淋巴瘤)的风险增高[12], 其具体机制尚未完全阐明.
本例患者曾使用5次IFX治疗, 但症状迅速进展, 最终在外科手术探查后, 手术病理得出淋巴瘤的诊断. 在这一病例中, IFX的使用是否影响了患者的疾病进程或预后?是IFX加速了原有恶性肿瘤的进展从而使其浮出水面, 还是IFX引起了新发恶性肿瘤, 抑或和疾病发展无任何关系. 相关文献报道在CD患者治疗过程中合并新发PIL的病例并不鲜见, 尤其是使用免疫抑制剂及生物制剂的患者[12-15]. 同时, 患者病程早期即同时罹患CD与PIL的可能性亦不能排除. 此类患者的病因仍需要更多的临床案例与更长时间的随访来推断与验证. 这也警示我们在开展生物制剂治疗前, 需仔细排查相关的风险因素, 包括肿瘤、结核、各种感染等, 对于难以确定的高危患者务必在治疗过程中严密监测, 防止新发恶性肿瘤的出现或潜在恶性肿瘤的进展, 最终导致治疗失败或病情恶化.
综上, 鉴于PIL与CD鉴别诊断较困难, 我们认为对因肠道非特异性症状伴全身表现就诊的患者进行CD诊断前, 应充分结合实验室检查、内镜检查、影像学表现进行初步判断, 根据病理检查结果确立诊断. 对于病理检查难以确诊、或病理与临床不能完全吻合的情况, 也不应盲从一次病理检查结果, 必要时可以多次重复活检, 加做免疫组化. 对于诊断后治疗效果不好的患者, 一定要及时分析原因, 甚至推翻先前诊断, 在治疗过程中, 需要严密监测肿瘤的发生发展. 临床上我们要提高对本病的认识及警惕性, 掌握与CD的鉴别点, 减少误诊、漏诊.
学科分类: 胃肠病学和肝病学
手稿来源地: 上海市
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): 0
D级 (一般): D
E级 (差): 0
科学编辑: 张砚梁 制作编辑:张砚梁
| 1. | Ding W, Zhao S, Wang J, Yang Q, Sun H, Yan J, Gao L, Yao W, Zhang W, Liu W. Gastrointestinal Lymphoma in Southwest China: Subtype Distribution of 1,010 Cases Using the WHO (2008) Classification in a Single Institution. Acta Haematol. 2016;135:21-28. [PubMed] [DOI] |
| 2. | Li B, Shi YK, He XH, Zou SM, Zhou SY, Dong M, Yang JL, Liu P, Xue LY. Primary non-Hodgkin lymphomas in the small and large intestine: clinicopathological characteristics and management of 40 patients. Int J Hematol. 2008;87:375-381. [PubMed] [DOI] |
| 4. | Ding D, Pei W, Chen W, Zuo Y, Ren S. Analysis of clinical characteristics, diagnosis, treatment and prognosis of 46 patients with primary gastrointestinal non-Hodgkin lymphoma. Mol Clin Oncol. 2014;2:259-264. [PubMed] [DOI] |
| 6. | 朱 庆强, 王 中秋, 陈 文新, 吴 晶涛, 王 守安. 小肠克罗恩病、肠结核和原发性小肠淋巴瘤的临床、内镜及CT特征的鉴别分析. 中华普通外科杂志. 2013;4:249-252. [DOI] |
| 11. | 杨 竞, 温 静, 闫 斌, 卢 忠生, 杨 云生. 原发性小肠淋巴瘤临床表现、内镜特点与病理分型. 胃肠病学和肝病学杂志. 2013;22:443-445. [DOI] |
| 12. | Beaugerie L, Rahier JF, Kirchgesner J. Predicting, Preventing, and Managing Treatment-Related Complications in Patients With Inflammatory Bowel Diseases. Clin Gastroenterol Hepatol. 2020;18:1324-1335.e2. [PubMed] [DOI] |
| 13. | Lemaitre M, Kirchgesner J, Rudnichi A, Carrat F, Zureik M, Carbonnel F, Dray-Spira R. Association Between Use of Thiopurines or Tumor Necrosis Factor Antagonists Alone or in Combination and Risk of Lymphoma in Patients With Inflammatory Bowel Disease. JAMA. 2017;318:1679-1686. [PubMed] [DOI] |
| 14. | Llanos-Chea A, Shapiro JM, Winter RW, Jerger L, Menz T, Gibson M, Friedmann AM, Treaba D, Papamichael K, Cheifetz AS, Friedman S, Hamilton MJ, Winter HS. Lymphoma in Pediatric-Onset Inflammatory Bowel Disease Treated with Infliximab Monotherapy: A Case Series. Dig Dis Sci. 2022;67:252-258. [PubMed] [DOI] |
| 15. | Scott FI, Vajravelu RK, Bewtra M, Mamtani R, Lee D, Goldberg DS, Lewis JD. The benefit-to-risk balance of combining infliximab with azathioprine varies with age: a markov model. Clin Gastroenterol Hepatol. 2015;13:302-309.e11. [PubMed] [DOI] |