修回日期: 2022-03-19
接受日期: 2022-04-19
在线出版日期: 2022-05-08
胃肠道是黑色素瘤转移相对常见的部位, 但胃黑色素瘤引起的大出血非常罕见, 而且其转移途径值得探讨, 考虑为口腔恶性黑色素瘤的种植转移.
我们医院报道了一例因呕血黑便1 d入院的88岁男性. 经检查初步诊断为胃癌或胃间质瘤破裂伴活动性出血, 予手术切除治疗后好转出院. 术后3 wk门诊复查时发现, 术前被忽视的口腔黑色素瘤已增大为当时数倍, 最终考虑为口腔黑色素瘤胃转移. 1 mo后患者在家中过世.
发现了口腔肿物但未进一步识别, 造成了误诊, 值得反思也应引起其他临床医生的重视. 在遇到消化道肿物时应想到恶性黑色素瘤的可能, 尤其合并有皮肤黏膜黑色素瘤时更应加强怀疑. 在遇到单纯皮肤黑色素瘤的患者, 也应关注其胃肠道症状主诉, 定期行消化内镜检查或全身筛查.
核心提要: 本例为首发症状消化道大出血的胃黑色素瘤患者, 初诊时伴有口腔黑色素瘤但未引起怀疑, 通过术后病理最终诊断为口腔恶性黑色素瘤的种植转移, 转移途径属实罕见, 提供一种新的临床思路.
引文著录: 许一帆, 金善恩. 口腔恶性黑色素瘤伴胃转移出血1例报道. 世界华人消化杂志 2022; 30(9): 420-424
Revised: March 19, 2022
Accepted: April 19, 2022
Published online: May 8, 2022
Although the gastrointestinal tract is a relatively common site of melanoma metastases, reports of digestive tract hemorrhage caused by melanoma are very rare. The metastatic route is still unclear, though it is considered as implant metastasis in oral malignant melanoma.
We report the case of an 88-year-old man who was admitted to our hospital with hematemesis and melena. By endoscopic inspection, he was diagnosed with active hemorrhage caused by primary gastric cancer or gastric stromal tumor. Eventually, he underwent surgical resection treatment and was discharged. At the outpatient review 3 wk postoperatively, it was noted that an oral melanoma which had been overlooked preoperatively had enlarged several times and was eventually considered to be the primary focus of the gastrointestinal melanoma. The patient passed away at home after 1 mo.
In the present case, an oral cavity mass was found but not further identified, which caused misdiagnosis. The possibility of malignant melanoma should be considered when encountering a gastrointestinal mass, especially when combined with mucocutaneous melanoma. In patients who have pure cutaneous melanoma, attention should also be paid to their gastrointestinal symptoms, with regular gastrointestinal endoscopy or systemic examination performed.
- Citation: Xu YF, Jin SE. Oral malignant melanoma with gastric metastasis and hemorrhage: A case report. Shijie Huaren Xiaohua Zazhi 2022; 30(9): 420-424
- URL: https://www.wjgnet.com/1009-3079/full/v30/i9/420.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v30.i9.420
黑色素瘤是一种高度恶性的肿瘤, 多发生于皮肤、眼部, 也可见于黏膜和内脏. 它可以转移到身体任何器官, 消化道转移不在少数, 其中以小肠转移最多见[1-3], 胃部相对罕见[4]. 由于临床医生对消化道黑色素瘤认识较少, 其发生频率较低和位置隐秘而经常被忽视, 导致漏诊或误诊, 术前误诊率可达73.64%[5]. 且大多数消化道黑色素瘤被发现时多伴转移(占68.87%)[5], 失去最佳的治疗时间. 现分享一例我院收治的胃黑色素瘤伴大出血患者, 其转移途径也较特殊, 为广大临床工作者提供参考.
患者男性88岁, 因呕血伴黑便1 d就诊. 患者1 d前因呕血黑便在当地医院就诊, 诊断为胃癌活动性出血, 行1次内镜止血治疗及多次输血治疗, 因再度呕血及重度贫血于2021-01-14转来我院急诊科. 入院后患者呕鲜红色血2-3次, 总量约700 mL, 解2次水样黑便, 伴乏力, 晕眩感, 无腹痛腹胀, 无恶心呕吐, 无畏寒发热. 近期体重无明显下降. 既往前列腺恶性肿瘤病史, 伴多发骨转移; 6年前心肌梗死行PCI术, 长期口服波立维、阿司匹林治疗, 因消化道出血后停药; 高血压30年, 口服药物血压控制稳定.
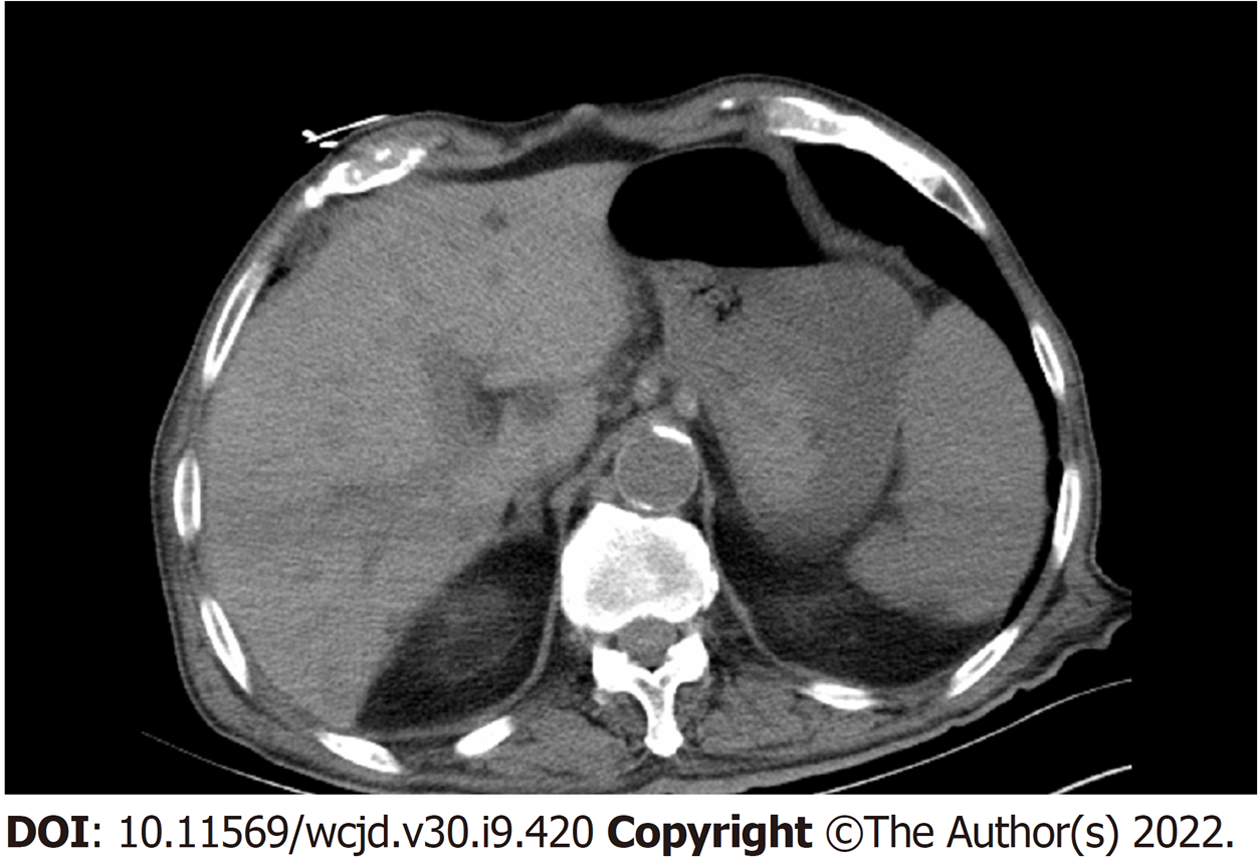
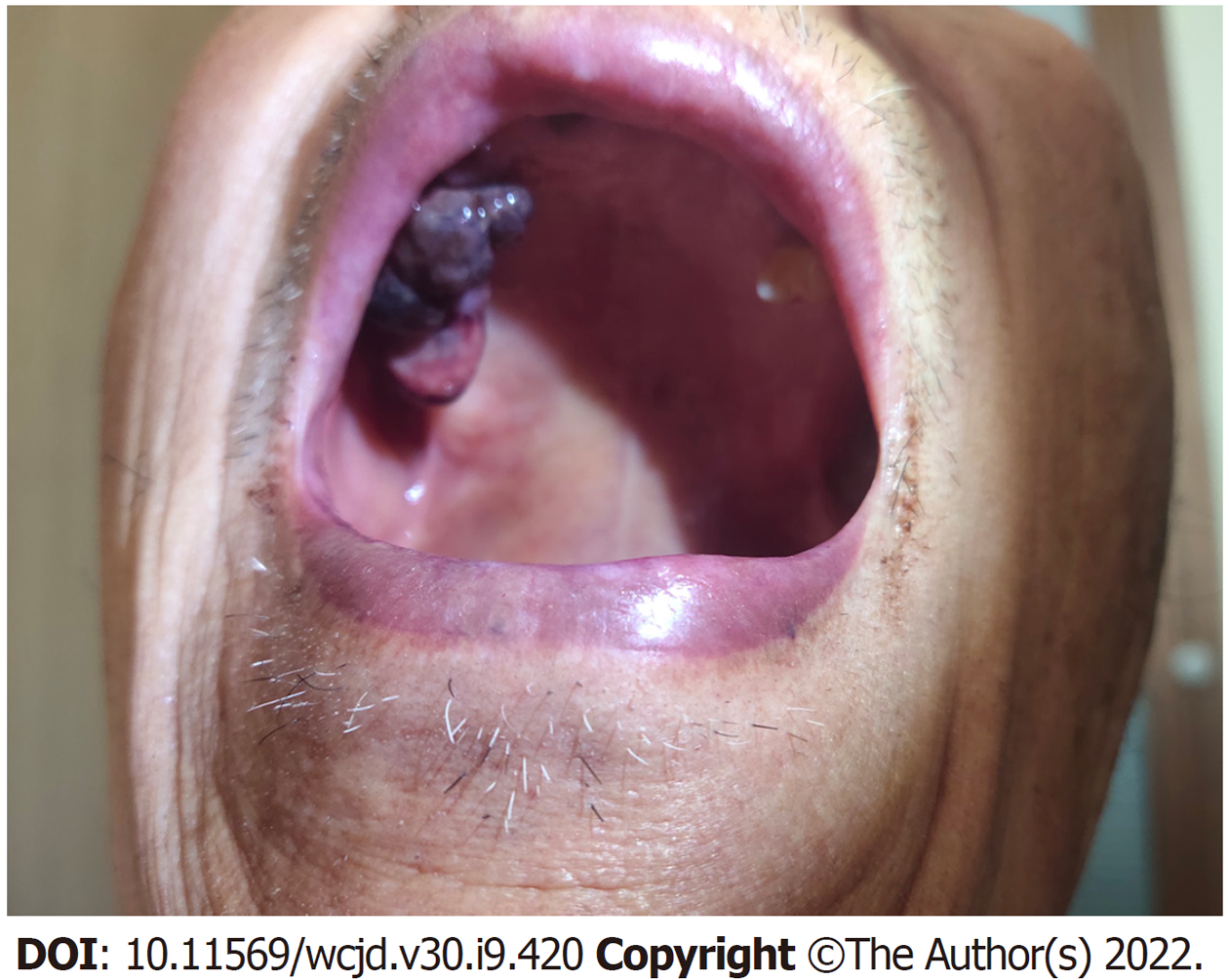
入院后体格检查: 神志清, 精神软, 口唇黏膜、眼睑结膜苍白, 口腔黏膜可见一圆形黑色肿物, 约1 cm×1 cm, 无破溃, 浅表淋巴结未触及肿大, 心肺未见异常. 腹软, 未触及包块, 无压痛反跳痛, 肠鸣音正常. 查血红蛋白45 g/L, 其他化验结果未见明显异常, 急诊CT提示(图1): 胃部可疑高密度影, 急诊胃镜提示(图2): 胃体中下部大弯侧见一粘膜下息肉样隆起, 大小约2.5 cm, 无颜色改变, 顶部破溃伴活动性出血.
消化科会诊: 考虑为肿瘤出血, 内镜下止血效果不佳, 建议介入止血或手术止血.
介入科会诊: 患者有栓塞止血指征, 但止血效果不确切.
胃肠外科会诊: 虽然患者有前列腺癌病史, 但胃转移几率极小. 考虑为胃间质瘤或原发性胃癌破裂出血, 有手术指征.
(1)胃恶性肿瘤伴出血; (2)重度贫血; (3)心肌梗死PCI术后; (4)前列腺恶性肿瘤个人史; (5)口腔肿物.
患者消化道大出血伴重度贫血, 内镜及保守治疗效果不显著. 当天行急诊手术予胃部分切除, 术中见: 胃体大弯侧后壁可见大小约2.5 cm×1.0 cm内生性肿块, 边界清, 未侵及浆膜外. 病理切开可见一灰白结节, 大小约1.8 cm×1.5 cm×1.3 cm, 切面灰白实性. 患者高龄且出血量大, 术后转ICU监护治疗. 2021-01-18转回普通病房. 2021-01-24患者病情好转出院, 口腔肿物未予特殊处理.
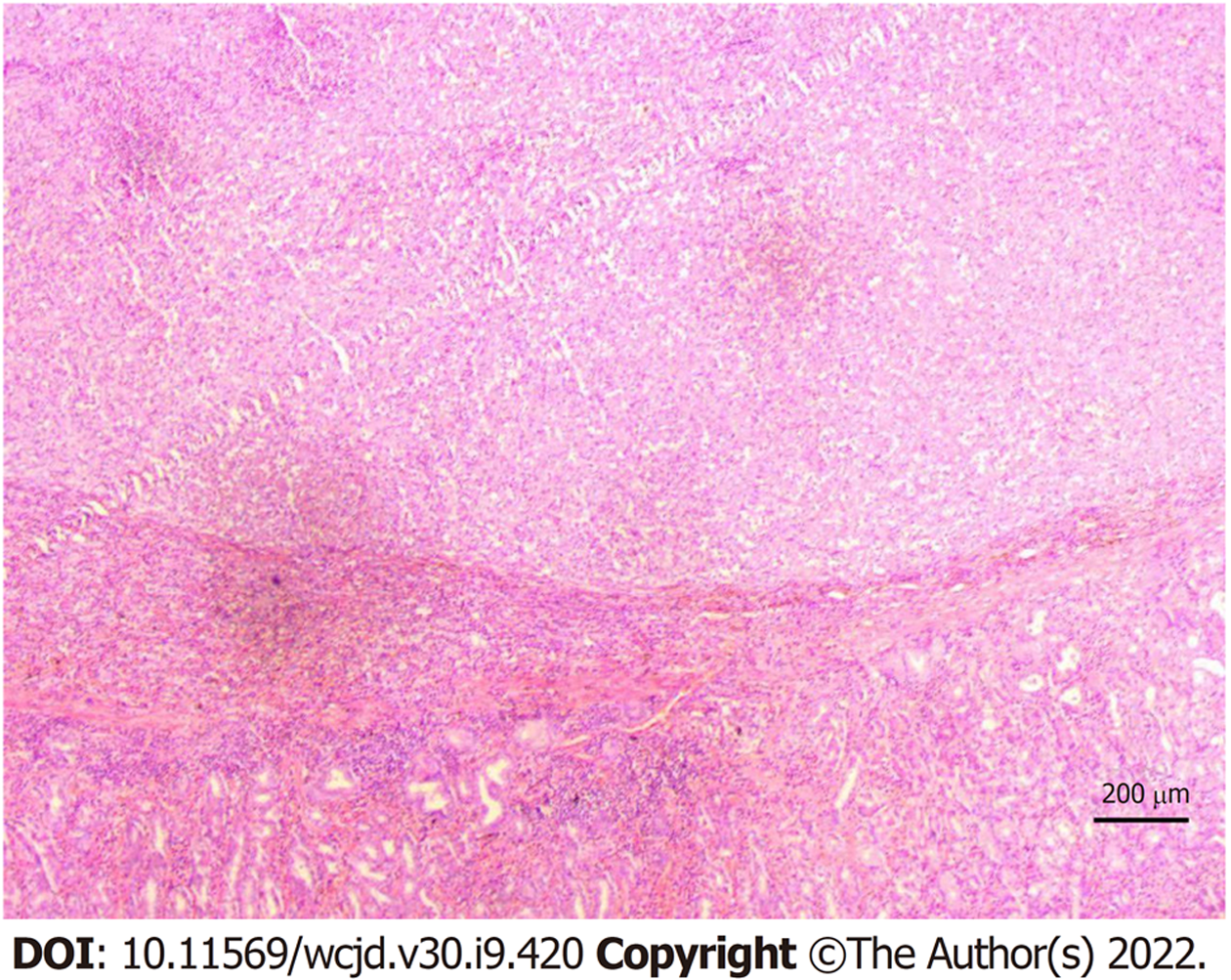
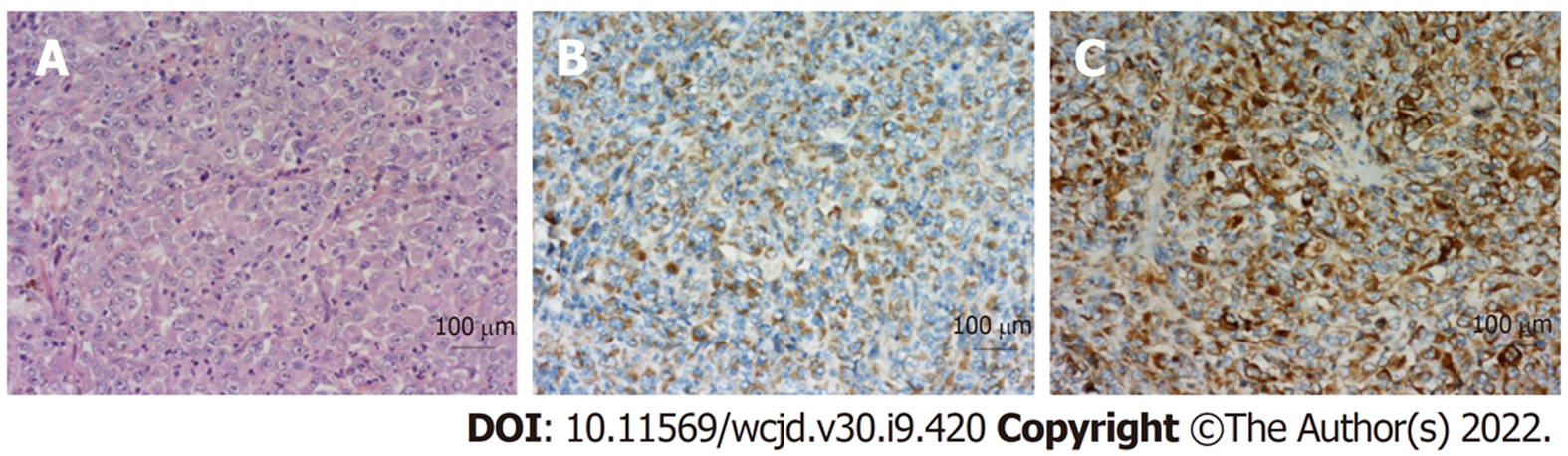
2021-02-07患者门诊复查时, 发现口腔黑色素瘤(图3), 生长迅速, 已增大至3 cm×2 cm×2 cm, 呈菜花样, 为3 wk前数倍大小. 同时查阅术后病理(图4): 首先考虑转移性恶性黑色素瘤. 免疫组化染色结果(图5): (第1次)A3-2: NKX3.1(-)、MLH1(+)、MSH2(+)、MSH6(+)、PMS2(+)、ERG(-)、AR(-)、P504S(-)、PSA(-); (第2次)A3-2: HMB45(Melanoma)(-)、S100(-)、CD31(-)、CD117(-)、DOG1(-)、TFE3(-)、CAM5.2(+)、SMA(-)、Vimentin(+)、CgA(-)、melan-A(+); (第3次)A3-2: CD30(-)、ALK(1A4)(-)、EMA(+)、CD2(-)、CD20(-)、CD3(-)、CD5(-)、CD7(-)、CD8(-)、CD4(-)、TIA-1(-)、Perforin(-)、CD1a(-)、CD34(-)、CD21(-)、CK(Pan)(+). 结合该患者术后病理, 最终诊断为口腔恶性黑色素瘤伴胃转移. 患者拒绝术后免疫及口腔肿物进一步治疗. 1 mo后患者因全身衰竭在家中过世.
黑色素瘤占所有恶性肿瘤的1%-3%[6], 其中1%-2%出现在消化道, 消化道黑色素瘤人群中总发病率为(2-2.6)例/100万人每年, 男性患者居多[7-9]. 它是一种黏膜黑色素瘤, 比皮肤黑色素瘤更具有侵袭性, 中位生存率为(6.2-9.6) mo[10], 5年生存率为25%, 且受疾病侵犯程度影响, 结直肠黑色素瘤为4.3%-17.4%[11], 食管和胃的甚至更短[12]. 其低生存率与诊断疾病延误和缺乏标准化治疗有关[13].
消化道黑色素瘤恶性程度高、侵袭性强, 早期诊断显得尤为重要,并需要临床医生对恶性黑色素瘤有一定的认识. 作为首发症状, 消化道黑色素瘤同其他肿瘤一样缺乏特异性: 常见腹痛、恶心呕吐、黑便、贫血, 其次呕血、穿孔症状少见, 食管病变可出现吞咽困难, 肠道病变可出现肠梗阻. 倘若患者合并可见的皮肤黏膜黑色素瘤, 则应高度怀疑胃肠道转移性黑色素瘤.
大多数消化道黑色素瘤患者在初次就诊时通过影像学检查发现, CT对消化道黑色素瘤的的诊断有一定价值, 敏感性约为65%[14]. 内镜检查及活检是诊断的主要手段. 大多数胃肠道黑色素瘤无典型的内镜下表现, 但都有迹可循, 经验丰富的内镜操作者可早期识别或怀疑该病, 而初学者可能会漏诊或误诊. 据国内文献报道[5], 内镜下表现隆起形最为多见(65.42%), 形态规则可呈息肉样或扁平隆起, 形态不规则呈菜花样、蕈伞样、桑椹样. 结节样、溃疡样相对少见; 肿瘤颜色褐色最为常见(36.71%), 其次为黑色、灰白色、蓝色, 少数为暗红色、紫黑色. 病变可被误诊为痔疮、腺瘤或息肉, 采用免疫组织化学染色的病理学可以明确, 多点活检可以减少误诊的机会[15]. 超声内镜可以评估胃肠道黑色素瘤浸润深度, 帮助建立临床分期和明确治疗方案[15]. 正电子发射计算机断层显像(PET-CT)检查有助于提高转移灶的检出率[16].
临床上判断黑色素瘤是原发还是继发对后续治疗很关键, 但想彻底明确黑色素瘤的病变来源是很困难的. 恶性黑色素瘤具有高度侵袭性, 有向任何器官转移的倾向, 病程难以预测, 一般先由淋巴道蔓延至局部淋巴结及软组织, 随后可经血行转移至肝、肺及皮肤等器官. 除此之外临床中还不乏通过局部播散种植转移的案例, 例如含有恶性黑色素瘤细胞的脓液流经的体表, 也可生长出恶性黑色素瘤. 与皮肤黑色素瘤相比, 黏膜黑色素瘤更具侵袭性, 这与黏膜丰富的淋巴管和血管供应有关[17].
回顾病史, 该患者的消化道黑色素瘤来源值得探讨. 患者在内镜检查发现胃部病灶时, 口腔内有1 cm×1 cm黑色肿物, 笔者认为该口腔肿物是胃黑色素瘤的原发灶, 原因如下: (1)两处恶性肿瘤用同病同源论解释, 首先应考虑口腔恶性黑色素瘤为原发灶, 胃恶性黑色素瘤为转移灶. 就转移途径而言, 血行及淋巴转移至胃部的概率极小, 所以更有可能是患者通过吞咽唾液动作将肿瘤细胞转运到胃肠道, 形成的种植转移. 恶性黑色素瘤侵袭性强, 种植转移可能性很大; (2)原发性胃肠道黑色素瘤的免疫组化通常有S100、HMB45、Melan A和MITF的表达[18], 该患者免疫组化结果和我院病理报告均倾向于转移灶; (3)查体过程中未在患者皮肤黏膜发现其他可疑的黑色素瘤, 所以两处恶性肿瘤均为转移灶也不考虑. 综上所述, 笔者认为该患者的胃恶性黑色素瘤为口腔恶性黑色素瘤种植转移的结果, 是一个罕见的转移案例.
反观治疗策略, 若能第一时间诊断为胃转移性恶性黑色素瘤, 则采取相对保守的治疗方案较为合适. 对于该病人而言, 胃部肿瘤较小, 且是顶部破溃, 优先选择内镜下止血内镜; 患者高龄, 手术对其打击较大, 且转移性恶性黑色素瘤发现时多为晚期, 手术根治不彻底, 手术创伤甚至可能加速原发灶的进展.
对于其他患者而言, 尽管胃肠道转移黑色素瘤被发现时多已处病情晚期, 但手术切除仍然被认为是一种有效姑息治疗的手段, 尤其当患者出现急性症状时, 如大出血、穿孔、肠梗阻等. 国内外有多篇文献报道证实[3,19-24], 手术切除治疗在延长生存期以及症状改善方面起着重要的积极作用. 化疗和放疗对胃肠道黑色素瘤的预后影响暂没有定论[23].
综上所述, 我们发现了口腔肿物但未进一步识别, 以及忽略了它与胃肠道病变的关联性, 造成了误诊, 这也应引起其他临床医生的重视. 消化道黑色素瘤虽然较少见, 但恶性程度高, 侵袭性强, 早期诊断尤为重要. 临床医生在遇到消化道肿物时应想到恶性黑色素瘤的可能, 尤其当患者合并有皮肤黏膜黑色素瘤时, 更应思考两者的关联性, 加强怀疑[25]. 在遇到单纯皮肤黑色素瘤的患者, 也应关注其胃肠道症状主诉, 定期行消化内镜检查, 或行全身筛查.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): C, C, C
D级 (一般): 0
E级 (差): 0
科学编辑: 张砚梁 制作编辑:张砚梁
| 1. | Lens M, Bataille V, Krivokapic Z. Melanoma of the small intestine. Lancet Oncol. 2009;10:516-521. [PubMed] [DOI] |
| 2. | López RG, Santomé PM, Porto EI, Moreiras MI, Gómez CG, Villanueva JM, Canosa MA, Veiga OR, Gutiérrez AE, Ares IM, Val FA. Intestinal perforation due to cutaneous malignant melanoma mestastatic implants. Rev Esp Enferm Dig. 2011;103:386-388. [PubMed] [DOI] |
| 3. | Kohoutova D, Worku D, Aziz H, Teare J, Weir J, Larkin J. Malignant Melanoma of the Gastrointestinal Tract: Symptoms, Diagnosis, and Current Treatment Options. Cells. 2021;10. [PubMed] [DOI] |
| 4. | Malladi V, Palanivelu C, Mathew S, Rajan PS, Jani K, Senthilkumar R, Senthilkumaran S, Kavalkat AJ. Malignant melanoma metastatic to the stomach and duodenum. Indian J Gastroenterol. 2005;24:133. [PubMed] |
| 6. | Augustyn A, de Leon ED, Yopp AC. Primary gastric melanoma: case report of a rare malignancy. Rare Tumors. 2015;7:5683. [PubMed] [DOI] |
| 7. | Schaefer T, Satzger I, Gutzmer R. Clinics, prognosis and new therapeutic options in patients with mucosal melanoma: A retrospective analysis of 75 patients. Medicine (Baltimore). 2017;96:e5753. [PubMed] [DOI] |
| 8. | Marcoval J, Moreno A, Peyrí J. Cutaneous infiltration by cancer. J Am Acad Dermatol. 2007;57:577-580. [PubMed] [DOI] |
| 9. | McLaughlin CC, Wu XC, Jemal A, Martin HJ, Roche LM, Chen VW. Incidence of noncutaneous melanomas in the US. Cancer. 2005;103:1000-1007. [PubMed] [DOI] |
| 10. | Schuchter LM, Green R, Fraker D. Primary and metastatic diseases in malignant melanoma of the gastrointestinal tract. Curr Opin Oncol. 2000;12:181-185. [PubMed] [DOI] |
| 11. | Tokuhara K, Nakatani K, Tanimura H, Yoshioka K, Kiyohara T, Kon M. A first reported case of metastatic anorectal amelanotic melanoma with a marked response to anti-PD-1 antibody nivolumab: A case report. Int J Surg Case Rep. 2017;31:188-192. [PubMed] [DOI] |
| 12. | Rathi PM, Gautam S, Sharma S. Primary Maligant Melanoma of the Oesophagus. J Assoc Physicians India. 2015;63:74-75. [PubMed] |
| 13. | Kahl AR, Gao X, Chioreso C, Goffredo P, Hassan I, Charlton ME, Lin C. Presentation, Management, and Prognosis of Primary Gastrointestinal Melanoma: A Population-Based Study. J Surg Res. 2021;260:46-55. [PubMed] [DOI] |
| 14. | Liang KV, Sanderson SO, Nowakowski GS, Arora AS. Metastatic malignant melanoma of the gastrointestinal tract. Mayo Clin Proc. 2006;81:511-516. [PubMed] [DOI] |
| 15. | Wang S, Sun S, Liu X, Ge N, Wang G, Guo J, Liu W, Hu J. Endoscopic diagnosis of gastrointestinal melanoma. Scand J Gastroenterol. 2020;55:330-337. [PubMed] [DOI] |
| 16. | Othman AE, Eigentler TK, Bier G, Pfannenberg C, Bösmüller H, Thiel C, Garbe C, Nikolaou K, Klumpp B. Imaging of gastrointestinal melanoma metastases: Correlation with surgery and histopathology of resected specimen. Eur Radiol. 2017;27:2538-2545. [PubMed] [DOI] |
| 17. | Sachs DL, Lowe L, Chang AE, Carson E, Johnson TM. Do primary small intestinal melanomas exist? Report of a case. J Am Acad Dermatol. 1999;41:1042-1044. [PubMed] [DOI] |
| 18. | La Selva D, Kozarek RA, Dorer RK, Rocha FG, Gluck M. Primary and metastatic melanoma of the GI tract: clinical presentation, endoscopic findings, and patient outcomes. Surg Endosc. 2020;34:4456-4462. [PubMed] [DOI] |
| 20. | Khalil DN, Carvajal RD. Treatments for noncutaneous melanoma. Hematol Oncol Clin North Am. 2014;28:507-521. [PubMed] [DOI] |
| 21. | Myint ZW, Goel G. Role of modern immunotherapy in gastrointestinal malignancies: a review of current clinical progress. J Hematol Oncol. 2017;10:86. [PubMed] [DOI] |
| 22. | Hanna TP, Nguyen P, Baetz T, Booth CM, Eisenhauer E. A Population-based Study of Survival Impact of New Targeted and Immune-based Therapies for Metastatic or Unresectable Melanoma. Clin Oncol (R Coll Radiol). 2018;30:609-617. [PubMed] [DOI] |
| 23. | Zheng Y, Cong C, Su C, Sun Y, Xing L. Epidemiology and survival outcomes of primary gastrointestinal melanoma: a SEER-based population study. Int J Clin Oncol. 2020;25:1951-1959. [PubMed] [DOI] |
| 24. | Kumano K, Enomoto T, Kitaguchi D, Owada Y, Ohara Y, Oda T. Intussusception induced by gastrointestinal metastasis of malignant melanoma: A case report. Int J Surg Case Rep. 2020;71:102-106. [PubMed] [DOI] |