修回日期: 2021-02-08
接受日期: 2021-03-15
在线出版日期: 2021-04-08
长基因间非编码RNA 152(long intergenic noncoding RNA 152, Linc00152)在胃癌组织中高表达, 且其能促进胃癌细胞增殖、迁移与侵袭, 而Linc00152对胃癌化疗耐药的影响和机制并不清楚.
探究Linc00152对人胃癌细胞系NCI-N87化疗耐药性的影响及相关的作用机制.
实时定量荧光聚合酶链式反应(real-time fluorescence quantitative polymerase chain reaction, Real-time PCR)检测人胃癌细胞系NCI-N87及其丝裂霉素(mitomycin, MMC)耐药细胞系NCI-N87/MMC中Linc00152的表达情况. 采用小分子RNA干扰技术敲除NCI-N87/MMC中Linc00152的表达后, MTT法检测细胞对MMC和顺铂的敏感性, 流式细胞术检测细胞凋亡, Western Blot检测B细胞淋巴瘤/白血病-2(B cell lymphoma/lewkmia-2, Bcl-2)、Bcl-2相关X蛋白(Bcl-2 associated X protein, Bax)、半胱氨酸天冬氨酸蛋白酶-3(cysteine aspartic acid proteinase 3, caspase3)和劈裂的caspase3(cleaved-caspase3)的蛋白表达水平. 此外, Real-time PCR和Western blot检测多药耐药蛋白1/P-糖蛋白(multidrug resistant protein 1/P-glycoprotein, MDR1/P-gp)、层粘连蛋白受体1前体抗原(P37-kDa laminin receptor-1 precursor antigen, Mgr1-Ag)以及多药耐药相关蛋白(multidrug resistance-associated protein, MRP)的表达.
NCI-N87/MMC细胞中Linc00152的表达水平明显高于其亲本细胞NCI-N87. 在NCI-N87/MMC细胞中, 敲除Linc00152可诱导细胞凋亡, 并增加其对MMC和顺铂的敏感性. 敲除Linc00152可抑制NCI-N87/MMC细胞中Bcl-2蛋白表达, 促进Bax蛋白表达和caspase 3的活化. 此外, 敲除Linc00152还可下调NCI-N87/MMC细胞中多药耐药基因MDR1、Mgr1-Ag、MRP及其编码的蛋白的表达.
下调NCI-N87/MMC细胞中Linc00152的表达可提高细胞对MMC和顺铂的敏感性, 其机制可能与调控细胞凋亡相关因子促进凋亡, 同时下调细胞中多药耐药基因MDR1、Mgr1-Ag及MRP的表达有关.
核心提要: 长基因间非编码RNA 152(long intergenic noncoding RNA 152, Linc00152)在丝裂霉素(mitomycin, MMC)耐药胃癌细胞系NCI-N87/MMC中高表达. 敲除Linc00152可提高NCI-N87/MMC细胞对MMC和顺铂的敏感性.
引文著录: 吴明东, 叶洁桐, 朱蓓蕾, 叶芳敏, 汪望月. 敲除Linc00152对丝裂霉素耐药胃癌细胞NCI-N87/MMC的化疗耐药性影响及机制. 世界华人消化杂志 2021; 29(7): 332-339
Revised: February 8, 2021
Accepted: March 15, 2021
Published online: April 8, 2021
Long intergenic noncoding RNA 152 (LINC00152) is highly expressed in gastric cancer tissues, and it can promote the proliferation, migration, and invasion of gastric cancer cells. However, the effects and mechanisms of LINC00152 on chemotherapy resistance in gastric cancer are not clear.
To explore the effects and related mechanisms of LINC00152 on chemotherapy resistance in human gastric cancer cell line NCI-N87.
The expression of LINC00152 in human gastric cancer cell line NCI-N87 and mitomycin (MMC) resistant cell line NCI-N87/MMC was detected by real-time PCR. After the expression of LINC00152 in NCI-N87/MMC cells was knocked down by RNA interference method, the sensitivity of cells to MMC and cisplatin was measured by MTT assay, cell apoptosis was detected by flow cytometry, and the protein expression levels of Bcl-2, Bax, Caspase 3, and cleaved Caspase 3 were determined by Western Blot. Furthermore, the expression levels of MDR1/P-gp, Mgr1-Ag, and MRP were evaluated by real-time PCR and Western Blot.
The expression level of INC00152 in NCI-N87/MMC cells was significantly higher than that in maternal NCI-N87 cells. LINC00152 knockdown induced apoptosis and increased sensitivity to MMC and cisplatin in NCI-N87/MMC cells. LINC00152 knockdown inhibited the expression of Bcl-2 protein in NCI-N87/MMC cells, but promoted the expression of Bax protein and the activation of Caspase 3. Furthermore, LINC00152 knockdown down-regulated the mRNA and protein expression of MDR1, Mgr1-Ag, and MRP in NCI-N87/MMC cells.
Down-regulation of LINC00152 in NCI-N87/MMC cells can increase the sensitivity of cells to MMC and cisplatin, and the mechanisms may be related to the promotion of cell apoptosis by regulating apoptotic-related factors, and down-regulation of MDR1, Mgr1-Ag, and MRP.
- Citation: Wu MD, Ye JT, Zhu BL, Ye FM, Wang WY. Effect and mechanisms of LINC00152 knockdown on chemotherapy resistance in mitomycin-resistant gastric cancer NCI-N87/MMC cells. Shijie Huaren Xiaohua Zazhi 2021; 29(7): 332-339
- URL: https://www.wjgnet.com/1009-3079/full/v29/i7/332.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v29.i7.332
胃癌是临床上较为常见的一类消化系统肿瘤. 近年来, 我国胃癌的发病率不仅一直居高不下, 且有攀升的趋势[1]. 目前其治疗方式依然是以手术和化疗相结合的综合治疗为主; 其中化疗是重要的治疗手段, 特别是针对手术无法根治以及胃癌晚期的患者[2,3]. 但在化疗进程中, 胃癌细胞会通过多种方式对各类化疗药物产生耐药性, 导致胃癌的化疗效果降低[4]. 因此, 深入研究胃癌细胞耐药的分子机制, 并寻找逆转耐药性的有效靶点成为医学工作者的重要课题, 其也对提高化疗疗效具有重要意义.
肿瘤细胞的耐药性大多为获得性耐药, 产生机制复杂, 且往往表现为多因素事件, 可涉及多种机制的联合作用, 不同机制间可相互影响[5]. 目前研究已发现的耐药机制主要包括[6-9]: 细胞膜上某些蛋白的异常表达导致药物摄入减少和/或外排增多, 从而引起细胞内有效的药物浓度降低; 如拓补异构酶Ⅱ等的异常表达, 导致化疗药物的作用靶点在质与量上出现改变, 降低了药物的细胞毒性; 谷胱甘肽转移酶等的异常表达, 导致细胞的解读防御功能和DNA修复功能增强; 抗凋亡和促凋亡基因的异常表达导致肿瘤细胞出现凋亡抑制等.
大量研究显示长链非编码RNA(long non-coding RNA, lncRNA)虽然不具备编码蛋白质的功能, 但在包括基因表达以及染色体修饰等在内的多种生物过程中发挥着重要的作用, 其可影响肿瘤的疾病进展[10]. 长基因间非编码RNA 152(long intergenic noncoding RNA 152, Linc00152)定位于人2号染色体2p11.2, 已被证实在多种肿瘤组织中存在异常表达[11-13]. Zhao等[14]的研究通过lncRNA芯片分析发现Linc00152在胃癌中高表达, 而下调Linc00152可抑制HGC-27和SGC-7901的增殖和周期G1/S转换、抑制细胞侵袭和迁移、促进细胞凋亡. 但Linc00152对胃癌细胞耐药的作用尚不清晰. 本研究通过小分子干扰技术下调胃癌丝裂霉素(mitomycin, MMC)耐药细胞中的Linc00152, 系统的探究了Linc00152在胃癌细胞NCI-N87中对MMC耐药的影响及其相关作用机制.
人胃癌细胞系NCI-N87购自美国典型菌种保藏中心(American Type Culture Collection, ATCC)细胞库; 胎牛血清(fetal bovine serum, FBS)购自杭州四季青生物工程材料有限公司; 一加转染试剂优化培养基(I reduced serum medium modification of minimum Eagle's medium, Opti-MEM I)及洛斯维公园纪念研究所-1640 (Roswell Park Memorial Institute-1640, RPMI-1640)培养基均购自美国Gibco公司; Linc00152小分子干扰RNA(small interference RNA targeting for Linc00152, si-Linc00152)及阴性对照siRNA (siRNA for negative control, si-NC)由上海生工生物技术有限公司提供; Trizol提取试剂盒、脂质体-3000(Lipofectamine 3000)及相关转染试剂购自美国Invitrogen公司; SYBR荧光染料与Ex-Taq酶预混液(SYBR Premix Ex Taq TM)试剂盒购自宝生物工程(大连)有限公司; 3-(4, 5-二甲基噻唑-2)-2, 5-二苯基四氮唑溴盐[3-(4,5-Dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide, MTT]试剂盒及异硫氰酸荧光素标记的膜联蛋白V(AnnexinV-FITC)/碘化丙啶(propidium iodide, PI)细胞凋亡检测试剂盒购自上海碧云天生物技术有限公司; B细胞淋巴瘤/白血病-2(B cell lymphoma/lewkmia-2, Bcl-2)、Bcl-2相关X蛋白(Bcl-2 associated X protein, Bax)、半胱氨酸天冬氨酸蛋白酶-3(cysteine aspartic acid proteinase 3, caspase3)、劈裂的caspase3(cleaved-caspase3)和甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase, GAPDH)一抗购自美国Abcam公司; P-糖蛋白(P-glycoprotein, P-gp)、层粘连蛋白受体1前体抗原(P37-kDa laminin receptor-1 precursor antigen, Mgr1-Ag)和多药耐药相关蛋白(multidrug resistance-associated protein, MRP)一抗购自北京博奥森生物科技有限公司; MMC购自浙江海正药业股份有限公司; 顺铂购自齐鲁制药公司.
1.2.1 细胞培养及耐药细胞构建: NCI-N87细胞常规培养于含10% FBS的RPMI-1640完全培养基中, 培养条件设置为37 ℃、含5% CO2及饱和湿度. NCI-N87/MMC耐药细胞是通过向培养液中连续加入MMC来构建, 培养过程中间断性(每2-3 wk递增0.5 μg/mL)逐步提高培养液中MMC的浓度, 直至细胞在含8 μg/mL的MMC培养液中保持良好生长. MTT法检测细胞对MMC和顺铂的耐药性后, 用于后续实验.
1.2.2 细胞转染: 转染组别设置为对照组(Ctrl), 阴性对照组(si-NC)和Linc00152干扰组(si-Linc00152). 转染方法: 取对数生长期的细胞消化后接种于细胞培养皿中, 待细胞生长至约70%融合时进行转染. 将si-Linc00152或si-NC加入Opti-MEM I优化培养基中, 室温静置5 min, 标记为1号液; 将Lipofectamine 3000加入Opti-MEM I优化培养基中, 室温静置5 min, 标记为2号液; 轻柔混合1号液和2号液, 置于室温继续反应25 min. 分别将混合液对应加入已分好组的细胞中, 将细胞转移至培养箱中孵育6 h, 更换培养基后继续培养48 h. 实验重复6次. 检测转染效率并进行后续实验分析.
1.2.3 实时定量荧光聚合酶链式反应(real-time fluore-scence quantitative polymerase chain reaction, Real-time PCR): 参照Trizol提取试剂盒的操作说明抽提细胞总RNA并经紫外分光光度计测定RNA的纯度和浓度. 取2 μg总RNA逆转录合成互补脱氧核糖核酸(complementary deoxyribonucleic acid, cDNA). 然后根据SYBR Premix Ex Taq TM试剂盒说明书, 将引物以及cDNA和试剂盒中相关试剂组成反应体系(反应体系为20 μL), 在ABI 7400实时定量PCR系统中进行反应. 反应程序设置: 94 ℃ 4 min, 然后进行40个PCR循环(94 ℃ 30 s, 60 ℃ 30 s, 72 ℃ 40 s). 采用2-△△CT法分析基因相对表达量, 其中Linc00152采用18S rRNA为内参, MDR1、Mgr1-Ag和MRP mRNA采用GAPDH为内参. 实验重复6次. 引物序列见表1.
| 基因 | 引物序列 |
| Linc00152 | F: 5'-TCACTTCAGAGCCAAGGCAG-3' |
| R: 5'-AAATGCCTACCGCCAGTTCA-3' | |
| 18S rRNA | F: 5'-ACACGGACAGGATTGACAGA-3' |
| R: 5'-GGACATCTAAGGGCATCACA-3' | |
| MDR1 | F: 5'-TCGTAGGAGTGTCCGTGGAT-3' |
| R: 5'-TCATTGGCGAGCCTGGTAG-3' | |
| Mgr1-Ag | F: 5'-CGGCTTCTTGTGGTTACTG-3' |
| R: 5'-TTGGTCACTGCCTTCTCAG-3' | |
| MRP | F: 5'-CGCCTTCGCTGAGTTCCT-3' |
| R: 5'-TCTGCGGTGCTGTTGTGG-3' | |
| GAPDH | F: 5'-GGAGCGAGATCCCTCCAAAAT-3' |
| R: 5'-GGCTGTTGTCATACTTCTCATGG-3' |
1.2.4 化疗药物敏感性检测: 取对数生长期的细胞按照1×105 mL的密度接种至96孔板中, 每孔设置三个平行孔. 待细胞贴壁生长至约80%, 换无血清培养基同步化12 h, 加入不同浓度的MMC(浓度梯度设置为0、2、4、8、16、32 μg/mL)或顺铂(cisplatin, 浓度梯度设置为0、0.01、0.1、1、10、100 μg/mL), 置于细胞培养箱中继续培养48 h, 加入20 μL的MTT试剂后继续在细胞培养箱中培养4 h, 弃去孔内液体后加入100 μL的DMSO, 振摇后采用酶标仪测定490 nm波长处的吸光度值, 计算各药物的半数抑制浓度IC50, 评估细胞的耐药性.实验重复6次. 并比较已转染si-Linc00152的NCI-N87/MMC细胞对MMC敏感性的变化.
1.2.5 AnnexinV-FITC/PI染色: 采用Annexin V/PI 双染色法流式细胞术检测细胞凋亡情况. 收集各组细胞后, 用冰PBS漂洗2次, 加入500 μL结合缓冲液重悬细胞. 避光加入Annexin V-FITC混匀后, 室温孵育15 min, 上机前5 min加入PI染液避光染色. 之后, 经流式细胞仪检测激发波长488 nm发射波长530 nm处的细胞分布情况, 并据此评估细胞的凋亡率. 实验重复6次.
1.2.6 Western blot: 加RIPA裂解细胞, 并离心收集蛋白, 之后采用BCA法进行蛋白定量并计算上样量(上样蛋白总量为60 μg). 各组上样样品中加入4倍体积的上样缓冲液, 煮沸变性. 用微量加样器上样后行十二烷基磺酸钠-聚丙烯酰胺凝胶电泳, 待蓝色的溴酚蓝泳出凝胶时即可转膜. 转膜结束后, 取出聚二偏氟乙烯膜, 加5%的脱脂乳粉封闭90 min. 依据说明书要求先后加入相应比例的一抗和二抗孵育液, 其中一抗4 ℃孵育过夜, 二抗室温孵育2 h. 免疫反应结束后, 用TBST振摇洗涤PVDF膜, 10 min´3次. 转移至暗室中洒ECL化学发光液、曝光并显影. 将实验结果扫描至电脑中, 采用Image J软件对蛋白表达条带进行分析. 实验重复6次.
统计学处理 将本组研究涉及数据录入Graphpad prism 8软件中进行统计学分析, 实验结果表示为均数±标准差(mean±SD), 两组数据比较采用t检验; 多组间数据的比较采用单因素方差分析, 两两比较则采用Bonferroni校正检验, P<0.05表示差异有统计学显著性.
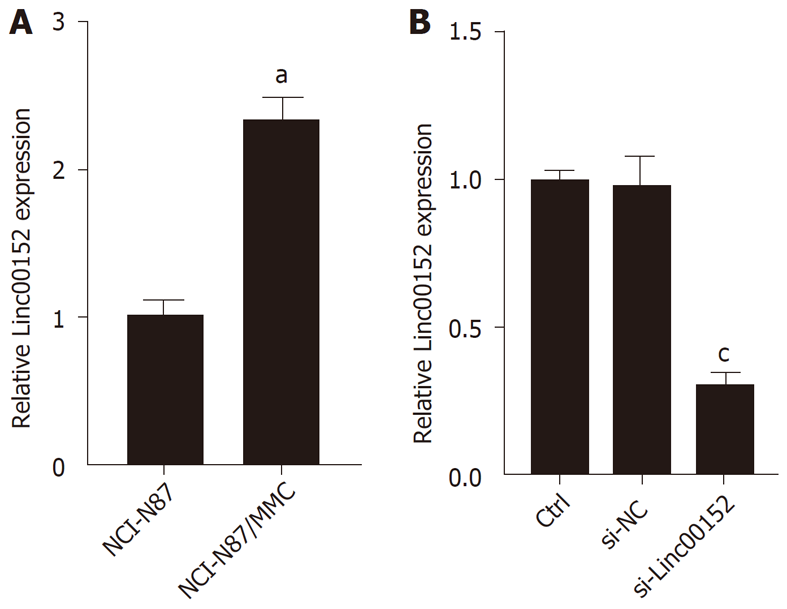
本实验首先检测了人胃癌细胞系NCI-N87及其MMC耐药细胞系NCI-N87/MMC对化疗药物的敏感性(表2), 结果证明NCI-N87/MMC的对MMC的耐药性显著强于NCI-N87细胞, 并对顺铂产生了交叉耐药. 同时Real-Time PCR的检测结果显示(图1A), NCI-N87/MMC中Linc00152的表达水平显著高于其亲本细胞NCI-N87, 提示Linc00152的表达可能与胃癌细胞NCI-N87的MMC耐药之间存在一定的关系.
为进一步证明Linc00152的表达与NCI-N87化疗耐药之间的关系, 本实验采用小分子RNA干扰技术下调NCI-N87/MMC细胞中Linc00152的表达, 并检测其化疗药物敏感性的变化. 转染效率检测如图1B所示, 相较于对照组, si-Linc00152组细胞中Linc00152的表达显著降低. MTT检测结果显示, 下调NCI-N87/MMC细胞中Linc00152的表达后, 细胞对MMC及顺铂的敏感性明显增加(P<0.05, 见表3).
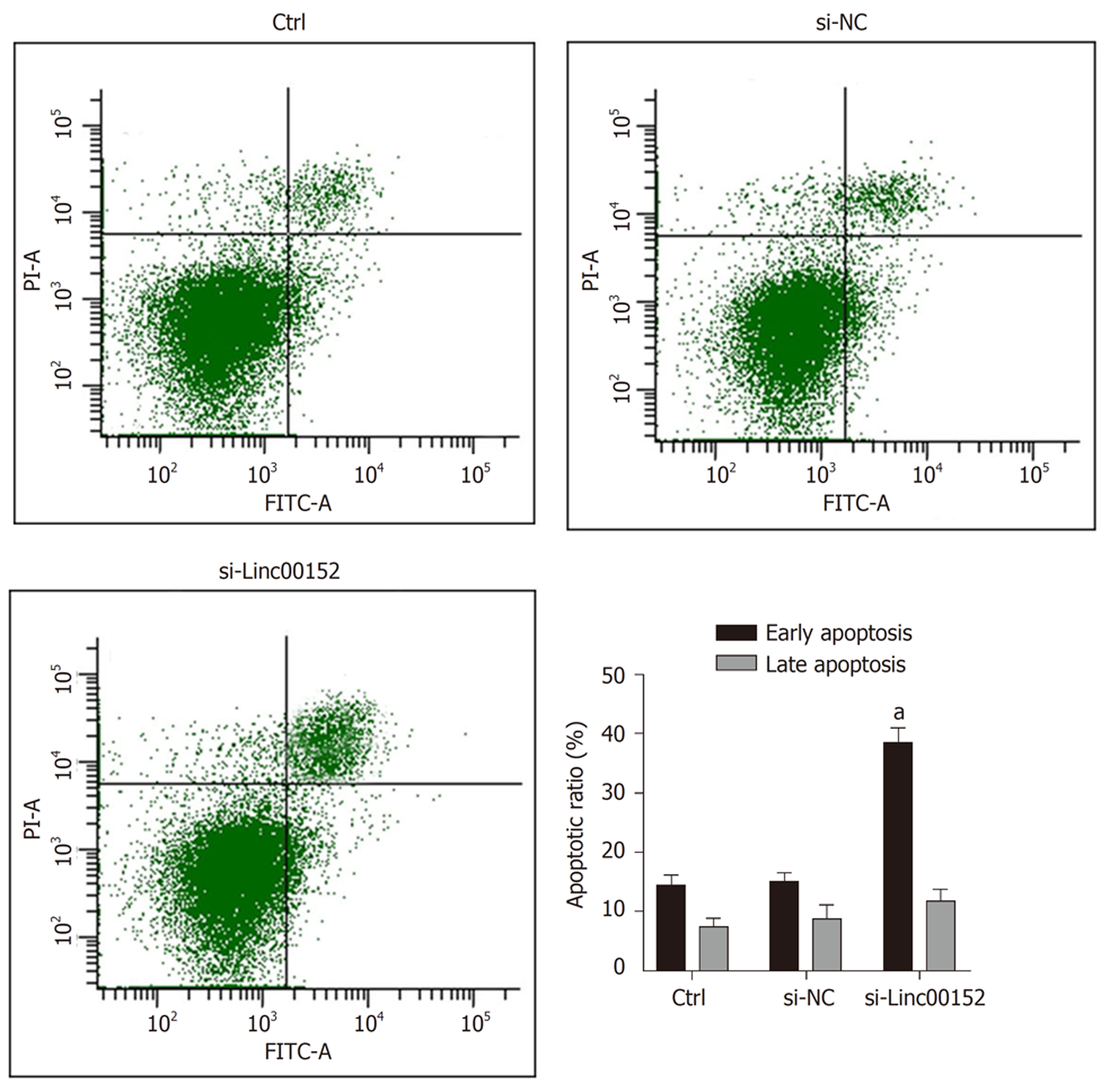
本实验采用流式细胞术评估了下调Linc00152对NCI-N87/MMC细胞凋亡的影响, 结果显示(图2), 相较于对照组细胞, si-Linc00152组细胞的早期凋亡率由(14.59±1.37)%增加至(38.67±3.54)%(P<0.05); 而中晚期细胞凋亡/坏死率由(7.65±1.53)%增加至(11.97±1.69)%. 表明下调Linc00152可显著促进耐药细胞NCI-N87/MMC的凋亡.
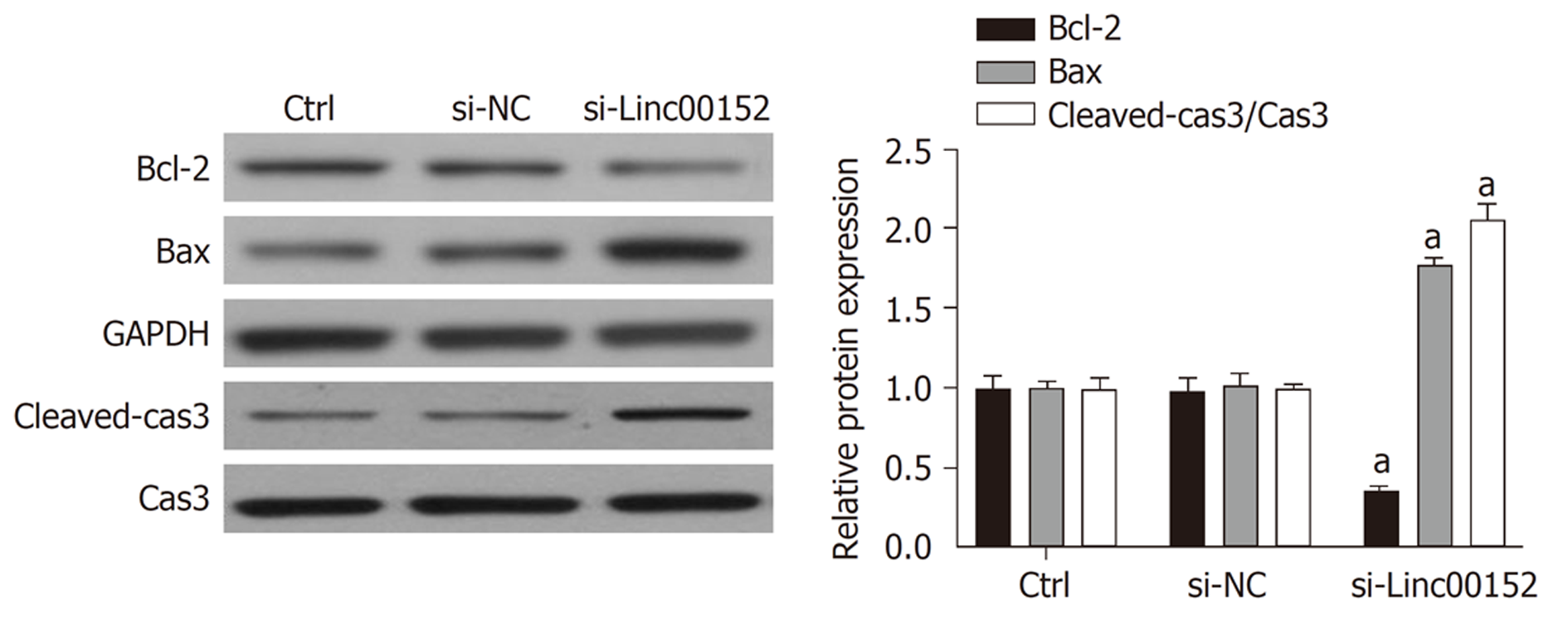
Western Blot检测(图3)结果显示, 相较于对照组, si-Linc00152组抗凋亡蛋白Bcl-2的表达显著下降, 而凋亡蛋白Bax、cleaved-caspase3的蛋白水平明显增加.
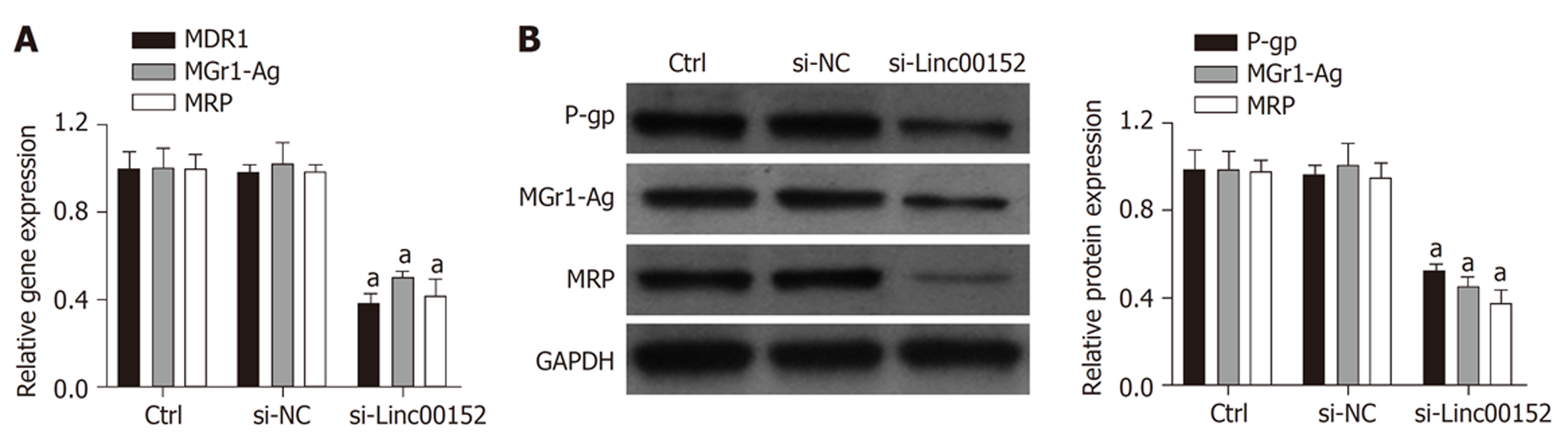
本实验进一步检测了NCI-N87/MMC细胞中耐药相关基因的表达情况, 结果显示(图4), 相较于对照组, si-Linc00152组MDR1、MGr1-Ag以及MRP的mRNA表达水平显著降低(图4A), 同时P-gp、MGr1-Ag以及MRP的蛋白表达水平也显著降低(图4B). 提示下调Linc00152可抑制NCI-N87/MMC细胞中耐药相关基因MDR1、MGr1-Ag、MRP及其编码的蛋白的表达.
研究发现, Linc00152具有癌基因样作用, 其可通过不同的信号途径调控肿瘤细胞增殖及凋亡[15]; 在胃癌中的相关研究显示, 相较于癌旁非肿瘤组织和炎性胃粘膜组织, Linc00152在胃癌组织中高表达, 且Linc00152的高表达能促进胃癌侵袭和迁移[14-16]. 本研究发现, Linc00152在MMC耐药的胃癌NCI-N87/MMC细胞中的表达显著高其亲本细胞NCI-N87, 而通过小分子干扰技术下调NCI-N87/MMC细胞中Linc00152的表达可增加细胞对MMC以及顺铂的敏感性. 由此推测, 下调Linc00152可在一定程度逆转NCI-N87/MMC细胞的化疗耐药.
考虑到Linc00152对肿瘤细胞增殖及凋亡的调控作用, 本研究进一步从细胞凋亡的角度探讨了Linc00152调控NCI-N87/MMC细胞的MMC耐药的作用机制. 流式细胞术的检测结果显示, 下调Linc00152可显著促进耐药细胞NCI-N87/MMC的凋亡. 该结果提示, 下调Linc00152提高NCI-N87/MMC对MMC的敏感性可能与诱导细胞凋亡有关. Bcl-2家族是调控细胞凋亡最重要的基因, 其中抗凋亡蛋白Bcl-2可与促凋亡蛋白Bax形成异二聚体, 抑制细胞凋亡[17,18]. 本实验的检测结果显示, 下调Linc00152可抑制NCI-N87/MMC细胞中Bcl-2的蛋白表达, 同时促进Bax的蛋白表达. caspase3则是细胞凋亡通路中最主要的终末剪切酶, 活化后可启动下游的级联反应, 诱发凋亡[19]. 本实验中, 下调Linc00152可促进NCI-N87/MMC细胞的caspase3的活化. 结果表明, 下调Linc00152可通过调控凋亡相关因子的表达促进NCI-N87/MMC细胞的凋亡.
此外, 肿瘤细胞的获得性耐药性还与多药耐药相关基因的表达密切相关. MDR1基因可通过编码P-gp(一种ATP依赖性跨膜糖蛋白)主动泵出化疗药物, 降低肿瘤细胞中有效药物浓度[20,21]. MRP主要是促进谷胱甘肽结合药物, 进而促进化疗药物外排[22]. MGr1-Ag实在胃癌长春新碱耐药细胞株SGC7901/VCR中筛选出的耐药相关分子, 不仅可以降低肿瘤细胞中药物浓度, 还可调控细胞凋亡[23,24]. 本实验的检测结果表明, 下调Linc00152可抑制NCI-N87/MMC细胞中耐药相关基因MDR1、MGr1-Ag、MRP及其编码的蛋白的表达. 但是其中是否还涉及其他耐药相关的机制以及具体的分子靶点还有待进一步深入的研究. 此外, 因本研究仅采用NCI-N87/MMC细胞对靶向抑制Linc00152后发挥的逆转化疗耐药的作用进行了初步探讨, 其结果具有一定局限性, 因此, 仍需多种化疗耐药胃癌细胞以及由化疗耐药胃癌细胞构建的移植瘤动物模型来进一步验证靶向抑制Linc00152在胃癌化疗耐药中的作用.
综上所述, 下调Linc00152可提高MMC耐药胃癌细胞NCI-N87/MMC对化疗药物MMC和顺铂的敏感性, 其作用可能与其诱导细胞凋亡以及下调多药耐药相关基因MDR1、MGr1-Ag、MRP的表达相关.
胃癌化疗易产生化疗药物耐药, 而寻找并干预影响胃癌细胞化疗耐药的特异性靶点有望逆转耐药性, 使得胃癌化疗耐药患者获益.
已有研究表明长基因间非编码RNA 152(long intergenic noncoding RNA 152, Linc00152)在胃癌组织中高表达, 且其促进胃癌恶性进展. 而目前尚不清楚Linc00152表达是否与胃癌化疗耐药具有内部联系.
探究Linc00152表达与胃癌化疗耐药之间的关系, 研究敲除Linc00152是否能增强丝裂霉素(mitomycin, MMC)耐药胃癌细胞系NCI-N87/MMC对MMC和顺铂的敏感性, 并分析其中涉及的分子学机制.
首先, 检测NCI-N87/MMC细胞和母本细胞NCI-N87中Linc00152的表达情况. 接着分析敲除Linc00152对NCI-N87/MMC细胞MMC和顺铂敏感性以及细胞凋亡的影响. 最后, 分析敲除Linc00152对NCI-N87/MMC细胞中凋亡相关蛋白以及多药耐药相关蛋白及其基因表达的影响.
Linc00152在NCI-N87/MMC细胞中高表达. 敲除NCI-N87/MMC细胞中Linc00152表达可增加其对MMC和顺铂的敏感性, 诱导细胞凋亡并下调多药耐药基因MDR1、Mgr1-Ag、MRP及其编码的蛋白的表达.
敲除Linc00152可部分逆转NCI-N87/MMC对MMC和顺铂的耐药性, 其机制可能与其诱导细胞凋亡并下调MDR1、MGr1-Ag、MRP的表达相关.
外源性靶向敲除Linc00152可能是增强胃癌化疗耐药患者的化疗效果的潜在策略.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C
D级 (一般): D, D
E级 (差): 0
科学编辑: 张砚梁 制作编辑:张砚梁
| 1. | Smyth EC, Nilsson M, Grabsch HI, van Grieken NC, Lordick F. Gastric cancer. Lancet. 2020;396:635-648. [PubMed] [DOI] |
| 2. | Song Z, Wu Y, Yang J, Yang D, Fang X. Progress in the treatment of advanced gastric cancer. Tumour Biol. 2017;39:1010428317714626. [PubMed] [DOI] |
| 3. | Johnston FM, Beckman M. Updates on Management of Gastric Cancer. Curr Oncol Rep. 2019;21:67. [PubMed] [DOI] |
| 4. | Nikolaou M, Pavlopoulou A, Georgakilas AG, Kyrodimos E. The challenge of drug resistance in cancer treatment: a current overview. Clin Exp Metastasis. 2018;35:309-318. [PubMed] [DOI] |
| 5. | Wu Q, Yang Z, Nie Y, Shi Y, Fan D. Multi-drug resistance in cancer chemotherapeutics: mechanisms and lab approaches. Cancer Lett. 2014;347:159-166. [PubMed] [DOI] |
| 6. | Assaraf YG, Brozovic A, Gonçalves AC, Jurkovicova D, Linē A, Machuqueiro M, Saponara S, Sarmento-Ribeiro AB, Xavier CPR, Vasconcelos MH. The multi-factorial nature of clinical multidrug resistance in cancer. Drug Resist Updat. 2019;46:100645. [PubMed] [DOI] |
| 7. | Hu W, Huang XS, Wu JF, Yang L, Zheng YT, Shen YM, Li ZY, Li X. Discovery of Novel Topoisomerase II Inhibitors by Medicinal Chemistry Approaches. J Med Chem. 2018;61:8947-8980. [PubMed] [DOI] |
| 8. | Shimizu T, Fujii T, Sakai H. The Relationship Between Actin Cytoskeleton and Membrane Transporters in Cisplatin Resistance of Cancer Cells. Front Cell Dev Biol. 2020;8:597835. [PubMed] [DOI] |
| 9. | Marin JJ, Al-Abdulla R, Lozano E, Briz O, Bujanda L, Banales JM, Macias RI. Mechanisms of Resistance to Chemotherapy in Gastric Cancer. Anticancer Agents Med Chem. 2016;16:318-334. [PubMed] [DOI] |
| 10. | Lucere KM, O'Malley MMR, Diermeier SD. Functional Screening Techniques to Identify Long Non-Coding RNAs as Therapeutic Targets in Cancer. Cancers (Basel). 2020;12. [PubMed] [DOI] |
| 11. | Wang S, Weng W, Chen T, Xu M, Wei P, Li J, Lu L, Wang Y. LINC00152 Promotes Tumor Progression and Predicts Poor Prognosis by Stabilizing BCL6 From Degradation in the Epithelial Ovarian Cancer. Front Oncol. 2020;10:555132. [PubMed] [DOI] |
| 12. | Wang B, Yang S, Zhao W. Long Non-Coding RNA NRAD1 and LINC00152 are Highly Expressed and Associated with Prognosis in Patients with Hepatocellular Carcinoma. Onco Targets Ther. 2020;13:10409-10416. [PubMed] [DOI] |
| 13. | Yuan ZJ, Yu C, Hu XF, He Y, Chen P, Ouyang SX. LINC00152 promotes pancreatic cancer cell proliferation, migration and invasion via targeting miR-150. Am J Transl Res. 2020;12:2241-2256. [PubMed] |
| 14. | Zhao J, Liu Y, Zhang W, Zhou Z, Wu J, Cui P, Zhang Y, Huang G. Long non-coding RNA Linc00152 is involved in cell cycle arrest, apoptosis, epithelial to mesenchymal transition, cell migration and invasion in gastric cancer. Cell Cycle. 2015;14:3112-3123. [PubMed] [DOI] |
| 15. | Yu Y, Yang J, Li Q, Xu B, Lian Y, Miao L. LINC00152: A pivotal oncogenic long non-coding RNA in human cancers. Cell Prolif. 2017;50. [PubMed] [DOI] |
| 16. | Pang Q, Ge J, Shao Y, Sun W, Song H, Xia T, Xiao B, Guo J. Increased expression of long intergenic non-coding RNA LINC00152 in gastric cancer and its clinical significance. Tumour Biol. 2014;35:5441-5447. [PubMed] [DOI] |
| 17. | Senichkin VV, Pervushin NV, Zuev AP, Zhivotovsky B, Kopeina GS. Targeting Bcl-2 Family Proteins: What, Where, When? Biochemistry (Mosc). 2020;85:1210-1226. [PubMed] [DOI] |
| 18. | Naumova N, Šachl R. Regulation of Cell Death by Mitochondrial Transport Systems of Calcium and Bcl-2 Proteins. Membranes (Basel). 2020;10. [PubMed] [DOI] |
| 19. | Jiang M, Qi L, Li L, Li Y. The caspase-3/GSDME signal pathway as a switch between apoptosis and pyroptosis in cancer. Cell Death Discov. 2020;6:112. [PubMed] [DOI] |
| 20. | Robey RW, Pluchino KM, Hall MD, Fojo AT, Bates SE, Gottesman MM. Revisiting the role of ABC transporters in multidrug-resistant cancer. Nat Rev Cancer. 2018;18:452-464. [PubMed] [DOI] |
| 21. | Silva R, Vilas-Boas V, Carmo H, Dinis-Oliveira RJ, Carvalho F, de Lourdes Bastos M, Remião F. Modulation of P-glycoprotein efflux pump: induction and activation as a therapeutic strategy. Pharmacol Ther. 2015;149:1-123. [PubMed] [DOI] |
| 22. | Li S, Li B, Wang J, Zhang D, Liu Z, Zhang Z, Zhang W, Wang Y, Bai D, Guan J, Zhang Y. Identification of Sensitivity Predictors of Neoadjuvant Chemotherapy for the Treatment of Adenocarcinoma of Gastroesophageal Junction. Oncol Res. 2017;25:93-97. [PubMed] [DOI] |
| 23. | Luo G, Wang W, Wu Q, Lu Y, Su T, Gu N, Li K, Wang J, Du R, Zhao X, Li X, Fan R, Zhang H, Nie Y, Zhou X, Shi Y, Liang J, Wang X, Fan D. MGr1-Antigen/37 kDa laminin receptor precursor promotes cellular prion protein induced multi-drug-resistance of gastric cancer. Oncotarget. 2017;8:71630-71641. [PubMed] [DOI] |