修回日期: 2021-01-30
接受日期: 2021-03-02
在线出版日期: 2021-03-28
多篇病例报道阿霉素(doxorubicin, DOX)引起急性胰腺炎的药物副作用, 但尚无动物实验研究证实, 且缺乏特异性的治疗药物. 异甘草素(isoliquiritigenin, ISL)具有抗炎、抗氧化等多种药理活性, 但是ISL对DOX引起药物性急性胰腺炎(drug-induced acute pancreatitis, DAP)的作用及机制尚不清楚.
证实DOX可引起DAP的病理损伤, 并阐明ISL保护DAP的作用及机制.
将雄性25-30 g ICR小鼠随机分为对照组(Control组, 腹腔注射等量生理盐水), DOX诱导的DAP模型组(DOX-DAP组, 隔日腹腔注射DOX 10 mg/kg/只)和ISL治疗组(DOX+ISL组, 隔日腹腔注射DOX 10 mg/kg/只, 同时提前一天每日给予ISL灌胃100 mg/kg/只) , 每组8只. 造模后5 d取材进行胰腺组织病理检测及评分; 免疫组织化学方法检测胰腺组织alpha淀粉酶表达; 免疫荧光法检测胰腺组织ROS生成; Western blot法检测胰腺组织Nrf2和HO-1蛋白表达.
与Control组相比, DOX-DAP组小鼠胰腺组织呈现水肿、炎性细胞浸润等特征性病理损伤, 胰腺组织病理学评分显著升高(P<0.001), 胰腺组织alpha淀粉酶表达水平显著下降(P<0.01). 与DOX-DAP组相比, ISL治疗组的胰腺组织病理评分显著降低(P<0.05), 胰腺组织alpha淀粉酶表达水平显著升高(P<0.05). ROS荧光染色及Western blot检测显示, 与Control组相比, DOX-DAP组小鼠胰腺组织ROS生成显著升高(P<0.001), Nrf2和HO-1蛋白表达水平轻度升高(P<0.001). 与DOX-DAP组相比, ISL治疗组的胰腺组织ROS水平显著降低(P<0.001), Nrf2和HO-1蛋白表达水平显著升高(P<0.001).
DOX能够引起小鼠胰腺出现以组织水肿和炎症细胞浸润为主要特征的病理损伤, ISL通过增强胰腺组织抗氧化应激水平对DOX引起的DAP具有保护作用, 有望为DAP的预防与治疗提供新的方法.
核心提要: 阿霉素(doxorubicin, DOX)诱导小鼠药物性急性胰腺炎(drug-induced acute pancreatitis, DAP)的发生, 表现为胰腺组织水肿, 炎症细胞浸润且伴随组织ROS积聚和氧化应激损伤. 异甘草素(isoliquiritigenin, ISL)能显著减轻DOX导致的胰腺组织病理损伤, 调节Nrf2/HO-1氧化应激通路抑制组织ROS生成, 保护DOX相关的DAP, 提示ISL可作为临床治疗DAP的潜在药物.
引文著录: 袁晨晨, 朱擎天, 沈沁浩, 许杏萌, 许尧, 杨琦, 李百强, 路国涛, 李维勤. 异甘草素通过调节Nrf2/HO-1氧化应激通路抑制ROS生成保护阿霉素诱导的药物性胰腺炎. 世界华人消化杂志 2021; 29(6): 282-290
Revised: January 30, 2021
Accepted: March 2, 2021
Published online: March 28, 2021
Several case studies have reported that doxorubicin (DOX) could induce acute pancreatitis, but no animal experiments have confirmed such side effect of DOX, and there is no specific treatment. Isoliquiritigenin (ISL) has a variety of pharmacological functions, including anti-inflammatory and antioxidant activities; however, the role and mechanism of ISL on DOX-induced acute pancreatitis (DAP) remain unclear.
To confirm whether doxorubicin (DOX) results in pancreatic tissue injury, and to determine the role and mechanism of isoliquiritigenin (ISL) in protecting against DOX-induced pancreatitis.
Male ICR mice (25-30 g) were randomly divided into a control group (intraperitoneal injection of normal saline), DOX-DAP model group (intraperitoneal injection of DOX 10 mg/kg every other day), and ISL treatment group (DOX + ISL group; intraperitoneal injection of DOX 10 mg/kg every other day and intragastric administration of ISL 100 mg/kg per day), with 8 mice in each group. Pancreatic histopathology and scoring were performed 5 d after modeling. The expression of alpha amylase in pancreatic tissue was detected by immunohistochemistry. Immunofluorescence assay was used to detect ROS production in pancreatic tissue. Protein expression of Nrf2 and HO-1 in pancreatic tissue was detected by Western blot.
Compared with the control group, the mice in the DOX-DAP model group showed characteristic pathological damage, such as pancreatic tissue edema and inflammatory cells infiltration, with significantly increased histopathological scores (P < 0.001) and decreased expression of alpha amylase in the pancreas (P < 0.01). Compared with the DOX-DAP model group, the DOX + ISL group had significantly decreased histopathological scores (P < 0.05) and increased expression of alpha amylase in the pancreas (P < 0.05). ROS fluorescence staining and Western blot analysis showed that compared with the control group, ROS generation in pancreatic tissue in the DOX-DAP model group was significantly increased (P < 0.001), and the expression levels of Nrf2 and HO-1 proteins were slightly increased (P < 0.001). Compared with the DOX-DAP group, the DOX + ISL group had significantly decreased ROS levels in pancreatic tissuesed (P < 0.001), and significantly increased expression of Nrf2 and HO-1 proteins (P < 0.001).
DOX can cause pancreatic pathological damage in mice, which is mainly characterized by pancreatic tissue edema and inflammatory cells infiltration. ISL administration has a protective effect on DOX-induced pancreatitis by enhancing the antioxidant stress level in pancreatic tissue, which is expected to provide a new method for the prevention and treatment of drug-induced pancreatitis.
-
Citation: Yuan CC, Zhu QT, Shen QH, Xu XM, Xu Y, Yang Q, Li BQ, Lu GT, Li WQ. Isoliquiritigenin ameliorates doxorubicin-induced acute pancreatitis by inhibiting ROS production
via modulation of Nrf2/HO-1 oxidative stress pathway. Shijie Huaren Xiaohua Zazhi 2021; 29(6): 282-290 - URL: https://www.wjgnet.com/1009-3079/full/v29/i6/282.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v29.i6.282
药物性急性胰腺炎(drug-induced acute pancreatitis, DAP)是药物诱发的一种消化系统急性炎症性疾病. 在急性胰腺炎(acute pancreatitis, AP)病因中药物引起的占2.8%-3.6%[1,2], 其中近80%为轻到中度病例[2], 预后较好. 过去几十年期间, 世界卫生组织(world health organization, WHO)报告了超过525种不同类别的药物可能会引起AP的副作用[3], 其中绝大多数数据来自病例报告, 只有31种明确与AP之间的因果关系[4], 其余仍有待研究证实. 阿霉素(doxorubicin, DOX)是一种高效广谱的蒽环类非特异性抗肿瘤药物, 可在不同生长阶段抑制肿瘤细胞的增殖, 已被广泛应用于血液肿瘤和各种实体肿瘤的临床化疗[5]. 有研究回顾了145例接受经动脉阿霉素化学栓塞治疗的肝细胞癌患者, 其中7例患者(0.4%)在化学栓塞后发生持续性腹痛及血淀粉酶升高, 诊断为DAP. 其中4例患者出现了AP相关并发症, 包括胰腺组织坏死(3例)和假性囊肿形成(1例)[6]. 此外有多篇病例报告报道了以DOX为基础的药物洗脱珠经导管动脉化疗栓塞术(TACE)治疗肝癌患者并发AP[7,8]. 但尚无动物实验研究阐明DOX是否可以引起DAP, 及造成的损伤严重程度如何. 且DAP的治疗以停药及支持治疗为主, 尚无特异性的治疗药物[9].
异甘草素(isoliquiritigenin, ISL)是从天然草药甘草根中提取的一种类黄酮化合物[10]. ISL具有广泛的药理作用, 包括抗肿瘤、抗炎、抗氧化应激等活性[11-13]. 本研究团队先前研究证实, ISL通过调节氧化应激通路保护雨蛙素诱导的小鼠AP模型[14]. 然而, ISL对DOX引起DAP的作用国内外尚无研究报道. 在本研究中, 我们旨在通过动物实验证实DOX引起DAP的损伤及严重程度, 阐明ISL对DAP的影响, 并探讨其潜在的机制.
材料、试剂与实验动物: 24只雄性8周龄ICR小鼠体重25-30 g, 购自南京江宁青龙山动物繁育基地. 实验前, 所有小鼠均饲养于SPF设施中, 给予实验特定干预前自由摄食标准啮齿动物饲料和水, 环境温度控制范围(25 ℃±2 ℃), 循环照明(12 h光照/12 h黑暗)条件. ICR小鼠健康状况符合国家普通实验动物健康标准. 实验方案经东部战区总医院实验动伦理审查委员会审查批准进行(批件号: 2020JLHKYLWDWLS-00311). DOX (Doxorubicin, 货号: HY-15142)购自中国MCE (MedChemExpress)公司, ISL (Isoliquiritigenin, CAS号: 961-29-5)购自上海阿拉丁生化科技股份有限公司. Dihydroethidium (DHE, 货号: GDP1018)和4, 6-Diamidino-2-Phenylindole, Dihydrochloride (DAPI, 货号: GDP1012)染色试剂购自武汉赛维尔生物科技有限公司. 抗核因子红系2相关因子2 (Nuclear factor erythroid 2-related factor 2, Nrf2)抗体(货号: ab31163), 抗血红素加氧酶-1 (Heme Oxygenase-1, HO-1)抗体(货号: ab68477), 抗胰腺alpha amylase抗体(货号: ab199132)均购自美国abcam公司, 内参基因GAPDH抗体(货号: G9545)购自SigmaAldrich上海贸易有限公司. 二抗和DAB显色剂均购自上海碧云天生物技术有限公司. 光学显微镜和荧光显微镜购自日本奥林巴斯. WB多功能成像仪(Tanon-5200)购自上海天能科技有限公司.
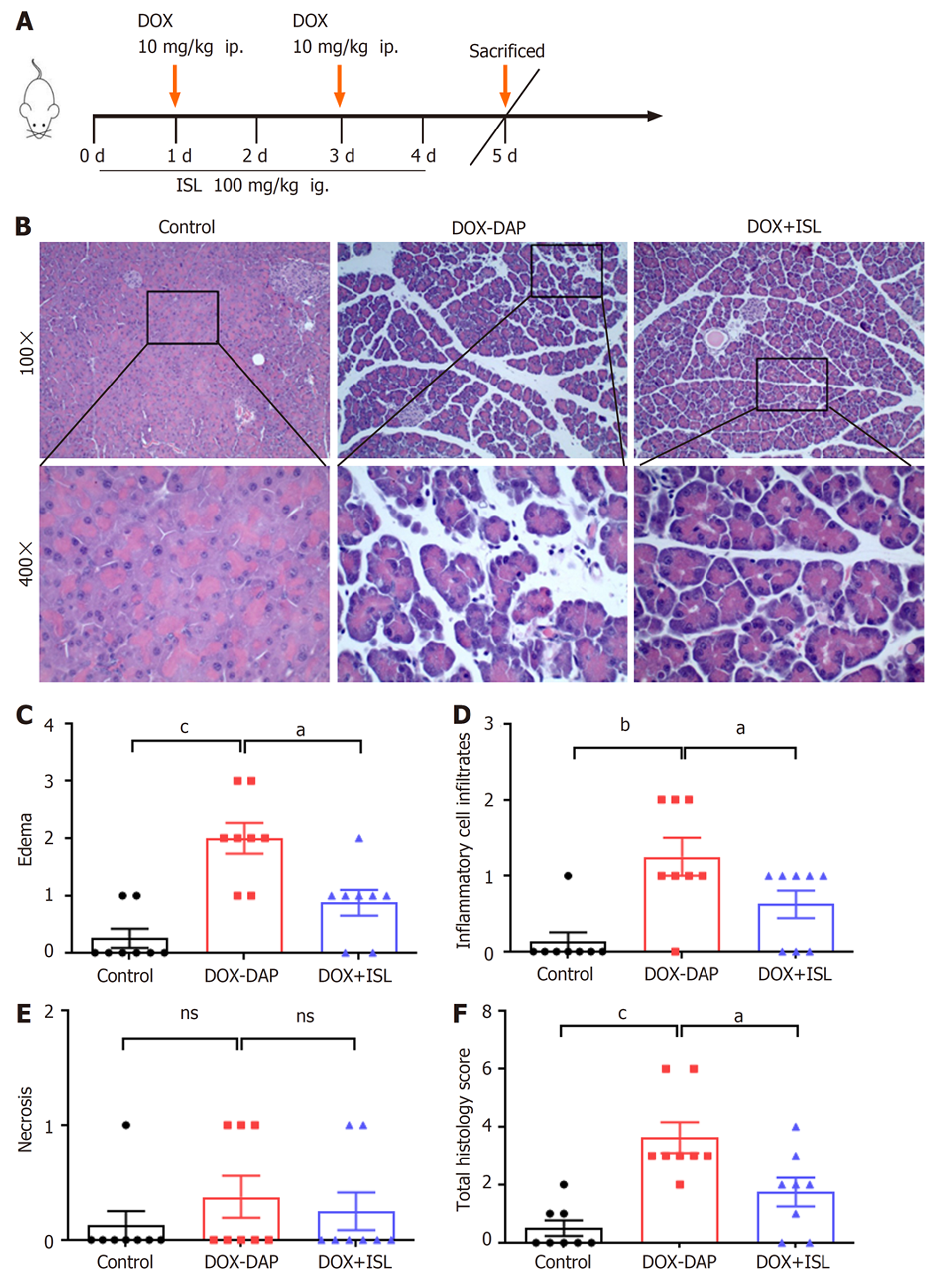
1.2.1 动物模型的建立及分组: 如图1A示, 24只雄性ICR小鼠根据随机数字表法随机分为三组: 对照组(Control组, 腹腔注射等量生理盐水), DOX诱导的DAP模型组(DOX-DAP组, 于第1 d和第3 d分别给予两次腹腔注射DOX, 每次注射剂量为10 mg/kg/只, 第二次腹腔注射后的48 h处死小鼠)和ISL治疗组(DOX+ISL组, 隔日腹腔注射DOX 10 mg/kg/只的同时, 提前一天每日给予ISL灌胃100 mg/kg/只, 共灌胃给药ISL五次) , 每组8只. 造模后5 d结束实验进行取材, 所有动物处死前均用5%水合氯醛(0.01 mL/g)腹腔注射麻醉. 立即留取小鼠胰腺组织, 4%多聚甲醛固定部分组织进行病理染色及免疫组化染色分析, 其余组织置于-80 ℃保存, 用于免疫荧光染色分析及Western blot检测.
1.2.2 胰腺组织HE染色及病理评分: 胰腺组织经4%多聚甲醛固定48 h后, 脱水, 打蜡和包埋制作成5 μm切片, 在60 ℃下烘烤. 使用苏木精-伊红(H&E)染色组织切片. 随后依次进行梯度酒精脱水, 二甲苯透明, 在显微镜下进行组织学观察并拍照. 组织的病理学评分和分析由2个独立的病理科医师采用盲法进行, 胰腺病理损伤评分依据Schmidt法[15]从组织水肿、炎症细胞浸润和腺泡细胞坏死三个方面进行评估.
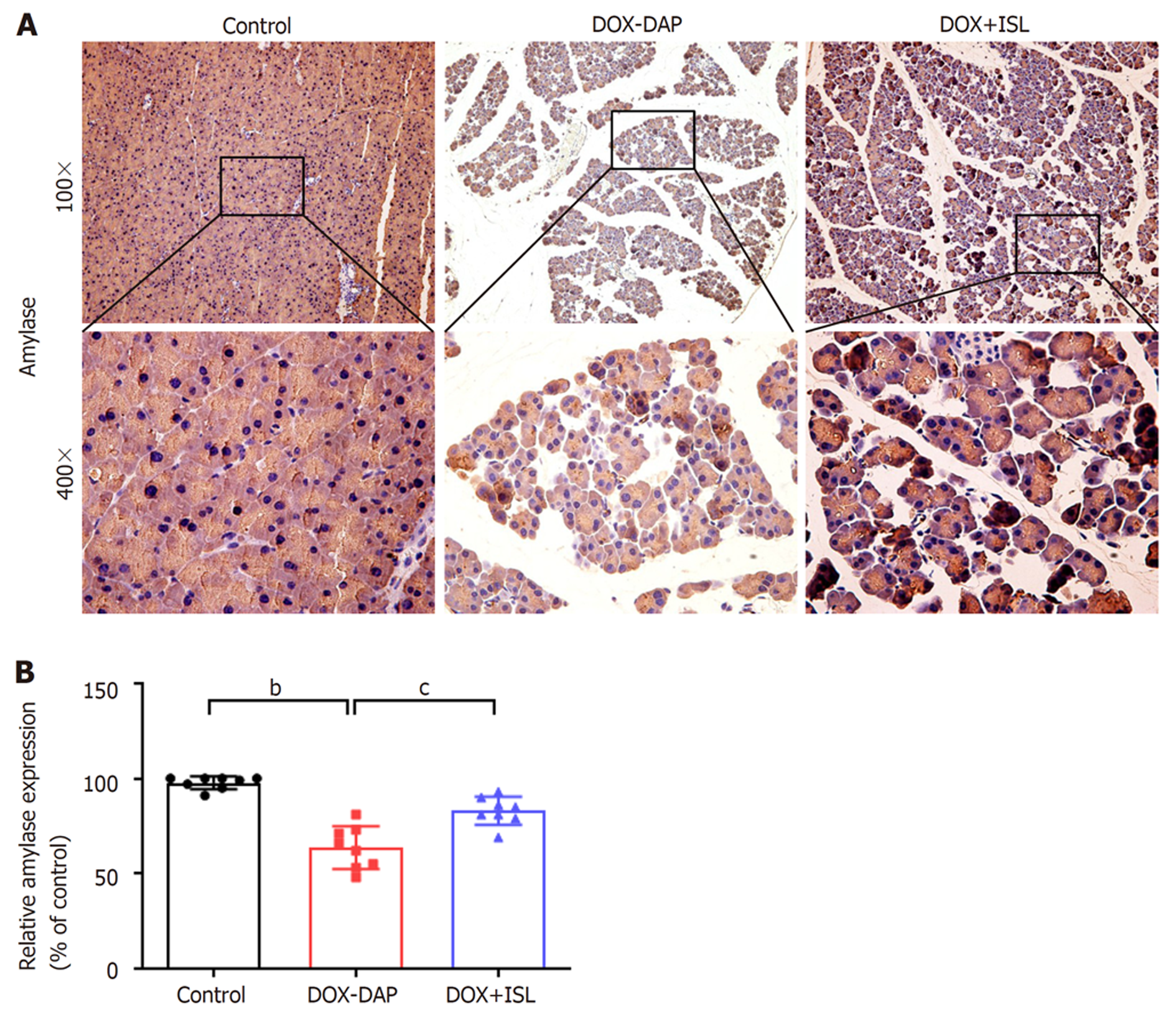
1.2.3 胰腺组织alpha淀粉酶免疫组化染色: 5 μm胰腺组织切片经脱蜡, 梯度酒精脱水, EDTA抗原修复缓冲液煮沸, 进行胰腺alpha淀粉酶的免疫组织化学染色. 经过自然冷却后, 3%过氧化氢溶液室温孵育15 min. 切片与alpha amylase抗体(1:200稀释)在4 ℃共同孵育过夜. 采用生物素标记的二抗(1:200稀释度)孵育1 h. 最后用苏木精复染, 在显微镜下观察玻片并拍照, 应用Image J软件对阳性染色区域进行半定量分析.
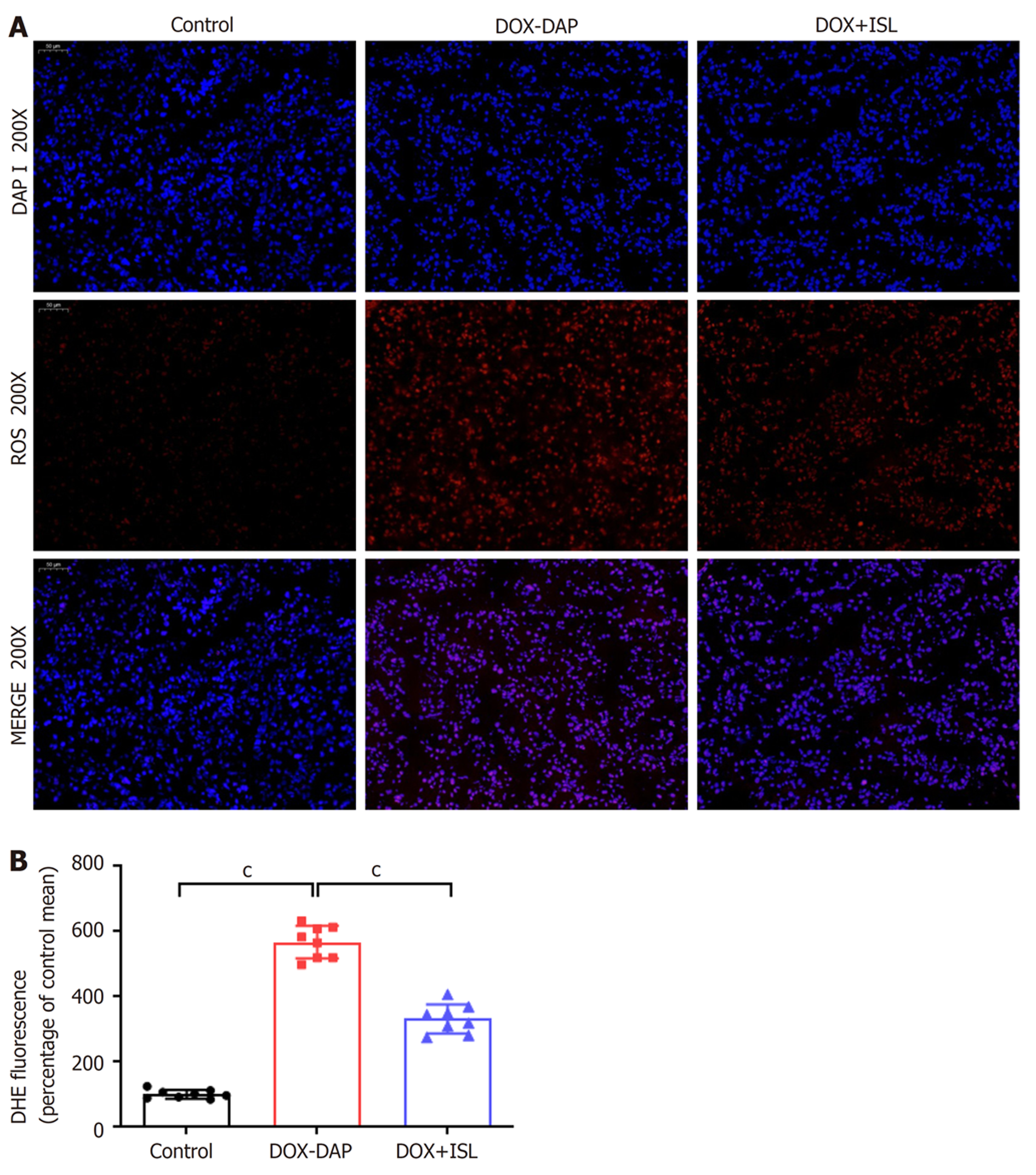
1.2.4 胰腺组织ROS免疫荧光染色: 用二氢乙锭(dihydroethidium, DHE)荧光探针检测胰腺组织中ROS的含量. -80 ℃保存的胰腺组织, 经冰冻切片机制成5 μm切片, 用免疫组织化学笔在切片组织周围画一个圈, 防止染色溶液流出. 滴加DHE探针染液室温振荡15 min, 随后玻片置于pH = 7.4的PBS中洗涤3次, 每次振荡5 min. 室温下DAPI溶液染核振荡10 min后, 再次PBS振荡洗涤3次, 封片. 荧光显微镜下观察玻片并拍照, 使用Image J软件对ROS红色荧光阳性染色区域进行半定量分析.
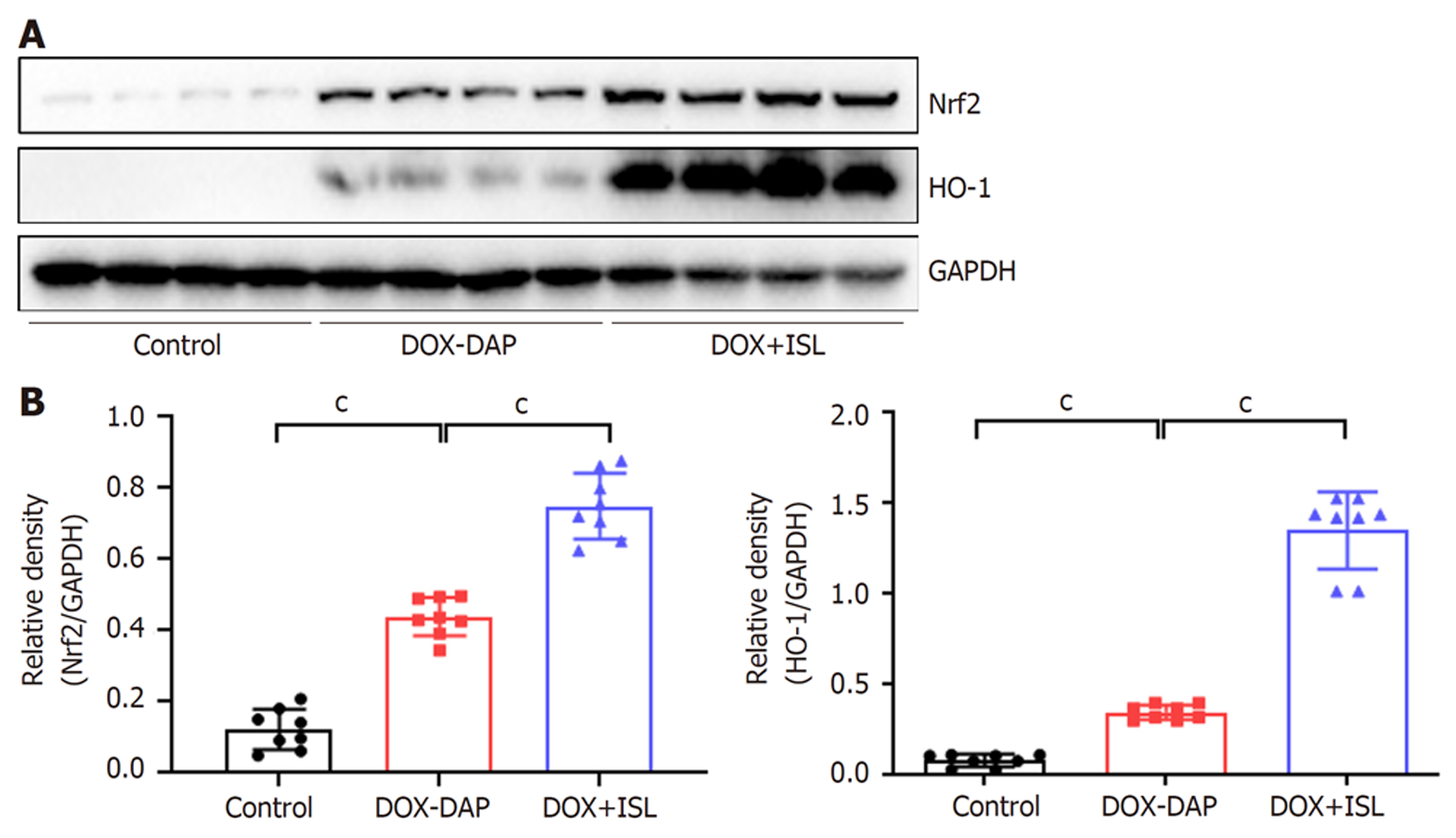
1.2.5 Western blot检测: 在含RIPA裂解液和蛋白酶抑制剂的混合物中制备胰腺组织匀浆液样品. BCA试剂盒测定蛋白质浓度. 取等量(30 mg)蛋白进行10% SDS-PAGE凝胶电泳分离并转移到PVDF膜上, 5%的脱脂牛奶在室温下封闭2 h, 4 ℃孵育抗Nrf2抗体(1:1000稀释), 抗HO-1抗体(1:1000稀释), 抗GAPDH抗体(1:5000稀释)过夜. 隔天TBST洗膜3次, 室温孵育山羊抗鼠抗体或山羊抗兔抗辣根过氧化物酶抗体(1:10000稀度) 2 h后TBST洗膜3次, ECL化学发光底物液检测, 天能-5200多功能成像仪曝光. 使用Image J软件半定量分析图像强度.
统计学处理 数据采用GraphPad Prism 8.01软件进行分析和制图, 计量资料以mean±SD表示, 柱状图数据均以mean±SD表示. 两组间比较采用t检验, 两因素的ANOVA进行多重比较. 统计学显著性用aP<0.05, bP<0.01或cP<0.001表示.
为了研究DOX给药是否可以引起药物性的急性胰腺炎症以及ISL治疗对其的影响, 根据图1A所示实验方案, 我们评估了胰腺的组织病理学损伤程度. HE染色结果显示, Control组的胰腺组织形态基本正常, DOX腹腔注射后可引起小鼠急性胰腺损伤, 胰腺组织总的病理学评分显著升高(P<0.001), 其特征表现以组织水肿为主(P<0.001), 伴有少量炎性细胞浸润(P<0.01), 同时很少见腺泡细胞坏死, 腺泡细胞坏死评分DOX-DAP组相较于Control组无统计学差异. 与DOX-DAP组相比, 给予ISL灌胃治疗后, 胰腺的组织学损伤明显减轻, 总的病理学评分明显降低(P<0.05), 仅表现为轻度水肿, 极少量炎症细胞浸润和无腺泡细胞坏死, 组织水肿和炎性细胞浸润评分也明显降低(P<0.05), 腺泡细胞坏死评分无统计学差异(图1B-F示).
为了评估DOX给药后及ISL治疗后胰腺组织淀粉酶变化水平, 我们对胰腺组织的病理切片进行了alpha淀粉酶的免疫组化染色. 结果(图2A-B)显示, 与Control组相比, DOX给药后胰腺组织alpha淀粉酶表达明显降低(P<0.01), 提示胰腺组织淀粉酶早期释放入血, 腺泡细胞受到损伤酶原合成功能障碍. 与DOX-DAP组相比, ISL治疗后胰腺组织alpha淀粉酶表达显著升高(P<0.05), 淀粉酶异常释放减少, 腺泡细胞功能恢复稳态.
ROS的聚集及其介导的氧化应激损伤在急性胰腺炎中起关键作用, 为了阐明ISL保护DOX引起的DAP的潜在机制, 我们进一步检测了胰腺组织ROS的产生以及抗氧化应激损伤相关蛋白(Nrf2和HO-1)的表达水平. 免疫荧光(图3A-B)与Western blot结果(图4A-B)显示, 与Control组相比, DOX给药后胰腺组织ROS产生水平明显升高(P<0.001), 胰腺组织中Nrf2蛋白和HO-1蛋白表达水平轻度升高(P<0.001). 与DOX-DAP组相比, ISL治疗后胰腺组织ROS水平显著降低(P<0.001), 胰腺组织中Nrf2蛋白和HO-1蛋白表达水平显著升高(P<0.001), 提示ISL给药通过激活Nrf2/HO-1抗氧化应激通路, 增加Nrf2及下游抗氧化蛋白HO-1的表达, 减少组织ROS蓄积引起的氧化应激损伤, 发挥保护DOX引起的DAP的作用.
DOX已成为抗癌治疗的基石, 但是其临床应用受到严重副作用的限制, 主要是剂量依赖性不可逆的心脏毒性作用[16]. 除此之外, 消化系统的毒性作用也屡见不鲜, 多篇病例报道研究了DOX引起急性胰腺炎的药物副作用[7,8,17], 但目前缺乏实验性证据证实. DOX杀伤细胞的作用机制主要是可逆地与拓扑异构酶Ⅰ和Ⅱ结合, 导致DNA断裂, 染色质损伤[18]. 此外, 线粒体也是DOX的主要毒性靶点, 线粒体内膜富含心磷脂, 与DOX有较高的亲和力. 线粒体是产生氧自由基的主要场所, 细胞中ROS大量积累, 破坏线粒体膜的通透性, 影响线粒体膜电位的维持[19-21]. 这些因素共同作用引起氧化应激损伤和细胞毒性. 依据文献报道DOX在动物体内的药物代谢动力学相关数据[22], 以及参考既往研究报道DOX诱导的小鼠心肌损伤动物模型[23,24]的给药方式与剂量, 设计了本研究DOX的给药方案. 本研究通过动物实验首次证明了腹腔注射DOX能够诱导小鼠胰腺腺泡细胞损伤, 导致DOX相关的DAP发生, 病理上主要表现为胰腺组织水肿, 伴有不同程度炎性细胞浸润, 腺泡细胞坏死较少见. 血清生化淀粉酶水平对于AP的诊断至关重要,动物实验中雨蛙素诱导的经典小鼠AP模型(连续7-10次腹腔注射给药, 50 μg/kg/h), 血清淀粉酶脂肪酶于6 h升高, 12 h达峰值, 24 h消退恢复接近正常[14]. 本研究中DOX采用隔日腹腔注射给药, 与雨蛙素的连续腹腔给药不同, 其血清淀粉酶显著变化的时间点不容易采集, 淀粉酶急性变化的窗口期很难把握, 同时多次取血增加小鼠的异常死亡. 本研究中缺少血清生化淀粉酶的实验数据是研究的不足, 生化酶学的动态变化还需进一步的实验阐明. 为了探究DOX损伤后胰腺组织淀粉酶变化水平, 我们对胰腺组织病理切片进行了alpha淀粉酶免疫组化染色, DOX-DAP组胰腺组织淀粉酶表达降低, 酶原合成功能障碍, 进一步证实了DOX引起DAP发生, 腺泡细胞损伤和功能障碍, 淀粉酶异常释放. 为了进一步探究DOX引起胰腺组织损伤的机制, 我们进行了ROS免疫荧光染色, 结果显示DOX作用后的胰腺组织ROS大量积累, 提示DOX的胰腺毒性作用与其导致的ROS氧化应激损伤相关.
氧化应激是细胞损伤的重要途径之一[25]. 临床和实验数据表明, 氧化应激存在于AP的发病早期, 被认为是AP的经典发病机制之一[26]. 在各种AP动物模型中, 抗氧化治疗也已被证明可以有效减少腺泡细胞坏死和减轻胰腺组织损伤的严重程度[27,28]. Nrf2/HO-1通路是细胞抗氧化反应的中枢调节因子. Nrf2是一种细胞内抗氧化转录因子, 进入细胞核后与下游HO-1蛋白相互作用, 激活氧化应激通路[29,30]. ISL是一种天然类黄酮化合物, 提取自天然草药甘草的水溶物中, 具有广泛的抗炎, 抗肿瘤和抗氧化作用[31,32]. 本团队前期研究证实, 在两种小鼠AP模型中, ISL可降低血清淀粉酶和脂肪酶水平, 并以剂量依赖的方式减轻胰腺组织的组织病理学表现, 降低氧化应激损伤, 增加Nrf2/HO-1通路蛋白的表达, 减轻小鼠AP. 给予Nrf2抑制剂(ML385)或HO-1抑制剂(Znpp)阻断Nrf2/HO-1通路后, 未能观察ISL对小鼠AP的保护作用. 在L-精氨酸诱导的SAP模型中, ISL可减轻胰腺组织损伤和胰腺炎相关性肺损伤的严重程度[14]. 但是, ISL对DOX引起DAP的作用及机制尚不清楚. 与前期研究结果一致的是, DOX作用后的胰腺组织WB检测Nrf2和HO-1蛋白表达轻度升高, 考虑可能是组织自身保护机制引起的适应性变化, 但是其升高水平不足以抵抗急性胰腺损伤. 经灌胃给予ISL治疗后, 显著降低DOX引起的胰腺组织病理损伤严重程度, 恢复组织alpha淀粉酶表达水平, 维持腺泡细胞稳态. 作用机制上, ISL治疗后, 降低胰腺组织ROS的产生和积聚, 进一步激活Nrf2/HO-1通路, 增加Nrf2及下游抗氧化蛋白HO-1的表达, 减少氧化应激损伤, 从而保护DOX引起的DAP.
总的来说, 我们的研究证明了DOX诱导小鼠DAP的发生, 表现为胰腺组织水肿, 炎症细胞浸润且伴随组织ROS积聚和氧化应激损伤. ISL能显著减轻DOX导致的胰腺组织病理损伤, 调节Nrf2/HO-1氧化应激通路抑制组织ROS生成, 保护DOX相关的DAP, 提示ISL可作为临床治疗DAP的潜在药物.
药物性急性胰腺炎是药物临床应用中常见的消化系统副作用, 大量研究仅限于病例报道, 缺乏动物实验证实其因果关系. 药物性急性胰腺炎(drug-induced acute pancreatitis, DAP)的治疗以停药及支持治疗为主, 尚无特异性的治疗药物. 明确药物引起动物体内胰腺病理损伤的实验性证据, 开发针对性治疗药物, 对于预防和治疗DAP具有重要意义.
多篇病例报道阿霉素(doxorubicin, DOX)引起急性胰腺炎的药物副作用, 但尚无动物实验研究证实, 且缺乏特异性的治疗药物. 异甘草素(isoliquiritigenin, ISL)具有抗炎、抗氧化等多种药理活性, 但是ISL对DOX引起DAP的作用及机制尚不清楚.
证实DOX可引起DAP的病理损伤, 并阐明ISL保护DAP的作用及机制.
将雄性25-30 g ICR小鼠随机分为对照组(Control组, 腹腔注射等量生理盐水), DOX诱导的DAP模型组(DOX-DAP组, 隔日腹腔注射DOX 10 mg/kg/只)和ISL治疗组(DOX+ISL组, 隔日腹腔注射DOX 10 mg/kg/只, 同时提前一天每日给予ISL灌胃100 mg/kg/只) , 每组8只. 造模后5 d取材进行胰腺组织病理检测及评分; 免疫组织化学方法检测胰腺组织alpha淀粉酶表达; 免疫荧光法检测胰腺组织ROS生成; Western blot法检测胰腺组织Nrf2和HO-1蛋白表达.
与Control组相比, DOX-DAP组小鼠胰腺组织呈现水肿、炎性细胞浸润等特征性病理损伤, 胰腺组织病理学评分显著升高(P<0.001), 胰腺组织alpha淀粉酶表达水平显著下降(P<0.01). 与DOX-DAP组相比, ISL治疗组的胰腺组织病理评分显著降低(P<0.05), 胰腺组织alpha淀粉酶表达水平显著升高(P<0.05). ROS荧光染色及Western blot检测显示, 与Control组相比, DOX-DAP组小鼠胰腺组织ROS生成显著升高(P<0.001), Nrf2和HO-1蛋白表达水平轻度升高(P<0.001). 与DOX-DAP组相比, ISL治疗组的胰腺组织ROS水平显著降低(P<0.001), Nrf2和HO-1蛋白表达水平显著升高(P<0.001).
DOX能够引起小鼠胰腺出现以组织水肿和炎症细胞浸润为主要特征的病理损伤, ISL通过增强胰腺组织抗氧化应激水平对DOX引起的DAP具有保护作用.
警惕DOX临床应用中的胰腺损伤副作用, ISL或可成为DAP预防与治疗的新方法.
学科分类: 胃肠病学和肝病学
手稿来源地: 江苏省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): B, B, B
C级 (良好): 0
D级 (一般): 0
E级 (差): 0
科学编辑: 刘继红 制作编辑:张砚梁
| 1. | Chadalavada P, Simons-Linares CR, Chahal P. Drug-induced acute pancreatitis: Prevalence, Causative agents, and Outcomes. Pancreatology. 2020;20:1281-1286. [PubMed] [DOI] |
| 2. | Sánchez-Aldehuelo R, García García de Paredes A, Rojo Lázaro D, Martínez Ortega A, García de la Filia Molina I, López-Durán S, Rodríguez Gandía MÁ, López-Sanromán A, Albillos A. outcomes of drug-induced acute pancreatitis: a ten-year experience of an academic center. Rev Esp Enferm Dig. 2020;. [PubMed] [DOI] |
| 3. | Nitsche C, Maertin S, Scheiber J, Ritter CA, Lerch MM, Mayerle J. Drug-induced pancreatitis. Curr Gastroenterol Rep. 2012;14:131-138. [PubMed] [DOI] |
| 4. | Weissman S, Aziz M, Perumpail RB, Mehta TI, Patel R, Tabibian JH. Ever-increasing diversity of drug-induced pancreatitis. World J Gastroenterol. 2020;26:2902-2915. [PubMed] [DOI] |
| 5. | Rivankar S. An overview of doxorubicin formulations in cancer therapy. J Cancer Res Ther. 2014;10:853-858. [PubMed] [DOI] |
| 6. | She WH, Chan ACY, Cheung TT, Chok KSH, Chan SC, Poon RTP, Lo CM. Acute pancreatitis induced by transarterial chemoembolization: a single-center experience of over 1500 cases. Hepatobiliary & Pancreatic Diseases International. 2016;15:93-98. [DOI] |
| 7. | Ku Y, Fukumoto T, Iwasaki T, Tominaga M, Samizo M, Nishida T, Kuroda Y, Hirota S, Sako M, Obara H. Clinical pilot study on high-dose intraarterial chemotherapy with direct hemoperfusion under hepatic venous isolation in patients with advanced hepatocellular carcinoma. Surgery. 1995;117:510-519. [PubMed] [DOI] |
| 8. | Musumba C, Evans J, Richardson P. Persistent abdominal pain and pyrexia after combined radiofrequency ablation and TACE. Gastroenterology. 2011;141:1976, 2277. [PubMed] [DOI] |
| 9. | Jones MR, Hall OM, Kaye AM, Kaye AD. Drug-induced acute pancreatitis: a review. Ochsner J. 2015;15:45-51. [PubMed] |
| 10. | Peng F, Du Q, Peng C, Wang N, Tang H, Xie X, Shen J, Chen J. A Review: The Pharmacology of Isoliquiritigenin. Phytother Res. 2015;29:969-977. [PubMed] [DOI] |
| 11. | Chen X, Cai X, Le R, Zhang M, Gu X, Shen F, Hong G, Chen Z. Isoliquiritigenin protects against sepsis-induced lung and liver injury by reducing inflammatory responses. Biochem Biophys Res Commun. 2018;496:245-252. [PubMed] [DOI] |
| 12. | Zhao TT, Xu YQ, Hu HM, Gong HB, Zhu HL. Isoliquiritigenin (ISL) and its Formulations: Potential Antitumor Agents. Curr Med Chem. 2019;26:6786-6796. [PubMed] [DOI] |
| 13. | Zeng J, Chen Y, Ding R, Feng L, Fu Z, Yang S, Deng X, Xie Z, Zheng S. Isoliquiritigenin alleviates early brain injury after experimental intracerebral hemorrhage via suppressing ROS- and/or NF-κB-mediated NLRP3 inflammasome activation by promoting Nrf2 antioxidant pathway. J Neuroinflammation. 2017;14:119. [PubMed] [DOI] |
| 14. | Liu X, Zhu Q, Zhang M, Yin T, Xu R, Xiao W, Wu J, Deng B, Gao X, Gong W, Lu G, Ding Y. Isoliquiritigenin Ameliorates Acute Pancreatitis in Mice via Inhibition of Oxidative Stress and Modulation of the Nrf2/HO-1 Pathway. Oxid Med Cell Longev. 2018;2018:7161592. [PubMed] [DOI] |
| 15. | Schmidt J, Rattner DW, Lewandrowski K, Compton CC, Mandavilli U, Knoefel WT, Warshaw AL. A better model of acute pancreatitis for evaluating therapy. Ann Surg. 1992;215:44-56. [PubMed] [DOI] |
| 16. | Henderson IC, Frei TE. Adriamycin and the heart. N Engl J Med. 1979;300:310-312. [PubMed] |
| 17. | Ben Kridis W, Khanfir A, Frikha M. Acute pancreatitis induced by anticancer chemotherapy. Acta Clin Belg. 2013;68:309-310. [PubMed] [DOI] |
| 18. | Qiao X, van der Zanden SY, Wander DPA, Borràs DM, Song JY, Li X, van Duikeren S, van Gils N, Rutten A, van Herwaarden T, van Tellingen O, Giacomelli E, Bellin M, Orlova V, Tertoolen LGJ, Gerhardt S, Akkermans JJ, Bakker JM, Zuur CL, Pang B, Smits AM, Mummery CL, Smit L, Arens R, Li J, Overkleeft HS, Neefjes J. Uncoupling DNA damage from chromatin damage to detoxify doxorubicin. Proc Natl Acad Sci USA. 2020;117:15182-15192. [PubMed] [DOI] |
| 19. | Govender J, Loos B, Marais E, Engelbrecht AM. Mitochondrial catastrophe during doxorubicin-induced cardiotoxicity: a review of the protective role of melatonin. J Pineal Res. 2014;57:367-380. [PubMed] [DOI] |
| 20. | Renu K, V G A, P B TP, Arunachalam S. Molecular mechanism of doxorubicin-induced cardiomyopathy - An update. Eur J Pharmacol. 2018;818:241-253. [PubMed] [DOI] |
| 21. | Gorini S, De Angelis A, Berrino L, Malara N, Rosano G, Ferraro E. Chemotherapeutic Drugs and Mitochondrial Dysfunction: Focus on Doxorubicin, Trastuzumab, and Sunitinib. Oxid Med Cell Longev. 2018;2018:7582730. [PubMed] [DOI] |
| 22. | Speth PA, van Hoesel QG, Haanen C. Clinical pharmacokinetics of doxorubicin. Clin Pharmacokinet. 1988;15:15-31. [PubMed] [DOI] |
| 23. | Durham KK, Kluck G, Mak KC, Deng YD, Trigatti BL. Treatment with apolipoprotein A1 protects mice against doxorubicin-induced cardiotoxicity in a scavenger receptor class B, type I-dependent manner. Am J Physiol Heart Circ Physiol. 2019;316:H1447-H1457. [PubMed] [DOI] |
| 24. | Durham KK, Chathely KM, Mak KC, Momen A, Thomas CT, Zhao YY, MacDonald ME, Curtis JM, Husain M, Trigatti BL. HDL protects against doxorubicin-induced cardiotoxicity in a scavenger receptor class B type 1-, PI3K-, and Akt-dependent manner. Am J Physiol Heart Circ Physiol. 2018;314:H31-H44. [PubMed] [DOI] |
| 25. | Sies H, Berndt C, Jones DP. Oxidative Stress. Annu Rev Biochem. 2017;86:715-748. [PubMed] [DOI] |
| 26. | Esrefoglu M. Experimental and clinical evidence of antioxidant therapy in acute pancreatitis. World J Gastroenterol. 2012;18:5533-5541. [PubMed] [DOI] |
| 27. | Dong Z, Shang H, Chen YQ, Pan LL, Bhatia M, Sun J. Sulforaphane Protects Pancreatic Acinar Cell Injury by Modulating Nrf2-Mediated Oxidative Stress and NLRP3 Inflammatory Pathway. Oxid Med Cell Longev. 2016;2016:7864150. [PubMed] [DOI] |
| 28. | Chen W, Yuan C, Lu Y, Zhu Q, Ma X, Xiao W, Gong W, Huang W, Xia Q, Lu G, Li W. Tanshinone IIA Protects against Acute Pancreatitis in Mice by Inhibiting Oxidative Stress via the Nrf2/ROS Pathway. Oxid Med Cell Longev. 2020;2020:5390482. [PubMed] [DOI] |
| 29. | Cuadrado A, Rojo AI, Wells G, Hayes JD, Cousin SP, Rumsey WL, Attucks OC, Franklin S, Levonen AL, Kensler TW, Dinkova-Kostova AT. Therapeutic targeting of the NRF2 and KEAP1 partnership in chronic diseases. Nat Rev Drug Discov. 2019;18:295-317. [PubMed] [DOI] |
| 30. | Yamamoto M, Kensler TW, Motohashi H. The KEAP1-NRF2 System: a Thiol-Based Sensor-Effector Apparatus for Maintaining Redox Homeostasis. Physiol Rev. 2018;98:1169-1203. [PubMed] [DOI] |
| 31. | Song Z, Zhang Y, Zhang H, Rajendran RS, Wang R, Hsiao CD, Li J, Xia Q, Liu K. Isoliquiritigenin triggers developmental toxicity and oxidative stress-mediated apoptosis in zebrafish embryos/larvae via Nrf2-HO1/JNK-ERK/mitochondrion pathway. Chemosphere. 2020;246:125727. [PubMed] [DOI] |
| 32. | Wang C, Chen Y, Wang Y, Liu X, Liu Y, Li Y, Chen H, Fan C, Wu D, Yang J. Inhibition of COX-2, mPGES-1 and CYP4A by isoliquiritigenin blocks the angiogenic Akt signaling in glioma through ceRNA effect of miR-194-5p and lncRNA NEAT1. J Exp Clin Cancer Res. 2019;38:371. [PubMed] [DOI] |