修回日期: 2021-04-29
接受日期: 2021-05-25
在线出版日期: 2021-08-08
近年来, 越来越多的疾病被发现与肠道菌群失调相关, 特别是近5年来一些颠覆性的发现使得肠道菌群成为健康、疾病领域的热点问题. 作为机体生物过程的重要协调者以及多种疾病发生发展过程中的共同参与者, 加之其组成和功能的可塑性, 肠道菌群逐渐成为一个极富吸引力的预防和治疗疾病的靶标而引起研究者的高度重视. 本文就肠道菌群与肠易激综合征、IBD和结直肠癌的关系进行了整理, 并介绍了在胃肠病中以肠道菌群为靶向的治疗策略的现状, 以期为靶向肠道菌群治疗策略的应用提供借鉴.
核心提要: 肠道微生物群的复杂性及其对健康、疾病的影响逐渐被认识、确证, 肠道菌群逐渐成为一个极富吸引力的用于治疗和预防疾病的目标而引起研究者的高度重视. 本文就肠道菌群与常见肠道疾病的相互关系以及治疗肠道疾病的靶向肠道菌群策略进行概述, 以期为肠道菌群研究和靶向菌群治疗策略的应用提供借鉴.
引文著录: 邵好青, 谭周进. 靶向肠道菌群治疗胃肠疾病研究进展. 世界华人消化杂志 2021; 29(15): 841-848
Revised: April 29, 2021
Accepted: May 25, 2021
Published online: August 8, 2021
In recent years, more and more diseases have been found to be related to dysbiosis. In particular, some disruptive discoveries in the past five years have made gut microbiota a hot topic in the field of health and diseases. As an important coordinator of biological processes and a common participant in the occurrence and development of multiple diseases, coupled with the plasticity of its composition and function, the gut microbiota has gradually become an attractive target for the intervention and management of diseases, arousing great attention of researchers. In this paper, we summarize the relationship between gut microbiota and irritable bowel syndrome, inflammatory bowel disease, and colorectal cancer. Then, we introduce the current status of microbiota-targeted therapeutics in gastrointestinal diseases.
- Citation: Shao HQ, Tan ZJ. Microbiota-targeted therapeutics in gastrointestinal diseases. Shijie Huaren Xiaohua Zazhi 2021; 29(15): 841-848
- URL: https://www.wjgnet.com/1009-3079/full/v29/i15/841.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v29.i15.841
近年来, 肠道微生态的研究如火如荼, 成为多种肠道及肠外疾病的研究热点. 肠道微生物群本质上是一种为宿主提供代谢、免疫和保护功能的微生物器官, 微生物之间及与宿主之间的相互作用在维持肠道正常生理功能、维护肠上皮屏障、调节机体免疫以及拮抗病原微生物定植等方面发挥着重要作用[1,2]. 得益于无菌小鼠的研究以及高通量测序技术、生物信息学等方法的不断发展与普及应用, 肠道微生物群的复杂性及其对健康、疾病的影响逐渐被认识、确证, 越来越多的肠道疾病被发现与肠道菌群相关, 对肠道疾病与肠道菌群关系的认识也逐渐由相关性报道深入到因果关系的研究[3]. 作为机体生物过程的重要协调者以及多种疾病发生发展过程中的共同参与者, 加上其组成和功能的可塑性, 肠道菌群逐渐成为一个极富吸引力的预防和治疗疾病的靶标而引起研究者的高度关注. 本文就肠道菌群与常见肠道疾病的相互关系以及治疗肠道疾病的靶向肠道菌群策略进行概述, 以期为肠道菌群研究和靶向菌群治疗策略的应用提供借鉴.
人体肠道菌群主要由厚壁菌门、拟杆菌门、放线菌门和变形菌门四大类组成, 其中厚壁菌门和拟杆菌门约占90%. 微生物群落之间比例的巨大变化或新细菌群的扩张以及功能的改变导致宿主-微生物间相互作用的不平衡, 称为菌群失调[4]. 微生物组成或其衍生物(如代谢产物或基因毒素)的变化可影响宿主病生理信号通路, 最终直接或间接地影响疾病的易感性, 引起或参与肠道疾病, 而这些成分也具有应用于靶向治疗的潜力. 尽管菌群与一些疾病的因果关系尚不确切, 但来自动物微生物群落移植模型的数据表明, 其中一些变化不仅仅是疾病的后果[5,6](表1).
| 疾病 | 与疾病相关的物种丰度变化 | Ref. | |
| 减少 | 增加 | ||
| 肠易激综合征 | Bifidobacterium, Faecalibacterium, Uncultured Clostridiales I | Lactobacillaceae, Bacteroides, Enterobacteriaceae | [10] |
| Veillonella, Lactobacillus | [12] | ||
| Lachnobacterium, Prevotella, Catenibacterium | Blautia, Bacteroides, Ruminoccocus, unknown Barnesiellaceae | [13] | |
| 溃疡性结肠炎 | Fusobacterium nucleatum | [18] | |
| Roseburia | [21] | ||
| 克罗恩病 | Ruminococcus gnavus | [19] | |
| Faecalibacterium, Roseburia | [20] | ||
| 结直肠癌 | Bacteroides fragilis, Fusobacterium nucleatum, Porphyromonas asaccharolytica, Parvimonas micra, Prevotella intermedia, Alistipes finegoldii, Thermanaerovibrio acidaminovorans | [23] | |
| Fusobacterium nucleatum spp., Atopobium parvulum, Actinomyces odontolyticus | [24] | ||
| Bacteroides fragilis | [25] | ||
| pks+ E. coli | [26] | ||
| Peptostreptococcus anaerobius | [28] | ||
肠易激综合征(irritable bowel syndrome, IBS)是一种常见的功能性胃肠疾病, 典型症状是腹痛或不适, 并与粪便性状或频率的改变有关[7]. 肠-脑轴、胃肠动力、肠道分泌、内脏高敏感性、肠道通透性和免疫激活是IBS涉及的主要病理生理环节, 而研究发现这几个环节都与肠道微生物群有关联[8]. 此外, IBS的症状易受宿主遗传、饮食、压力和环境的影响, 这些因素又都可以影响和塑造肠道菌群.
来自动物和人类研究的证据也支持肠道菌群在IBS的发展和迁延中的关键作用. 首先, 无菌小鼠模型提供了直接的证据, 将IBS-D患者的粪便菌群移植给无菌小鼠, 可引起受体小鼠出现胃肠道转运加快、低度炎症和类似焦虑的肠道功能和行为改变, 表明菌群失调可能是IBS的结肠运动功能障碍和行为症状的原因[5]. 然而, 在没有明确的IBS动物模型的情况下, 直接的因果关系无法得到明确的证明. 其次, 感染后IBS (PI-IBS)的流行病学证据显示, 尽管清除了病原体, 但胃肠道细菌感染导致持续功能性胃肠道症状的可能性增加且至少持续8年, 有力的证明了肠道微生物群在部分患者的IBS发病中起着主要作用[9]. 最后, 比对IBS患者和健康人群的临床样本也发现, IBS患者伴随着特定的肠道菌群及代谢特征. 一项纳入了24个病例对照研究的系统性回顾分析显示, IBS人群的肠杆菌科(Enterobacteriaceae)、乳杆菌科(Lactobacillaceae)和拟杆菌属(Bacteroides)增加, 而不可培养的梭菌目Ⅰ(Clostridiales Ⅰ)、粪杆菌属(Faecalibacterium) [包括普氏粪杆菌(Faecalibacterium prausnitzii)]和双歧杆菌属(Bifidobacterium)减少[10]. 一项纵向取样的整合多组学方法的研究显示, IBS-C患者中短链脂肪酸(short-chain fatty acids, SCFAs)和初级胆汁酸减少, 而IBS-D患者中色胺和初级胆汁酸增多, 研究人员表示这些菌群代谢物参与刺激结肠液体分泌, 是造成IBS亚型症状的潜在原因[11]. 此外, IBS患者的特征菌群与其症状也有直接关联. IBS患者粪便菌群中Veillonella和Lactobacillus增加, 而这两类菌可产生乙酸、丙酸等有机酸, 高乙酸和/或丙酸水平的IBS患者表现出更差的胃肠道症状、生活质量和负面情绪[12]; IBS-M和IBS-D患者粪便样本中产丁酸盐和甲烷的细菌丰度减少, 而丁酸盐已知能改善肠屏障结构和功能, 产甲烷的微生物是人体结肠中氢处理的主要机制, 可以部分解释IBS患者易出现腹胀的原因[13].
炎症性肠病(inflammatory bowel disease, IBD)包括溃疡性结肠炎(ulcerative colitis, UC)和克罗恩病(Crohn's disease, CD)两大类. IBD被认为是由遗传易感性、环境和微生物因素共同驱动的慢性免疫介导的肠道炎症[14,15].
一方面, IBD患者中富集的微生物类群陆续被证实具有促炎症的作用. Yilmaz等[16]通过重复两项独立的长期纵向IBD队列之间的关键结果发现, 拟杆菌门、厚壁菌门和变形菌门是区别IBD患者和健康人群的主要微生物类群. 此外, CD和UC患者分别具有特征性的细菌互作网络, 包含毛螺菌科和瘤胃菌科的互作网络的紊乱, 与疾病的频繁复发、抗TNF-α抗体治疗低效化相关[16]. Seishima等[17]发现UC和CD患者的微生物群在分类和功能上与健康人群有差异, 粪肠球菌(E. faecium)作为差异最大的菌种与患者的疾病严重程度呈正相关. 相比于分离自健康人粪便中的屎肠球菌菌株, 分离自UC患者粪便中的屎肠球菌菌株能促进IL-10敲除小鼠的结肠炎病理评分及炎症因子表达升高[17]. Chen等[18]发现具核梭杆菌(Fusobacterium nucleatum)富集于51.78%的UC组织中, 并与UC的临床病程、临床活动度和难治性显著相关. 进一步的机制研究显示, 具核梭杆菌可通过结肠上皮细胞中的NOD2而靶向上调CARD3, 从而激活IL-17F/NF-κB信号通路, 促进肠道炎症的发生[18]. 活泼瘤胃球菌(Ruminococcus gnavus)是一种常见的厌氧革兰氏阳性肠道细菌, 在CD患者中活泼瘤胃球菌的相对丰度升高与症状增加相关, 研究发现R. gnavus可合成并分泌一种复杂的促炎症性多糖, 能以TLR4依赖性方式诱导树突细胞分泌炎症因子TNF-α[19].
另一方面, IBD患者中缺乏的微生物类群和细菌代谢物被发现具有抗炎作用. 细菌代谢产物SCFAs可以调节保护性免疫并减轻组织炎症. 研究发现, CD患儿肠道菌群中粪杆菌属(Faecalibacterium)、罗氏菌属(Roseburia)等SCFA产生菌减少, 且粪便中的SCFA及非结合胆汁酸的水平降低, 而英夫利昔单抗治疗使CD患儿粪便中的胆盐水解酶产生菌富集, 结合胆汁酸水平降低、非结合胆汁酸水平和非结合/结合胆汁酸比例升高[20]. 在CD和UC患者中丰度显著下降的罗氏菌属(Roseburia)是存在于肠黏液层的乙酸-丁酸转化器, 能在黏液层产生抗炎作用[21]. 除SCFAs之外, 具有调节宿主Treg细胞稳态和TH17、Treg细胞分化作用的胆汁酸代谢在IBD患者中也被发现呈紊乱状态[20,22].
肠癌是世界第三大常见的癌症. 对来自中国、奥地利、美国、德国和法国队列的526个宏基因组样本的联合分析[23]显示, 结直肠癌患者的粪便菌群与健康人群存在明显差异, 并鉴定出脆弱拟杆菌(Bacteroides fragilis)、具核梭杆菌(Fusobacterium nucleatum)、Porphyromonas asaccharolytica、微小微单胞菌(Parvimonas micra)、中间普雷沃菌(Prevotella intermedia)、Alistipes finegoldii和Thermanaerovibrio acidaminovorans等7种在结直肠癌样本中稳定富集的、具有潜在诊断价值的细菌标志物, 说明在肠癌的患者中存在菌群紊乱. 针对多发性息肉样腺瘤、粘膜内癌和更晚期肠癌样本的宏基因组学研究[24]发现, 在肠癌的多步发展阶段存在微生物组的迁延转移, 具体表现为具核梭杆菌(Fusobacterium nucleatum spp.)的相对丰度从粘膜内癌向更晚期病变持续升高以及在粘膜内癌中共现的Atopobium parvulum和Actinomyces odontolyticus仅在多发性息肉样腺瘤和/或粘膜内癌中丰度显著增加, 表明菌群的变化发生在结直肠癌发展的早期阶段, 可能起到一个驱动作用或者是始动作用. 将来自肠癌患者的粪便灌胃给无菌小鼠和抗生素处理后给予致癌物的小鼠, 可增加两种模型小鼠的息肉数量、肠道发育不良、增殖(Ki-67阳性)细胞水平、炎症标记物(CXCR1、CXCR2、IL17A、IL22、IL23A)以及结肠中Th1和Th17细胞的比例[6], 进一步说明了菌群可激活肠黏膜的免疫, 诱发炎症反应, 促进上皮细胞增殖, 从而起到促癌的作用.
对单菌功能的研究进一步论证了肠道微生物中的一类促致癌细菌具有引发和/或促进结肠癌的潜力. 如研究发现, 脆弱拟杆菌(Bacteroides fragilis)产生的肠毒素是婴幼儿腹泻病的病因之一, 亦可触发结肠上皮中促致癌的多步骤炎症级联反应, 与肠癌的发生发展密切相关. 脆弱拟杆菌毒素可引发结肠上皮细胞中的IL-17黏膜免疫信号, 该信号又传递回上皮细胞激活NF-κb信号并触发CXC趋化因子表达, 继而引发肿瘤前髓样细胞浸润至结肠远端, 与平行发生的Stat3信号共同促进产肠毒素脆弱拟杆菌介导的肿瘤发生[25]. 其他已鉴定的、与肠癌相关的促致癌菌还有携带pks的大肠杆菌(pks+ E. coli)[26]、具核梭杆菌(Fusobacterium nucleatum)[27]、厌氧消化链球菌(Peptostreptococcus anaerobius)[28]和产肠毒素的粪肠球菌.
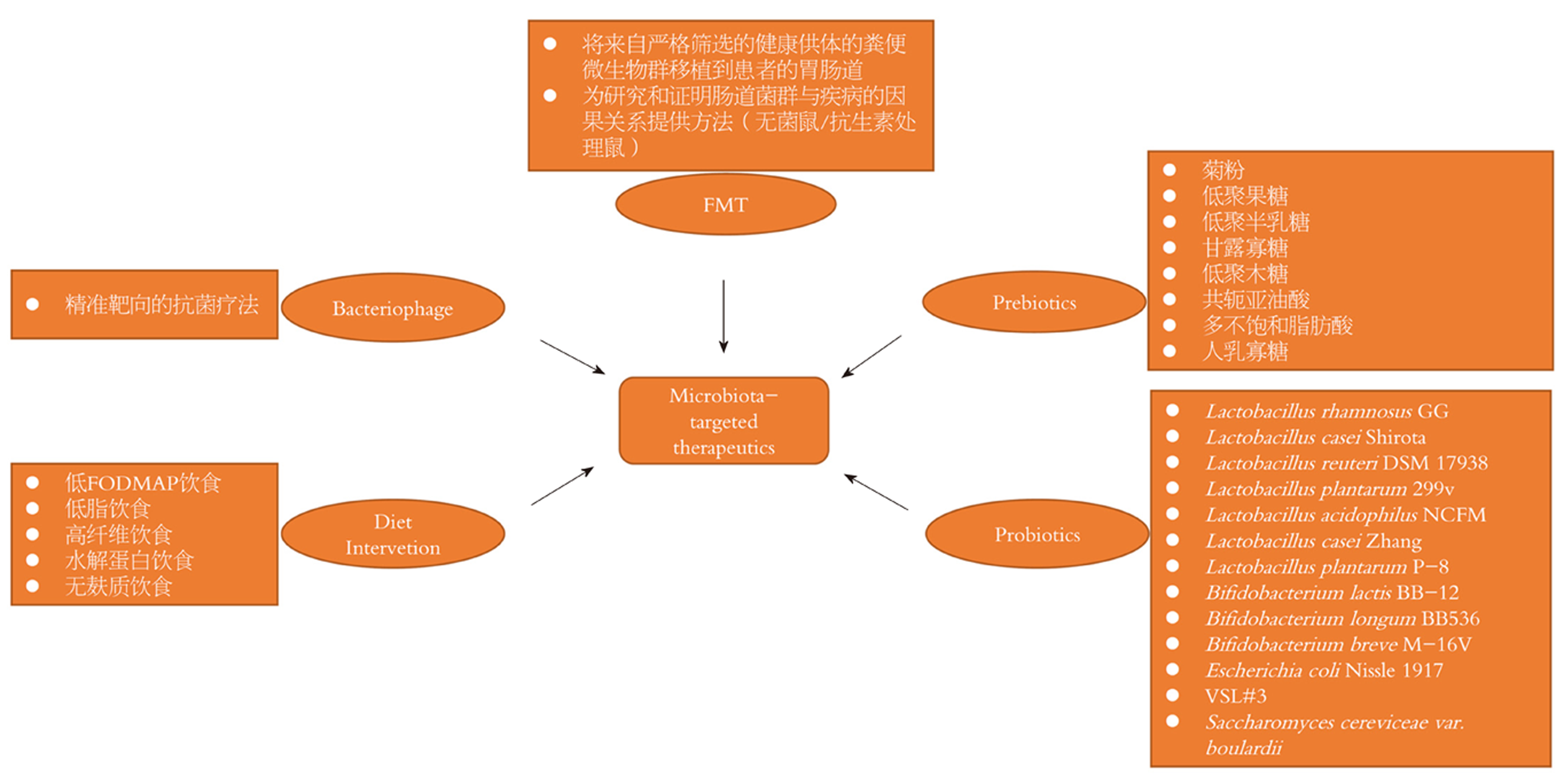
肠道菌群与宿主胃肠道之间的互作关系, 以及其在胃肠疾病发生、发展中的作用, 为预防和治疗胃肠疾病提供了极具潜力的治疗靶点(图1).
益生菌是指当摄入足够量时对宿主有健康益处的活的微生物[29]. 益生元是能够被宿主体内的菌群选择性利用并转化为有益于宿主健康的物质[30]. 美国胃肠病协会建议, 益生菌可考虑用于治疗IBD的功能性症状[31]. 多项随机、安慰剂对照临床试验也提供了积极的临床证据支撑益生菌应用于防治胃肠疾病[32-34]. 在一篇更新于JAMA临床证据概要的Cochrane系统评价中, 研究人员对来自15个国家的23项(N = 3938)益生菌预防儿童抗生素相关性腹泻的随机试验进行了评估, 中等质量的证据表明, 预防性使用鼠李糖乳杆菌或布拉氏酵母菌与儿童(1个月至18岁)较低的抗生素相关性腹泻发生率相关, 而不良事件也未见增加[35]. 纳入12项随机对照试验(N = 886)评估益生菌对UC作用的分析显示, 益生菌可显著降低活动性UC患者的疾病活动指数, 而含有双歧杆菌的益生菌可显著缓解疾病, 且维持缓解效果与美沙拉嗪无显著差异[33]. 对200例IBD患者进行长达36个月以上的跟踪调查, 结果显示服用益生菌可有效降低全身性类固醇用药、住院及手术等不良事件的发生率, 而且益生菌服用时间越长效果越好[36].
益生菌和益生元的作用机制复杂多样, 且通常有着菌株特异性. 益生菌可以通过交叉喂养相互作用、降低Ph值改变胃肠道微环境、与致病菌竞争营养物质和结合位点以及产生抗菌物质如细菌素等途径作用于宿主微生物群, 从而发挥健康益处[37,38]. 此外, 益生菌效应分子(包括菌毛、脂磷壁酸、胞外多糖和各种表层蛋白质)可以直接与肠上皮、肠内分泌和免疫细胞以及迷走神经传入纤维中的受体相互作用, 产生增强肠道屏障完整性等局部肠道效应, 以及通过宿主免疫、内分泌、神经系统介导的全身效应[39,40]. 益生元效应则通常是通过微生物群中特定群体对底物的消耗来介导的, 从而促进它们的生长和代谢活性, 同时也能通过交叉喂养相互作用促进生长等方式间接影响微生物群中的其他类群. 益生元摄入引起的微生物组成和代谢物的变化会进一步影响宿主上皮、免疫、神经和内分泌信号, 发挥对肠道功能、免疫反应、抗炎、糖脂代谢、食欲和饱腹感等的调节[30,39].
虽然益生菌的应用取得了一定范围内可喜的疗效, 但关于益生菌菌株和制剂的研究数据在一些情况下仍相互矛盾和有争议, 主要涉及益生菌的肠道定植、菌株水平的活性、与本地微生物群的相互作用、安全性和对宿主的影响等[41].
粪菌移植(fecal microbiota transplantation, FMT)是将来自健康供体的粪便微生物群移植到患者的胃肠道, 以纠正菌群失调, 重塑肠稳态[42]. FMT作为一种古老的肠道菌群干预措施, 最早见于东晋葛洪所著《肘后备急方》, 应用粪便的悬浮液治疗食物中毒和严重的腹泻[43]. 与口服益生菌制剂相比, FMT具有移植菌群种类丰富、数量庞大、最大限度保留原有功能菌等优势. 相较于利用某些特定的细菌来调控肠道菌群, FMT发挥作用的关键是依靠整体菌群来重建患者的内稳态.
FMT被公认为是治疗难治性难辨梭状芽孢杆菌感染(Clostridium difficile infections, CDI)的最有效方法, FMT一次治疗CDI的有效率可达85%-90%, 二次治疗有效率可达100%, 已被写入美国CDI治疗指南[44,45]. 除了CDI治疗, FMT益处的最大证据来自对IBD患者的研究[46-48]. Meta分析[48]显示FMT治疗CD患者缓解率为50.5%(42/83), 明显优于UC患者[36%(201/555)]. 经胃镜至远端十二指肠的FMT可显著改善IBS患者的腹部症状、疲劳感和生活质量, 改善效果随着剂量增加而增强[49]. 另有研究显示, FMT移植方式的选择对治疗IBS的疗效有直接影响, 用肠镜或鼻空肠管的方式移植新鲜或冷冻粪便或优于粪菌胶囊[50].
尽管多项随机对照研究证实了FMT的有效性, 但其安全性和机制仍待深入研究, 推进标准化FMT尚需更大努力. 2019年6月, NEJM杂志曾报导了两名免疫功能低下患者在接受来自同一供体的FMT后感染了具有超广谱β-内酰胺类药物抗性的大肠杆菌, 导致严重的菌血症, 其中一人死亡[51]. 为此, 美国FDA发出关于FMT的安全性警示, 要求在进行试验性FMT时, 必须针对供体的多重耐药菌携带情况进行筛查和检测, 以减少耐药菌传播和感染风险[52].
噬菌体是以细菌为寄主的病毒, 故也称为细菌病毒. 噬菌体能通过诱导细菌细胞裂解、影响细菌表型等机制塑造细菌群落[53]. 作为一种抗菌疗法, 相较于抗生素, 噬菌体疗法具有精准靶向的优势, 可用于调节肠道菌群、杀灭多重耐药菌[54]. 噬菌体疗法在东欧部分国家被用作抗生素的替代或补充疗法[55]. 在西方国家, 噬菌体虽未被批准用于治疗细菌感染, 但噬菌体制剂已在美国被作为益生元(如前噬菌体、预噬菌体)在商业上可供人体使用[56].
在胃肠病中, 噬菌体疗法研究集中在感染性疾病上[56]. 幼兔模型显示, 单个噬菌体Phi_1可预防性和治疗性地控制霍乱而没有可检测到的耐药水平[57]. 黏附侵袭性大肠杆菌(adherent invasive Escherichia coli, AIEC)是CD患者回肠黏膜中常见的致病菌, 能与上皮细胞表面表达的CEACAM6受体结合, 诱发结肠炎症状[58]. 以AIEC为靶标的三种噬菌体混合物可显著减少CEABAC10转基因小鼠(表达人CEACAM6 AIEC受体)肠黏膜中AIEC LF82菌株的定植, 减轻DSS诱导的结肠炎症状[58], 为靶向AIEC菌株治疗CD提供了一种潜在的新选择.
在影响宿主肠道菌群组成和结构的因素中, 饮食至关重要. 饮食干预被认为是一种低成本、易操作的调节肠道菌群、治疗菌群失调相关疾病的理想方式. 在欧洲, 纯肠内营养因具有更优于皮质类固醇的疾病缓解率和良好的安全性已被列为治疗小儿CD的一线疗法[59]. 多项随机对照试验显示, 低FODMAP饮食干预可充分缓解IBS患者的症状, 同时伴有Bifidobacterium adolescentis、Bifidobacterium longum、Faecalibacterium prausnitzii、Bacteroides丰度的减少和粪便丁酸盐水平的下降[60-62]. 在对缓解期或轻度UC患者进行的一项交叉试验中[63], 研究人员发现, 有针对性的摄入低脂饮食或高纤维饮食4 wk后, 均可显著改善生活质量. 此外, 低脂饮食可显著降低患者的炎症标志物水平并改善失调的肠道菌群[63]. 基于IBD动物模型的研究发现, 水解蛋白饮食诱导的疾病缓解与致病菌(如E. coli、C. perfringens)的丰度降低、次级胆汁酸产生菌Clostridium hiranonis的丰度增加和次级胆汁酸(石胆酸、脱氧胆酸)水平的升高有关[64].
尽管事实上肠道菌群与胃肠道疾病的发生发展有关, 而且饮食可以用于缓解或治疗胃肠疾病的症状, 但饮食干预的多数机制尚不十分清楚. 此外, 基于肠道菌群的饮食干预, 可因基线菌群的组成和功能的个体差异呈现不同疗效[62].
肠道菌群与疾病之间的关系不断被挖掘, 但仍面临着不少挑战. 一个亟待解决的问题是关于肠道微生物群与疾病之间的因果关系, 这需要无菌动物、疾病模型和临床证据的反复验证. 靶向肠道菌群的治疗策略已展现出巨大潜力, 尽管"精准"调节肠道菌群的最佳方式仍处于研究阶段, 但是毋容置疑的是, 肠道微生物的调节将会更广泛地用于整体健康改善和疾病辅助治疗. 通过进一步的研究, 与疾病状态有关的肠道菌群失调的真正的含义可以被更好的理解, 以及什么是促进整体健康的最佳肠道菌群将会被更好地明确出来, 这将对公共健康产生广泛的积极作用.
学科分类: 胃肠病学和肝病学
手稿来源地: 湖南省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C, C, C, C
D级 (一般): D
E级 (差): 0
科学编辑: 刘继红 制作编辑:张砚梁
| 1. | Cani PD. Microbiota and metabolites in metabolic diseases. Nat Rev Endocrinol. 2019;15:69-70. [PubMed] [DOI] |
| 2. | Kayama H, Okumura R, Takeda K. Interaction Between the Microbiota, Epithelia, and Immune Cells in the Intestine. Annu Rev Immunol. 2020;38:23-48. [PubMed] [DOI] |
| 3. | Walter J, Armet AM, Finlay BB, Shanahan F. Establishing or Exaggerating Causality for the Gut Microbiome: Lessons from Human Microbiota-Associated Rodents. Cell. 2020;180:221-232. [PubMed] [DOI] |
| 4. | Jin L, Shi X, Yang J, Zhao Y, Xue L, Xu L, Cai J. Gut microbes in cardiovascular diseases and their potential therapeutic applications. Protein Cell. 2021;12:346-359. [PubMed] [DOI] |
| 5. | De Palma G, Lynch MD, Lu J, Dang VT, Deng Y, Jury J, Umeh G, Miranda PM, Pigrau Pastor M, Sidani S, Pinto-Sanchez MI, Philip V, McLean PG, Hagelsieb MG, Surette MG, Bergonzelli GE, Verdu EF, Britz-McKibbin P, Neufeld JD, Collins SM, Bercik P. Transplantation of fecal microbiota from patients with irritable bowel syndrome alters gut function and behavior in recipient mice. Sci Transl Med. 2017;9. [PubMed] [DOI] |
| 6. | Wong SH, Zhao L, Zhang X, Nakatsu G, Han J, Xu W, Xiao X, Kwong TNY, Tsoi H, Wu WKK, Zeng B, Chan FKL, Sung JJY, Wei H, Yu J. Gavage of Fecal Samples From Patients With Colorectal Cancer Promotes Intestinal Carcinogenesis in Germ-Free and Conventional Mice. Gastroenterology. 2017;153:1621-1633.e6. [PubMed] [DOI] |
| 7. | Ford AC, Lacy BE, Talley NJ. Irritable Bowel Syndrome. N Engl J Med. 2017;376:2566-2578. [PubMed] [DOI] |
| 8. | Bhattarai Y, Muniz Pedrogo DA, Kashyap PC. Irritable bowel syndrome: a gut microbiota-related disorder? Am J Physiol Gastrointest Liver Physiol. 2017;312:G52-G62. [PubMed] [DOI] |
| 9. | Marshall JK, Thabane M, Garg AX, Clark WF, Moayyedi P, Collins SM; Walkerton Health Study Investigators. Eight year prognosis of postinfectious irritable bowel syndrome following waterborne bacterial dysentery. Gut. 2010;59:605-611. [PubMed] [DOI] |
| 10. | Pittayanon R, Lau JT, Yuan Y, Leontiadis GI, Tse F, Surette M, Moayyedi P. Gut Microbiota in Patients With Irritable Bowel Syndrome-A Systematic Review. Gastroenterology. 2019;157:97-108. [PubMed] [DOI] |
| 11. | Mars RAT, Yang Y, Ward T, Houtti M, Priya S, Lekatz HR, Tang X, Sun Z, Kalari KR, Korem T, Bhattarai Y, Zheng T, Bar N, Frost G, Johnson AJ, van Treuren W, Han S, Ordog T, Grover M, Sonnenburg J, D'Amato M, Camilleri M, Elinav E, Segal E, Blekhman R, Farrugia G, Swann JR, Knights D, Kashyap PC. Longitudinal Multi-omics Reveals Subset-Specific Mechanisms Underlying Irritable Bowel Syndrome. Cell. 2020;182:1460-1473.e17. [PubMed] [DOI] |
| 12. | Tana C, Umesaki Y, Imaoka A, Handa T, Kanazawa M, Fukudo S. Altered profiles of intestinal microbiota and organic acids may be the origin of symptoms in irritable bowel syndrome. Neurogastroenterol Motil. 2010;22:512-519, e114-e115. [PubMed] [DOI] |
| 13. | Pozuelo M, Panda S, Santiago A, Mendez S, Accarino A, Santos J, Guarner F, Azpiroz F, Manichanh C. Reduction of butyrate- and methane-producing microorganisms in patients with Irritable Bowel Syndrome. Sci Rep. 2015;5:12693. [PubMed] [DOI] |
| 14. | Ni J, Wu GD, Albenberg L, Tomov VT. Gut microbiota and IBD: causation or correlation? Nat Rev Gastroenterol Hepatol. 2017;14:573-584. [PubMed] [DOI] |
| 15. | Neurath MF. Host-microbiota interactions in inflammatory bowel disease. Nat Rev Gastroenterol Hepatol. 2020;17:76-77. [PubMed] [DOI] |
| 16. | Yilmaz B, Juillerat P, Øyås O, Ramon C, Bravo FD, Franc Y, Fournier N, Michetti P, Mueller C, Geuking M, Pittet VEH, Maillard MH, Rogler G; Swiss IBD Cohort Investigators, Wiest R, Stelling J, Macpherson AJ. Microbial network disturbances in relapsing refractory Crohn's disease. Nat Med. 2019;25:323-336. [PubMed] [DOI] |
| 17. | Seishima J, Iida N, Kitamura K, Yutani M, Wang Z, Seki A, Yamashita T, Sakai Y, Honda M, Yamashita T, Kagaya T, Shirota Y, Fujinaga Y, Mizukoshi E, Kaneko S. Gut-derived Enterococcus faecium from ulcerative colitis patients promotes colitis in a genetically susceptible mouse host. Genome Biol. 2019;20:252. [PubMed] [DOI] |
| 18. | Chen Y, Chen Y, Cao P, Su W, Zhan N, Dong W. Fusobacterium nucleatum facilitates ulcerative colitis through activating IL-17F signaling to NF-κB via the upregulation of CARD3 expression. J Pathol. 2020;250:170-182. [PubMed] [DOI] |
| 19. | Henke MT, Kenny DJ, Cassilly CD, Vlamakis H, Xavier RJ, Clardy J. Ruminococcus gnavus, a member of the human gut microbiome associated with Crohn's disease, produces an inflammatory polysaccharide. Proc Natl Acad Sci USA. 2019;116:12672-12677. [PubMed] [DOI] |
| 20. | Wang Y, Gao X, Zhang X, Xiao F, Hu H, Li X, Dong F, Sun M, Xiao Y, Ge T, Li D, Yu G, Liu Z, Zhang T. Microbial and metabolic features associated with outcome of infliximab therapy in pediatric Crohn's disease. Gut Microbes. 2021;13:1-18. [PubMed] [DOI] |
| 21. | Vich Vila A, Imhann F, Collij V, Jankipersadsing SA, Gurry T, Mujagic Z, Kurilshikov A, Bonder MJ, Jiang X, Tigchelaar EF, Dekens J, Peters V, Voskuil MD, Visschedijk MC, van Dullemen HM, Keszthelyi D, Swertz MA, Franke L, Alberts R, Festen EAM, Dijkstra G, Masclee AAM, Hofker MH, Xavier RJ, Alm EJ, Fu J, Wijmenga C, Jonkers DMAE, Zhernakova A, Weersma RK. Gut microbiota composition and functional changes in inflammatory bowel disease and irritable bowel syndrome. Sci Transl Med. 2018;10. [PubMed] [DOI] |
| 22. | Franzosa EA, Sirota-Madi A, Avila-Pacheco J, Fornelos N, Haiser HJ, Reinker S, Vatanen T, Hall AB, Mallick H, McIver LJ, Sauk JS, Wilson RG, Stevens BW, Scott JM, Pierce K, Deik AA, Bullock K, Imhann F, Porter JA, Zhernakova A, Fu J, Weersma RK, Wijmenga C, Clish CB, Vlamakis H, Huttenhower C, Xavier RJ. Gut microbiome structure and metabolic activity in inflammatory bowel disease. Nat Microbiol. 2019;4:293-305. [PubMed] [DOI] |
| 23. | Dai Z, Coker OO, Nakatsu G, Wu WKK, Zhao L, Chen Z, Chan FKL, Kristiansen K, Sung JJY, Wong SH, Yu J. Multi-cohort analysis of colorectal cancer metagenome identified altered bacteria across populations and universal bacterial markers. Microbiome. 2018;6:70. [PubMed] [DOI] |
| 24. | Yachida S, Mizutani S, Shiroma H, Shiba S, Nakajima T, Sakamoto T, Watanabe H, Masuda K, Nishimoto Y, Kubo M, Hosoda F, Rokutan H, Matsumoto M, Takamaru H, Yamada M, Matsuda T, Iwasaki M, Yamaji T, Yachida T, Soga T, Kurokawa K, Toyoda A, Ogura Y, Hayashi T, Hatakeyama M, Nakagama H, Saito Y, Fukuda S, Shibata T, Yamada T. Metagenomic and metabolomic analyses reveal distinct stage-specific phenotypes of the gut microbiota in colorectal cancer. Nat Med. 2019;25:968-976. [PubMed] [DOI] |
| 25. | Chung L, Thiele Orberg E, Geis AL, Chan JL, Fu K, DeStefano Shields CE, Dejea CM, Fathi P, Chen J, Finard BB, Tam AJ, McAllister F, Fan H, Wu X, Ganguly S, Lebid A, Metz P, Van Meerbeke SW, Huso DL, Wick EC, Pardoll DM, Wan F, Wu S, Sears CL, Housseau F. Bacteroides fragilis Toxin Coordinates a Pro-carcinogenic Inflammatory Cascade via Targeting of Colonic Epithelial Cells. Cell Host Microbe. 2018;23:203-214.e5. [PubMed] [DOI] |
| 26. | Pleguezuelos-Manzano C, Puschhof J, Rosendahl Huber A, van Hoeck A, Wood HM, Nomburg J, Gurjao C, Manders F, Dalmasso G, Stege PB, Paganelli FL, Geurts MH, Beumer J, Mizutani T, Miao Y, van der Linden R, van der Elst S; Genomics England Research Consortium, Garcia KC, Top J, Willems RJL, Giannakis M, Bonnet R, Quirke P, Meyerson M, Cuppen E, van Boxtel R, Clevers H. Mutational signature in colorectal cancer caused by genotoxic pks+ E. coli. Nature. 2020;580:269-273. [PubMed] [DOI] |
| 27. | Yang Y, Weng W, Peng J, Hong L, Yang L, Toiyama Y, Gao R, Liu M, Yin M, Pan C, Li H, Guo B, Zhu Q, Wei Q, Moyer MP, Wang P, Cai S, Goel A, Qin H, Ma Y. Fusobacterium nucleatum Increases Proliferation of Colorectal Cancer Cells and Tumor Development in Mice by Activating Toll-Like Receptor 4 Signaling to Nuclear Factor-κB, and Up-regulating Expression of MicroRNA-21. Gastroenterology. 2017;152:851-866.e24. [PubMed] [DOI] |
| 28. | Long X, Wong CC, Tong L, Chu ESH, Ho Szeto C, Go MYY, Coker OO, Chan AWH, Chan FKL, Sung JJY, Yu J. Peptostreptococcus anaerobius promotes colorectal carcinogenesis and modulates tumour immunity. Nat Microbiol. 2019;4:2319-2330. [PubMed] [DOI] |
| 29. | Hill C, Guarner F, Reid G, Gibson GR, Merenstein DJ, Pot B, Morelli L, Canani RB, Flint HJ, Salminen S, Calder PC, Sanders ME. Expert consensus document. The International Scientific Association for Probiotics and Prebiotics consensus statement on the scope and appropriate use of the term probiotic. Nat Rev Gastroenterol Hepatol. 2014;11:506-514. [PubMed] [DOI] |
| 30. | Gibson GR, Hutkins R, Sanders ME, Prescott SL, Reimer RA, Salminen SJ, Scott K, Stanton C, Swanson KS, Cani PD, Verbeke K, Reid G. Expert consensus document: The International Scientific Association for Probiotics and Prebiotics (ISAPP) consensus statement on the definition and scope of prebiotics. Nat Rev Gastroenterol Hepatol. 2017;14:491-502. [PubMed] [DOI] |
| 31. | Colombel JF, Shin A, Gibson PR. AGA Clinical Practice Update on Functional Gastrointestinal Symptoms in Patients With Inflammatory Bowel Disease: Expert Review. Clin Gastroenterol Hepatol. 2019;17:380-390.e1. [PubMed] [DOI] |
| 32. | Goldenberg JZ, Mertz D, Johnston BC. Probiotics to Prevent Clostridium difficile Infection in Patients Receiving Antibiotics. JAMA. 2018;320:499-500. [PubMed] [DOI] |
| 33. | Astó E, Méndez I, Audivert S, Farran-Codina A, Espadaler J. The Efficacy of Probiotics, Prebiotic Inulin-Type Fructans, and Synbiotics in Human Ulcerative Colitis: A Systematic Review and Meta-Analysis. Nutrients. 2019;11. [PubMed] [DOI] |
| 34. | Xu H, Ma C, Zhao F, Chen P, Liu Y, Sun Z, Cui L, Kwok LY, Zhang H. Adjunctive treatment with probiotics partially alleviates symptoms and reduces inflammation in patients with irritable bowel syndrome. Eur J Nutr. 2020;. [PubMed] [DOI] |
| 35. | Johnston BC, Goldenberg JZ, Parkin PC. Probiotics and the Prevention of Antibiotic-Associated Diarrhea in Infants and Children. JAMA. 2016;316:1484-1485. [PubMed] [DOI] |
| 36. | Dore MP, Rocchi C, Longo NP, Scanu AM, Vidili G, Padedda F, Pes GM. Effect of Probiotic Use on Adverse Events in Adult Patients with Inflammatory Bowel Disease: a Retrospective Cohort Study. Probiotics Antimicrob Proteins. 2020;12:152-159. [PubMed] [DOI] |
| 37. | Monteagudo-Mera A, Rastall RA, Gibson GR, Charalampopoulos D, Chatzifragkou A. Adhesion mechanisms mediated by probiotics and prebiotics and their potential impact on human health. Appl Microbiol Biotechnol. 2019;103:6463-6472. [PubMed] [DOI] |
| 38. | Plaza-Diaz J, Ruiz-Ojeda FJ, Gil-Campos M, Gil A. Mechanisms of Action of Probiotics. Adv Nutr. 2019;10:S49-S66. [PubMed] [DOI] |
| 39. | Cunningham M, Azcarate-Peril MA, Barnard A, Benoit V, Grimaldi R, Guyonnet D, Holscher HD, Hunter K, Manurung S, Obis D, Petrova MI, Steinert RE, Swanson KS, van Sinderen D, Vulevic J, Gibson GR. Shaping the Future of Probiotics and Prebiotics. Trends Microbiol. 2021;. [PubMed] [DOI] |
| 40. | Lebeer S, Bron PA, Marco ML, Van Pijkeren JP, O'Connell Motherway M, Hill C, Pot B, Roos S, Klaenhammer T. Identification of probiotic effector molecules: present state and future perspectives. Curr Opin Biotechnol. 2018;49:217-223. [PubMed] [DOI] |
| 41. | Hill C. Balancing the risks and rewards of live biotherapeutics. Nat Rev Gastroenterol Hepatol. 2020;17:133-134. [PubMed] [DOI] |
| 42. | Olesen SW, Leier MM, Alm EJ, Kahn SA. Searching for superstool: maximizing the therapeutic potential of FMT. Nat Rev Gastroenterol Hepatol. 2018;15:387-388. [PubMed] [DOI] |
| 43. | Zhang F, Luo W, Shi Y, Fan Z, Ji G. Should we standardize the 1,700-year-old fecal microbiota transplantation? Am J Gastroenterol. 2012;107:1755; author reply p.1755-1755; author reply p.1756. [PubMed] [DOI] |
| 44. | Surawicz CM, Brandt LJ, Binion DG, Ananthakrishnan AN, Curry SR, Gilligan PH, McFarland LV, Mellow M, Zuckerbraun BS. Guidelines for diagnosis, treatment, and prevention of Clostridium difficile infections. Am J Gastroenterol. 2013;108:478-98; quiz 499. [PubMed] [DOI] |
| 45. | McDonald LC, Gerding DN, Johnson S, Bakken JS, Carroll KC, Coffin SE, Dubberke ER, Garey KW, Gould CV, Kelly C, Loo V, Shaklee Sammons J, Sandora TJ, Wilcox MH. Clinical Practice Guidelines for Clostridium difficile Infection in Adults and Children: 2017 Update by the Infectious Diseases Society of America (IDSA) and Society for Healthcare Epidemiology of America (SHEA). Clin Infect Dis. 2018;66:987-994. [PubMed] [DOI] |
| 46. | Paramsothy S, Kamm MA, Kaakoush NO, Walsh AJ, van den Bogaerde J, Samuel D, Leong RWL, Connor S, Ng W, Paramsothy R, Xuan W, Lin E, Mitchell HM, Borody TJ. Multidonor intensive faecal microbiota transplantation for active ulcerative colitis: a randomised placebo-controlled trial. Lancet. 2017;389:1218-1228. [PubMed] [DOI] |
| 47. | Costello SP, Hughes PA, Waters O, Bryant RV, Vincent AD, Blatchford P, Katsikeros R, Makanyanga J, Campaniello MA, Mavrangelos C, Rosewarne CP, Bickley C, Peters C, Schoeman MN, Conlon MA, Roberts-Thomson IC, Andrews JM. Effect of Fecal Microbiota Transplantation on 8-Week Remission in Patients With Ulcerative Colitis: A Randomized Clinical Trial. JAMA. 2019;321:156-164. [PubMed] [DOI] |
| 48. | Paramsothy S, Paramsothy R, Rubin DT, Kamm MA, Kaakoush NO, Mitchell HM, Castaño-Rodríguez N. Faecal Microbiota Transplantation for Inflammatory Bowel Disease: A Systematic Review and Meta-analysis. J Crohns Colitis. 2017;11:1180-1199. [PubMed] [DOI] |
| 49. | El-Salhy M, Hatlebakk JG, Gilja OH, Bråthen Kristoffersen A, Hausken T. Efficacy of faecal microbiota transplantation for patients with irritable bowel syndrome in a randomised, double-blind, placebo-controlled study. Gut. 2020;69:859-867. [PubMed] [DOI] |
| 50. | Ianiro G, Eusebi LH, Black CJ, Gasbarrini A, Cammarota G, Ford AC. Systematic review with meta-analysis: efficacy of faecal microbiota transplantation for the treatment of irritable bowel syndrome. Aliment Pharmacol Ther. 2019;50:240-248. [PubMed] [DOI] |
| 51. | DeFilipp Z, Bloom PP, Torres Soto M, Mansour MK, Sater MRA, Huntley MH, Turbett S, Chung RT, Chen YB, Hohmann EL. Drug-Resistant E. coli Bacteremia Transmitted by Fecal Microbiota Transplant. N Engl J Med. 2019;381:2043-2050. [PubMed] [DOI] |
| 52. | FDA. Information Pertaining to Additional Safety Protections Regarding Use of Fecal Microbiota for Transplantation - Screening and Testing of Stool Donors for Multi-drug Resistant Organisms, 2019. Available from: https://www.fda.gov/vaccines-blood-biologics/safety-availability-biologics/information-pertaining-additional-safety-protections-regarding-use-fecal-microbiota-transplantation. |
| 53. | Ofir G, Sorek R. Contemporary Phage Biology: From Classic Models to New Insights. Cell. 2018;172:1260-1270. [PubMed] [DOI] |
| 54. | Manrique P, Dills M, Young MJ. The Human Gut Phage Community and Its Implications for Health and Disease. Viruses. 2017;9. [PubMed] [DOI] |
| 55. | Expert round table on acceptance and re-implementation of bacteriophage therapy. Silk route to the acceptance and re-implementation of bacteriophage therapy. Biotechnol J. 2016;11:595-600. [PubMed] [DOI] |
| 56. | Sabino J, Hirten RP, Colombel JF. Review article: bacteriophages in gastroenterology-from biology to clinical applications. Aliment Pharmacol Ther. 2020;51:53-63. [PubMed] [DOI] |
| 57. | Bhandare S, Colom J, Baig A, Ritchie JM, Bukhari H, Shah MA, Sarkar BL, Su J, Wren B, Barrow P, Atterbury RJ. Reviving Phage Therapy for the Treatment of Cholera. J Infect Dis. 2019;219:786-794. [PubMed] [DOI] |
| 58. | Galtier M, De Sordi L, Sivignon A, de Vallée A, Maura D, Neut C, Rahmouni O, Wannerberger K, Darfeuille-Michaud A, Desreumaux P, Barnich N, Debarbieux L. Bacteriophages Targeting Adherent Invasive Escherichia coli Strains as a Promising New Treatment for Crohn's Disease. J Crohns Colitis. 2017;11:840-847. [PubMed] [DOI] |
| 59. | Ruemmele FM, Veres G, Kolho KL, Griffiths A, Levine A, Escher JC, Amil Dias J, Barabino A, Braegger CP, Bronsky J, Buderus S, Martín-de-Carpi J, De Ridder L, Fagerberg UL, Hugot JP, Kierkus J, Kolacek S, Koletzko S, Lionetti P, Miele E, Navas López VM, Paerregaard A, Russell RK, Serban DE, Shaoul R, Van Rheenen P, Veereman G, Weiss B, Wilson D, Dignass A, Eliakim A, Winter H, Turner D; European Crohn's and Colitis Organisation; European Society of Pediatric Gastroenterology, Hepatology and Nutrition. Consensus guidelines of ECCO/ESPGHAN on the medical management of pediatric Crohn's disease. J Crohns Colitis. 2014;8:1179-1207. [PubMed] [DOI] |
| 60. | Wilson B, Rossi M, Kanno T, Parkes GC, Anderson S, Mason AJ, Irving PM, Lomer MC, Whelan K. β-Galactooligosaccharide in Conjunction With Low FODMAP Diet Improves Irritable Bowel Syndrome Symptoms but Reduces Fecal Bifidobacteria. Am J Gastroenterol. 2020;115:906-915. [PubMed] [DOI] |
| 61. | Cox SR, Lindsay JO, Fromentin S, Stagg AJ, McCarthy NE, Galleron N, Ibraim SB, Roume H, Levenez F, Pons N, Maziers N, Lomer MC, Ehrlich SD, Irving PM, Whelan K. Effects of Low FODMAP Diet on Symptoms, Fecal Microbiome, and Markers of Inflammation in Patients With Quiescent Inflammatory Bowel Disease in a Randomized Trial. Gastroenterology. 2020;158:176-188.e7. [PubMed] [DOI] |
| 62. | Zhang Y, Feng L, Wang X, Fox M, Luo L, Du L, Chen B, Chen X, He H, Zhu S, Hu Z, Chen S, Long Y, Zhu Y, Xu L, Deng Y, Misselwitz B, Lang BM, Yilmaz B, Kim JJ, Owyang C, Dai N. Low fermentable oligosaccharides, disaccharides, monosaccharides, and polyols diet compared with traditional dietary advice for diarrhea-predominant irritable bowel syndrome: a parallel-group, randomized controlled trial with analysis of clinical and microbiological factors associated with patient outcomes. Am J Clin Nutr. 2021;. [PubMed] [DOI] |
| 63. | Fritsch J, Garces L, Quintero MA, Pignac-Kobinger J, Santander AM, Fernández I, Ban YJ, Kwon D, Phillips MC, Knight K, Mao Q, Santaolalla R, Chen XS, Maruthamuthu M, Solis N, Damas OM, Kerman DH, Deshpande AR, Lewis JE, Chen C, Abreu MT. Low-Fat, High-Fiber Diet Reduces Markers of Inflammation and Dysbiosis and Improves Quality of Life in Patients With Ulcerative Colitis. Clin Gastroenterol Hepatol. 2021;19:1189-1199.e30. [PubMed] [DOI] |
| 64. | Wang S, Martins R, Sullivan MC, Friedman ES, Misic AM, El-Fahmawi A, De Martinis ECP, O'Brien K, Chen Y, Bradley C, Zhang G, Berry ASF, Hunter CA, Baldassano RN, Rondeau MP, Beiting DP. Diet-induced remission in chronic enteropathy is associated with altered microbial community structure and synthesis of secondary bile acids. Microbiome. 2019;7:126. [PubMed] [DOI] |