修回日期: 2020-11-09
接受日期: 2020-11-24
在线出版日期: 2020-12-28
电压门控氯通道3(voltage-gated chloride channel 3, ClC-3)可参与调节卵巢癌、宫颈癌和肺癌的化疗敏感性的调节, 而其在结直肠癌(colorectal cancer, CRC)的奥沙利铂化疗中的作用和机制尚不清楚.
探究CRC细胞中ClC-3对奥沙利铂化疗敏感性的影响, 以及细胞自噬在其中发挥的作用.
用免疫组化染色观察ClC-3和微管相关蛋白1Ⅱ轻链3(microtubule-associated protein 1Ⅱ light chain 3, LC3-Ⅱ)在CRC耐药和敏感组织中的表达. 用Western blot检测ClC-3和LC3-Ⅱ在CRC HT-29细胞以及奥沙利铂耐药细胞(HT-29/L-OHP)中的表达. 用ClC-3 siRNA分别转染HT-29细胞和HT-29/L-OHP细胞后, CCK-8法检测细胞对奥沙利铂的敏感性变化; 用Cyto-ID染色观察自噬点形成; 用Western blot检测自噬相关蛋白Beclin1、LC3-Ⅰ、LC3-Ⅱ和p62的表达. 用自噬激动剂雷帕霉素处理已转染ClC-3 siRNA的HT-29细胞和HT-29/L-OHP细胞后, 用CCK-8法和Western blot分别检测细胞对奥沙利铂的敏感性变化以及Beclin1、LC3-Ⅰ、LC3-Ⅱ、p62和ClC-3蛋白的表达.
CRC耐药组织以及HT-29/L-OHP细胞中LC3Ⅱ和ClC-3均呈现高表达. 抑制ClC-3表达后, HT-29细胞和HT-29/L-OHP细胞对奥沙利铂的敏感性均增加, 细胞的自噬水平降低. 雷帕霉素能逆转抑制ClC-3对CRC细胞对奥沙利铂的增敏效应, 但其对ClC-3的表达无影响.
下调ClC-3可通过抑制细胞自噬来增强CRC细胞对奥沙利铂化疗的敏感性.
核心提要: 下调电压门控氯通道3可通过抑制细胞自噬来发挥增强结直肠癌细胞对奥沙利铂化疗的敏感性.
引文著录: 段琼, 陈斌辉, 林义. 下调ClC-3通过抑制细胞自噬增强结直肠癌细胞对奥沙利铂化疗敏感性. 世界华人消化杂志 2020; 28(24): 1235-1242
Revised: November 9, 2020
Accepted: November 24, 2020
Published online: December 28, 2020
Voltage-gated chloride channel 3 (ClC-3) can regulate the chemotherapy sensitivity of ovarian cancer, cervical cancer, and lung cancer, while its effect and mechanism in oxaliplatin therapy for colorectal cancer (CRC) are still unknown.
To investigate the effect of ClC-3 on oxaliplatin sensitivity and the role of autophagy in CRC cells.
The expression of ClC-3 and microtubule-associated protein 1 light chain 3 Ⅱ (LC3-Ⅱ) in the tissues of chemotherapy resistant and sensitive CRC was detected by immunohistochemical staining. The expression levels of ClC-3 and LC3-Ⅱ in HT-29 and HT-29/L-OHP cells were detected by Western blot. After transfection of HT-29 and HT-29/L-OHP cells with ClC-3 siRNA, the sensitivity of the cells to oxaliplatin was detected by CCK-8 assay, the autophagy was detected by Cyto-ID staining, and the expression levels of autophagy-related proteins Beclin1, LC3-Ⅰ, LC3-Ⅱ, and p62 were detected by Western blot. The HT-29 and HT-29/L-OHP cells transfected with ClC-3 siRNA were subsequently treated with the autophagy agonist rapamycin, and then the sensitivity of the cells to oxaliplatin and the expression levels of Beclin1, LC3-Ⅰ, LC3-Ⅱ, p62, and ClC-3 were detected by CCK-8 assay and Western blot, respectively.
LC3-Ⅱ and ClC-3 were highly expressed in tissues of chemo-resistant colorectal cancer and HT-29/L-OHP cells. After inhibition of ClC-3, the sensitivity of HT-29 cells and HT-29/L-OHP cells to oxaliplatin was both increased, and the autophagy level of the cells was decreased. Rapamycin reversed the sensitization of ClC-3 inhibition to oxaliplatin in colorectal cancer cells, but had no effect on the expression of ClC-3.
Down-regulation of ClC-3 can enhance the sensitivity of colorectal cancer cells to oxaliplatin chemotherapy by inhibiting autophagy.
- Citation: Duan Q, Chen BH, Lin Y. Down-regulation of ClC-3 enhances chemosensitivity of colorectal cancer cells to oxaliplatin by inhibiting autophagy. Shijie Huaren Xiaohua Zazhi 2020; 28(24): 1235-1242
- URL: https://www.wjgnet.com/1009-3079/full/v28/i24/1235.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v28.i24.1235
结直肠癌(colorectal cancer, CRC)是常见的消化系统恶性肿瘤之一, 尽管我国CRC发病率和死亡率低于发达国家水平[1], 但随着经济的发展和人们饮食习惯的变更, 我国近几年CRC的发病率正以年均4%以上的速度增长[2], 且北京、上海、广州等发达地区的CRC发病率已和发达国家持平[3]. 大部分CRC患者确诊时已是中晚期, 手术难以根除[4]. 目前临床上应用的FOLFOX方案是利用奥沙利铂(oxaliplatin, L-OHP)与5-氟尿嘧啶及亚叶酸联合用药作为CRC的一线、二线治疗[5], 但多数患者在治疗一段时间后产生获得性耐药. 且化疗不仅易出现耐药性, 还极易出现毒副作用, 导致临床上治疗效果不佳以及预后不良[6]. 因此如何逆转CRC细胞对奥沙利铂的耐药性, 提高CRC细胞对奥沙利铂的敏感性, 提高患者的生存率和减轻患者的毒副作用是目前研究的热点.
电压门控氯通道3(voltage-gated chloride channel 3, ClC-3)基因定位于4q33, 编码760个氨基酸组成的蛋白质, 广泛分布于心、脑、肝、肠、胰腺等组织. 依赖ClC-3的容积调节性氯电流参与调控细胞容积变化, 而细胞容积变化直接参与调控增殖、凋亡、细胞周期、细胞粘附、细胞动力学等多种生物学功能[7-9]. 实体肿瘤化疗时能使得实体肿瘤细胞内部微环境发生改变[10]. 在缺氧和缺营养的微环境高渗环境下, 细胞发生调节性容量增加(regulatory volume increase, RVI)[8]. 有文献[11]提出稳定过表达ClC-3的宫颈癌细胞对顺铂敏感性降低; ClC-3 siRNA转染后, 卵巢癌顺铂耐药细胞SKOV-3/DDP对顺铂敏感性增强[12]. 因此, 我们推测ClC-3表达可能与对肿瘤细胞化疗相关.
由以上研究背景可见, ClC-3均与肿瘤化疗药物敏感性相关, 但ClC-3在CRC癌奥沙利铂化疗中的研究却鲜有报道. 本研究试图探究下调ClC-3是否可以调节CRC细胞对奥沙利铂化疗的敏感性, 以及其中的机制.
CRC组织耐药标本收集: 收集我院经FOLFOX方案化疗后再次复发的CRC患者再次行肿瘤切除术的肿瘤组织和相应的癌旁组织(距离癌灶组织边缘2-3 cm)标本, 肿瘤组织和相应的癌旁组织经过病理科验证. 筛选出化疗耐药CRC组织(n = 28例)和化疗敏感CRC组织(n = 10例). 其中, 化疗耐药组织定义为经FOLFOX方案化疗后≤6 mo出现复发的CRC患者的CRC组织, 化疗敏感组织定义为经FOLFOX方案化疗后>6 mo出现复发的CRC患者的CRC组织. 本次收集的化疗耐药CRC组织为FOLFOX方案化疗后4.12 mo±1.13 mo再次复发的CRC患者再次行肿瘤切除术的结直肠组织, 化疗敏感CRC组织为FOLFOX方案化疗后22.35 mo±4.25 mo再次复发的CRC患者再次行肿瘤切除术的结直肠组织. 所有标本及临床资料的收集均符合伦理规范, 同时征得患者或其家属同意并签署相关知情同意书.
1.2.1 细胞培养及奥沙利铂耐药细胞模型构建: HT-29细胞(ATCC, 美国)用含10%胎牛血清(Gibco, 美国)和100 U/mL青/链霉素双抗的DMEM培养基(Thermo Fisher Scientific, 美国)常规培养, 2 d换一次液, 每6 d按照1:3传代一次. 取对数期HT-29细胞, 将培养基换成含有2 μmol/L奥沙利铂(赛诺菲(杭州)制药有限公司)培养液, 培养48 h, 洗除药物, 换正常培养基, 每2 d换正常培养基一次, 持续6 d, 此为一个循环. 每个浓度反复刺激3个循环. 如此反复诱导、换液、传代, 并逐渐增加奥沙利铂浓度(每次增加1 μmol/L)间歇诱导培养, 最终获得能耐受20 μmol/L奥沙利铂的细胞, 并将其培养在含有10 μmol/L奥沙利铂培养液中, 直达细胞在10 μmol/L奥沙利铂培养液中稳定生长. 最终获得奥沙利铂耐药的HT-29/L-OHP细胞.
1.2.2 转染: 由Invitrogen公司(美国)按照BLOCK-iT™ RNAi Designer设计合成人ClC-3 cDNA不同区域的RNAi(ClC-3 siRNA, 序列为: 5'-AUAAUAGCUAACCUCCUC CAAACUA-3'), 以及无已知的基因编码的阴性对照siRNA(NC siRNA, 序列为: 5'-AAUUCUCCGAACGUGUCACGU-3'). 按照说明书步骤, 用脂质体lipofectAMINE2000(Invitrogen, 美国)分别将ClC-3 siRNA和NC siRNA通过瞬时转染法染入HT-29细胞和HT-29/L-OHP细胞, 细胞继续在培养箱孵育48 h, 收集细胞用于后续研究.
1.2.3 药物处理: 用100 nmol/L雷帕霉素(自噬激动剂, 上海阿拉丁生化科技股份有限公司)处理已/未转染ClC-3 siRNA的HT-29细胞和HT-29/L-OHP细胞30 min, 再继续培养48 h后, 收集细胞用于后续研究.
1.2.4 CCK-8实验: 调整雷帕霉素已/未处理的已/未转染ClC-3 siRNA的HT-29细胞和HT-29/L-OHP密度为1×104个/孔, 接种于96孔板, 然后分别给予(0、4、8、16、32、64、100 μmol/L)奥沙利铂处理48 h, 待测孔加入100 μL CCK-8工作液(江苏凯基生物技术股份有限公司), 孵箱培养2 h. 用酶标仪在490 nm处测量吸光值计算细胞活力.
1.2.5 Cyto-ID自噬率检测: 将已转染ClC-3 siRNA或NC-siRNA的HT-29细胞和HT-29/L-OHP细胞调整密度为1×105个/mL接种于24孔板内, 细胞处理后用PBS清洗3次, 用4%多聚甲醛室温固定15 min, PBS清洗3次, 加入Cyto-ID检测试剂(ENZO, 美国)孵育45 min, 激光共聚焦显微镜下观察, 统计单个细胞中Cyto-ID的阳性自噬点数, 每样本至少统计50个细胞.
1.2.6 免疫组化: 取癌旁组织、CRC化疗耐药组织和化疗敏感组织组织, 并用石蜡包埋. 切为6 μm厚度的组织切片, 并经脱蜡至水、阻断内源性过氧化物酶和封闭后, 分别室温孵育抗ClC-3(1:150, Abcam, 美国)和抗微管相关蛋白1Ⅱ轻链3(microtubule-associated protein 1Ⅱ light chain 3, LC3-Ⅱ)(1:100, Abcam, 美国)2 h. PBS冲洗后, 室温孵育酶标抗兔二抗(1:100, 北京中山金桥生物技术有限公司)45 min. PBS冲洗后, 用DAB液显色, 苏木素复染后, 显微镜白光视野下观察并拍照, 用Image J软件统计阳性信号值.
1.2.7 蛋白质免疫印迹: 用RIPA细胞裂解液(上海碧云天生物技术有限公司)在冰上裂解细胞并提取蛋白. 蛋白用BCA蛋白浓度检测试剂盒(上海碧云天生物技术有限公司)进行定量后, 调整蛋白上样量(50 μg/样品), 进行SDS-PAGE凝胶电泳分离. 电泳结束, 将PVDF膜覆盖于分离胶上, 置于电转槽中用湿转法以200 mA恒流电转90 min. 用含5%脱脂奶粉的TBST将PVDF膜在室温中封闭1 h. 在室温下孵育针对ClC-3(1:1000, Abcam, 美国)、Beclin1 (1:2000, Cell Signaling Technology, 美国)、LC3(1:1500, Cell Signaling Technology, 美国)和β-actin (1:5000, 武汉博士德生物工程有限公司)的一抗2 h. 洗膜后, 孵育HRP标记的二抗(上海碧云天生物技术有限公司)1 h. 洗膜后, 用避光ECL超敏发光液(上海碧云天生物技术有限公司)显影. 使用Image J软件分析条带光密度值.
统计学处理 数据以mean±SD表示, 用SPSS 21.0软件包对实验数据进行分析. 两组数据比较采用t检验; 多组间数据比较用方差分析, 再采用SNK检验法进行均数的两两比较. 以P<0.05为差异有统计学意义.
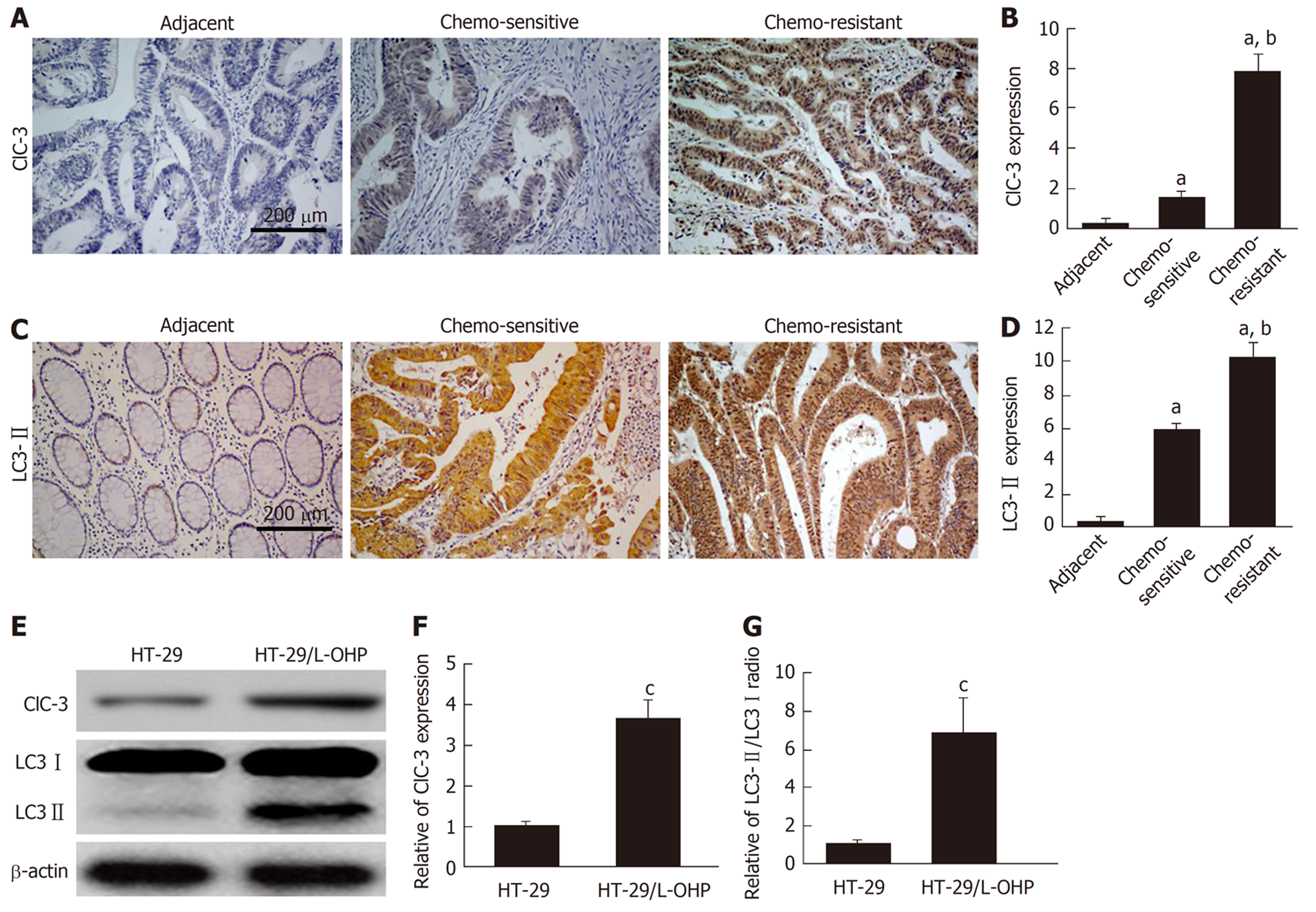
免疫组化染色结果显示, 与化疗敏感组织比较, 化疗耐药组织中ClC-3(图1A、B)和LC3-Ⅱ(图1C、D)的表达均明显增加(P<0.05), 说明CLC-3和LC3-Ⅱ在CRC化疗耐药组织中呈现高水平. Western blot结果显示, 与HT-29细胞比较, 奥沙利铂耐药细胞HT-29/L-OHP中ClC-3表达(图1E、F)和LC3-Ⅱ/LC3-Ⅰ比率(图1E、G)均明显增加(P<0.05). 以上结果提示, ClC-3表达和自噬可能与CRC奥沙利铂耐药相关.
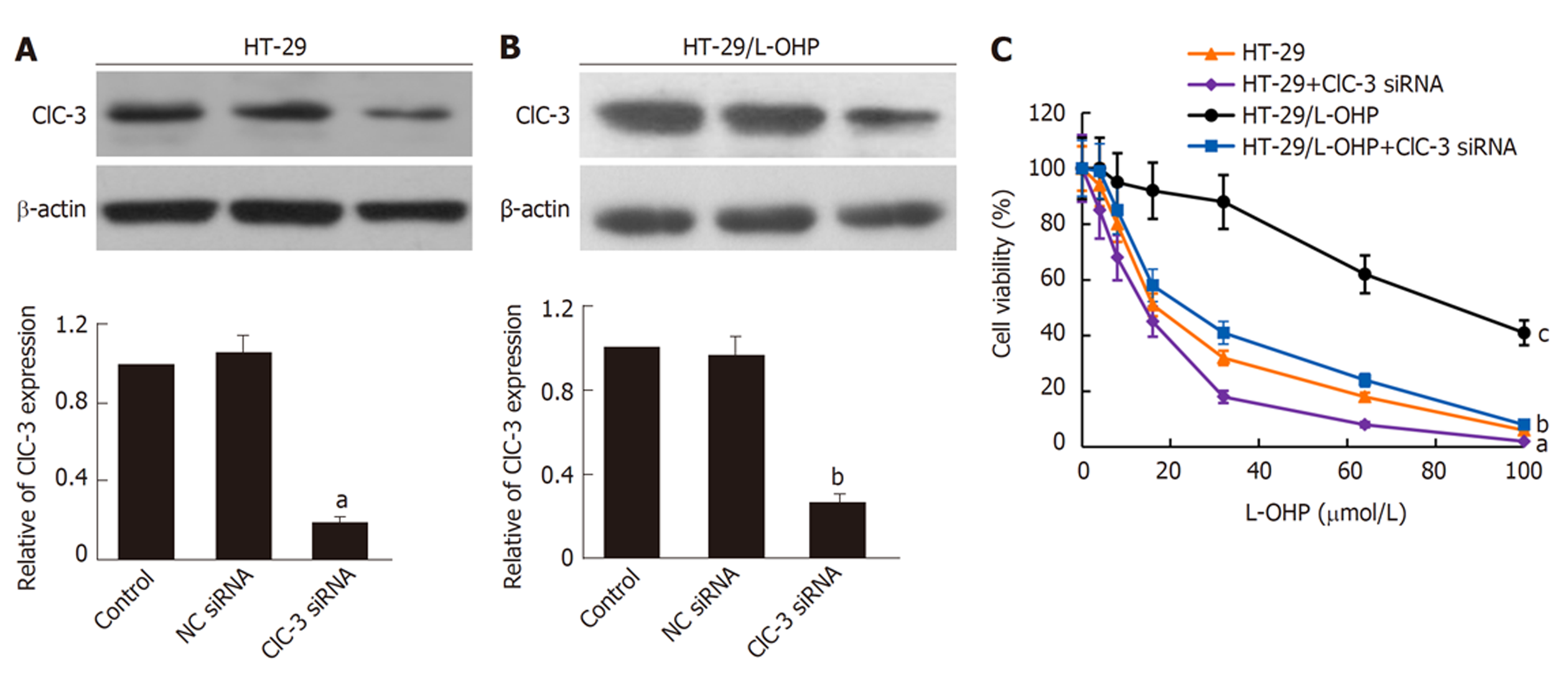
用ClC-3 siRNA分别转染HT-29细胞和HT-29/L-OHP细胞, 与对照组比较, ClC-3 siRNA组的HT-29细胞和HT-29/L-OHP细胞中ClC-3表达均明显降低(图2A、B; P<0.05), 说明构建的ClC-3 siRNA转染细胞成功. 用CCK-8法检测不同处理后细胞活力的变化, 如图2C所示, 相比于HT-29细胞, 用ClC-3 siRNA处理的HT-29细胞的细胞活力明显下降, 表明细胞对于奥沙利铂化疗的敏感性增加; 同时, 在奥沙利铂耐药细胞HT-29/L-OHP中抑制ClC-3后, 细胞对奥沙利铂敏感性增强. 总之, 不管是否发生奥沙利铂耐药, 抑制细胞中ClC-3表达均可以增强细胞对奥沙利铂的敏感性.
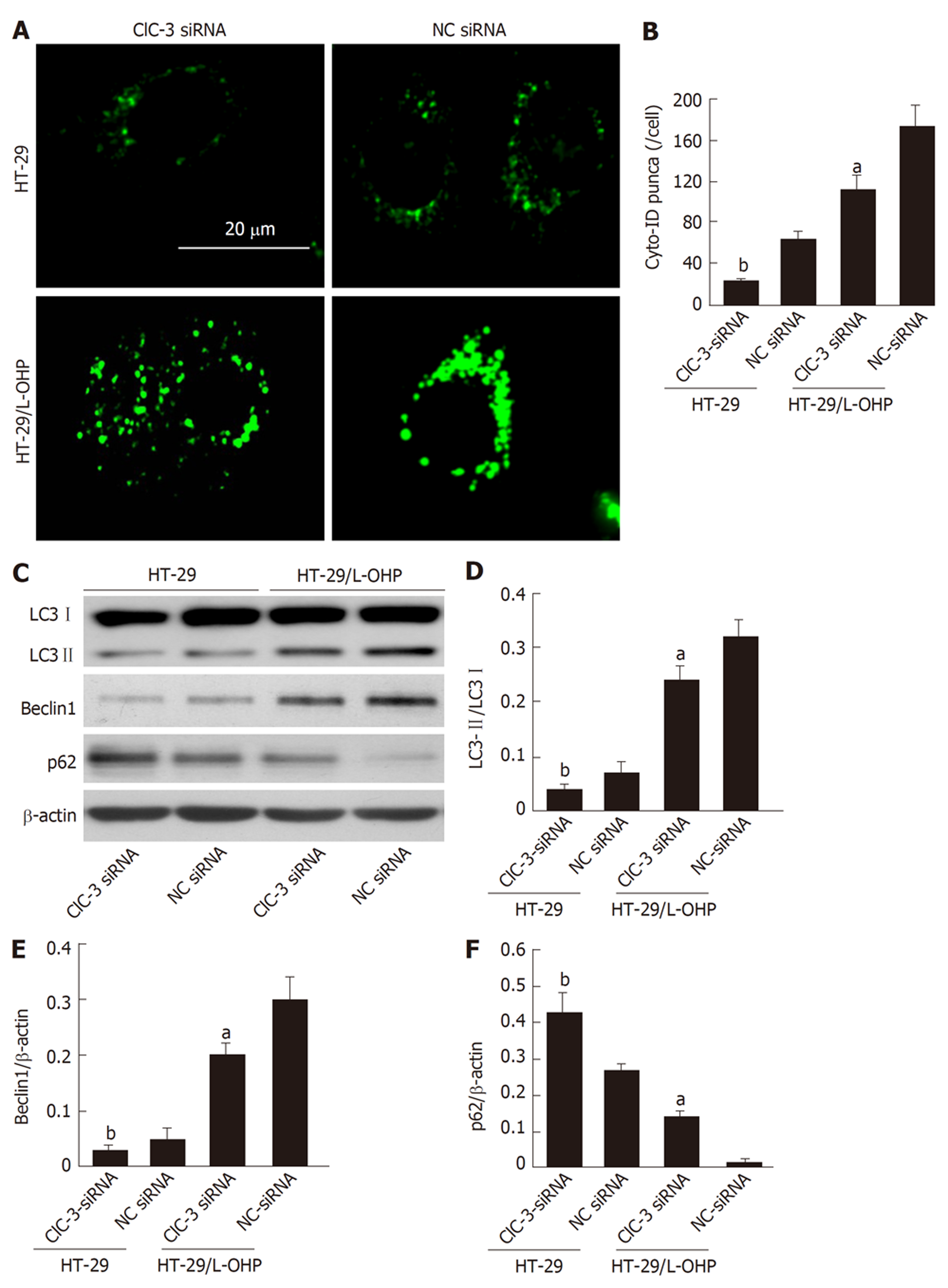
Cyto-ID染色结果(图3A、B)显示, 在HT-29细胞和HT-29/L-OHP细胞中转染ClC-3 siRNA, 转染ClC-3 siRNA后的两种细胞的细胞内Cyto-ID的阳性自噬点数均降低(P<0.05). 进一步通过Western blot检测细胞内自噬关键蛋白的表达(图3C), 结果(图3C-F)显示, 不管是在HT-29细胞和HT-29/L-OHP细胞中, 与转染NC siRNA比较, 转染ClC-3 siRNA后的两种细胞中LC3-Ⅱ/LC3-Ⅰ比率(图3D)和Beclin1表达(图3E)均明显降低(P<0.05), 同时p62表达(图3F)明显增加(P<0.05). 以上结果说明, 抑制ClC-3表达能降低CRC细胞的自噬水平.
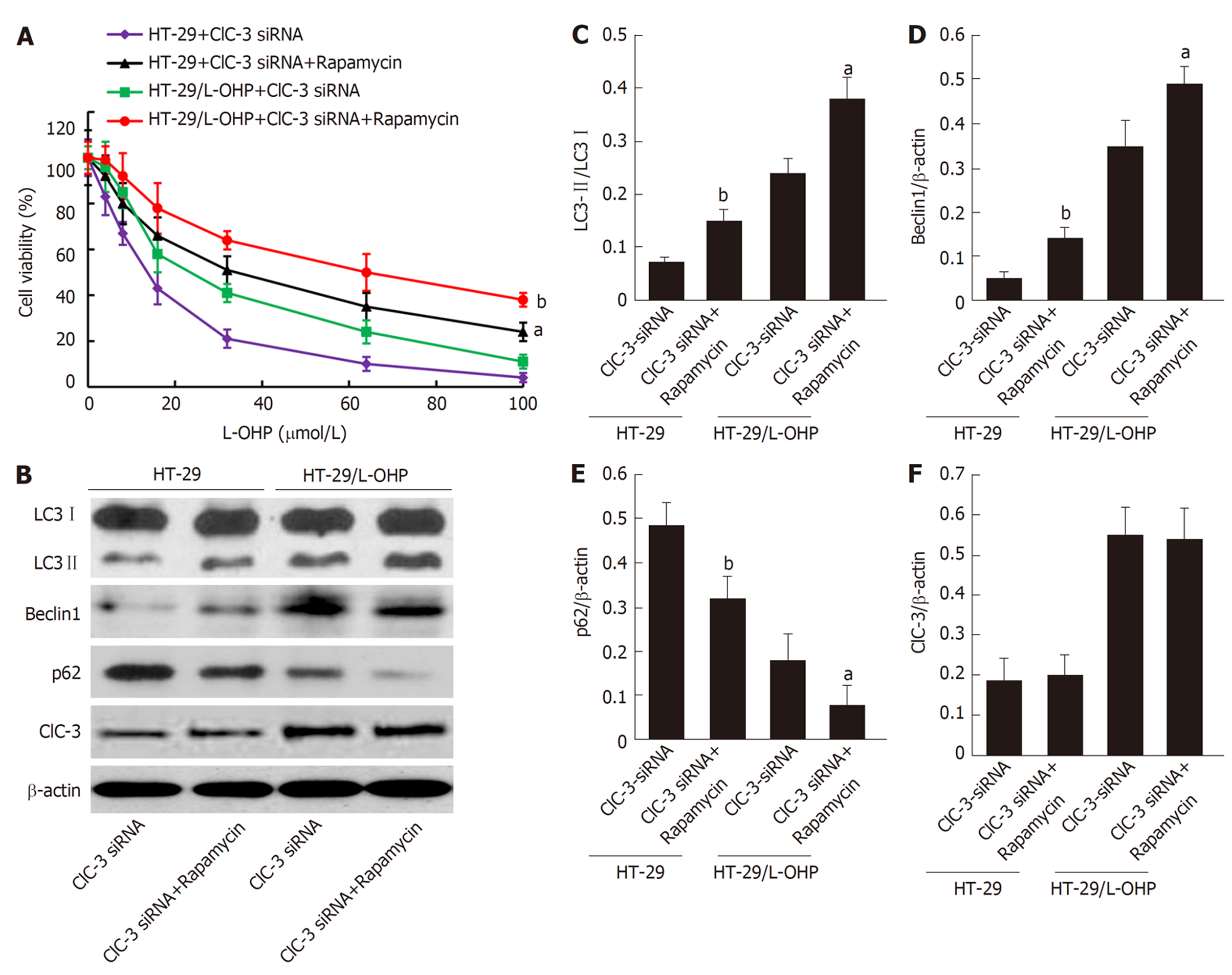
CCK-8结果(图4A)显示, 不管是在HT-29细胞和HT-29/L-OHP细胞中, 与转染ClC-3 siRNA比较, 用自噬激动剂雷帕霉素处理均能降低细胞对奥沙利铂的敏感性(P<0.05). Western blot结果(4B-E)显示, 不管是在HT-29细胞和HT-29/L-OHP细胞中, 与转染ClC-3 siRNA比较, 用雷帕霉素处理后的两种细胞中LC3-Ⅱ/LC3-Ⅰ比率(图4B、C)和Beclin1表达(图4B、D)均明显增加(P<0.05), 同时p62表达(图4B、E)明显降低(P<0.05); 以上结果说明, 促进自噬能逆转ClC-3 siRNA对CRC细胞的奥沙利铂的增敏效应. 另外, 结果(图4B、F)显示, 不管是在HT-29细胞和HT-29/L-OHP细胞中, 雷帕霉素对ClC-3表达无影响, 这提示ClC-3是细胞自噬的上游调节分子.
自噬是实体肿瘤细胞在缺氧和缺营养的癌灶中生存的重要方式, 而化疗药物往往能增强实体肿瘤细胞缺氧和缺营养的微环境[10]. 在自噬过程中, Beclin1上调能发挥启动自噬的作用; LC3-Ⅱ则是自噬体形成的标记物; p62可同自噬过程中的降解底物一起被自噬体结合并降解. 且研究[13]已显示, 在实体肿瘤化疗耐药组织切片中发现, 其自噬关键标记物Beclin1和LC3-Ⅱ的蛋白水平升高. 因此, 自噬在实体肿瘤化疗敏感性中可能发挥着重要的作用. 另外, 缺氧和缺营养的微环境能促进细胞ClC-3表达[8]. 由此观之, 在肿瘤化疗中, ClC-3表达、自噬水平和化疗敏感性三者之间可能具有一定的内部联系. 因此, 本研究关注ClC-3和细胞自噬的作用, 以及它们在调控CRC化疗耐药细胞对奥沙利铂化疗的敏感性的作用.
ClC-3是电压门控性氯离子通道家族的成员, 有研究[14]发现抑制ClC-3的表达, 可抑制神经胶质瘤细胞U251的自噬, 促进U251细胞对顺铂化疗敏感性. 我们同样在CRC化疗耐药组织和奥沙利铂耐药的HT-29/L-OHP细胞株中发现ClC-3和LC3-Ⅱ高表达, 由此推测ClC-3和LC3-Ⅱ表达可能与CRC奥沙利铂化疗敏感性相关. 为证明ClC-3通过自噬参与结直肠的奥沙利铂化疗敏感性, 本研究采用ClC-3 siRNA转染HT-29细胞和HT-29/L-OHP细胞, 观察自噬水平和其奥沙利铂化疗敏感性变化, 结果显示, 不管是否发生奥沙利铂耐药, 抑制ClC-3表达均能使结直肠细胞对奥沙利铂增敏, 且其过程伴随自噬水平降低. 且Sun等[15]发现在化疗耐药CRC细胞中抑制细胞自噬, 奥沙利铂处理可以促使肿瘤细胞凋亡增加. 比较直接的证据是Selvakumaran等[16]在CRC细胞研究中发现, 给予自噬抑制剂氯喹预处理的CRC细胞或转染Beclin1 siRNA的CRC细胞对奥沙利铂的敏感性明显升高. 为证明下调ClC-3对CRC细胞的奥沙利铂的增敏效应是否通过抑制细胞自噬, 本研究进一步选用自噬激动剂雷帕霉素处理已转染ClC-3 siRNA的HT-29细胞和HT-29/L-OHP细胞, 发现增强自噬能逆转ClC-3 siRNA对奥沙利铂的增敏效应, 但其对ClC-3表达无影响, 这一结果, 更进一步证明了ClC-3是自噬的上游分子, 抑制ClC-3是通过降低CRC细胞自噬水平来达到对奥沙利铂的增敏.
总之, 我们的研究发现下调ClC-3通过抑制细胞自噬从而增强了CRC细胞对奥沙利铂化疗的敏感性. 我们的研究工作从组织学和细胞学两个方面探究ClC-3在CRC细胞奥沙利铂敏感性中的调控作用, 明确下调ClC-3在CRC化疗中的作用机制, 从一个新的角度为评估ClC-3参与CRC化疗作用提供了理论依据.
化疗是肿瘤治疗的最主要的治疗策略之一. 而化疗敏感性制约着肿瘤的化疗效果. 因此, 研究增加化疗敏感性的策略对肿瘤的化疗具有重大的意义.
自噬是肿瘤细胞应对化疗的重要生存方式之一. 已有报道表明电压门控氯通道3(voltage-gated chloride channel 3, ClC-3)在化疗耐药组织高表达. 而在肿瘤化疗中, ClC-3表达、自噬和化疗药物敏感性三者之间的内部关系尚不完全清楚.
研究结直肠癌(colorectal cancer, CRC)奥沙利铂化疗中, ClC-3表达、自噬和奥沙利铂敏感性三者之间的关系, 并分析内在的机制.
分别检测FOLFOX方案化疗后的CRC化疗耐药组织和化疗敏感组织以及CRCHT-29细胞和奥沙利铂耐药细胞(HT-29/L-OHP)中ClC-3和微管相关蛋白1Ⅱ轻链3(microtubule-associated protein 1Ⅱ light chain 3, LC3-Ⅱ)表达; 敲减HT-29和HT-29/L-OHP中ClC-3的表达后, 分别检测奥沙利铂敏感性和自噬水平的变化; 用雷帕霉素处理上述细胞, 再分别检测奥沙利铂敏感性、自噬水平和ClC-3表达的变化.
CRC耐药组织以及奥沙利铂耐药细胞中均存在高表达的LC3Ⅱ和ClC-3. 在HT-29和HT-29/L-OHP中, 下调ClC-3表达均对奥沙利铂增敏并降低自噬; 用雷帕霉素能部分消除敲减ClC-3对奥沙利铂的增敏效应.
下调ClC-3通过抑制CRC细胞自噬水平来达到对奥沙利铂的增敏效应.
在CRC化疗中, 下调ClC-3表达可能会让患者获益.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C, C, C
D级 (一般): 0
E级 (差): 0
科学编辑: 张砚梁 制作编辑:张砚梁
| 1. | Siegel RL, Miller KD, Jemal A. Cancer statistics, 2018. CA Cancer J Clin. 2018;68:7-30. [PubMed] [DOI] |
| 2. | Zheng ZX, Zheng RS, Zhang SW, Chen WQ. Colorectal cancer incidence and mortality in China, 2010. Asian Pac J Cancer Prev. 2014;15:8455-8460. [PubMed] [DOI] |
| 3. | Fang JY, Dong HL, Sang XJ, Xie B, Wu KS, Du PL, Xu ZX, Jia XY, Lin K. Colorectal Cancer Mortality Characteristics and Predictions in China, 1991-2011. Asian Pac J Cancer Prev. 2015;16:7991-7995. [PubMed] [DOI] |
| 4. | Coppedè F, Lopomo A, Spisni R, Migliore L. Genetic and epigenetic biomarkers for diagnosis, prognosis and treatment of colorectal cancer. World J Gastroenterol. 2014;20:943-956. [PubMed] [DOI] |
| 5. | Guo Y, Xiong BH, Zhang T, Cheng Y, Ma L. XELOX vs. FOLFOX in metastatic colorectal cancer: An updated meta-analysis. Cancer Invest. 2016;34:94-104. [PubMed] [DOI] |
| 6. | Nagashima M, Ooshiro M, Moriyama A, Sugishita Y, Kadoya K, Sato A, Kitahara T, Takagi R, Urita T, Yoshida Y, Tanaka H, Oshiro T, Okazumi S, Katoh R. Efficacy and tolerability of controlled-release oxycodone for oxaliplatin-induced peripheral neuropathy and the extension of FOLFOX therapy in advanced colorectal cancer patients. Support Care Cancer. 2014;22:1579-1584. [PubMed] [DOI] |
| 7. | Zhou FM, Huang YY, Tian T, Li XY, Tang YB. Knockdown of Chloride Channel-3 Inhibits Breast Cancer Growth In Vitro and In Vivo. J Breast Cancer. 2018;21:103-111. [PubMed] [DOI] |
| 8. | Ma MM, Lin CX, Liu CZ, Gao M, Sun L, Tang YB, Zhou JG, Wang GL, Guan YY. Threonine532 phosphorylation in ClC-3 channels is required for angiotensin II-induced Cl(-) current and migration in cultured vascular smooth muscle cells. Br J Pharmacol. 2016;173:529-544. [PubMed] [DOI] |
| 9. | Jentsch TJ, Pusch M. CLC Chloride Channels and Transporters: Structure, Function, Physiology, and Disease. Physiol Rev. 2018;98:1493-1590. [PubMed] [DOI] |
| 10. | Hui L, Chen Y. Tumor microenvironment: Sanctuary of the devil. Cancer Lett. 2015;368:7-13. [PubMed] [DOI] |
| 12. | 于 春艳, 刘 希, 苏 静, 钟 加滕, 孙 连坤, 刘 玉和. 抑制ClC-3表达促进顺铂诱导人卵巢癌SKOV3/DDP细胞凋亡的作用机制. 中国妇幼保健. 2013;28:1004-1006. [DOI] |
| 13. | Vasilevskaya IA, Selvakumaran M, Roberts D, O'Dwyer PJ. JNK1 Inhibition Attenuates Hypoxia-Induced Autophagy and Sensitizes to Chemotherapy. Mol Cancer Res. 2016;14:753-763. [PubMed] [DOI] |
| 14. | Su J, Xu Y, Zhou L, Yu HM, Kang JS, Liu N, Quan CS, Sun LK. Suppression of chloride channel 3 expression facilitates sensitivity of human glioma U251 cells to cisplatin through concomitant inhibition of Akt and autophagy. Anat Rec (Hoboken). 2013;296:595-603. [PubMed] [DOI] |
| 15. | Sun C, Wang FJ, Zhang HG, Xu XZ, Jia RC, Yao L, Qiao PF. miR-34a mediates oxaliplatin resistance of colorectal cancer cells by inhibiting macroautophagy via transforming growth factor-β/Smad4 pathway. World J Gastroenterol. 2017;23:1816-1827. [PubMed] [DOI] |
| 16. | Selvakumaran M, Amaravadi RK, Vasilevskaya IA, O'Dwyer PJ. Autophagy inhibition sensitizes colon cancer cells to antiangiogenic and cytotoxic therapy. Clin Cancer Res. 2013;19:2995-3007. [PubMed] [DOI] |