修回日期: 2020-09-18
接受日期: 2020-10-16
在线出版日期: 2020-11-28
目前结直肠癌(colorectal cancer, CRC)的患者仍有很高比例的复发和远处转移, 严重影响预后. HOXB8与CRC发生发展相关.
本研究旨在探讨HOXB8基因在CRC患者预后中的判断价值, 为监测高危CRC的疾病进展和复发提供思路.
从肿瘤基因组图谱数据库下载CRC患者HOXB8基因的mRNA测序数据, 分析HOXB8的表达与CRC临床病理因素之间的关系, 并进行生存分析. 使用单因素和多因素COX模型筛选出CRC的预后危险因素. 然后基于HOXB8及上述多因素COX模型的危险因素建立一个新的CRC预后模型及列线图, 并分别使用一致性指数、标准曲线和临床决策曲线(decision curve analyses, DCA)进行评价.
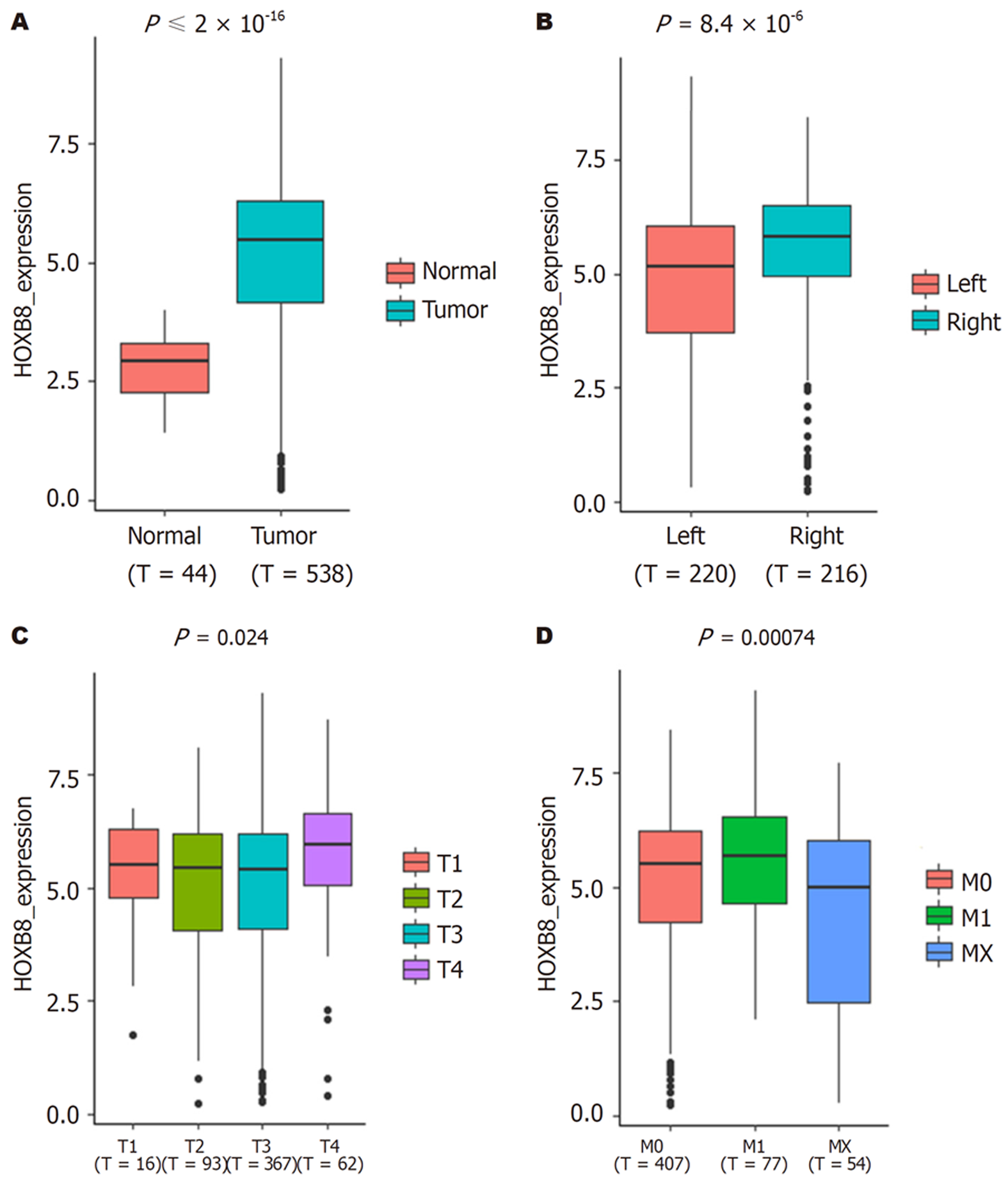
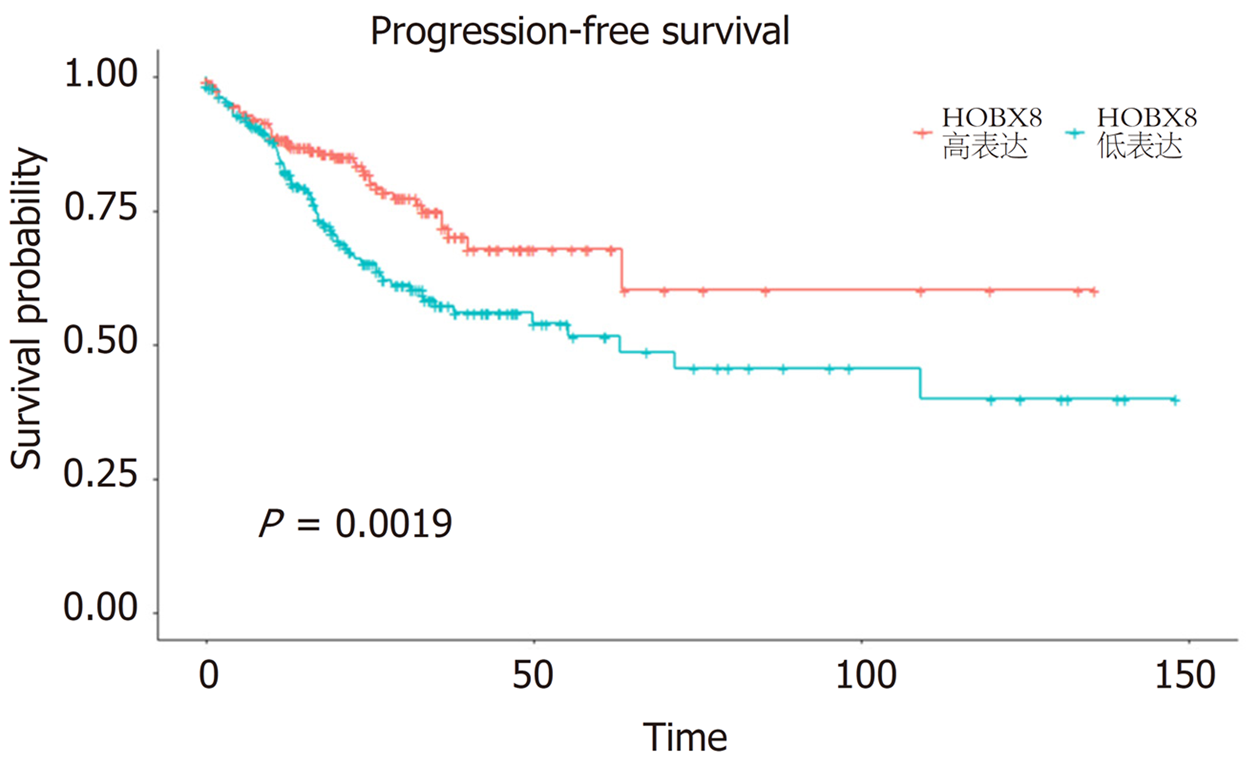
HOXB8的表达分析显示HOXB8在CRC肿瘤组织(P<0.001)、右半CRC (P<0.001)、T分期(P = 0.024)、M分期(P = 0.0074)中均存在不同程度的差异表达. 生存分析显示HOXB8的高表达与CRC患者更差的无进展生存期(progression-free survival, PFS)的相关(P = 0.0019). 单因素和多因素COX分析显示HOXB8的表达水平[HR: 1.539 (1.066-2.221), P = 0.021]、TNM分期(P<0.05)是影响CRC患者PFS的独立预后因素. 利用HOXB8和TNM分期总共4个因素建立了预测3年和5年患者PFS的列线图. 一致性指数结果为0.735, 提示区分度较好; 标准曲线和DCA的结果同样显示该列线图的预测能力和临床实用性较好.
HOXB8的表达与CRC患者预后密切相关, 对CRC患者的疾病进展和复发具有一定的预测能力. HOXB8可以作为一种潜在的生物标记物来识别高危CRC患者, 有希望成为CRC的新治疗靶点和预后监测指标.
核心提要: 本研究首先对HOXB8在结直肠癌中的表达进行分析, 发现其与结直肠癌的发生发展关系密切, 并基于HOXB8基因建立了结直肠癌的预后模型及列线图, 且验证的结果表明该模型及列线图有较好的预测价值.
引文著录: 池强伟, 赵畅, 李绍堂. 基于HOXB8基因的结直肠癌预后模型及列线图的建立与验证. 世界华人消化杂志 2020; 28(22): 1128-1136
Revised: September 18, 2020
Accepted: October 16, 2020
Published online: November 28, 2020
At present, colorectal cancer (CRC) is still associated with a high rate of recurrence and distant metastasis with a poor prognosis. HOXB8 gene is related to the tumorigenesis and development in CRC.
To explore the prognostic value of HOXB8 gene in CRC patients, and provide a novel insight into the monitoring of disease progression and cancer recurrence in patients with high-risk CRC.
The mRNA sequencing data of HOXB8 in CRC patients was downloaded from The Cancer Genome Atlas database. Then, we analyzed the relationship between HOXB8 expression and clinicopathologic features in CRC, and performed survival analysis based on HOXB8 expression. Univariate and multivariate Cox regression analyese were performed for identifying prognostic factors for CRC, and then a nomogram was established and evaluated by concordance index, calibration curve, and decision curve analysis (DCA).
HOXB8 mRNA expression was significantly correlated with CRC tumor tissue (P < 0.001), right-side CRC (P < 0.001), T stage (P = 0.024), and M stage (P = 0.0074). Survival analysis showed that overexpression of HOXB8 was associated with a poor progression-free survival (PFS) in CRC patients (P = 0.0019). Univariate and multivariate COX analyses suggested that the expression level of HOXB8 [HR: 1.539 (1.066-2.221), P = 0.021] and TNM stage were independent prognostic factors for PFS of CRC patients. A nomogram was established to predict 3- and 5-year PFS of CRC patients based on four factors including HOXB8 expression and TNM stage. The concordance index was 0.735, suggesting good discrimination; the calibration curve and DCA showed that the nomogram had good predictive power and clinical practicability.
The expression of HOXB8 is significantly related to the prognosis of CRC patients, and it has appreciated predictive ability for disease progression and cancer recurrence in CRC patients. HOXB8 could act as a potential biomarker to identify high-risk CRC patients and become a novel therapeutic target and prognostic indicator for CRC.
- Citation: Chi QW, Zhao C, Li ST. Development and validation of a HOXB8 gene-based prognostic model and nomogram for colorectal cancer patients. Shijie Huaren Xiaohua Zazhi 2020; 28(22): 1128-1136
- URL: https://www.wjgnet.com/1009-3079/full/v28/i22/1128.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v28.i22.1128
结直肠癌(colorectal cancer, CRC)是世界范围内最常见的消化道恶性肿瘤之一, 其发病率及病死率仍居高不下, 每年有接近140万人的新发确诊病例和70万人的死亡病例[1]. 尽管近年来多种抗癌策略的发展改善了CRC的治疗效果, 但仍有很高比例的患者最终出现局部复发或远处转移, 预后非常差[2,3]. 目前, 有一些血清标记物已广泛用于CRC的预后监测, 如癌胚抗原、糖类抗原等, 但其对CRC的预后价值仍不理想[4-6]. 因此, 鉴定一个敏感的分子标志物来早期发现预后较差的CRC患者对CRC的治疗和预后监测具有重要意义.
Homeobox B8 (HOXB8)基因属于Homeobox基因家族的成员之一, 位于17号染色体, 其编码的蛋白质是一种参与胚胎发育的序列特异性转录因子[7]. 据报道, HOXB8在CRC细胞中表达显著上调[8], 并且这种情况在CRC发展的各个阶段都有出现[9]. 然而, 目前还没有证据表明HOXB8可以作为一个敏感的生物标记物来预测CRC患者的预后.
本研究基于肿瘤基因组图谱(the cancer genome atlas, TCGA)数据库, 收集和分析了CRC患者的HOXB8的mRNA表达信息和相关临床预后资料, 探索HOXB8与CRC临床病理特征及预后的关系, 建立了具有良好预后判断价值的列线图, 为CRC的研究开拓新的思路.
数据来源和处理: 从TCGA数据库(http://portal.gdc.cancer.gov)下载临床和生存资料完善的RNA测序数据, 包括538个CRC患者样本和44个正常组织样本[10]. 使用R软件(R version 3.6.0)读入下载的mRNA数据, 并将每个mRNA的readcounts值转化成TPM值以便后续进行表达水平比较, 接着对探针进行基因名称注释, 最终提取HOXB8的mRNA的表达量和相应临床数据. 对HOXB8在CRC患者中的表达进行统计分析, 并初步评估HOXB8与CRC患者的预后关系. 此外, 以HOXB8的中位表达量为分组依据将538个CRC样本分为HOXB8高表达组和低表达组, 收集并统计其临床基线资料.
单因素和多因素COX回归分析: 首先, 我们使用Cox回归模型对CRC患者的相关临床病理因素进行单因素生存分析, 包括诊断时的年龄(>65岁, ≤65岁)、性别、肿瘤位置、HOXB8表达水平、是否接受放疗、TNM分期(AJCC标准), 生存时间包括总生存期(overall survival, OS)和无进展生存期(progression-free survival, PFS). 接着, 将单因素COX分析中有统计学意义的变量纳入多因素COX分析筛选预后相关的风险因素.
基于上述建立的多因素COX分析模型, 我们使用R软件的survival包和rms (Regression Modeling Strategies)包将预后相关的风险因素可视化建立列线图. 接着我们使用一致性指数(concordance index, C指数)、标准曲线[11]和临床决策曲线(decision curve analyses, DCA)[12]来评价列线图的区分度、准确性和临床实用性.
统计学处理 所有的统计分析均在R 3.6.0软件中完成, 包括HOXB8表达比较、生存分析、单因素和多因素的COX分析、列线图构建、一致性指数的计算、标准曲线和DCA的绘制. HOXB8的mRNA表达量使用log2(TPM+1)表示, 两组组间比较采用Wilcoxon检验. 临床基线特征的组间差异采用卡方检验. HOXB8的生存分析采用Kaplan-Meier法和Log-rank检验进行分析. P<0.05认为有统计学差异.
我们一共统计了538例患者资料, 其临床特征资料收入表1. 统计分析显示HOXB8高表达与CRC的肿瘤位置(P<0.001)、T分期(P = 0.050)相关(表1). HOXB8的表达分析显示HOXB8在CRC肿瘤组织(P<0.001)、右半CRC (P<0.001)、晚期T分期(P = 0.024)、M1分期(P = 0.0074)中均存在不同程度的表达上调(图1). 如图2所示, 生存分析显示HOXB8的高表达与CRC患者更差的PFS的相关(P = 0.0019).
| 所有病人(n = 538) | HOXB8表达水平 | χ2值 | P值 | ||
| 高表达(n = 269) | 低表达(n = 269) | ||||
| 性别 | 0.268 | 0.604 | |||
| 男 | 287 | 147 | 140 | ||
| 女 | 251 | 122 | 129 | ||
| 年龄 | 0.03 | 0.862 | |||
| ≤ 65岁 | 235 | 116 | 119 | ||
| > 65 岁 | 303 | 153 | 150 | ||
| 肿瘤位置 | 22.676 | < 0.001 | |||
| 左半 | 220 | 93 | 127 | ||
| 右半 | 216 | 135 | 81 | ||
| 未知 | 102 | 41 | 61 | ||
| 放射治疗 | 0 | 1 | |||
| 有 | 267 | 134 | 133 | ||
| 无 | 271 | 135 | 136 | ||
| AJCC T | 7.782 | 0.05 | |||
| T1 | 16 | 9 | 7 | ||
| T2 | 93 | 45 | 48 | ||
| T3 | 367 | 174 | 193 | ||
| T4 | 62 | 41 | 21 | ||
| AJCC N | 1.865 | 0.393 | |||
| N0 | 317 | 152 | 165 | ||
| N1 | 128 | 65 | 63 | ||
| N2 | 93 | 52 | 41 | ||
| AJCC M | 4.743 | 0.093 | |||
| M0 | 407 | 206 | 201 | ||
| M1 | 77 | 43 | 34 | ||
| Mx | 54 | 20 | 34 | ||
| AJCC stage | 2.454 | 0.483 | |||
| Ⅰ | 94 | 48 | 46 | ||
| Ⅱ | 214 | 99 | 115 | ||
| Ⅲ | 153 | 79 | 74 | ||
| Ⅳ | 77 | 43 | 34 | ||
在单因素分析中, 年龄[HR: 2.214 (1.449-3.381), P<0.001]、T分期(P<0.001)、N分期(P<0.001)、M分期(P<0.001)、总分期(P<0.001)与CRC患者的OS相关; 而HOBX8的高表达[HR: 1.742 (1.222-2.482), P = 0.002]、T分期(P<0.001)、N分期(P<0.001)、M分期(P<0.001)、总分期(P<0.001)则与PFS相关(表2). 接着我们将单因素分析中有统计学意义的变量如年龄、T、N、M分期纳入OS的多因素COX分析, 同时把HOBX8表达水平、T、N、M阶段纳入PFS的多因素COX分析(为避免多重共线性, 均没有将总分期与TNM共同纳入多因素分析). 在多因素分析中, 年龄[HR: 2.508 (1.628-3.864), P<0.001]、T阶段(P = 0.016)、N阶段(P<0.001)、M阶段(P<0.001)与CRC患者的OS相关; 而HOBX8的高表达[HR: 1.539 (1.066-2.221), P = 0.021]、T阶段(P = 0.016)、N阶段(P = 0.004)、M阶段(P<0.001)则与CRC患者的PFS相关(表3).
| OS | PFS | |||
| HR (95%CI) | P值 | HR (95%CI) | P值 | |
| 性别 | 1.016 (0.699-1.478) | 0.932 | 1.172 ( 0.828-1.656) | 0.37 |
| 年龄 | 2.214 (1.449-3.381) | <0.001 | 1.068 (0.754-1.512) | 0.711 |
| 肿瘤位置 | 0.157 | 0.98 | ||
| 左半 | Ref. | Ref. | ||
| 右半 | 1.487 (0.986-2.241) | 0.058 | 1.033 (0.709-1.506) | 0.862 |
| 未知 | 1.147 (0.646-2.033) | 0.639 | 0.994 (0.607-1.626) | 0.981 |
| 放射治疗 | 1.340 (0.919-1.953) | 0.128 | 0.909 (0.644-1.283) | 0.59 |
| HOXB8表达水平 | 1.148 (0.788-1.673) | 0.472 | 1.742 (1.222-2.482) | 0.002 |
| AJCC T stage | <0.001 | <0.001 | ||
| T1 | Ref. | Ref. | ||
| T2 | 0.924 (0.195-4.367) | 0.92 | 0.864 (0.186-4.008) | 0.852 |
| T3 | 1.769 (0.434-7.211) | 0.425 | 2.342 (0.576-9.512) | 0.233 |
| T4 | 5.622 (1.326-23.842) | 0.019 | 6.738 (1.600-28.380) | 0.009 |
| AJCC N stage | <0.001 | <0.001 | ||
| N0 | Ref. | Ref. | ||
| N1 | 1.717 (1.070-2.757) | 0.025 | 1.680 (1.099-2.569) | 0.016 |
| N2 | 4.005 (2.593-6.185) | <0.001 | 4.082 (2.716-6.135) | <0.001 |
| AJCC M stage | <0.001 | <0.001 | ||
| M0 | Ref. | Ref. | ||
| M1 | 3.904 (2.569-5.932) | <0.001 | 4.681 (3.187-6.875) | <0.001 |
| Mx | 1.716 (0.921-3.197) | 0.088 | 1.207 (0.656-2.217) | 0.545 |
| AJCC stage | <0.001 | <0.001 | ||
| Ⅰ | Ref. | Ref. | ||
| Ⅱ | 1.883 (0.784-4.519) | 0.156 | 2.241 (1.051-4.776) | 0.036 |
| Ⅲ | 3.450 (1.455-8.180) | 0.004 | 3.370 (1.577-7.203) | 0.001 |
| Ⅳ | 8.064 (3.390-19.183) | <0.001 | 10.66 (4.990-22.779) | <0.001 |
| OS | PFS | |||
| HR (95%CI) | P值 | HR (95%CI) | P值 | |
| 年龄 | 2.508 (1.628-3.864) | <0.001 | - | - |
| HOXB8表达水平 | 0.974 (0.655-1.446) | 0.894 | 1.539 (1.066-2.221) | 0.021 |
| AJCC T stage | 0.009 | 0.016 | ||
| T1 | Reference | Reference | ||
| T2 | 0.561 (0.117-2.692) | 0.47 | 0.845 (0.182-3.922) | 0.829 |
| T3 | 0.784 (0.186-3.312) | 0.741 | 1.694 (0.410-6.987) | 0.466 |
| T4 | 1.766 (0.393-7.931) | 0.458 | 2.906 (0.664-12.714) | 0.156 |
| AJCC N stage | 0.002 | 0.004 | ||
| N0 | Reference | Reference | ||
| N1 | 1.382 (0.818-2.335) | 0.227 | 1.055 (0.662-1.681) | 0.82 |
| N2 | 2.508 (1.492-4.216) | 0.001 | 2.054 (1.275-3.307) | 0.003 |
| AJCC M stage | 0.005 | <0.001 | ||
| M0 | Reference | Reference | ||
| M1 | 2.289 (1.382-3.789) | 0.001 | 2.986 (1.888-4.721) | <0.001 |
| Mx | 1.619 (0.855-3.066) | 0.139 | 1.220 (0.658-2.259) | 0.527 |
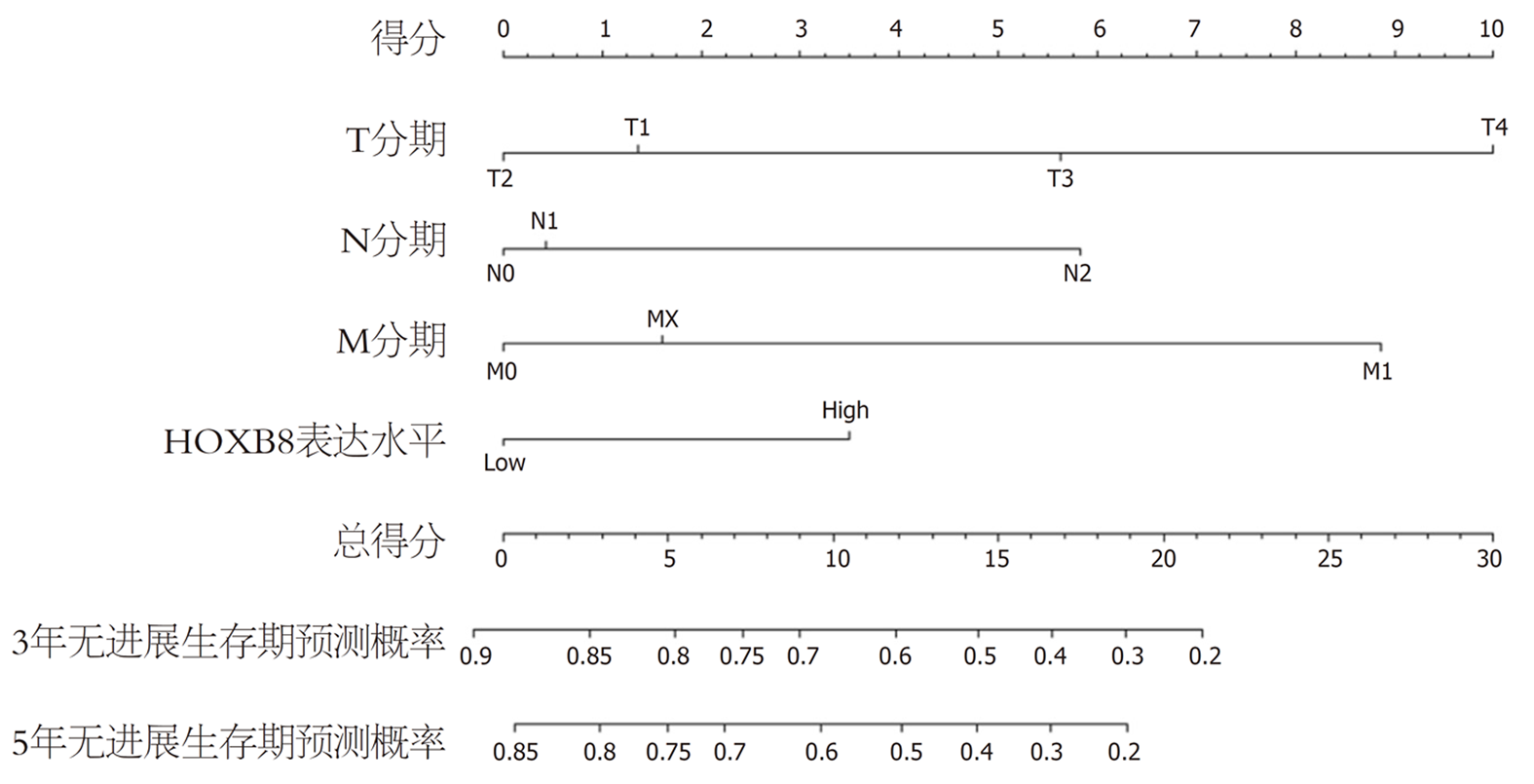
经过单因素和多因素COX分析, 我们发现HOXB8的表达水平及TNM分期与CRC的PFS相关. 为了更好的预测CRC患者的预后情况, 我们通过rms包和survival包将上述多因素COX模型可视化建立了列线图(图3).
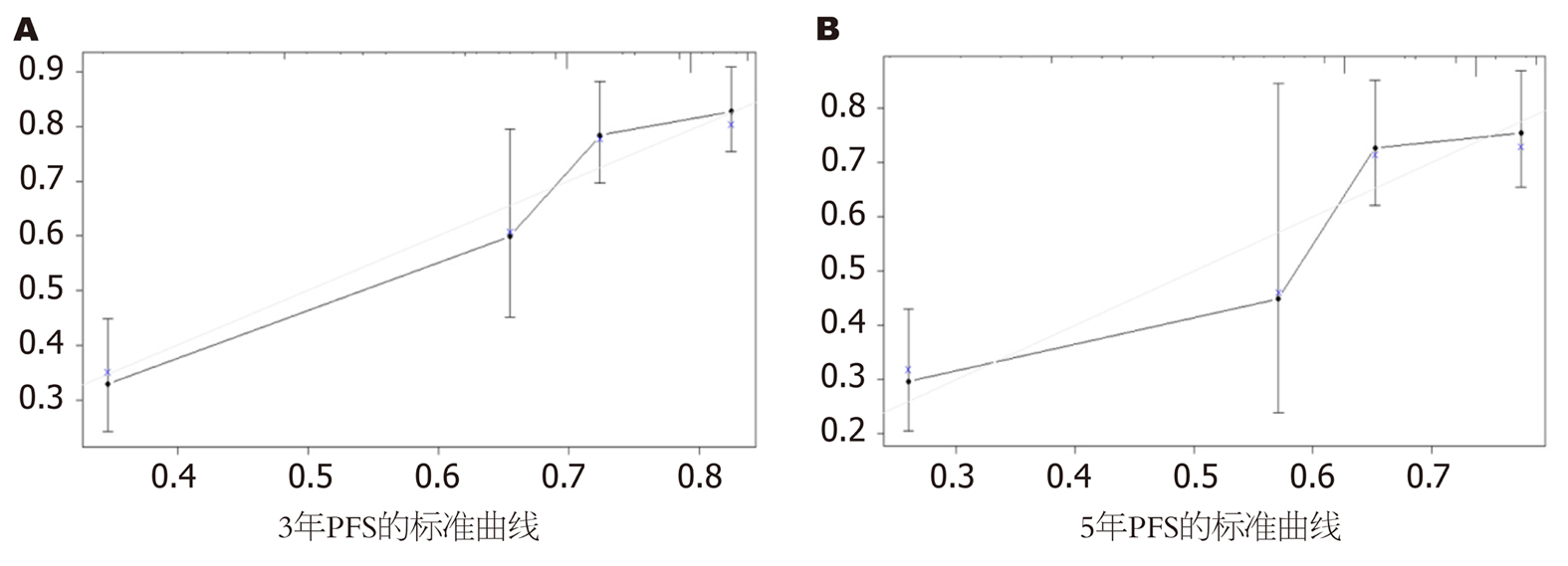
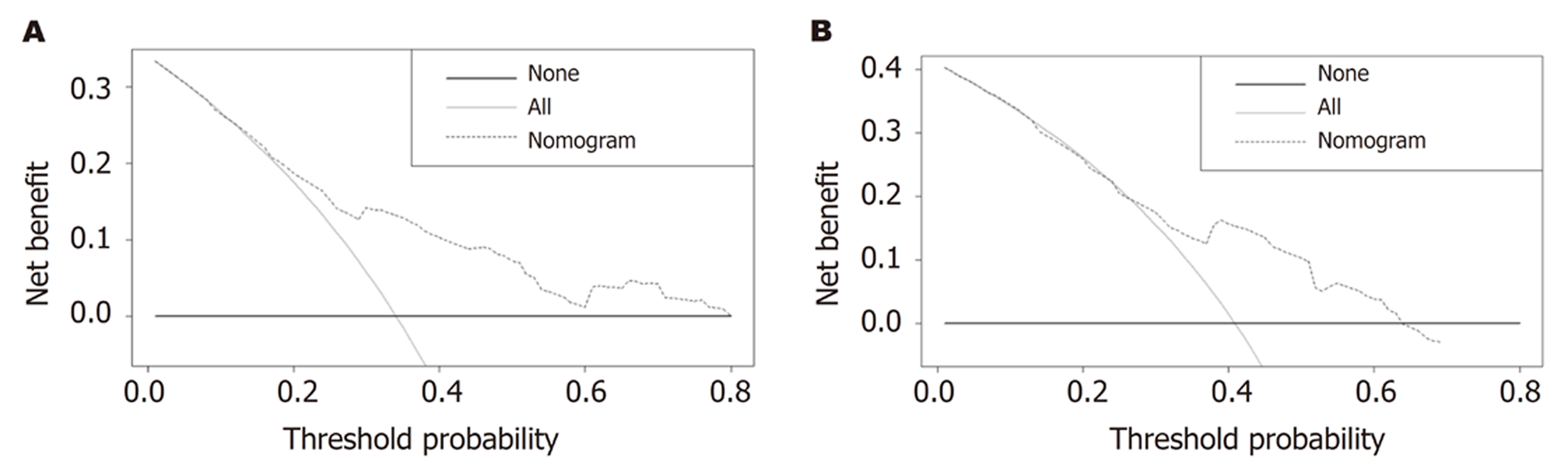
为了评估所建立的列线图的价值, 我们计算和构建了C指数、标准曲线和DCA. 该列线图C指数的计算结果为0.735, 大于0.7提示该列线图的区分度较好. 标准曲线的结果显示列线图在估计3年和5年PFS预测值与实际观测值之间展现了较好的可接受的一致性(图4), 提示该列线图的准确度较好. 另外, DCA分析显示列线图预测3年和5年PFS在较广的阈值概率范围内均表现出良好的净效益, 说明该列线图的临床实用性和可靠性较好(图5).
HOX基因是一段长度约183 bp的核苷酸序列, 编码高度保守的61个氨基酸的同源结构域. 目前, 已鉴定出39种人类HOX基因, 将其分为HOXA, HOXB, HOXC, HOXD四个簇, 分别位于7p15、17p21、12q13和2q31染色体上[13,14]. HOXB8是Hox基因家族的一员. 近年来越来越多的证据表明HOXB8在人类癌症中表达失调, 与多种恶性肿瘤的发生、发展和转移密切相关, 包括胃癌, 结肠直肠癌和卵巢浆液性癌等[15-17]. 在CRC中HOXB8能通过激活STAT3诱导上皮细胞-间充质转化(epithelial- mesenchymal transition, EMT), 进而参与CRC细胞的发生, 发展和进展[17]. 同时, 也有研究发现HOXB8的过表达与CRC细胞化疗耐药也存在密切相关[18]. Shen等[19]的实验证明miR-196通过上调HOXB8的表达使CRC患者对术前新辅助化疗FOLFOX4方案的治疗反应变差, 从而影响患者预后. Lu等[20]的研究中利用HOXB8等7个基因建立了预测肝转移的CRC患者对FOLFOX4化疗方案治疗敏感性的预测模型, 并且表现出很好的预测能力. 以上发现提示HOXB8有希望成为一个潜在的生物标记物, 用于CRC治疗反应检测和预后评估.
TCGA是一个具有里程碑意义的癌症基因组学计划, 收集了33种不同癌症类型、11000多个人类肿瘤样本的临床病理数据以及多平台分子图谱, 其对于癌症的研究有着不可估量的价值[10]. 本研究基于TCGA数据库, 获得HOXB8的mRNA的表达量数据和相应临床数据并进行统计分析, 探索HOXB8在CRC种表达和预后判断价值.
本研究首先比较了HOXB8在CRC中的mRNA表达水平, 评估其表达与CRC相关临床特征间的关系. 我们发现HOXB8在CRC肿瘤组织中显著高表达, 同时还与T分期和M分期之间存在密切相关. 林飞燕等[21]通过细胞实验证明高表达的HoxB8基因能够促进CRC细胞的增殖和克隆形成能力, 同时HoxB8能够增强CRC细胞的迁移能力. 这与本研究结果相一致, 都提示了HOXB8在肿瘤发生发展、局部浸润和远处转移中起重要作用. 其次, 我们还发现HOXB8在不同肿瘤位置的CRC中也有差异表达. 以往的研究已经证明左半和右半CRC之间在病理类型、临床表现、预后与化疗耐药等方面均存在显著不同[22-24]. 然而, 其潜在的分子机制还不甚清楚. 对HOXB8深入探索或许能为研究左右半结肠癌提供新的思路. 另外, HOXB8的生存分析也表明其表达与CRC患者的PFS密切相关. 因此, 我们推断HOXB8可能在CRC的发生发展中起到了关键作用, 导致结果截然不同的化疗耐药和预后.
其次, 为了评估HOXB8在CRC中的预后价值, 我们进行了单因素和多因素COX分析, 发现HOXB8的表达水平、TNM分期是CRC患者独立预后因素. 为了更好的预测CRC患者的PFS, 我们依据上述的预后因素将COX模型可视化后建立了列线图, 并全面地对其进行评价, 结果发现HOXB8在预测CRC患者3年和5的PFS中表现良好. 这些结果进一步证明了HOXB8在CRC中预后价值.
综上所述, HOXB8的表达与CRC患者预后密切相关, 对CRC患者的疾病进展和复发具有一定的预测能力. HOXB8可以作为一种潜在的生物标记物来识别高危CRC患者, 有希望成为CRC的新治疗靶点和预后监测指标. 同时, 还需要进行更深入的分子基础研究和随机化临床试验, 来揭示HOXB8与CRC患者的预后之间的作用机制及HOXB8在CRC中的临床应用.
结直肠癌(colorectal cancer, CRC)是常见的消化道恶性肿瘤, 目前CRC患者仍有很高比例的复发和远处转移, 严重影响预后. 同时, HOXB8与CRC发生发展相关.
基于CRC的转移和复发居高不下, 本研究旨在探讨HOXB8基因在CRC患者预后中的判断价值, 为监测高危CRC的疾病进展和复发提供思路.
本研究希望了解HOXB8基因的表达与CRC患者相关病理特征及预后的联系, 并利用HOXB8建立一个全新的及有价值的CRC预后模型.
通过分析肿瘤基因组图谱数据库中的HOXB8表达数据与CRC临床病理因素及生存预后之间的关系, 然后基于HOXB8建立一个新的CRC预后模型及列线图, 并对其进行全面科学的验证和评价.
HOXB8主要在CRC肿瘤组织、右半CRC及较晚的临床分期中呈现高表达. 生存分析显示HOXB8的高表达与CRC患者更差的无进展生存期的相关. 基于HOXB8建立的CRC预后模型及列线图具有良好的预测价值.
HOXB8的表达与CRC患者预后密切相关, 对CRC患者的疾病进展和复发具有一定的预测能力.
HOXB8可以作为一种潜在的生物标记物来识别高危CRC患者, 有希望成为CRC的新治疗靶点和预后监测指标.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C
D级 (一般): 0
E级 (差): 0
科学编辑: 刘继红 制作编辑:张砚梁
| 1. | Ferlay J, Soerjomataram I, Dikshit R, Eser S, Mathers C, Rebelo M, Parkin DM, Forman D, Bray F. Cancer incidence and mortality worldwide: sources, methods and major patterns in GLOBOCAN 2012. Int J Cancer. 2015;136:E359-E386. [PubMed] [DOI] |
| 2. | Chua YJ, Zalcberg JR. Progress and challenges in the adjuvant treatment of stage II and III colon cancers. Expert Rev Anticancer Ther. 2008;8:595-604. [PubMed] [DOI] |
| 3. | Miller KD, Siegel RL, Lin CC, Mariotto AB, Kramer JL, Rowland JH, Stein KD, Alteri R, Jemal A. Cancer treatment and survivorship statistics, 2016. CA Cancer J Clin. 2016;66:271-289. [PubMed] [DOI] |
| 4. | Zhong W, Yu Z, Zhan J, Yu T, Lin Y, Xia ZS, Yuan YH, Chen QK. Association of serum levels of CEA, CA199, CA125, CYFRA21-1 and CA72-4 and disease characteristics in colorectal cancer. Pathol Oncol Res. 2015;21:83-95. [PubMed] [DOI] |
| 5. | Duffy MJ, Lamerz R, Haglund C, Nicolini A, Kalousová M, Holubec L, Sturgeon C. Tumor markers in colorectal cancer, gastric cancer and gastrointestinal stromal cancers: European group on tumor markers 2014 guidelines update. Int J Cancer. 2014;134:2513-2522. [PubMed] [DOI] |
| 6. | Shibutani M, Maeda K, Nagahara H, Ohtani H, Sakurai K, Toyokawa T, Kubo N, Tanaka H, Muguruma K, Ohira M, Hirakawa K. Significance of CEA and CA19-9 combination as a prognostic indicator and for recurrence monitoring in patients with stage II colorectal cancer. Anticancer Res. 2014;34:3753-3758. [PubMed] |
| 7. | Yue Y, Farcas R, Thiel G, Bommer C, Grossmann B, Galetzka D, Kelbova C, Küpferling P, Daser A, Zechner U, Haaf T. De novo t(12;17)(p13.3;q21.3) translocation with a breakpoint near the 5' end of the HOXB gene cluster in a patient with developmental delay and skeletal malformations. Eur J Hum Genet. 2007;15:570-577. [PubMed] [DOI] |
| 8. | Vider BZ, Zimber A, Hirsch D, Estlein D, Chastre E, Prevot S, Gespach C, Yaniv A, Gazit A. Human colorectal carcinogenesis is associated with deregulation of homeobox gene expression. Biochem Biophys Res Commun. 1997;232:742-748. [PubMed] [DOI] |
| 9. | Vider BZ, Zimber A, Chastre E, Gespach C, Halperin M, Mashiah P, Yaniv A, Gazit A. Deregulated expression of homeobox-containing genes, HOXB6, B8, C8, C9, and Cdx-1, in human colon cancer cell lines. Biochem Biophys Res Commun. 2000;272:513-518. [PubMed] [DOI] |
| 10. | Liu J, Lichtenberg T, Hoadley KA, Poisson LM, Lazar AJ, Cherniack AD, Kovatich AJ, Benz CC, Levine DA, Lee AV, Omberg L, Wolf DM, Shriver CD, Thorsson V; Cancer Genome Atlas Research Network, Hu H. An Integrated TCGA Pan-Cancer Clinical Data Resource to Drive High-Quality Survival Outcome Analytics. Cell. 2018;173:400-416.e11. [PubMed] [DOI] |
| 11. | Van Calster B, McLernon DJ, van Smeden M, Wynants L, Steyerberg EW; Topic Group 'Evaluating diagnostic tests and prediction models' of the STRATOS initiative. Calibration: the Achilles heel of predictive analytics. BMC Med. 2019;17:230. [PubMed] [DOI] |
| 12. | Zhang Z, Rousson V, Lee WC, Ferdynus C, Chen M, Qian X, Guo Y; written on behalf of AME Big-Data Clinical Trial Collaborative Group. Decision curve analysis: a technical note. Ann Transl Med. 2018;6:308. [PubMed] [DOI] |
| 13. | Bhattacharjee A, Ghangal R, Garg R, Jain M. Genome-wide analysis of homeobox gene family in legumes: identification, gene duplication and expression profiling. PLoS One. 2015;10:e0119198. [PubMed] [DOI] |
| 14. | Haria D, Naora H. Homeobox Gene Deregulation: Impact on the Hallmarks of Cancer. Cancer Hallm. 2013;1:67-76. [PubMed] [DOI] |
| 15. | Stavnes HT, Holth A, Don T, Kærn J, Vaksman O, Reich R, Trope' CG, Davidson B. HOXB8 expression in ovarian serous carcinoma effusions is associated with shorter survival. Gynecol Oncol. 2013;129:358-363. [PubMed] [DOI] |
| 16. | Ding WJ, Zhou M, Chen MM, Qu CY. HOXB8 promotes tumor metastasis and the epithelial-mesenchymal transition via ZEB2 targets in gastric cancer. J Cancer Res Clin Oncol. 2017;143:385-397. [PubMed] [DOI] |
| 17. | Wang T, Lin F, Sun X, Jiang L, Mao R, Zhou S, Shang W, Bi R, Lu F, Li S. HOXB8 enhances the proliferation and metastasis of colorectal cancer cells by promoting EMT via STAT3 activation. Cancer Cell Int. 2019;19:3. [PubMed] [DOI] |
| 19. | Shen S, Pan J, Lu X, Chi P. Role of miR-196 and its target gene HoxB8 in the development and proliferation of human colorectal cancer and the impact of neoadjuvant chemotherapy with FOLFOX4 on their expression. Oncol Lett. 2016;12:4041-4047. [PubMed] [DOI] |
| 20. | Lu X, Pan J, Li S, Shen S, Chi P, Lin H, Huang Y, Xu Z, Huang S. Establishment of a predictive genetic model for estimating chemotherapy sensitivity of colorectal cancer with synchronous liver metastasis. Cancer Biother Radiopharm. 2013;28:552-558. [PubMed] [DOI] |
| 22. | Mukund K, Syulyukina N, Ramamoorthy S, Subramaniam S. Right and left-sided colon cancers - specificity of molecular mechanisms in tumorigenesis and progression. BMC Cancer. 2020;20:317. [PubMed] [DOI] |
| 23. | Nawa T, Kato J, Kawamoto H, Okada H, Yamamoto H, Kohno H, Endo H, Shiratori Y. Differences between right- and left-sided colon cancer in patient characteristics, cancer morphology and histology. J Gastroenterol Hepatol. 2008;23:418-423. [PubMed] [DOI] |
| 24. | Gao P, Song YX, Xu YY, Sun Z, Sun JX, Xu HM, Wang ZN. Does the prognosis of colorectal mucinous carcinoma depend upon the primary tumour site? Results from two independent databases. Histopathology. 2013;63:603-615. [PubMed] [DOI] |