修回日期: 2020-06-19
接受日期: 2020-06-24
在线出版日期: 2020-07-28
延长进展期肝癌生存时间是目前临床上一大难点. 索拉菲尼(Sorfenib, Sor)是目前唯一用于治疗进展期肝癌的靶向药物, 但其耐药成为一个问题. 本研究拟通过实验研究二甲双胍(Metformin, Met)增强Sor的疗效, 为进展期肝癌的治疗提供参考.
探讨Met增强Sor诱导人肝癌HepG2细胞凋亡及潜在分子机制.
MTT法检测Met、Sor及二者联合对人肝癌HepG2细胞的增殖抑制作用,流式细胞仪测定各组的凋亡率; Western blot检测各组表达Caspase-3、Bax、AMPK、P53及mTORC1水平.
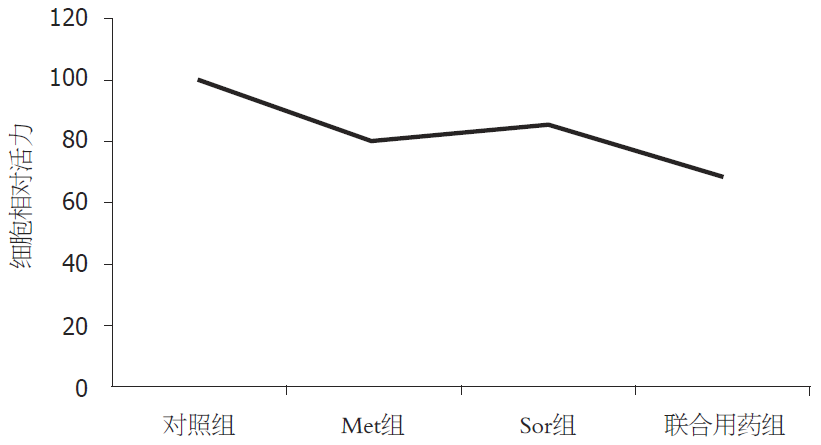
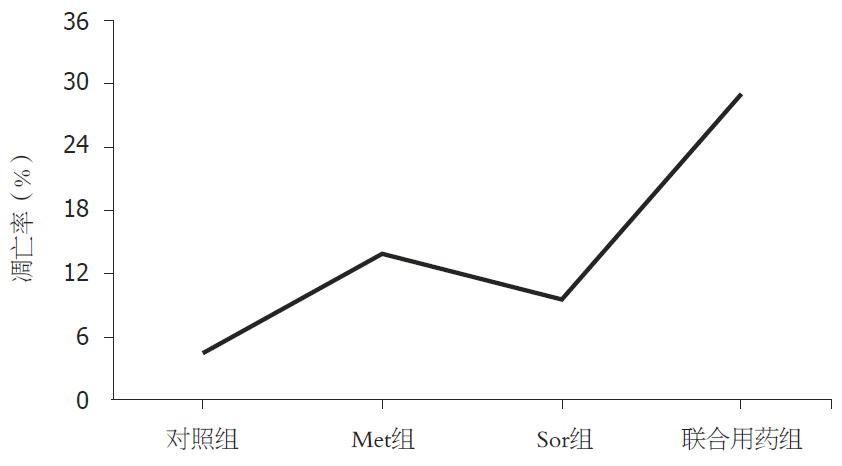
MTT结果显示Met和Sor联合对HepG2细胞的增殖抑制作用强于单药组、对照组、Met组、Sor组、联合用药组的细胞相对活力分别为100%、79.96%±4.41%、85.33%±1.00%、68.60%±4.02%, 差别有统计学意义(P<0.05); 流式细胞分析结果显示Met和Sor联合对HepG2细胞的凋亡诱导作用强于单药组、对照组、Met组、Sor组、联合用药组的凋亡率分别为4.47%±1.93%、13.73%±1.18%、9.50%±0.20%、29.03%±0.35%, 差别有统计学意义(P<0.05); Western blot显示, 与对照组及单药组相比, 联合用药组Caspase-3、Bax、AMPK、P53的表达增加, 而mTORC1的表达减少.
Met可增强Sor诱导人肝癌HepG2细胞凋亡.
核心提要: 索拉菲尼是唯一推荐于治疗晚期肝癌的靶向药物, 但耐药是一个恼人的问题! 二甲双胍近年来广泛被报道可以抑制肿瘤增殖、诱导凋亡, 且在临床上可以改善肿瘤病人的预后. 本文就是通过二者的联合作用, 观察其联合对HepG2细胞凋亡的影响及分子机制.
引文著录: 叶艳清, 曾斌, 廖跃光, 刘茂生, 华宗荣. 二甲双胍增强索拉菲尼诱导HepG2细胞凋亡的分子机制. 世界华人消化杂志 2020; 28(14): 581-586
Revised: June 19, 2020
Accepted: June 24, 2020
Published online: July 28, 2020
Prolonging the survival time of patients with advanced liver cancer is a major clinical challenge. Sorafenib (Sor) is the only targeted drug for the treatment of advanced liver cancer, but drug resistance has become a problem.
To explore the effect and molecular mechanism of metformin (Met) in enhancing pro-apoptotic effect of Sor in HepG2 cells.
MTT assay was used to evaluate the anti-proliferation effects of Met and Sor, alone or in combination. Flow cytometry was employed to analyze cell cycle and cell apoptosis. The expression of Caspase-3, Bax, AMPK, P53, and mTORC1 was evaluated by Western blot.
MTT assay showed that both Met and Sor decreased HepG2 cells viability, and Met combined with Sor had a synergistic inhibitory effect. The relative cell viability rates of the control group, Met group, Sor group, and combination group were 100%, 79.96% ± 4.41%, 85.33% ± 1.00%, and 68.60% ± 4.02%, respectively. Flow cytometry showed that both Met and Sor induced HepG2 cell apoptosis, and Met combined with Sor had a synergistic effect. The apoptosis rates of the control group, Met group, Sor group, and combination group were 4.47% ± 1.93%, 13.73% ± 1.18%, 9.50% ± 0.20%, and 29.03% ± 0.35%, respectively. Western blot analysis showed that both Met and Sor increased the expression of Caspase-3, Bax, P53, and AMPK and decreased the expression of mTORC1.
Met can enhance the pro-apoptotic effect of Sor in HepG2 cells.
- Citation: Ye YQ, Zeng B, Liao YG, Liu MS, Hua ZR. Molecular mechanism for metformin to enhance pro-apoptotic effect of sorafenib in HepG2 cells. Shijie Huaren Xiaohua Zazhi 2020; 28(14): 581-586
- URL: https://www.wjgnet.com/1009-3079/full/v28/i14/581.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v28.i14.581
肝细胞肝癌的发病率居恶性肿瘤第五位, 也是第三大恶性肿瘤相关性死亡中的死因[1]. 中国是乙型病毒性肝炎大国, 因此中国的肝癌占世界的一半以上. 尽管手术切除、介入消融、靶向治疗等治疗方法不断进步, 但大部分肝癌就诊时已处进展期, 因此目前肝癌的治疗仍不理想. 寻找新的进展期肝癌治疗方法, 对延长肝癌患者生存期意义重大. 索拉菲尼(Sorafenib, Sor)是一种新型口服多靶点抗肿瘤药物, 是目前唯一推荐用于治疗进展期肝癌的靶向药物, 且作用机制可能与促进肝癌细胞凋亡有关[2]. 然而, 随着Sor在临床的广泛应用, 其耐药问题又随之而来. 我们前期研究发现, 二甲双胍(Merformin, Met)可抑制HepG2细胞增殖和迁移[3]、诱导其凋亡及增加靶向药物的敏感性. 新近也有研究证实, Met与Sor通过AMPK途径联合抗肝恶性肿瘤, 但其下游分子却不清楚. 本研究就是进一步探讨Met增强Sor抑制肝癌增殖及促进凋亡的分子机制, 为肝癌的治疗提供理论依据.
Met、Sor(Amresco公司); MTT、PI(Sigma公司); DMSO(BBI公司); DMEM培养基(GIBCO 公司); 胎牛血清(Clark Bio公司); 小鼠抗人AMPK抗体、小鼠抗人Caspase-3抗体、兔抗人P53抗体、兔抗人Bax抗体、兔抗人mTORC1抗体、小鼠抗人β-actin抗体(Santa Cruz公司); 硝酸纤维素膜(Millipore公司); 生物素标记的山羊抗兔(二抗)购自Sigma公司; 生物素标记的山羊抗小鼠(二抗)购自公Sigma公司; Alexa Flour555标记的羊抗兔(荧光二抗)购自Invitrogen 公司; ABC (avidin2biotin complex)试剂盒购自美国Vector Laboratories公司; ECL化学发光试剂盒购自Pierce公司.
1.2.1 细胞培养: HepG2细胞培养于含10%胎牛血清的DMEM培养基(含青、链霉素各100 IU/L)中, 3 d传代一次, 用0.25%的胰酶和0.01%EDTA溶液消化后, 按一比三传代到25 cm2培养瓶中培养, 单层培养和孵化于培养箱中, 在37 ℃, 95%湿度和5%CO2的条件下进行培养, 24 h后进行各项预处理.
1.2.2 MTT法测定细胞相对活力: 细胞按每孔5×103个细胞在200 μL培养基中传代至96孔板中, 生长12 h后弃原培养基, 分别按对照组(无药物处理)、Sor组(3 μmol/L Sor)、Met处理组(5 mmol/L Met)、Met+Sor组(3 μmol/L Sor+10 mmol/L Met)进行预处理, 每孔设6个复孔, 并设调零孔; 24 h后每孔分别加入20 μLMTT (5 g/L), 继续孵育4 h后弃培养基, 加入150 μL DMSO, 避光剧烈振荡5 min后, 用酶标仪在492 nm处测吸光值. 相对细胞活力计算为加药处理组的吸光值与未加药正常组吸光值的比值.
1.2.3 细胞周期分析: 用流式细胞仪进行测定细胞周期, 分别按对照组、Sor组、Met处理组、Met+Sor组(具体浓度同MTT法)预处理后, 用0.25%的胰酶消化细胞后收集细胞. 加入300 μL的1×Binding Buffer悬浮细胞; 加入5 μL的Annexin V-FITC混匀后, 避光, 室温孵育15 min; 上机前5 min再加入5 μL的PI染色; 最后补加200 μL的1×Binding Buffer进行上机检测细胞凋亡率. 用WinMDI 2.9软件对结果进行分析.
1.2.4 免疫印迹法测定蛋白表达情况: 按前面分组进行预处理HepG2细胞24 h后,收集细胞后按试剂说明书提取细胞总蛋白, 采用Western蛋白印迹法检测Caspase-3、Bax、AMPK、P53及mTORC1表达情况. 具体来, 等量上样后用SDS-PAGE电泳, 转膜到NC膜上, 用5%脱脂牛奶室温封闭30 min, 然后分别与兔抗人Caspase-3 (1:1000)、兔抗人mTORC1 (1:1000)、兔抗人P53 (1:1000)、鼠抗人Bax (1:1000)、小鼠抗人AMPK (1:1000)在4 ℃过夜, 接着与二抗山羊抗兔(1:5000)、山羊抗鼠(1:3000)室温孵育60 min, 最后用ECL化学发光法暴光. 条带灰度用Quantity One软件进行分析.
统计学处理 所有的实验均重复3次, 采用SPSS 22.0统计学软件进行数据分析,各组数据均用mean±SD表示, 以P<0.05为差异有统计学意义.
从图1可以看出, 对照组、Met组、Sor组及联合组细胞相对活力分别为100%、79.96%±4.41%、85.33%±1.00%、68.60%±4.02%, 差别有统计学意义(P<0.05, 图1).
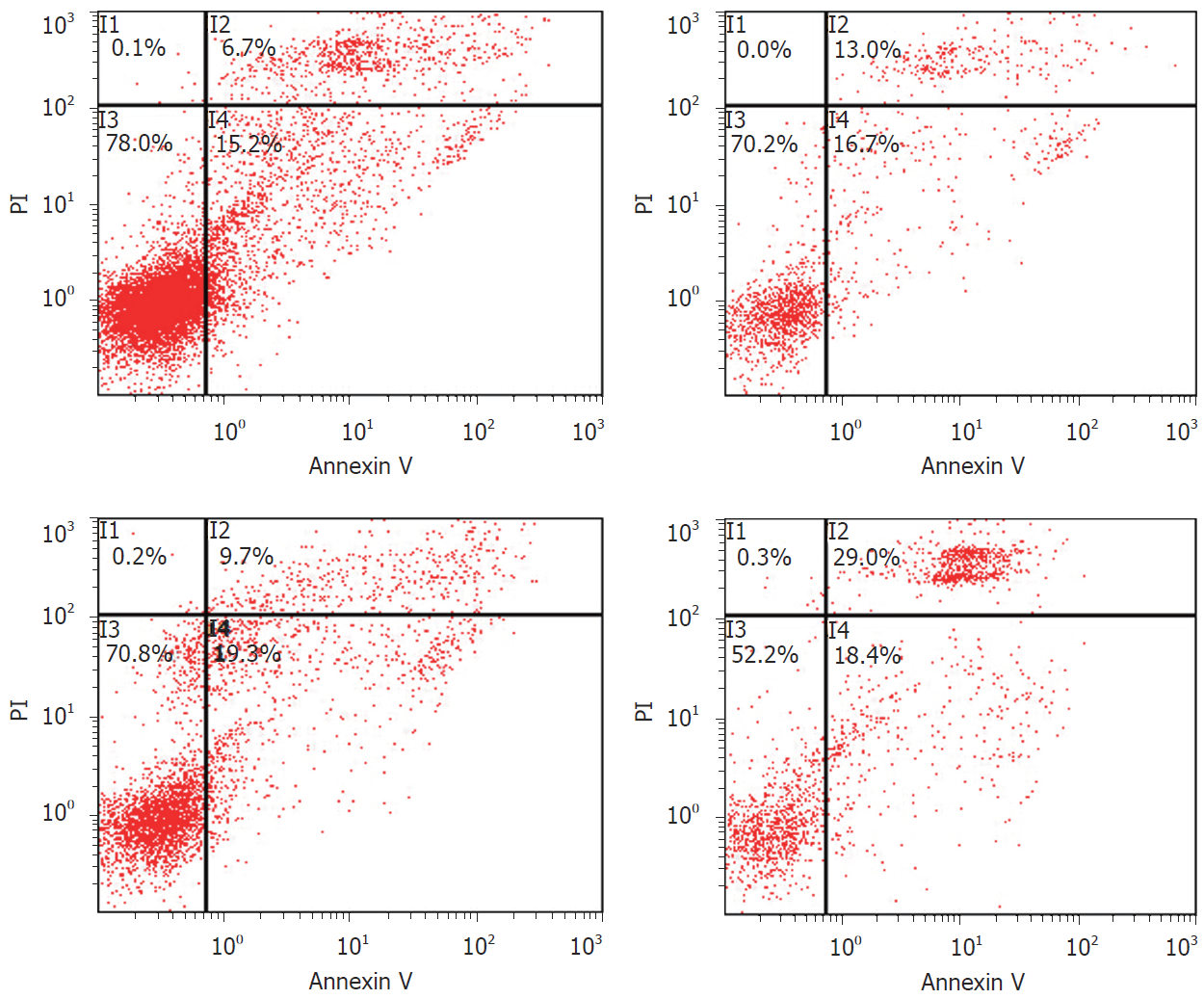
从图2及图3可以看出, 对照组、Met组、Sor组及联合组细胞经Annexin V-FITC/PI双染流式细胞仪检测细胞凋亡率明显增加, 其凋亡率分别为4.47%±1.93%、13.73%±1.18%、9.50%±0.20%、29.03%±0.35%, 差别有统计学意义(P<0.05, 图3).
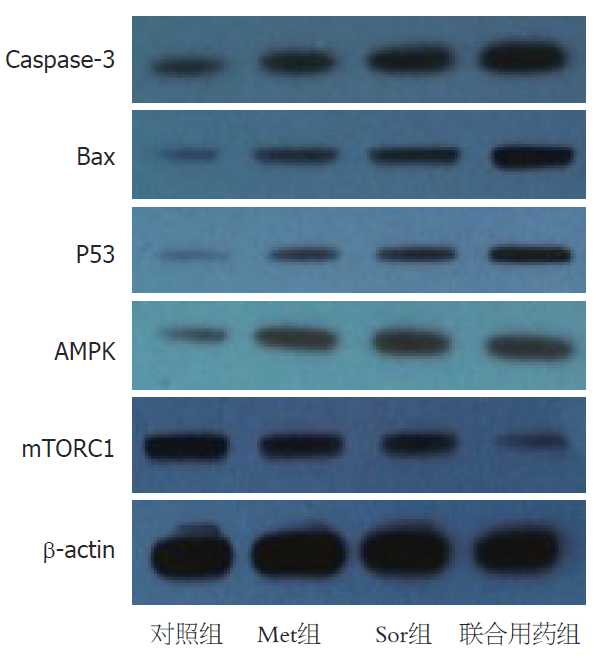
用Western blot检测对照组、Met、Sor及双药联合组HepG2细胞表达Caspase-3、Bax、AMPK、P53、mTORC1的变化, 图4可以看出, Met、Sor均可促进HepG2细胞表达Caspase-3、Bax、AMPK、P53, 且减少mTORC1的表达, 而二者联合则促进Caspase-3、Bax、AMPK、P53的表达和减少mTORC1的表达更加明显,差别有统计学意义(P<0.05).
Met是一种广泛用于治疗2型糖尿病的药物, 其有不导致低血糖发生、不增加体重等优点. 然而近年来, 大量流行病学与临床观察发现, 与不用Met的糖尿病患者比较, 用Met治疗的糖尿病患者发生肝癌[4]、胃癌[5]、乳腺癌[6]、前列腺癌[7]、肺癌[8]、胰腺癌[9]等恶性肿瘤风险降低, 还发现Met应用可减少多种恶性肿瘤死亡风险, 延长生存时间, 改善预后, 这引起了研究者的广泛关注[10]. 进一步的基础研究表明, Met可明显抑制多种恶性肿瘤细胞如肝癌、肺癌、卵巢癌[11]、结肠癌[12]等肿瘤细胞的增殖并促进凋亡, 但其具体机制却各不相同. 索拉非尼是是唯一推荐用于治疗进展期肝癌的靶向药物, 它可通过抑制AMPK通路上的RAF激酶诱导肝癌细胞凋亡. Chun等[13]发现, Met可提高肝癌对Sor的敏感性, 但机制却不明确.
在早期研究中我们发现, Met可明显抑制HepG2细胞的增殖, 可能与诱导凋亡有关, 且这个过程可能有VEGF的参与[3]. 本研究中, 我们首先通过MTT证实Met可以增强Sor对HepG2细胞的增殖抑制作用. 进一步通过流式细胞仪分析细胞周期还发现, 可增强Sor诱导HepG2细胞的凋亡, 且Western blot证实伴随凋亡相关蛋白Caspase-3、Bax、P53表达的增加, 以上结果表明Met可以增强Sor诱导人肝癌HepG2细胞凋亡, 与已报道的部分研究结果一致[14-16].
Met抗肿瘤机制有以下几个方面: (1)激活AMPK途径: AMPK是异三聚体的丝氨酸/苏氨酸蛋白激酶, 通过感受细胞内的能量变化起到相应的调节作用, 当细胞内AMP/ATP比率增高时AMPK途径被激活[17]; (2)促进细胞周期停滞: 细胞周期分为DNA复制前的G1期、DNA合成期(S期)、DNA复制后的G2期及有丝分裂期(M期)4期, 细胞周期的循环中有G1/S和G2/M两个主要限制点, 研究发现在所有的调节因子中, 只有G1期的调节因子被发现在肿瘤的发生中出现改变或突变, 从而导致细胞增殖的不可控性; (3)降低循环中胰岛素及IGFs: 大量流行病学调查及实验室数据提示胰岛素抵抗、高胰岛素血症及细胞膜上胰岛素受体异常都可能导致细胞生长异常, 从而发生肿瘤[18,19]; (4)抑制肿瘤新生血管生成: Met可以抑制胰岛素和IGF-1诱导的HIF-1α和VEGF表达, 也可以抑制血管生成, 发挥抗肿瘤的作用; (5)其它: Met还有调节免疫、杀灭肿瘤干细胞、抗炎、自噬等抗肿瘤机制[20,21]. 我们的研究证实, Met联合Sor可增强AMPK的表达, 抑制mTORC1的表达, 提示Met增强Sor诱导肝癌细胞凋亡可能与活化AMPK有关.
综上所述, 我们的结果提示, Met可以增强Sor诱导肝癌HepG2细胞的凋亡, 这个过程可能与AMPK通路有关, 具体详细机制则需要进一步研究. 另外, 我们的研究均建立在单一细胞株水平的研究, 接下来还需要多株细胞株及动物水平的进一步研究来证实.
我国是肝癌大国, 每年新发肝癌占世界至少一半以上. 许多肝癌诊断时已处晚期, 因此, 延长晚期肝癌的生存期显得尤为重要. 索拉菲尼(Sorafenib, Sor)是临床上唯一用于晚期肝癌的靶向药物, 但耐药问题同样不容乐观. 本研究拟通过细胞实验证实二甲双胍(Merformin, Met)可以增强Sor的抑制肝癌细胞增殖和促进其凋亡, 为临床提供一定的参考.
通过细胞实验证实Met可以增强Sor的抑制肝癌细胞增殖和促进肝癌细胞凋亡, 为临床应用提供理论依据.
通过细胞实验证实Met可以增强Sor的抑制肝癌细胞增殖作用, 同时证实其过程与促进细胞凋亡有关.
首先通过MTT法测定单用Sor或Sor联合Met细胞增殖的影响, 再进一步用流式细胞仪测量各组的凋亡率的影响, 最后用Western-blot证实这个过程是否与相关蛋白表达的变化.
MTT实验证实Met可以增强Sor抑制肝癌细胞的增殖, 流式细胞技术进一步证实了这个过程与促进凋亡有在. Western-blot实验证实这个过程与AMPK通路活化有关.
Met可以增强Sor抑制肝癌细胞的增殖, 且这个过程会促进其凋亡和AMPK通路的活化.
本研究仅建立在细胞水平的研究, 且只有一个细胞株. 未来应该增加细胞株数, 同时开展动物实验, 进一步证实其作用. 还可以在临床上对晚期肝癌合并糖尿病人应用Sor治疗进行分组, 按是否用Met分组, 观察对生存期的影响.
学科分类: 胃肠病学和肝病学
手稿来源地: 江西省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): 0
D级 (一般): D
E级 (差): 0
科学编辑: 张晗 制作编辑:刘继红
| 1. | La Vecchia C, Negri E. A review of epidemiological data on epilepsy, phenobarbital, and risk of liver cancer. Eur J Cancer Prev. 2014;23:1-7. [PubMed] [DOI] |
| 2. | Zhang R, Chen Z, Wu SS, Xu J, Kong LC, Wei P. Celastrol Enhances the Anti-Liver Cancer Activity of Sorafenib. Med Sci Monit. 2019;25:4068-4075. [PubMed] [DOI] |
| 4. | Zhang ZJ, Zheng ZJ, Shi R, Su Q, Jiang Q, Kip KE. Metformin for liver cancer prevention in patients with type 2 diabetes: a systematic review and meta-analysis. J Clin Endocrinol Metab. 2012;97:2347-2353. [PubMed] [DOI] |
| 5. | Li P, Zhang C, Gao P, Chen X, Ma B, Yu D, Song Y, Wang Z. Metformin use and its effect on gastric cancer in patients with type 2 diabetes: A systematic review of observational studies. Oncol Lett. 2018;15:1191-1199. [PubMed] [DOI] |
| 6. | De A, Kuppusamy G. Metformin in breast cancer: preclinical and clinical evidence. Curr Probl Cancer. 2020;44:100488. [PubMed] [DOI] |
| 7. | Kuo YJ, Sung FC, Hsieh PF, Chang HP, Wu KL, Wu HC. Metformin reduces prostate cancer risk among men with benign prostatic hyperplasia: A nationwide population-based cohort study. Cancer Med. 2019;8:2514-2523. [PubMed] [DOI] |
| 8. | Zeng S, Gan HX, Xu JX, Liu JY. Metformin improves survival in lung cancer patients with type 2 diabetes mellitus: A meta-analysis. Med Clin (Barc). 2019;152:291-297. [PubMed] [DOI] |
| 9. | Wynn A, Vacheron A, Zuber J, Solomon SS. Metformin Associated With Increased Survival in Type 2 Diabetes Patients With Pancreatic Cancer and Lymphoma. Am J Med Sci. 2019;358:200-203. [PubMed] [DOI] |
| 10. | Mallik R, Chowdhury TA. Metformin in cancer. Diabetes Res Clin Pract. 2018;143:409-419. [PubMed] [DOI] |
| 11. | Zou G, Bai J, Li D, Chen Y. Effect of metformin on the proliferation, apoptosis, invasion and autophagy of ovarian cancer cells. Exp Ther Med. 2019;18:2086-2094. [PubMed] [DOI] |
| 12. | Zhang JJ, Zhang QS, Li ZQ, Zhou JW, Du J. Metformin attenuates PD-L1 expression through activating Hippo signaling pathway in colorectal cancer cells. Am J Transl Res. 2019;11:6965-6976. [PubMed] |
| 13. | Chung YK, Hwang S, Song GW, Lee YJ, Kim KH, Ahn CS, Moon DB, Ha TY, Jung DH, Park GC, Ryoo BY, Lee SG. Absence of antitumor effects of metformin in sorafenib-treated patients with hepatocellular carcinoma recurrence after hepatic resection and liver transplantation. Ann Hepatobiliary Pancreat Surg. 2018;22:297-304. [PubMed] [DOI] |
| 14. | Chen M, Zhang J, Hu F, Liu S, Zhou Z. Metformin affects the features of a human hepatocellular cell line (HepG2) by regulating macrophage polarization in a co-culture microenviroment. Diabetes Metab Res Rev. 2015;31:781-789. [PubMed] [DOI] |
| 15. | Zhu X, Yan H, Xia M, Chang X, Xu X, Wang L, Sun X, Lu Y, Bian H, Li X, Gao X. Metformin attenuates triglyceride accumulation in HepG2 cells through decreasing stearyl-coenzyme A desaturase 1 expression. Lipids Health Dis. 2018;17:114. [PubMed] [DOI] |
| 16. | Feng Y, Guo X, Huang X, Wu M, Li X, Wu S, Luo X. Metformin reverses stem celllike HepG2 sphere formation and resistance to sorafenib by attenuating epithelialmesenchymal transformation. Mol Med Rep. 2018;18:3866-3872. [PubMed] [DOI] |
| 17. | Luo Z, Zhu T, Luo W, Lv Y, Zhang L, Wang C, Li M, Wu W, Shi S. Metformin induces apoptotic cytotoxicity depending on AMPK/PKA/GSK-3β-mediated c-FLIPL degradation in non-small cell lung cancer. Cancer Manag Res. 2019;11:681-689. [PubMed] [DOI] |
| 18. | Kamarudin MNA, Sarker MMR, Zhou JR, Parhar I. Metformin in colorectal cancer: molecular mechanism, preclinical and clinical aspects. J Exp Clin Cancer Res. 2019;38:491. [PubMed] [DOI] |
| 19. | Berstein LM. New developments of metformin in the clinical cancer area. Oncotarget. 2018;9:36820-36821. [PubMed] [DOI] |
| 20. | Fu H, Zhang J, Pan T, Ai S, Tang L, Wang F. miR378a enhances the sensitivity of liver cancer to sorafenib by targeting VEGFR, PDGFRβ and cRaf. Mol Med Rep. 2018;17:4581-4588. [PubMed] [DOI] |