修回日期: 2018-12-16
接受日期: 2018-12-31
在线出版日期: 2019-05-08
油脂是人类饮食中重要的营养元素, 它与人类生活紧密联系. 长期以来人们对油脂的认识不足, 造成了一些对油脂摄取的认知盲区. 油脂摄入量不当会改变血中甘油三酯、胆固醇及低密度脂蛋白胆固醇浓度, 增加心脑血管疾病、肥胖症、脂肪肝、胃肠道疾病等慢性病发生的危险, 同时高脂饮食也会扰乱肠道微生物继而引发肠癌. 目前研究发现饮食对于塑造肠道菌群至关重要, 因此在无法大规模改变宿主基因组成的前提下, 研究如何通过油脂影响机体疾病的发生和发展具有更现实的意义. 本文从食用油摄取不当-导致菌群失调-引发各种疾病的角度来作一些简单的探讨, 引导人们正确选择油脂来改善肠道菌群的平衡.
核心提要: 食用油在维持机体肠道菌群平衡中起了重要作用, 其摄入过量已证实与多种慢性代谢性疾病密切相关. 本文从积累、代谢、肠道微生物等方面述评其致病机制, 深入研究后揭示食用油摄入不当会引发脂质代谢紊乱、慢性炎症、血管内皮损伤、肠道菌群失衡等, 最终导致相关慢性代谢病的发生发展, 并提出可通过靶向肠道菌群的变化制定符合国情的膳食策略.
引文著录: 刘娅薇, 惠华英, 谭周进. 食用油对身体健康的影响及与肠道菌群的关系. 世界华人消化杂志 2019; 27(9): 583-588
Revised: December 16, 2018
Accepted: December 31, 2018
Published online: May 8, 2019
Oil is an important nutrient in the human diet, and it is closely related to human life. For a long time, people's understanding of oil has been insufficient, resulting in some blind spots for oil intake. Excessive oil intake will increase blood triglyceride (TG), cholesterol (TC), and low-density lipoprotein cholesterol (LDL-C) concentrations, and the risk of chronic diseases such as cardiovascular and cerebrovascular diseases, obesity, fatty liver, and gastrointestinal tract diseases will be increased. Moreover, high-fat diets can also disrupt intestinal microbes and cause intestinal cancer. On the other hand, if oil intake is too low, the intake of essential fatty acids will be insufficient, and the absorption and utilization of fat-soluble vitamins will be reduced. The energy substances required for probiotics in the intestine will be reduced, and eventually the imbalance of human flora will lead to a variety of metabolic diseases. This article makes some simple discussions from the perspective of improper intake of edible oils, which will lead to dysbacteriosis and cause various diseases, with an aim to guide people to correctly choose dietary oils to improve the balance of intestinal flora.
- Citation: Liu YW, Hui HY, Tan ZJ. Effect of edible oil on health: Relationship with intestinal microflora. Shijie Huaren Xiaohua Zazhi 2019; 27(9): 583-588
- URL: https://www.wjgnet.com/1009-3079/full/v27/i9/583.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v27.i9.583
早至周代, 文献中有不少烹饪用膏的记载. 《周礼·天官·应人》: "凡用禽兽, 春行羔豚, 膳膏香; 夏行腒鱐, 膳膏臊; 秋行犊麤, 膳膏腥; 冬行鱻羽, 膳膏膻". 此处的"膏"就是我们所说的食用油, 食用油能够提供人体热能和必需脂肪酸, 是促进脂溶性维生素吸收的重要食物. 油脂能够提供丰富的营养, 但同时也会诱发脂肪肝、肥胖症、心血管疾病、高血糖、高血脂以及影响子代发育等[1]. 中国膳食营养素参考摄入量(dietary reference intakes, DRIs)推荐居民DRIs: 脂肪占总能量20%-30%, 总碳水化合物占总能量50%-65%[2]. 膳食中脂肪和碳水化合物是重要的产热营养素, 近年来人们对食用油脂的卫生及安全缺乏足够认识, 摄入脂肪、碳水化合物增多, 引起人体肠道菌群失调促使一系列疾病发生, 这也使油脂摄入量逐渐成为肠道疾病研究的焦点, 预防膳食相关疾病成为医学界的研究重点和方向[3].
随着生活水平的提高, 消费者对食用油脂的需求呈现多样化. 有富含单不饱和脂肪酸(monounsaturated fatty acids, MUFA)的橄榄油、富含多不饱和脂肪酸(polyunsaturated fatty acids, PUFA)的豆油、富含饱和脂肪酸(saturated fatty acids, SFA)的猪油等. 脂肪酸构成不同的油脂对健康的影响也不一样, 研究不同油脂对健康的影响对油脂的健康效应及指导居民合理选择食用油具有重要意义[4].
本文述评近年来食用油摄入过量与多种慢性疾病关系的研究, 深入了解高脂饮食与疾病之间的关系, 以提高适当摄入油脂的认知, 为慢性代谢病的防治开拓新的思路和方向、科学膳食的制定方案提供新参考和依据, 对进一步阐明疾病的病因及发病机制, 优化治疗策略意义重大.
油脂代谢主要受遗传因素、激素、酶等调节, 在维持能量平衡、参与信号识别、免疫调节等方面发挥重要作用, 当这些因素出现异常时造成肠道功能、脂肪代谢紊乱从而导致慢性代谢性疾病的发生. 长期不合理膳食结构是导致脂肪异常代谢的主要原因之一[1]. 食用油是由不同的脂肪酸混合组成, 按其饱和程度分类为: SFA; 不饱和脂肪酸(unsaturated fatty acids, UFA)又分为MUFA和PUFA; PUFA; 反式脂肪酸(trans fat acids, TFA). 这些脂肪酸均是维持人体正常生理功能不可缺少的物质, 但其摄取过量或不足都会导致人体的代谢紊乱, 因此脂肪酸合理比例的摄取对生长、血脂水平的变化、发育及疾病防治具有非常重要的意义[5,6].
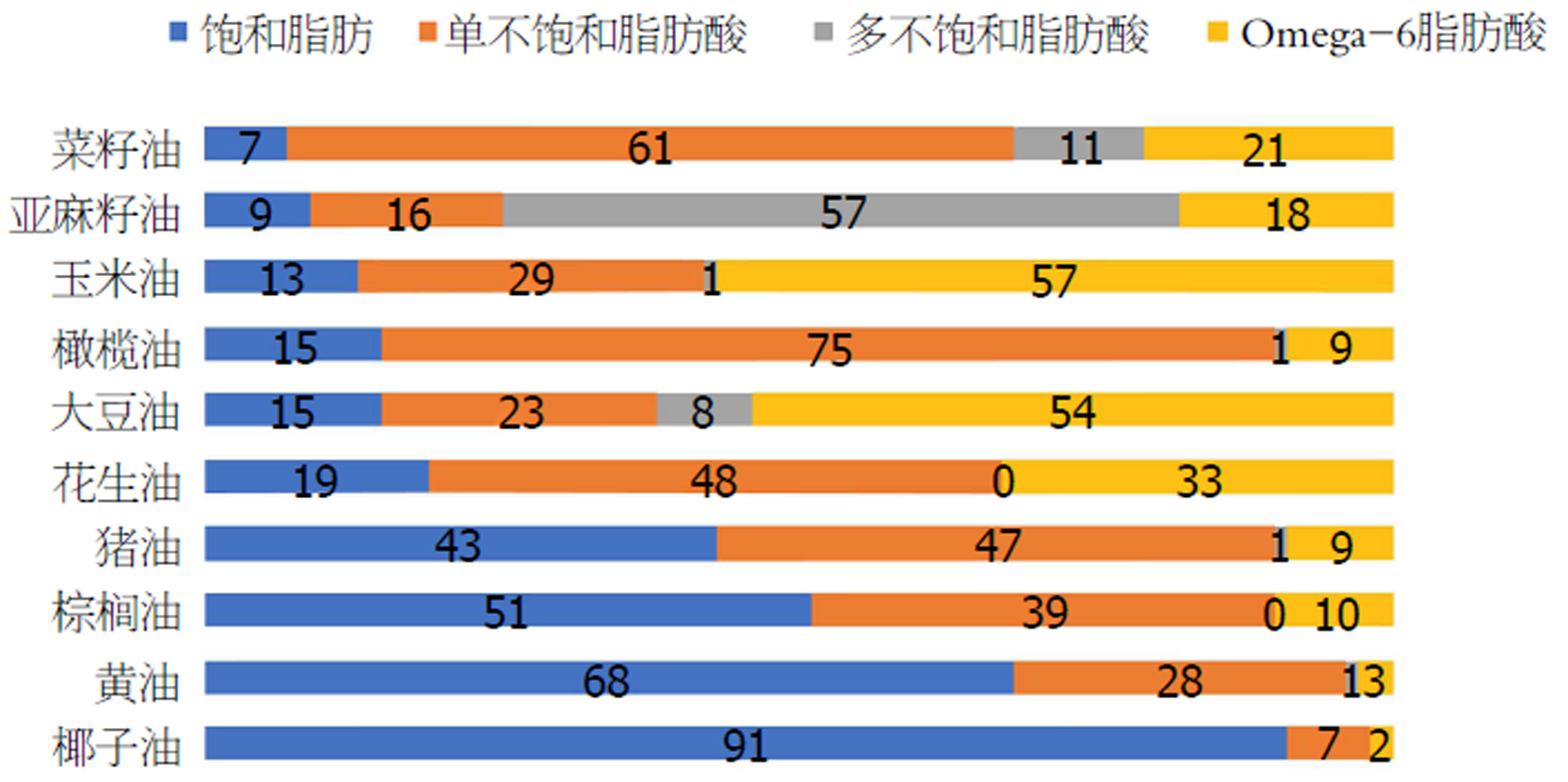
SFA主要来自于动物油脂. 若摄入过量SFA可使血液的甘油三酯(triglyceride, TG)升高, 并且SFA使LDL-C与TC升高的作用相平衡[7], 同时可调节免疫应答和炎症反应、抑制肿瘤生长、促进细胞分化和凋亡的作用[8]. UFA主要是油酸[9], 有改善胰岛素抵抗、保护心血管、预防心脏病等作用. 近些年来富含多UFA的植物油已被大量科学研究证明会加重人体炎症、增加细胞突变, 导致一系列疾病如癌症、心血管疾病、多囊卵巢等[10,11]. 目前有少数研究表明天然TFA并不会像人造TFA一样导致心血管疾病和致癌[12](图1).
肥胖病因受遗传、饮食、生活习惯等多种因素的影响, 在我国肥胖症同样是个不容忽视的问题, 目前我国人口中体重超标者占总人口的15%, 并呈现年轻化、低龄化趋势, 儿童肥胖的发病率较15年前增加了20倍[13]. 脂肪是产生能量最高的营养素, 是生命活动所需要热量的重要来源, 在《中国居民营养素与慢性病状况报告(2015年)》中2012年中国居民膳食脂肪提供能量比例为32.9%, 其中城市为36.1%, 与《中国居民膳食指南(2007)》推荐摄入量的30%上限相比, 城市高出了6.1%[14]. 不良饮食习惯会对肠道正常的菌群数量、比例、结构造成对机体的能量代谢的影响[15]. 由饮食习惯诱发的肥胖与肠道末端的微生态菌群有着显著的关系[16]. PUFA对机体肥胖诱导的肠道微生态紊乱能起到一定的改善功效并有效控制体重增加[17], 某些短链脂肪酸如醋酸酯, 能改善肠道微生物菌群落结构, 使厚壁菌的数量减少, 拟杆菌数量增加, 并抑制慢性炎症的发生, 高脂肪饮食喂养引起的体重增加也显著地受到一定的抑制[18].
在内外环境的影响下, 肠道菌群结构的改变对食物中多糖成分的降解效率产生影响, 进而机体对能量的摄入增多导致肥胖发生率提高[19]. 肥胖与肠道菌群的关系非常密切, 与调节宿主肥胖相关基因的难度相比, 通过改变肠道微生物组成来调节肠道菌群基因模式, 达到肠道菌群转录组、蛋白质组和代谢组的改变, 进而调节宿主能量相关代谢水平的方法, 更为方便可行[20]. Den等[21]发现SCFA能够通过诱导腺苷酸活化蛋白激酶(adenylate-activated protein kinase, AMPK)磷酸化抑制乙酰辅酶A羧化酶活性, 使下游肉碱软脂酰基转移酶1活性增加从而刺激线粒体的脂肪酸氧化, 并促进能量消耗进而减少脂肪蓄积. 此外, 有研究发现肠道菌群发酵产生的丁酸通过激活AMPK可明显改善脂肪酸氧化, 增加机体对脂肪酸的利用从而减轻脂肪堆积[22]. 因此, 通过调节肠道菌群影响能量代谢对改善肥胖有直接作用[23]. 若将肠道菌群组成的变化作为成为治疗肥胖人群的一个重要靶点和早期诊断的生物标记物来预警疾病, 纠正失衡的菌群使其宿主机体恢复稳态, 修复肠道微生态平衡成为了疾病预防的新靶点, 且有明显治疗效果的同时也降低治疗费用[24].
糖尿病是因胰岛素绝对或相对不足引起的一种营养代谢性疾病, 其主要表现为糖代谢紊乱, 分解代谢大于合成代谢[25]. 有研究表明2型糖尿病患者直接增加富含EPA、DHA的n-3多不饱和脂肪酸摄入有利于减轻胰岛素抵抗及控制血糖水平[26]. 肠道菌群可通过免疫调节及改变肠道的通透性导致糖尿病的发病[27]. Silva等[28]研究发现饮食中脂肪和碳水化合物过高, 不仅会对脂肪代谢产生影响, 而且影响与糖代谢相关的酶的活性, 引发糖尿病等问题[29]. 西式饮食后代谢产物促使B细胞分泌促炎性抗体, 并影响T细胞功能, 而PUFA和SCFA可影响B细胞功能和肠道菌群, 并抑制炎症反应; 饮食和肠道菌群影响B细胞功能, 可导致自身免疫病或炎症性疾病的发生[30].
大量研究表明长期饮食中油脂摄入过量致使肠道菌群结构发生改变, 导致肠道菌群基因丰度降低, 从而导致2型糖尿病[31]. 其机制可能是通过影响短链脂肪酸、脂多糖的产生, 减少肠道激素GLP-1、肽YY等的释放, 从而作用于肠道菌群-脑-β细胞轴形成正反馈, 进而诱发内毒素血症和机体的慢性炎症等, 引起胰岛素抵抗和胰岛β细胞的破坏、凋亡, 最终导致2型糖尿病的发生[32]. 上海交通大学教授赵立平研究证实[24]肠道内的类杆菌、乳酸杆菌与血糖高低关系密切, 而厌氧菌群可以调控人体PPARg受体的转运和活性, 该受体与胰岛素抵抗和Ⅱ型糖尿病关系密切.
菌群的改变使得胃肠的通透性发生改变, 出现葡萄糖耐量降低、脂肪增加、体重增加等一系列的变化, 通过调节肠内微生物菌群平衡或许对临床治疗糖尿病肥胖症患者有一定作用. 通过用饮食干预和粪菌移植调节菌群, 用各种药物调整影响肠道屏障和功能的关键因子, 甚至疫苗都可作为新型治疗策略, 有助于维持肠道菌群的稳态, 并对糖尿病的治疗有着积极的作用.
随着社会的发展、人们生活方式和年龄结构的改变, 高血压患病率不断升高成为了严重的公共卫生问题[33,34]. 高血压病实质上是一种生活方式病, 膳食干预对高血压的控制率显得尤为重要[35]. 目前有学者认为传统的地中海式饮食可降低心血管疾病, 7447例55到80岁心血管高风险患者分入三个饮食组: 地中海饮食添加特级初榨橄榄油、地中海饮食添加混合坚果、接受减少膳食脂肪建议的对照组, 每季度进行一次指导并评估对饮食方案的依从性, 中位随访4.8年; 实验数据显示添加特级初榨橄榄油和坚果的地中海饮食者, 心血管风险分别下降31%和28%[36].
摄入过多SFA不但改变肠道菌群构成, 而且损伤肠黏膜屏障, 引起内毒素入血. 肠道菌群也会影响糖脂代谢. 肠道菌群能通过产生胆固醇氧化酶、抑制肝脂肪合成酶的活性、调节胆固醇的重分布、影响胆盐的肝肠循环等方式发挥调节血脂作用[37]. 已有研究证明[38], 3种n-3 PUFAs, 即ALA、EPA和DHA的摄入对心血管疾病的预防及治疗具有积极作用. 这些脂肪酸存在于哺乳动物的细胞膜中, 其不同含量影响各种细胞功能, 对脂质和蛋白质代谢起调节作用[39].
肠道益生菌促进肠道中内毒素的吸收, 并阻断产生来源、降低对机体的伤害, 也有利于机体血压的下降和控制, 通过产生小分子的SCFA、过氧化氢、抗菌活性肽等物质, 降低肠道中氨类、胺类等有毒代谢产物, 抑制产生这些有毒代谢产物的腐败菌的生长和繁殖[40-42]. 乳酸菌可通过影响肠道微生物的代谢活动, 进而调节自主神经与肠道神经之间的活动, 改善交感神经与副交感神经之间的平衡, 实现对宿主肠道屏障和血压的调节. 现已发现了多种具有降血压作用的乳酸菌, 从传统的发酵乳制品获得瑞士乳杆菌株(Lactobacillus helveticus)具有很好血管紧张素转换酶抑制活性和降压作用[43]. 副干酪乳杆菌NTU101发酵产品(NTU101F)不但降压, 还可以发挥大脑中的神经保护作用, 减轻高血压引起的血管性痴呆[44]. 综上, 益生菌可通过肠道微生物的代谢活动影响肠道神经和自主神经, 这些作用和功能具备帮助机体实现血压调节的可能.
脂肪酸在各个方面促进肿瘤发生发展, 脂肪酸为肿瘤细胞增殖提供构建细胞膜的脂质材料和细胞信号通路的脂质分子, 并为肿瘤细胞提供能量来源[45]. 高脂饮食下的大鼠血清中的游离脂肪酸含量增加[46], 动物性脂肪的摄入会导致肠内胆汁酸的分泌增加, 使相应血液中胆固醇增加[47], 过氧化物酶和线粒体氧化过多的脂肪酸, 进一步导致肝炎、肝硬化的发生[48]. 脂肪酸脱氢酶Fat-l基因, 可使细胞内的ω-6 PUFA转化为ω-3 PUFA, 内源性ω-3 PUFA可抑制AKT和Ras癌基因信号通路, 并可进一步抑制肝癌细胞增殖和克隆形成能力. 目前的研究表明, Fat-1基因抑制AKT/Ras癌基因信号通路, 是通过改变ω-3/ω-6 PUFA的比率, 使内源性的ω-3PUFA增多而起作用的[45].
在由Liu等[49]进行的研究中, 益生菌补充剂降低了黄曲霉毒素暴露的生物剂量, 益生菌在肝脏炎症及肝硬化等治疗中起到积极的效果, 可以有效预防肝癌的发生. Chen等[50]微生态学家发现肠道菌群中的毛螺菌、双歧杆菌等益生菌与肝硬化有直接关系[51]. 有学者发现肠道菌群中的肝原螺旋杆菌可使机体罹患肝癌的风险增大[52], 尤其对于丙肝患者, 需格外注意肠道内螺旋杆菌的含量监控[29].
在临床肝癌治疗中, 改善肠道菌群失调或许可以作为一种辅助治疗方法应用于肝癌治疗以及预后, 并通过提供有效的饮食方法来降低患肝癌的风险. 从肠道靶向微生物标记物探索肠道微生物与肝脏的相互作用方面, 继而分析肝癌的促发原因和形成机制, 对我国HBV-HCC的发病机制研究, 预防和治疗都将有着重要的意义[53].
近年来国内外研究发现高脂高碳水化合物饮食使肠道菌群失衡, 益生菌对于肥胖、糖尿病等代谢综合征疾病有一定的积极作用, 同时国内外学者利用酚酸类等植物提取物在肥胖、高脂血症治疗方面取得了一定效果[54-56], 各国的膳食指南都逐渐强调健康的膳食模式(而不是单一食物或营养素)对健康的重要性. 本文综述了食用油的摄入量对机体的肠道微生态的影响从而对机体的内分泌系统、消化系统、血液循环系统等方面产生相互作用. 尽管目前国内外研究已经表明益生菌的摄入对于血压的下降具有积极的影响, 但对于肠道菌群的变化以及哪些菌群对于血压的升高或降低的贡献无更为深入的研究[57]. 目前食用油对相关基因通路的调控以及对肠道菌群影响方面研究尚未完全清楚. 另由于取材等特殊性, 较多使用动物实验验证, 临床上人为控制及回访数据并不详细[1].
肠道菌群通过宿主与饮食交互作用调节能量代谢, 肠道菌群的改变也可导致过多毒素产生进而诱发炎症反应和促进脂质代谢综合征, 食用油可以通过改变肠道菌群的变化来影响到心血管系统、消化系统以及内分泌系统等产生一系列代谢性疾病, 肠道菌群构成的变化可影响菌群代谢物、胃肠激素、内分泌的改变, 故合理摄入油脂, 能够促进机体健康发展. 现代饮食结构的变化导致肠道菌群的结构、组成和功能受到不同程度的影响, 加强食用油与肠道微生物的相关研究, 为合理应用食用油提供重要的参考价值的同时也为临床膳食机理研究及应用提供新的思路.
学科分类: 胃肠病学和肝病学
手稿来源地: 湖南省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C, C
D级 (一般): D, D, D
E级 (差): 0
编辑: 崔丽君 电编:刘继红
| 8. | Hassig CA, Tong JK, Schreiber SL. Fiber-derived butyrate and the prevention of colon cancer. Chem Biol. 1997;4:783-789. [PubMed] [DOI] |
| 9. | Kris-Etherton PM, Pearson TA, Wan Y, Hargrove RL, Moriarty K, Fishell V, Etherton TD. High-monounsaturated fatty acid diets lower both plasma cholesterol and triacylglycerol concentrations. Am J Clin Nutr. 1999;70:1009-1015. [PubMed] [DOI] |
| 13. | Yang ZR, Zeng GM, Peng LH, Zhang MM, Cheng JL, Zhan RT. Preliminary study on effect of Rhodiolae Crenulatae Radix et Rhizoma cell wall-broken decoction pieces on intestinal flora of mice. Zhongguo Zhong Yao Za Zhi. 2015;40:3053-3058. [PubMed] [DOI] |
| 14. | 国家卫生计生委疾病预防控制局. 中国居民营养与慢性病状况报告(2015). 北京: 人民卫生出版社 2015; . |
| 15. | Nagai M. Gut Microbiota and Internal Diseases: Update Information. Topics: V. Gut Microbiota: Topics in Various Medical Fields; 3. Does the intestinal flora relate to nervous system disorders? Nihon Naika Gakkai Zasshi. 2015;104:75-80. [PubMed] [DOI] |
| 18. | Lu Y, Fan C, Li P, Lu Y, Chang X, Qi K. Short Chain Fatty Acids Prevent High fat diet induced Obesity in Mice by Regulating G Protein-coupled Receptors and Gut Microbiota. Sci Rep. 2016;6:37589. [PubMed] [DOI] |
| 19. | Yamashina A. Gut Microbiota and internal diseases: update information. topics: V. Gut microbiota: Topics in Various Medical Fields; 1. Does intestinal flora promote atherosclerosis, Nihon. Naika Gakkai Zasshi. 2015;104:66-70. [DOI] |
| 20. | Sommer F, Backhed F. The gut microbiota--masters of host development and physiology. Nat Rev Microbio. 2013;11:227-238. [PubMed] [DOI] |
| 21. | den Besten G, Bleeker A, Gerding A, van Eunen K, Havinga R, van Dijk TH, Oosterveer MH, Jonker JW, Groen AK, Reijngoud DJ, Bakker BM. Short-chain fatty acids protect against high-fat diet-induced obesity via a PPARγ- dependent switch from lipogenesis to fat oxidation. Diabetes. 2015;64:2398-2408. [PubMed] [DOI] |
| 22. | Mollica MP, Mattace Raso G, Cavaliere G, Trinchese G, De Filippo C, Aceto S, Prisco M, Pirozzi C, Di Guida F, Lama A, Crispino M, Tronino D, Di Vaio P, Berni Canani R, Calignano A, Meli R. Butyrate regulates liver mitochondrial function, efficiency, and dynamic, in insulin resistant obese mice. Diabetes. 2017;66:1405-1418. [PubMed] [DOI] |
| 25. | Rossi G, American Diabetes Association. Diagnosis and classification of diabetes mellitus. Recenti Prog Med. 2010;101:274-276. [PubMed] [DOI] |
| 27. | 刘 硒碲, 夏 宁, 梁 瑜祯. 姜黄素通过调节肠道菌群可改善脂多糖诱导糖尿病. 基因组学与应用生物学. 2014;33:970-974. [DOI] |
| 28. | Silva J. The effects of very high fat, very low carbohydrate diets on safety, blood lipid profile, and anabolic hormone status. J Int Soc Sport Nutr. 2014;11:1. [DOI] |
| 29. | 谢 玲林. 肠道菌群与疾病关系的研究进展. 基因组学与应用生物学. 2017;11:4570-4573. [DOI] |
| 30. | Petta I, Fraussen J, Somers V, Kleinewietfeld M. Interrelation of Diet, Gut Microbiome, and Autoantibody Production. Front Immunol. 2018;9:439. [PubMed] [DOI] |
| 33. | Dreher ML. Dietary Patterns and Hypertension. Dietary Patterns and Whole Plant Foods in Aging and Disease. 2018;371-389. [DOI] |
| 34. | Garcia-Rios A, Torres-Peña JD, Perez-Jimenez F, Perez-Martinez P. Gut Microbiota: A New Marker of Cardiovascular Disease. Curr Pharm Des. 2017;23:3233-3238. [PubMed] [DOI] |
| 36. | Estruch R, Ros E, Salas-Salvadó J, Covas MI, Corella D, Arós F, Gómez-Gracia E, Ruiz-Gutiérrez V, Fiol M, Lapetra J, Lamuela-Raventos RM, Serra-Majem L, Pintó X, Basora J, Muñoz MA, Sorlí JV, Martínez JA, Martínez-González MA. Retraction and Republication: Primary Prevention of Cardiovascular Disease with a Mediterranean Diet. N Engl J Med. 2018;378:2441-2442. [PubMed] [DOI] |
| 39. | Colussi G, Catena C, Novello M, Bertin N, Sechi LA. Impact of omega-3 polyunsaturated fatty acids on vascular function and blood pressure: relevance for cardiovascular outcomes. Nutr Metab Cardiovasc Dis. 2017;27:191-200. [PubMed] [DOI] |
| 40. | Miyamoto J, Kasubuchi M, Nakajima A, Irie J, Itoh H, Kimura I. The role of short-chain fatty acid on blood pressure regulation. Curr Opin Nephrol Hypertens. 2016;25:379-383. [PubMed] [DOI] |
| 41. | Canfora EE, Jocken JW, Blaak EE. Short-chain fatty acids in control of body weight and insulin sensitivity. Nat Rev Endocrinol. 2015;11:577-591. [PubMed] [DOI] |
| 42. | Seldin MM, Meng Y, Qi H, Zhu W, Wang Z, Hazen SL, Lusis AJ, Shih DM. Trimethylamine N-Oxide Promotes Vascular Inflammation Through Signaling of Mitogen-Activated Protein Kinase and Nuclear Factor-κB. J Am Heart Assoc. 2016;5. [PubMed] [DOI] |
| 43. | Chen Y, Liu W, Xue J, Yang J, Chen X, Shao Y, Kwok LY, Bilige M, Mang L, Zhang H. Angiotensin-converting enzyme inhibitory activity of Lactobacillus helveticus strains from traditional fermented dairy foods and antihypertensive effect of fermented milk of strain H9. J Dairy Sci. 2014;6680-6692. [PubMed] [DOI] |
| 44. | Cheng MC, Pan TM. Prevention of hypertension-induced vascular dementia by Lactobacillus paracasei subsp. paracasei NTU 101-fermented products. Pharm Biol. 2017;55:487-496. [PubMed] [DOI] |
| 48. | Sanyal AJ, Campbell-Sargent C, Mirshahi F, Rizzo WB, Contos MJ, Sterling RK, Luketic VA, Shiffman ML, Clore JN. Nonalcoholic steatohepatitis: association of insulin resistance and mitochondrial abnormalities. Gastroenterology. 2001;120:1183-1192. [PubMed] [DOI] |
| 49. | Liu Y, Li T, Xu YH, Xu EJ, Zhou M, Wang BL, Shen JL. Effects of TLR4 gene silencing on the proliferation and apotosis of hepatocarcinoma HEPG2 cells. Oncology Letters. 2016;11:3054-3060. [PubMed] [DOI] |
| 50. | Gaia S, Smedile A, Omedè P, Olivero A, Sanavio F, Balzola F, Ottobrelli A, Abate ML, Marzano A, Rizzetto M, Tarella C. Feasibility and safety of G-CSF administration to induce bone marrow-derived cells mobilization in patients with end stage liver disease. J Hepatol. 2006;45:13-19. [PubMed] [DOI] |