修回日期: 2018-12-26
接受日期: 2019-01-10
在线出版日期: 2019-02-08
探讨血清脂蛋白相关磷脂酶A2(lipoprotein related phospholipase A2, Lp-PLA2)水平与乙型肝炎肝硬化Child-Pugh分级的关系.
选择269例乙型肝炎肝硬化患者为病例组, 慢性乙型肝炎(chronic hepatitis B, CHB)组157例为疾病对照组, 健康体检者120例为正常组, 肝硬化患者根据Child-Pugh分级分为A、B、C组进行, 各组均抽取静脉血采用免疫散射比浊法检测其血清Lp-PLA2水平, 采用倾向性评分匹配统计学分析进行筛选, 根据匹配结果对应的分组进行统计分析, 比较各组间的差异.
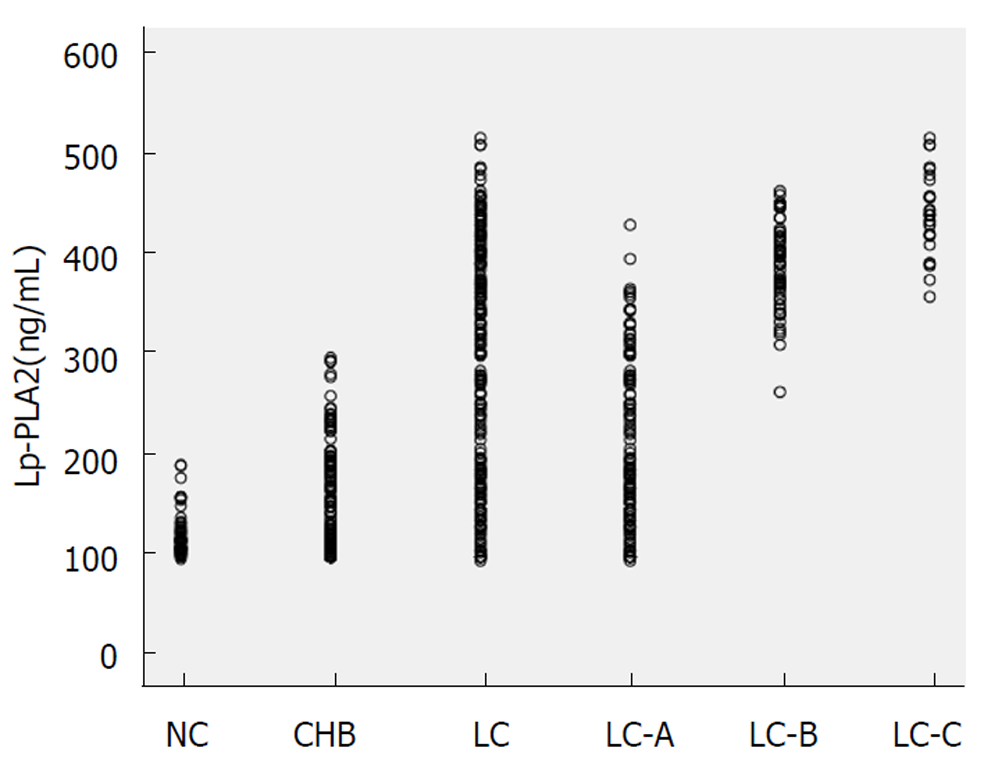
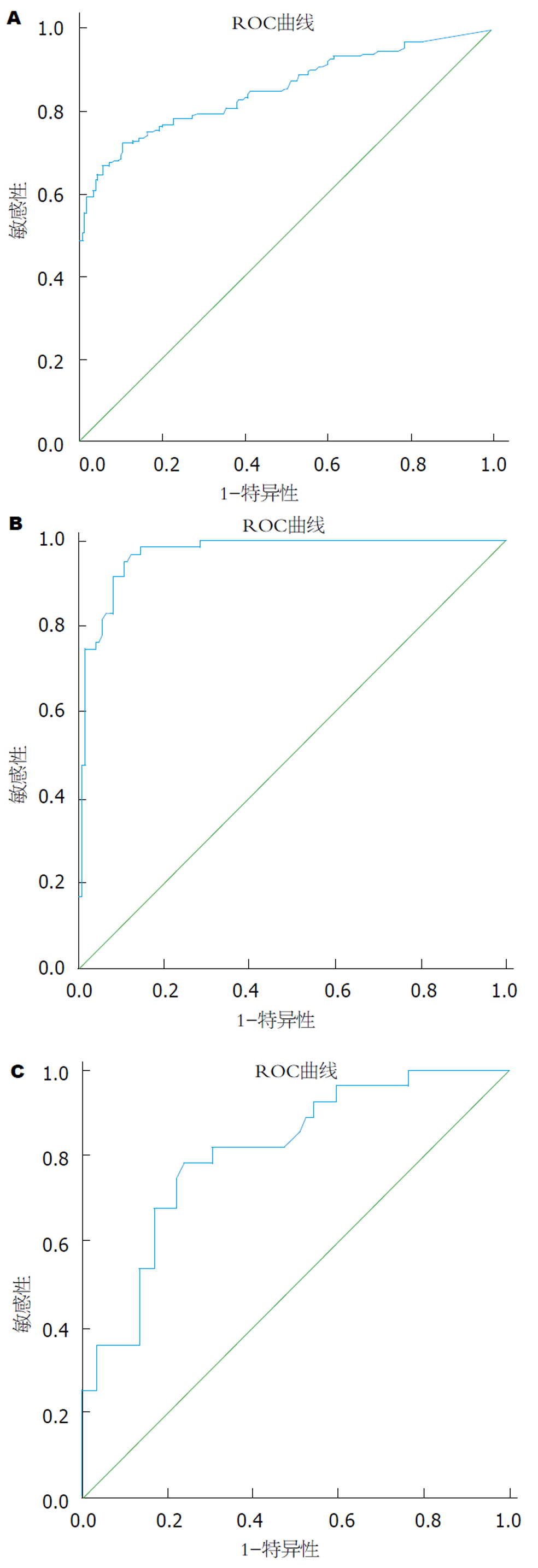
肝硬化C组血清Lp-PLA2水平(443.1 ng/mL ± 40.6 ng/mL)明显高于肝硬化A组(208.5 ng/mL ± 84.6 ng/mL)、B组(390.5 ng/mL ± 42.3 ng/mL)和CHB组(154.3 ng/mL ± 54.1 ng/mL)(P<0.01), 肝硬化B组明显高于肝硬化A组和CHB组(P<0.01), 肝硬化A组明显高于CHB组(P<0.01), CHB组与健康对照组(119.1 ng/mL ± 19.8 ng/mL)相比差异显著(P<0.01); ROC曲线显示: 当对照组设为CHB对肝硬化的AUC为0.852, 诊断阈值为262.5 ng/mL; 对照组设为硬化A级对肝硬化B级的AUC为0.969, 诊断阈值为311.5 ng/mL; 对照组设为硬化B级对24例肝硬化C级的AUC为0.809, 诊断阈值为420.5 ng/mL.
血清Lp-PLA2水平随乙型肝炎肝硬化的病程进展呈升高趋势, 有助于肝硬化Child-Pugh分级的判断, 血清Lp-PLA2水平的变化可作为乙型肝炎肝硬化病程监测的参考指标.
核心提要: 本研究发现在排除基础因素的影响后, 血清脂蛋白相关磷脂酶A2(lipoprotein related phospholipase A2, Lp-PLA2)水平随着慢性乙型肝炎、肝硬化A级、肝硬化B级、肝硬化C级的进展逐步升高, 并应用ROC曲线评价其在乙肝肝炎肝硬化Child-Pugh分级中的诊断价值. Lp-PLA2水平升高趋势可能与肝硬化的缺氧程度有关.
引文著录: 邢继成, 何玉杰, 李平, 朱月蓉, 楼小伟, 顾畅, 邱红. 脂蛋白相关磷脂酶A2与乙肝肝硬化Child-Pugh分级. 世界华人消化杂志 2019; 27(3): 160-166
Revised: December 26, 2018
Accepted: January 10, 2019
Published online: February 8, 2019
To investigate the association between serum lipoprotein related phospholipase A2 (Lp-PLA2) level and Child-Pugh classification in patients with hepatitis B cirrhosis.
A total of 269 patients with hepatitis B cirrhosis were selected as a case group, 157 patients with chronic hepatitis B selected as a disease control group, and 120 healthy subjects as a normal control group. Cirrhotic patients were divided into groups A, B, and C according to Child-Pugh classification. The venous blood was collected from each group and serum Lp-PLA2 level was detected by immunoturbidimetry. After propensity score matching (PSM), statistical analysis was performed to compare serum Lp-PLA2 levels between different groups.
The level of serum Lp-PLA2 was significantly higher in the liver cirrhosis group C (443.1 ng/mL ± 40.6 ng/mL) than in the liver cirrhosis groups A (208.5 ng/mL ± 84.6 ng/mL) and B (390.5 ng/mL ± 42.3 ng/mL) and the chronic hepatitis B group (154.3 ng/mL ± 54.1 ng/mL) (P < 0.01), in the liver cirrhosis group B than in the liver cirrhosis group A and the chronic hepatitis B group (P < 0.01), and in the liver cirrhosis group A than in the liver chronic hepatitis B group (P < 0.01). Similar results were also found between the chronic hepatitis B group and the healthy control group (119.1 ng/mL ± 19.8 ng/mL) (P < 0.01). The ROC curve showed that when chronic hepatitis B was used as the control group, the area under the ROC curve of liver cirrhosis was 0.852, and the diagnostic threshold was 262.5 ng/mL. When cirrhosis grade A was used as the control group, the area under the ROC curve of cirrhosis grade B was 0.969, and the diagnostic threshold was 311.5 ng/mL. When cirrhosis grade B was used as the control group, the area under the ROC curve of cirrhosis grade C was 0.809, and the diagnostic threshold was 420.5 ng/mL.
The level of serum Lp-PLA2 increases with the progression of hepatitis B cirrhosis, which is helpful for judging the Child-Pugh classification of patients with hepatitis B cirrhosis. Serum Lp-PLA2 level can be used as a reference index for monitoring the course of hepatitis B cirrhosis.
- Citation: Xing JC, He YJ, Li P, Zhu YR, Lou XW, Gu C, Qiu H. Relationship between Lp-PLA2 and Child-Pugh classification in patients with hepatitis B cirrhosis. Shijie Huaren Xiaohua Zazhi 2019; 27(3): 160-166
- URL: https://www.wjgnet.com/1009-3079/full/v27/i3/160.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v27.i3.160
脂蛋白相关磷脂酶A2(lipoprotein associated phospho-lipase A2, Lp-PLA2)是心血管疾病中一种新发现的新型炎症标记物, 是冠脉粥样硬化(coronary atherosclerosis, CA)的独立危险因素, 可用于心血管疾病患病风险及患者预后判断[1], Lp-PLA2主要由成熟的巨噬细胞与淋巴细胞合成和分泌, 受炎症介质的调节[2], 参与血管病变, 与临床预后相关. 近年来, Lp-PLA2的研究多倾向于心脑血管疾病, 对于在肝硬化方面的研究情况未见报道, 我们发现, 血清Lp-PLA2水平在肝病进展的过程中有增高的趋势, 目前, 肝硬化Child-Pugh分级是国内外应用最多的肝功能分级方法[3], 我们根据肝硬化Child-Pugh分级进行了分组研究, 旨在观察血清Lp-PLA2水平在乙肝肝硬化疾病进程中的临床意义.
选取2016-03/2018-07中国人民解放军第八一医院住院患者, 根据诊断标准[4]选取肝硬化组(liver cirrhosis, LC)269例, 其中男174例, 女95例, 年龄54(25-78)岁, 慢性乙型肝炎(chronic hepatitis B, CHB)组157例, 其中男105例, 女52例, 年龄48(25-82)岁. 所有患者均有乙型肝炎病毒(hepatitis B virus, HBV)感染史(排除标准: 动脉粥样硬化、血液病, 代谢性疾病引起的肝脾肿大者, 结核性腹膜炎、缩窄性心包炎、慢性肾小球肾炎导致的腹水患者, 非门脉高压型上消化道出血者, 合并心力衰竭者, 合并原发肾功能不全者, 感染指标[超敏C反应蛋白(CRP)>8 mg/L、降钙素原(PCT)>0.5 ng/mL]纳入研究. 根据Child-Pugh分级标准[5]把肝硬化对应分为: 肝硬化A级(LC-A)(5-6分, 手术危险度小, 预后最好)、肝硬化B级(LC-B)(7-9分, 手术危险度中等)、肝硬化C级(LC-C)(≥10分, 手术危险度较大, 预后较差)三组. 健康对照组(healthy control, NC)120名来源于本院体检正常并排除其他慢性疾病的健康者. 其中男60名, 女60名, 年龄51(24-63)岁, 与病例组性别年龄无显著性差异. 本研究获得中国人民解放军第八一医院伦理委员会批准(81YY-KYLL-18-09).
真空采血管, 肘静脉采血, 3000 r/min离心10 min分离血清冷冻保存, 统一检测其中Lp-PLA2水平和相关生化指标. Lp-PLA2检测采用南京诺尔曼(NORMAN)生物技术有限公司试剂盒, 使用免疫增强散射比浊法; PCT检测采用深圳瑞莱生物工程有限公司试剂盒, 使用双向侧流免疫反应原理检测; CRP采用深圳国赛生物技术有限公司试剂盒, 使用免疫增强散射比浊法检测. 实验严格遵照说明书步骤在同一实验室室温下进行, 均采用原厂提供的质控品. 相关肝功能、肾功能、血脂指标均采用西门子原厂试剂盒, 检测使用ADVIA2400型全自动生化仪, 凝血功能指标采用希森美康原厂试剂盒, 检测使用CS-5100型全自动凝血分析仪, 质控均采用伯乐质控品和临床靶值, 在检测前保证质控结果在控.
统计学处理 数据采用统计软件SPSS 22.0分析. 采用倾向性评分匹配(propensity score matching, PSM)统计学分析进行筛选, 根据匹配结果进行分组, 计量资料组间比较采用非参数检验; ROC曲线分析血清Lp-PLA2水平对肝硬化Child-Pugh分级患者的诊断效能, 并计算敏感性、特异性, 以Youden指数(敏感性+特异性-1)最大处为诊断界限值(cut-off值). 以P<0.05为差异有统计学意义.
PSM前, Lp-PLA2阴性组和阳性组的年龄的分布有显著性差异, 在性别、吸烟史、糖尿病史、肾功能指标、血脂指标、高血压家族史和饮酒史中分布无显著差异, 结果见表1. PSM后, 结果见表2, 原Lp-PLA2阳性组217例, 阴性组209例, 共有171对病例匹配成功, 匹配后病例的年龄为53(25-82)岁, 各匹配因素在两组间都均衡可比(P>0.05), PSM匹配使用阈值(Match Tolerance)为0.05.
| 变量 | Lp-PLA2(n = 426) | P值 | ||
| 阴性组(n = 209) | 阳性组(n = 217) | |||
| 年龄(岁) | 18-40 | 39 | 25 | |
| 40- | 122 | 122 | ||
| 60- | 49 | 78 | 0.042 | |
| 性别 | 男 | 148 | 131 | |
| 女 | 62 | 85 | 0.451 | |
| 高血压家族史 | 是 | 22 | 31 | |
| 否 | 188 | 185 | 0.510 | |
| 饮酒史 | 是 | 43 | 45 | |
| 否 | 167 | 171 | 0.608 | |
| 吸烟史 | 是 | 48 | 46 | |
| 否 | 162 | 170 | 0.689 | |
| 肾功能 | 是 | 6 | 8 | |
| 否 | 204 | 208 | 0.893 | |
| 糖尿病 | 是 | 17 | 10 | |
| 否 | 193 | 206 | 0.771 | |
| 脂代谢 | 是 | 159 | 167 | |
| 否 | 51 | 51 | 0.838 | |
| 变量 | Lp-PLA2(n = 342) | P值 | ||
| 阴性组(n = 173) | 阳性组(n = 169) | |||
| 年龄(岁) | 18-40 | 26 | 23 | |
| 40- | 101 | 97 | ||
| 60- | 46 | 49 | 0.068 | |
| 性别 | 男 | 116 | 96 | |
| 女 | 57 | 73 | 0.735 | |
| 高血压家族史 | 是 | 14 | 14 | |
| 否 | 159 | 155 | 0.785 | |
| 饮酒 | 是 | 37 | 39 | |
| 否 | 136 | 130 | 0.838 | |
| 抽烟 | 是 | 39 | 33 | |
| 否 | 134 | 136 | 0.918 | |
| 肾功能 | 是 | 5 | 8 | |
| 否 | 168 | 161 | 0.902 | |
| 糖尿病 | 是 | 8 | 7 | |
| 否 | 165 | 162 | 0.924 | |
| 脂代谢 | 是 | 132 | 128 | |
| 否 | 41 | 41 | 0.602 | |
各组间Lp-PLA2水平: LC>CHB>NC(P<0.01), LC-C>LC-B>LC-A(P = 0.000), 均有递增趋势, 结果见表3和图1.
当对照组设为(1)CHB鉴别诊断肝硬化ROC曲线见图2A, ROC 曲线下面积(The areas under ROC curve; ROC-AUC)为0.852诊断效能有显著意义; 鉴别诊断肝硬化A级ROC曲线, ROC-AUC为0.686诊断效能无显著意义. (2)肝硬化A级鉴别诊断肝硬化B级ROC曲线见图2B, ROC-AUC为0.969诊断效能有显著意义. (3)肝硬化B级鉴别诊断肝硬化C级ROC曲线见图2C, ROC-AUC为0.809诊断效能有显著意义. ROC-AUC和判断阈值见表4.
| 对照组/鉴别诊断组 | Lp-PLA2阳性例数 | 敏感度(%) | 特异度(%) | 阳性预测值(%) | 阴性预测值(%) | ROC-AUC值 | 判断阈值(ng/mL) |
| CHB/LC | 169 | 72.0 | 89.6 | 83.4 | 60.1 | 0.852 | 262.5 |
| LC-A/LC-B | 114 | 98.3 | 85.4 | 53.5 | 100 | 0.969 | 311.5 |
| LC-B/LC-C | 88 | 78.6 | 76.3 | 30.7 | 100 | 0.809 | 420.5 |
CHB是全世界主要的公共卫生问题之一, 据世界卫生组织报道, 全球约20亿人曾感染过HBV, 其中2.57亿人为慢性HBV感染者, 每年约有89万人死于HBV感染所致的肝衰竭、肝硬化和肝癌[6,7], 在亚洲国家, CHB是肝硬化的主要病因, 发生肝硬化后患者5年生存率55%-84%[8]. 肝纤维化是肝硬化演变发展的一个重要阶段, 是继发于各种慢性致病因素引起的肝脏损伤和炎症后组织修复过程的代偿反应, 肝纤维化发生发展的过程中存在组织缺氧, 且缺氧贯穿于肝纤维化发生和发展的始终[9]. 氧化应激在肝纤维化过程中起着重要作用[10], 氧自由基介导肝纤维化的发生, 高水平的氧自由基还可激活炎症信号通路, 加剧细胞内炎症反应[11,12], 进一步促使肝纤维化的进展.
Lp-PLA2是磷脂酶A2(phospholipase A2, PLA2)家族中的一员, 是第一个脑卒中预警标志物[13]. 近年来, 血清Lp-PLA2的研究多倾向于心脑血管疾病方面, 对于在肝硬化病程中的研究较少. 大量研究证实, 体内Lp-PLA2活化与氧化应激相关[14]. 长期慢性缺氧能够激活体内氧化应激系统, 介导活性氧和炎性介质大量释放, 随着机体的不断缺氧, 释放大量的自由基使Lp-PLA2表达上调[15], 上调的Lp-PLA2对ox-LDL诱导的肝损伤有保护作用[16]. Svetlov等[17]研究表明肝损伤后血清Lp-PLA2分泌增加, 其含量的增加, 可促进过氧化磷脂的清除, 防止进一步的肝损伤. Grypioti等[18]通过动物实验表明, Lp-PLA2对氧化应激所致的肝脏损伤有抑制作用, 并能促进肝脏的恢复.
我们在工作中发现, 血清Lp-PLA2水平在肝病的进展过程中有增高的趋势, 故对其水平在乙型肝炎各个病程中的分布情况进行了初步研究. 为了排除一般基础因素的影响, 我们采用PSM统计分析了相关因素, 并根据PSM后对应的临床分组进行了比较分析. 研究结果表明, 在排除年龄、性别、烟、酒、糖尿病、肾功能异常、高血压家族史、脂代谢紊乱因素的影响下, Lp-PLA2水平随着CHB、肝硬化A级、B级、C级的进展逐步升高如图1所示. 血清Lp-PLA2在乙型肝炎肝硬化的病情进展中的升高趋势可能与肝硬化的缺氧程度有关, 当机体缺氧后, 严重影响或损害线粒体功能, 释放大量的自由基使Lp-PLA2表达上调来抑制肝损伤, 与Svetlov等[17], Grypioti等[18]研究结果基本一致. 血清Lp-PLA2水平随乙肝肝硬化程度的增加而增加, 可预测肝纤维化的严重程度, 可用于临床动态监测.
本研究应用ROC曲线评价血清Lp-PLA2水平对乙型肝炎肝硬化Child-Pugh分级的诊断价值, 并对其最佳诊断界值做了相关分析. 各组间ROC-AUC均大于0.75, CHB到肝硬化的阳性预测值达83.4%, 乙型肝炎肝硬化Child-Pugh分级组间的阴性预测值均达到了100%, 敏感性和特异性均达到了75%以上. 因此, 血清Lp-PLA2水平可作为肝硬化Child-Pugh分级各组区分的一个良好指标, 对判断CHB向肝硬化进展及肝硬化的分级具有一定的临床意义.
血清脂蛋白相关磷脂酶A2(lipoprotein related phospholipase A2, Lp-PLA2)的研究多倾向于心脑血管疾病, 对于在肝硬化方面的研究情况未见报道, 慢性乙型肝炎(chronic hepatitis B, CHB)是导致肝硬化的主要病因, 组织缺氧贯穿于肝纤维化的发生发展, 自由基介导肝纤维化的进展. 长期慢性缺氧可以激活氧化应激系统, 体内Lp-PLA2活化也与氧化应激相关, 探讨乙肝肝硬化病程与Lp-PLA2是否存在关联.
通过健康组、CHB组和肝硬化组的对比, 探讨Lp-PLA2在各组间的表达水平, 同时观察其在肝硬化Child-Pugh分级中的诊断效能.
探究Lp-PLA2在乙肝肝硬化病程中的变化趋势以及在肝硬化Child-Pugh分级中临床意义.
以乙型肝炎肝硬化患者为病例组, CHB为疾病对照组, 健康体检者为正常组, 将肝硬化患者根据Child-Pugh分级分为A、B、C组, 采用免疫散射比浊法检测其血清Lp-PLA2水平, 采用倾向性评分匹配统计学分析排除基础因素的影响, 比较各组间的差异. 并用ROC曲线分析Lp-PLA2水平在肝硬化分级中的诊断效能.
Lp-PLA2水平的表达随着CHB向肝硬化的病程的进展呈升高趋势, 各组间ROC 曲线下面积也均大于0.75.
Lp-PLA2表达水平对判断CHB向肝硬化进展及肝硬化的分级具有一定的临床意义.
本研究旨在探讨Lp-PLA2水平的表达与CHB、肝硬化病程进展之间的关联, 结果证实Lp-PLA2水平随着乙型肝炎病程的进展有逐渐增高的趋势, 对肝硬化的分级具有诊断效能. 但是本研究仍存在一些不足, 对于乙型肝炎引起的肝衰竭、肝癌晚期患者Lp-PLA2水平的表达没有具体讨论, Lp-PLA2水平升高的机制还没有实验数据支持, 还需要后续的研究作为补充.
学科分类: 胃肠病学和肝病学
手稿来源地: 江苏省
同行评议报告分类
A级 (优秀): A
B级 (非常好): 0
C级 (良好): C
D级 (一般): D
E级 (差): 0
编辑: 崔丽君 电编:张砚梁
| 1. | Cai A, Li G, Chen J, Li X, Li L, Zhou Y. Increased serum level of Lp-PLA2 is independently associated with the severity of coronary artery diseases: a cross-sectional study of Chinese population. BMC Cardiovasc Disord. 2015;15:14. [PubMed] [DOI] |
| 5. | Pugh RN, Murray-Lyon IM, Dawson JL, Pietroni MC, Williams R. Transection of the oesophagus for bleeding oesophageal varices. Br J Surg. 1973;60:646-649. [PubMed] [DOI] |
| 6. | Ganem D, Prince AM. Hepatitis B virus infection--natural history and clinical consequences. N Engl J Med. 2004;350:1118-1129. [PubMed] [DOI] |
| 7. | World Health Organization. Hepatitis B. Available from: http://www.who.int/en/news-room/fact-sheets/detail/hepatitis-b. |
| 8. | Tseng PL, Lu SN, Tung HD, Wang JH, Changchien CS, Lee CM. Determinants of early mortality and benefits of lamivudine therapy in patients with hepatitis B virus-related decompensated liver cirrhosis. J Viral Hepat. 2005;12:386-392. [PubMed] [DOI] |
| 9. | Watanabe N, Takashimizu S, Nishizaki Y, Kojima S, Kagawa T, Matsuzaki S. An endothelin A receptor antagonist induces dilatation of sinusoidal endothelial fenestrae: implications for endothelin-1 in hepatic microcirculation. J Gastroenterol. 2007;42:775-782. [PubMed] [DOI] |
| 10. | Richter K, Kietzmann T. Reactive oxygen species and fibrosis: further evidence of a significant liaison. Cell Tissue Res. 2016;365:591-605. [PubMed] [DOI] |
| 11. | Reuter S, Gupta SC, Chaturvedi MM, Aggarwal BB. Oxidative stress, inflammation, and cancer: how are they linked? Free Radic Biol Med. 2010;49:1603-1616. [PubMed] [DOI] |
| 12. | Bulua AC, Simon A, Maddipati R, Pelletier M, Park H, Kim KY, Sack MN, Kastner DL, Siegel RM. Mitochondrial reactive oxygen species promote production of proinflammatory cytokines and are elevated in TNFR1-associated periodic syndrome (TRAPS). J Exp Med. 2011;208:519-533. [PubMed] [DOI] |
| 13. | Rawlins ML, La'ulu SL, Moon N, Roberts WL. Performance characteristics of an immunoturbidimetric assay for lipoprotein-associated phospholipase A2. Clin Chim Acta. 2009;406:66-70. [PubMed] [DOI] |
| 14. | Stafforini DM. Biology of platelet-activating factor acetylhydrolase (PAF-AH, lipoprotein associated phospholipase A2). Cardiovasc Drugs Ther. 2009;23:73-83. [PubMed] [DOI] |
| 15. | 李 月春, 刘 国荣, 闫 洁. 缺氧对磷脂酶A2和脂蛋白相关磷脂酶A2及溶血磷脂酸的影响. 中华老年心脑血管病杂志. 2014;2:200-204. [DOI] |
| 16. | Liu Z, Li H, Zheng Y, Gao Z, Cong L, Yang L, Zhou Y. Association of Lipoprotein-Associated Phospholipase A2 with the Prevalence of Nonalcoholic Fatty Liver Disease: A Result from the APAC Study. Sci Rep. 2018;8:10127. [PubMed] [DOI] |
| 17. | Svetlov SI, Sturm E, Olson MS, Crawford JM. Hepatic regulation of platelet-activating factor acetylhydrolase and lecithin:cholesterol acyltransferase biliary and plasma output in rats exposed to bacterial lipopolysaccharide. Hepatology. 1999;30:128-136. [PubMed] [DOI] |
| 18. | Grypioti AD, Kostopanagiotou G, Mykoniatis M. Platelet-activating factor inactivator (rPAF-AH) enhances liver's recovery after paracetamol intoxication. Dig Dis Sci. 2007;52:2580-2590. [PubMed] [DOI] |