修回日期: 2019-09-02
接受日期: 2019-09-03
在线出版日期: 2019-12-08
肝细胞癌(hepatocellular carcinoma, HCC)是临床上常见的恶性肿瘤之一, HCC切除术后3年复发率约为50%, 5年复发率超过70%, 居高不下的高复发率严重影响HCC患者手术疗效和长期生存, 是导致HCC患者术后死亡的首要原因. HCC术后复发是一个多步骤、多环节、多因素和多分子参与的复杂过程, 涉及机体、微环境和肿瘤组织三个方面因素, 包括机体免疫力、局部pH值、间质压力、血管渗透压、炎性反应、肿瘤细胞黏附、细胞外基质降解、细胞迁移、细胞增殖和肿瘤血管形成等, 与多个基因表达异常和相关分子功能改变密切相关, 但HCC术后复发的分子机制仍未完全阐明, 需要更深入的研究. HCC术后复发如何治疗直接影响HCC患者预后, 涉及再次手术、肝移植、局部微创治疗、放疗、分子靶向药物、免疫和中医药治疗, 单一治疗方法难以达到治愈或控制肿瘤进展, 需要两种或两种以上治疗方法有机地联合, 达到协同增效的治疗效果. 针对患者的具体情况, 分析其个体特性, 结合临床医生的临床经验和最佳证据, 采取个体化的治疗方案, 选择合适的治疗方法是提高疗效的关键. 对于存在高危复发因素的HCC患者, 术后选择适当的治疗方法预防HCC复发, 是降低HCC术后复发率, 延长患者生存期的重要措施, 才能使术后HCC患者最大程度获益.
核心提要: 肝细胞癌(hepatocellular carcinoma, HCC)术后复发是一个多步骤、多环节的复杂过程, 与患者、肿瘤和相关分子功能异常密切相关. HCC术后复发治疗包括再次手术切除、肝移植、局部微创治疗、放疗、分子靶向药物、免疫和中医药治疗, 针对患者的具体情况, 采取个体化的治疗方案是提高疗效的关键. 对于存在高危复发因素的HCC患者, 术后选择适当的方法预防治疗, 是降低HCC术后复发率, 延长患者生存期的重要措施.
引文著录: 秦建民. 肝细胞癌切除术后复发的原因与防治策略. 世界华人消化杂志 2019; 27(23): 1407-1418
Revised: September 2, 2019
Accepted: September 3, 2019
Published online: December 8, 2019
Hepatocellular carcinoma (HCC) is one of the most common malignant tumors in China. The recurrence rate is about 50% at 3 years and over 70% at 5 years after hepatectomy for HCC. The high recurrence rate seriously affects the curative effect and long-term survival of patients with HCC, and is the primary cause of death after operation. Postoperative recurrence of HCC is a complex multi-step, multi-factorial process involving three factors: the body, microenvironment, and tumor tissue, which include body immunity, local pH value, interstitial pressure, vascular osmotic pressure, inflammatory reaction, tumor cell adhesion, extracellular matrix degradation, cell migration, cell proliferation, and tumor angiogenesis. HCC recurrence is closely related to abnormal gene expression and related molecular function changes, but the molecular mechanism has not been fully elucidated. How to treat the recurrence of HCC after operation directly affects the prognosis of patients with HCC, and treatments include reoperation, liver transplantation, local minimally invasive treatment, radiotherapy, molecular targeted drugs, immunotherapy, and traditional Chinese medicine treatment. It is difficult to cure or control tumor progression by a single therapy. Two or more therapeutic methods need to be combined organically to achieve a synergistic therapeutic effect. According to the specific situation of patients with HCC, it is key to analyze the individual characteristics of patients, to combine the clinical experience of clinicians and the best evidence, to adopt the individualized treatment plan, and to choose the appropriate treatment methods. For HCC patients with high-risk factors for recurrence, selecting the appropriate treatment is important to reduce the recurrence of HCC after operation and prolong the survival of patients.
- Citation: Qin JM. Postoperative recurrent factors and therapeutic and preventive strategies for hepatocellular carcinoma. Shijie Huaren Xiaohua Zazhi 2019; 27(23): 1407-1418
- URL: https://www.wjgnet.com/1009-3079/full/v27/i23/1407.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v27.i23.1407
肝细胞癌(hepatocellular carcinoma, HCC)是临床上常见的恶性肿瘤之一, 发病率居全球第五位, 死亡率为第三位[1]. HCC是我国第二大恶性肿瘤, 每年大约有30-40万人死于HCC, 约占全球HCC病死率的51%[2], HCC切除术后3年复发率约为50%, 5年复发率超过70%[3]. 小HCC术后5年复发率为40%-60%, 而大HCC术后5年复发率高达80%, 严重影响HCC患者预后[4]. HCC术后复发80%-90% 源于肝内复发, 10%-20%为多中心发生, 复发性肝脏肿瘤75%来自手术残留或肝内转移灶导致的残癌生长, 属于单克隆起源, 25%来自残肝新生肿瘤细胞克隆性生长, 属于多克隆起源[5,6]. HCC术后复发分为早期(术后2年内)和晚期复发(2年以上), 早期复发肿瘤来源于原发肿瘤肝内转移, 而晚期复发肿瘤来源于剩余肝脏产生新的肿瘤, 早晚期复发的肿瘤生物学行为、临床进程、预后存在差异[7]. HCC术后复发转移有两个高峰, 第1个高峰出现在HCC根治术后1年, 而后呈下降趋势, 复发率维持在低水平, 第2个复发高峰出现在术后4年[8] . HCC术后1、2、3、4、5年累计复发率分别为43.3%、56.6%、66.2%、72.3%、72.3%; 术后1、2、3、4、5年逐年复发率分别为43.3%、25.2%、27.1%、24.3%、0%[9]. HCC术后1年内复发者1、3、5年生存率分别为75.7%、36.6%、28.3%, 显著低于2年后复发者(100%、92.2%、68.6%)[10]. HCC术后2年内死亡的主要原因是肿瘤的早期复发, HCC术后复发、转移是一个多步骤、多环节、多因素和多分子参与的复杂过程, 涉及机体、微环境和肿瘤组织三个方面因素, 包括机体免疫力、局部pH值、间质压力、血管渗透压、炎性反应、肿瘤细胞黏附、细胞外基质降解、细胞迁移、细胞增殖和肿瘤血管形成等, 与多个基因表达异常和相关分子功能改变密切相关. HCC术后复发与转移的分子机制仍未完全阐明, 居高不下的高复发率严重影响HCC患者手术疗效和长期生存, 是导致HCC患者术后死亡的首要原因. 本文结合相关文献, 探讨HCC术后复发的原因及其防治策略.
与男性相比, 女性HCC患者术后复发率低, 有更好的预后, 可能与性激素受体差异性表达有关. 年轻HCC患者乙型肝炎表面抗原(hepatitis B surface antigen, HBsAg)阳性率高, 肿瘤包膜不完整, 多呈浸润性生长, 术后复发机率高于年老患者[11]. 合并乙型肝炎病毒(hepatitis B virus, HBV)/丙型肝炎病毒(hepatitis C virus, HCV)肝硬化的HCC患者术后复发率显著高于无肝炎或肝硬化患者, 尤其HBV基因C型、HBV和HCV同时感染的HCC患者术后复发风险更高[12,13]. 有肝硬化HCC患者术后肿瘤复发风险是无肝硬化患者的2.79倍, 肝硬化是HCC患者术后中晚期复发的唯一危险因素[14,15].
肿瘤直径<5 cm术后5年复发率为51.6%, 而肿瘤>5 cm术后5年复发率高达82.5%, 肿瘤>5 cm是HCC术后早期复发转移的危险因素[16,17]. 肿瘤数目>1个HCC患者术后5年内几乎均出现肝内复发, 与HCC多中心起源有关[18]. HCC微血管侵犯(microvascular invasion, MVI)发生率为29%-45%, 瘤体越大癌栓形成率越高, 肿瘤直径≤3 cm和>3 cm HCC的微血管癌栓发生率分别为6.9%和23.5%[19-21]. 肿瘤分化程度与发生MVI密切相关, 高分化HCC发生MVI为12%, 中分化HCC为29%, 低分化HCC高达50%, MVI是HCC术后早期复发的独立危险因素, 肿瘤>2 cm发生MVI对术后发生复发有预测作用[22,23]. MVI阳性HCC患者术后6 mo和1年肿瘤复发率分别为42.86%、51.02%, 术后1、3、5年累积生存率分别是86.5%、44.7%、35.8%; MVI阴性HCC患者术后6 mo和1年肿瘤复发率分别为22.06%、27.94%, 术后1、3、5年累积生存率分别是93.5%、84.5%、75.3%(P<0.05)[24]. 与无血管侵犯者相比, 肿瘤血管侵犯的HCC术后早期复发风险为2.215倍, 肿瘤肝外侵犯患者的早期复发风险是无肝外侵犯患者的2.299倍[25]. 伴血管癌栓的HCC患者术后肿瘤复发风险是无血管癌栓的3.796倍[14]. 肿瘤包膜不完整的HCC患者术后早期转移复发率是肿瘤包膜完整的1.4倍[26]. 肿瘤间质比<50%是HCC术后复发的高危因素[27]. 肿瘤直径、数目、卫星结节、脉管瘤栓和血管侵犯等与HCC术后复发率呈正相关, 肿瘤分化程度等与肿瘤复发率呈负相关[28].
HBV或/和HCV感染的HCC患者在根治性切除术后较非肝炎病毒感染的患者有较高的早期复发率, 且HBV合并HCV双重感染患者早期复发率更高, 提示HBV合并HCV感染使肝细胞恶变作用协同加强, 是促进HCC术后早期复发的重要因素[29-31]. 高水平的HBsAg和高病毒载量(HBV-DNA≥2000 IU/mL)是HBV相关HCC术后复发转移的独立危险因素[32]. 术后晚期复发与HBV活动引起的残肝持续炎症损害有关[33].
血管内皮生长因子(vascular endothelial growth factor, VEGF)、p53蛋白表达与肿瘤微血管密度(microvessel density, MVD)呈正相关, p53基因突变导致HCC组织中VEGF表达上调, 促进肿瘤血管生成和术后肿瘤复发和转移[34,35]. HCC组织Syk基因启动子甲基化发生率为29.7%, 与Syk基因启动子无甲基化相比, HCC患者术后复发转移发生率显著增高(73.7% vs 42.2%)[36]. 肝细胞生长因子(hepatocyte growth factor, HGF)能调节肿瘤增殖, 促进肿瘤的侵袭和转移, 肝细胞生长因子受体在HCC细胞生长、侵袭和转移中具有重要作用[37]. E-钙黏素使肿瘤细胞相互粘附、不易脱落, E-钙黏素低表达促使肿瘤的复发和转移[38]. PKC-α高表达的HCC患者术后3年累积复发率明显高于PKC-α低表达者[39]. 整合素α和β两个亚单位在HCC组织中表达较高时促进HCC复发转移. P和E选择素水平增高促进HCC细胞侵粘附袭, HCC术后具有较高的复发转移率[40]. CD44促进肿瘤血管侵犯和波形蛋白的表达, 导致HCC术后复发转移[41]. 骨桥蛋白表达水平与HCC术后转移复发呈正相关[42]. 磷脂酰肌醇蛋白多糖-3在HCC组织高表达, 促进术后肿瘤复发[43]. 与HCC术后复发转移正相关的分子: P16、H-ras、c-erbB-2、mdm-2、转化生长因子-α、表皮生长因子受体、基质金属蛋白酶(matrix metalloproteinase, MMP)-2、尿激酶型纤溶酶原激活剂、尿激酶型纤溶酶原激活剂受体、纤溶酶原激活物抑制因子-1、细胞间黏附分子-1、VEGF、血小板衍生内皮细胞生长因子、碱性成纤维细胞生长因子等; 与HCC术后复发转移负相关的分子: nm23-H1、KAL1 、基质金属蛋白酶-2抑制剂、整合素α5、E-钙黏素等[44,45].
与开放手术相比, 腹腔镜下HCC切除术可明显减少术中出血, 患者术后并发症少、恢复快, 但二者术后HCC复发率无明显差异[46,47]. HCC行规则性和非规则性肝切除术后1年复发率分别为24.14%、51.72%, 1年生存率分别为81.03%、63.79%, 差异显著(P<0.05)[48]. 手术操作对瘤体的挤压、肿瘤破裂可造成癌细胞脱落播散入血或腹腔, 肝切除量、术中失血量>1000 mL、输血量≥800 mL是HCC术后复发的独立危险因素[49-51]. HCC肿瘤切除时, 随着肝门阻断次数及时间的增加, 肝脏损伤逐渐加重, 导致肝脏局部VEGF mRNA、MMP-9 mRNA表达上调, 增加HCC细胞的侵袭性及转移, 是HCC术后复发的独立影响因素[52]. 间歇性肝门阻断的HCC患者, 术后1、2年的肿瘤复发率分别29.1%和46.8%, 均明显高于对照组患者的18.7%和35.5%[53]. 中央型HCC与第一、二肝门及较大血管相邻较近, 限制了肿瘤切缘距离, 易发生门静脉和胆道的播散, 术后复发率高于外周型HCC[54]. HCC手术切缘阴性且距离大于1 cm的患者术后复发率明显低于切缘低于1 cm患者[55]. 术中淋巴结是否清扫与HCC术后复发尚无确切定论[56]. HCC术后预防性TACE能够及时发现90%以上微小残留灶, 癌细胞在术后增殖的速度远高于术前, 对抗癌药物的敏感性最高, TACE使肝脏局部化疗药物浓度高, 有效抑制微转移灶及手术遗留下的微小残癌病灶, 防治术后肿瘤复发[57,58]. HCC患者术后行TACE预防性治疗1、2、3年的累积复发率分别为10%、45%、67.5%, 显著低于未行TACE预防治疗者(45.1%、66.2%、84.5%)[59].
(1)精神因素: 术前焦虑、抑郁情绪进一步破坏HCC患者术后的细胞免疫功能, 增加术后肿瘤复发风险[60]; (2)低蛋白血症: HCC术后晚期复发的危险因素, 表明机体的营养状态参与了肿瘤的发生发展[61]; (3)性激素: HCC术后复发与性激素比例失衡及雄激素受体阳性表达有关[62]. HCC术后复发患者E2/T值在术后6 mo、12 mo时再次显著升高, 雌激素受体β基因在术后复发的HCC组织中显著高表达, 参与HCC细胞增殖、RNA转录, 表明HCC术后复发与性激素比例失衡有关[63,64]; (4)术前血液甲胎蛋白(α-fetoprotein, AFP): AFP mRNA阳性的HCC患者较AFP mRNA阴性的HCC患者术后更容易产生复发或远处转移, 术前血AFP mRNA阳性的患者术后1、2、3年肿瘤复发率(58.3%、75%、100%)显著高于术前血AFP mRNA阴性的患者(23.6%、42.1%、68.4%), 术前血AFP水平越高, 术后早期复发率越高[65,66]; (5)血清脱-γ-羧基凝血酶原(de-gamma-carboxyl prothrombi, DCP): 血DCP≥100 AU/L与HCC切除术后肿瘤复发密切相关, 血清DCP≥400 AU/L与血清DCP水平在100-400 AU/L比较, 微血管浸润增加(62% vs 27%), 且肿瘤恶性程度更高(38% vs 16%)[67]; (6)HCC干细胞: HCC组织中HCC干细胞具有自我更新、多向分化能力, HCC干细胞增殖的不受控性、分化不成熟性和对常规治疗方法的抵抗性, 参与了HCC的发生、发展、转移和复发[68-70]. 术前外周血上皮细胞黏附因子(epithelial cell adhesion molecule, EpCAM)阳性HCC细胞数目≥2个的患者较术前EpCAM阳性HCC细胞数目<2个的患者具有更高的早期复发率, 术前EpCA M阳性HCC细胞数目≥2个是患者术后HCC复发的独立危险因素[71]; (7)循环肿瘤细胞(circulating tumor cells, CTC)手术前后CTC均阴性的HCC患者术后复发率为14.29%, 术前后CTC均阳性组HCC患者的术后复发率为46.15%, 术后CTC阴性患者术后复发率为17.65%, 术后CTC阳性患者术后复发率为35.59%. 术后CTC检测阳性的HCC患者复发率显著高于阴性患者[72]; (8)炎性细胞: 中性粒细胞通过释放各类趋化因子促进肿瘤细胞增殖、侵袭转移和定植, 帮助肿瘤细胞逃避免疫监视, 而淋巴细胞在抑制肿瘤增殖和转移, 肿瘤体积>183.59 cm3、术前血清中性粒细胞/淋巴细胞比值>2.215是HCC患者术后肿瘤复发的独立危险因素[73,74]; (9)MicroRNA: 是一类内源性非编码的小分子RNA, 长度为21-23 nt, 通过对靶基因转录后水平的负性调控作用, 降低靶基因表达水平, 参与调节肿瘤细胞的增殖、分化和凋亡等多个生物学进程. 邓治亮等[75]采用microRNA芯片技术筛选出mir-144、mir-451、mir-486-5p、mir-602、mir-551b、mir-96、mir-502-3p与原发性HCC术后早期复发密切相关. 促进HCC复发miRNA: miRNA-519a、miRNA-135a、miRNA-346; 抑制HCC复发miRNA: miRNA-214-3p、miRNA-30a、miRNA-589-5p、miRNA-126、miRNA-203、miRNA-630、miRNA-28-5p、miRNA-508-5p、miRNA-502-3p、miRNA-1258、miRNA-122. HCC组织中miRNA-9、miRNA-22、miRNA-155、miRNA-199a、miRNA-200a及miRNA-203, 以及血液中miRNA-148a、miRNA-192是预测HCC总生存期的潜在预后指标[76].
复发性HCC的治疗包括手术、局部消融、血管内介入、放疗等方法, 治疗方法的选择应根据肿瘤的生物学特征(部位、大小、数目、血管侵犯)、肝脏储备功能、残余肝体积以及病人的全身情况综合考虑.
原发性HCC术后复发再次手术切除率为10%-31%, 再次手术术后5年生存率为22%-83%, 与首次切除相近, 明显好于未治疗患者(2年生存率为7.3%)[77,78]. 术后复发HCC再切除适用于肿瘤单发或多发(≤3个), 无大血管侵犯, 肝功能Child A级, 无明显门静脉高压, 残余肝体积应占标准肝体积的30%-40%以上, 全身情况能够耐受手术的复发性HCC患者. 由于复发肿瘤部位、数目、剩余肝脏储备功能及前次手术引起的粘连等因素, 导致复发性HCC再切除率仅为20%[77]. 复发性HCC患者再次手术切除, 围手术期死亡率为1%, 再切除术后1、3、5年存活率分别为75.8%、45.7%与37.5%, 是复发性HCC最有效的治疗方法[79-81]. HCC术后复发时间、手术切缘、复发肿瘤最大径与血管侵犯是影响再次手术后疗效和预后的显著性影响因子[82].
对于肝功能Child B/C级, 存在明显门静脉高压, 残余肝体积占标准肝体积的30%以下, 无血管侵犯和远处转移但不能耐受再次手术切除的术后复发性HCC, 肝移植是最佳的有效治疗方法. 首次手术切除后肿瘤复发时间<1年的复发性HCC行肝移植术后1、3、5年总生存率分别为47%、21%、21%, 而首次切除后复发时间>1年的复发性HCC行肝移植术后1、3、5年总生存率分别为81%、45%、45%, 表明首次切除术后肿瘤复发时间间隔越长, 肝移植术后预后较好[83].
对于术后复发性HCC, 患者存在严重的心、肺、肾和肝功能障碍, 不能耐受手术, 或受肿瘤大小、数目、部位、剩余肝脏体积等因素影响无法再次手术切除, 或者有再次手术切除指证但患者/家属不愿意再次手术者, 可以选择肿瘤局部消融治疗(包括微波、射频、冷冻、无水酒精、不可逆性电穿孔等). 局部消融治疗适用于单个复发肿瘤, 最大径≤5 cm; 或复发肿瘤数目≤3个, 最大径≤3 cm, 同时无血管、胆管和邻近器官侵犯以及远处转移的术后复发HCC. 尤其对于单发、直径≤3 cm复发肿瘤疗效类似于手术切除, 避免再次手术, 而且局部消融可以反复、多次治疗, 能够最大限度地保护残余肝脏功能. 复发性HCC经局部射频消融(radiofrequency ablation, RFA)治疗后1、3、5和10年总生存率分别为94.7%、65.1%、37.3%和33.4%[84,85]. 局部消融治疗对于不适合手术或不愿再次手术的复发性HCC患者是有效的治疗方法, 疗效仅次于手术切除, 但对于复发肿瘤邻近肝门、膈顶、胆囊、胃结肠、肝内大血管等特殊部位, 肿瘤直径>5 cm, 数目>3个, 应慎重选择局部消融治疗, 以免引起大出血、胆漏、胃肠瘘及癌残留等严重并发症.
利用碘油、微球等栓塞剂栓塞肿瘤血管, 与肿瘤血管内注入化疗药物协同作用特点, 使肿瘤细胞缺血、缺氧、坏死、凋亡, 杀灭肿瘤细胞, 用于术后复发HCC的治疗. 钟崇等[86]研究发现肝动脉栓塞化疗(transarterial chemoembolization, TACE)治疗术后复发性HCC中位生存期为18 mo, 1、3、5年生存率分别是为70%、18%和6.8%. TACE栓塞形成的血流阻断或减少使栓塞远端动脉压力降低与近端动脉的压力差增加, 迫使小血管开放, 以减少两者间的压力差; 另外栓塞造成肿瘤组织缺血、缺氧导致血管活性物质增加, 促使侧枝血管开放. 肝外侧支供血动脉在3-4次TACE后出现率为17.9%, 5-6次TACE后高达56.4%, 侧枝循环和交通支的开放、异位血供的形成造成肿瘤供血血管栓塞不完全, 导致TACE难以完全杀灭肿瘤[87]. 由于TACE疗效取决于肿瘤滋养血管丰富和栓塞程度, 肿瘤侧枝循环和交通支的开放, 残癌的存在、局部缺氧致残癌细胞及血管内皮细胞的增殖、激活HBV的复制等因素严重影响TACE疗效, 导致TACE后3、5年存活率显著低于手术切除和RFA治疗[88]. 因此单一TACE治疗复发性HCC疗效受限, 需要与其它治疗方法联合才能提高疗效.
由于单纯TACE治疗肿瘤的完全坏死率仅20%左右, 肿瘤直径<3 cm与3-5 cm行RFA治疗一次毁损率分别为87.5%、80%, 肿瘤局部复发率为13.6%, 病灶的残留是影响TACE和局部消融治疗疗效的主要障碍[89-91]. 因此对于肿瘤数目>3个和/或最大直径>3 cm, 不适合手术切除的复发HCC患者宜采用多种微创方法联合治疗, TACE联合RFA可使残留肿瘤组织进一步坏死, 尤其对缺乏血供的肿瘤组织, RFA可直接通过高温杀伤肿瘤细胞, 增强TACE术后的疗效[92]. 先行TACE使HCC组织大部分血流被阻断, 减少肿瘤血供, 而后行射频/微波治疗, 能够降低热消融治疗时血流的"冷却效应", 导致射频/微波产生的热效应增加, 增大热凝固范围, 同时减低肿瘤内阻抗, 纤维间隔分解使肿瘤内热弥散分布更容易, 缩短热消融治疗时间, 二者互相结合协同降低癌残留, 显著提高肿瘤灭活效果[93]. TACE+RFA和再手术切除治疗复发性HCC, 1、2、3年生存率分别为75.8%、63.2%、51.7%和69.4%、58.3%、47.2%, 疗效及预后无显著性差异(P>0.05)[94]. TACE联合局部RFA治疗不仅拓宽了复发性HCC治疗的适应证, 而且术后肝功能损害恢复快, 是临床治疗复发性HCC有效治疗措施.
立体定向放射治疗(stereotactic body radiation therapy, SBRT)对靶区精确定位, 按照三维治疗计划制定照射野的数目、角度, 对复发肝肿瘤进行聚集照射, 使肿瘤组织达到更高的局部照射剂量和更低的正常组织并发症, 治疗后1、3、5年生存率分别为71.6%、31.8%和13%[95]. 125Ⅰ粒子置入肿瘤组织内持续发射X和γ射线, 通过电离作用产生氧自由基直接杀灭肿瘤细胞, 或使肿瘤细胞DNA双联断裂、诱导细胞凋亡. 125Ⅰ粒子置入肿瘤组织内治疗术后复发HCC, 1、3年生存率与手术切除无显著性差异[96,97]. 李欢等[98]采用射波刀治疗复发性HCC, 放疗后中位生存期34 mo, 患者1、2、3年总体生存率分别为91.2%、70.6%和44.1%, 1、2、3年的无进展生存率分别为55.9%、38.2%、29.4%, 具有较好的肿瘤局部控制效果. SBRT适用于无法手术、局部微创治疗的复发性HCC患者, 或联合微创、分子靶向药物等治疗达到协同增效治疗复发性HCC.
分子靶向药物治疗是针对在肿瘤发生、发展及转移过程中起关键作用的靶分子及其相关信号通路, 干扰或阻断其功效, 抑制肿瘤生长、转移. 分子靶向药物使原癌基因失活, 抑癌基因重激活, 阻断参与癌细胞生长、侵袭和转移相关信号传导通路分子, 干扰肿瘤细胞生长、侵袭的微环境, 激发机体免疫细胞杀灭肿瘤效应[99]. 近年来研发用于HCC治疗的分子靶向药物如索拉非尼、舒尼替尼、瑞戈非尼、乐伐替尼等对于晚期HCC治疗具有一定的疗效, 疾病控制率为38%-69%, 延长总生存率为3-9 mo[100,101]. 但对于晚期复发性HCC的治疗, 单一应用索拉非尼等分子靶向药物疗效有限, 索拉菲尼联合TACE及RFA、放疗能够显著提高疗效, 延长患者生存率[102]. 应用瑞戈非尼序贯治疗索拉非尼耐药的复发性HCC, 可使患者受益, 延长总生存期[103]. 但由于复发或转移性HCC的异质性高, 单一分子靶向药物的作用有限, 随着HCC复发与转移机制研究的不断深入, 寻找新的参与HCC细胞侵袭转移的分子靶点, 研制出更加有效治疗HCC的分子靶向药物, 需要作用不同靶点多种药或联合, 才能提高疗效, 改善复发性HCC患者预后.
由于手术创伤、麻醉、失血和围手术期输血等原因导致HCC患者术后早期细胞免疫功能进一步受到抑制, HCC细胞通过对自身表面抗原的修饰以及改变HCC组织周围的微环境来逃避机体的免疫识别与攻击, 抑制树突状细胞成熟, 影响调节性T细胞功能抑制免疫效应细胞功能, 导致HCC术后发生肿瘤免疫逃逸出现肿瘤复发与转移[104-106]. 免疫检查点抑制剂(PD-1、PD-L1等)、肿瘤免疫疫苗、溶瘤病毒、免疫细胞(CAR-T、TCR-T等)等免疫治疗方法已经用于进展期HCC的治疗, 但用于复发性HCC治疗临床报道较少, 随着临床应用实践, 不久会有类似的临床研究结果报道. 单用免疫治疗方法用于复发性HCC疗效受限, 临床上需要两种免疫抑制剂联合或免疫治疗联合化疗、放疗、分子靶向药物、TACE等方法, 才能提高疗效.
HCC术后患者在体质上是以气血两虚为主, 治疗HCC术后复发主要采用补益正气、扶正固本、清热解毒、化瘀散结的治疗原则. 刘展华等[107]采用参桃软肝丸以益气健脾养血为原则, 兼以活血化瘀消癞, 清热化湿解毒, 改善HCC术后复发患者的临床症状及机体功能状态和肝脏储备功能, 有效稳定瘤体, 3 mo、6 mo、10 mo生存率分别为82.31%、70.42%、50.33%, 显著高于对照组(72.7%、65.70%、46.33%), 延长了患者的中位生存期和无进展生存期. 中医药充分发挥了中医辨证与辨病相结合的独特优势, 把扶正和抗癌有机地结合起来, 在复发性HCC治疗中具有显著的优势, 不仅提高了带瘤患者的生存质量, 而且延长了患者的生存时间.
HCC术后复发高危因素: (1)单发病灶>5 cm; (2)病灶数>2处; (3)肿瘤无包膜或包膜不完整受累; (4)结节融合型肿瘤; (5)肿瘤紧贴大血管手术切缘<1 cm; (6)肉眼或术后病理检查镜下血管癌栓. 符合其中任意一条为术后高危复发患者[108-110]. 对于术后存在高危复发的HCC患者, 围手术期必须采取积极的有效措施, 才能有效降低术后肿瘤复发率.
术后在残肝断面植入5-FU缓释剂, 使局部药物浓度保持在全身药物浓度的20-500倍, 大剂量、低毒性和高浓度化疗药物持续性作用于肝脏创面, 在第一时间内杀灭肿瘤细胞, 提高术后抗复发效果[111]. HCC切除术后残肝断面植入5-Fu缓释剂对HCC的转移复发具有抑制作用, 术后复发率显著低于创面未用5-FU患者(13% vs 27%), 且不对肝功能造成影响, 不良反应率低[112]. HCC术中切缘放置125Ⅰ粒子后局部复发率3、5年为28.2%、37.5%, 明显低于单纯切除组(59.4%、87.5%), 表明术中应用125Ⅰ粒子植入对局部复发有显著抑制作用[113]. 对于术中因肿瘤位置临近大血管、胆管和重要脏器无法保证足够切缘的HCC患者, 术中切缘局部应用化疗药物、放射粒子等是降低术后肿瘤复发的重要措施.
HCC最常见的复发途径是经门静脉系统肝内播散, HCC术后行门静脉化疗能够最大程度地杀灭残存在门静脉内的微小癌栓或癌细胞, 避免癌细胞经同侧门静脉系统转移, 减少了HCC细胞在门静脉壁附着和生长, 同时保护机体的免疫功能, 降低术后肝内复发[114]. HCC术后4 wk左右, 肝功能及免疫功能基本恢复, 而残癌和癌前病变仍处于快速增殖阶段, 此时化疗为最最佳时机. HCC术后行门静脉化疗6 mo、1年、3年、5年的复发率分别为4%、30%、58%、76%, 无门静脉化疗复发率分别为12%、56%、72.1%、100%, HCC术后门静脉化疗显著降低HCC术后复发率[115]. HCC术后行肝动脉、门静脉、肝动脉联合门静脉灌注化疗1、2、3年肿瘤复发率分别为4.6%、25%和40%, 1.5%、45%和60%, 5.0%、20.7%和45.9%, 未化疗1、2、3年肿瘤复发率分别为50%、50%和72.2%, 表明不同化疗途径对肿瘤复发率无显著影响, 但采用门静脉和/或肝动脉化疗能够显著降低术后肿瘤复发率[116].
HCC术后2 mo内, 若有残留癌细胞开始向组织浸润定位着床, 肿瘤血管生成, 形成显微镜下浸润, 此时进行肝动脉预防量的化疗栓塞治疗, 能够阻断肿瘤血供, 杀灭肿瘤细胞, 因此术后第1年定期行肝动脉预防性栓塞化疗不仅能够早期发现转移复发病灶(敏感性为92%)并及时给予有效的治疗, 早期消灭HCC术后残留的微小病灶, 减少肿瘤多中心生长的机会, 而且又能延迟肿瘤复发时间, 降低术后肿瘤转移复发率[117,118]. HCC根治性术后1-2 mo首次TACE , 若无复发灶, 则依次行第2、3次, 治疗间隔时间为2-4 mo, 既能及早有效的杀灭残癌细胞或癌前病变, 又能最大限度的保护肝功能, 覆盖了术后1年内的复发高峰期[119]. 行3次及3次以上TACE治疗的HCC患者中位生存时间明显高于1次或2次治疗的患者, 但重复多次的TACE治疗在增加肿瘤坏死的同时, 对肝功能产生损害, 导致肝脏纤维化及引起或加重肝硬变[120]. 肝脏功能损害的程度与TACE介入治疗次数成正比, 经过3次以上的TACE治疗易导致栓塞部位的血管闭锁, 栓塞化疗药物无法积聚而影响疗效, 同时形成新的肝外侧枝动脉血供, 使肿瘤产生新的滋养血管, 促使肿瘤的复发[121,122]. HCC术后≤3次预防性TACE治疗能够明显提高HCC术后患者3年生存率, >3次TACE治疗对HCC患者术后3年无瘤生存率无明显影响[123]. 因此TACE用于预防HCC术后高危复发患者治疗不宜超过3次, 对于存在高危复发因素的乙肝病毒相关HCC患者术后TACE能够显著降低33%肿瘤复发率, 术后3年总生存率增加7.8%, 但对于肿瘤直径≤3 cm、有完整包膜、手术切缘距离≥2 cm, 无血管侵犯的HCC患者, HCC术后预防性TACE对其复发和无瘤生存期无显著影响, 术后不建议预防性TACE治疗[124,125].
HBeAg阳性、术前HBV-DNA水平可检测、Ishak炎症评分高、术前TACE、手术时间长、输血是乙肝相关HCC患者术后HBV再活化的独立危险因素. HCC根治性切除术后HBV病毒再激活率为28%, 化疗使HCC患者HBV病毒再激活率为19%-55%, 术后HBV病毒的再激活显著影响HCC患者的预后[126]. HBV高负荷是HCC术后肿瘤复发的独立危险因素[127]. HBV感染进一步加重患者肝硬化程度, 程度较重的肝硬化患者术后肝脏的耐受能力较差, 而肝脏的基础炎性、纤维化和硬变加速术后残肝新癌灶的生长导致肿瘤复发. 另外HCV的感染使肝细胞性HCC分化性降低, HBV和HCV双重感染使术后复发率显著增加[128,129]. 外周血乙肝病毒含量>2000 IU/mL, 抗乙肝病毒治疗能够减轻剩余肝脏慢性炎症, 改善肝功能, 降低肿瘤发展风险和晚期肿瘤复发, 提高术后无瘤生存, 抗乙肝病毒治疗是晚期肿瘤复发的独立保护因素[130-132]. 对于术前在基线水平低病毒载量HBV-DNA水平的HCC患者, 术后5年累积HCC复发率为67.7%, 抗病毒治疗不仅能预防HBV再激活, 降低术后晚期肿瘤复发率, 而且能提高术后生存率, 因此低病毒载量的HBV相关的HCC患者术后亦应该立即进行抗病毒治疗[133]. 干扰素不仅可以增强HCC术后患者的细胞免疫功能, 而且通过抑制乙肝和丙肝病毒的复制, 降低乙型和丙型肝炎病毒导致的肝硬化患者的HCC发生率[134,135], 从而有助于降低乙肝和丙肝相关HCC切除术后的复发率.
HCC术后无瘤生存期≤1年的患者, CD4+T细胞数相对较低, CD8+T细胞数相对较高, CD4+/CD8+比值低, 表明患者细胞免疫功能低下, 容易早期复发; 术后无瘤生存期≥2年的HCC患者, CD4+T细胞数较高, CD8+T细胞数相对较低, CD4+/CD8+比值增高, 表明患者细胞免疫功能较强, 不容易出现复发. 术后肿瘤复发前有一个细胞免疫功能逐渐下降的过程, 及时对HCC术后患者进行免疫增强治疗, 能够延缓肿瘤的复发、转移[136]. HCC术后行辅助过继免疫治疗, 3年复发率可降到52.6%-69%[137], 表明术后严密监测HCC患者机体细胞和体液免疫功能变化, 及时给予相应的免疫治疗, 降低HCC术后肿瘤复发.
分子靶向药物通过阻断HCC细胞和相关细胞信号传导, 控制细胞致癌基因表达改变, 在不损伤正常细胞情况下抑制或杀灭肿瘤细胞[138]. 目前多激酶靶点抑制剂如索拉非尼、仑伐替尼、瑞戈非尼已用于不可手术切除HCC的靶向治疗药物, 提高HCC患者的生存率[139,140]. HCC患者术后服用索拉非尼4 mo, 复发时间为21.5 mo±2.0 mo, 显著高于未服用索拉非尼者(13.4 mo±2.7 mo) , 术后复发率29.4%显著低于未服用索拉非尼者70.7%, 表明索拉非尼具有防止HCC术后早期复发的作用[141]. 但关于分子靶向药物用于预防HCC术后复发目前国内外尚缺乏多中心临床研究, 药物选择、应用时机、剂量、疗程、不同靶点药物联合及与其它治疗联合等均需要进一步深入研究, 才能有效降低HCC术后肿瘤复发率.
健脾化瘀法通过调节机体免疫、改善残余肝脏功能、诱导细胞凋亡等多途径和多靶点抗HCC术后复发[142]. As2O3通过诱导HCC细胞凋亡、抑制HCC细胞增殖和VEGF信号通路, 从而控制肿瘤血管形成以及抑制HCC细胞侵袭, 降低术后早期复发率(29.2%)[143,144]. 槐耳颗粒通过激活自然杀伤细胞活性, 诱导和产生α和γ干扰素, 提高体液免疫能力, 改善HCC患者的免疫功能状态, 影响血管内皮细胞的增殖、迁移和附壁能力及血管生成, 下调患者血清VEGF表达. 服用槐耳颗粒HCC患者术后转移复发率40.9%显著低于未服用者61.7%[145]. 另外复方斑蝥胶囊、金龙胶囊、平消胶囊、贞芪扶正颗粒等中药亦可用于HCC术后患者, 能够不同程度改善HCC患者术后机体免疫功能, 破淤散结, 扶正祛邪, 降低术后肿瘤复发率.
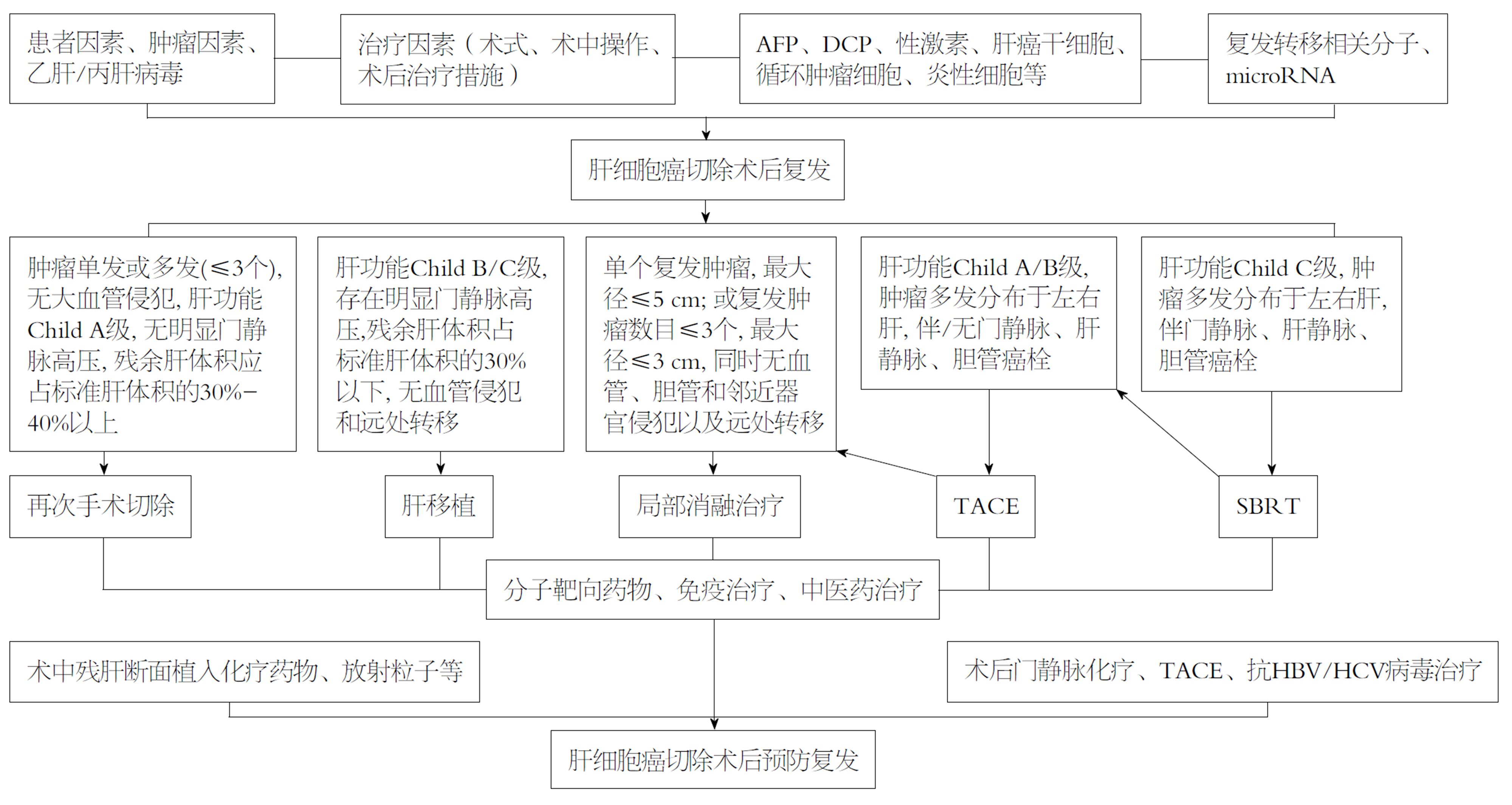
复发性HCC的治疗以手术切除作为首先选择, 其次依据患者情况选择局部微创消融、TACE、放疗等治疗, 当单一治疗方式不能完全控制肿瘤时, 需要采用多种方法联合治疗模式, 以提高疗效(图1). 常用的联合治疗方式有手术+TACE、TACE+RFA/MCT、RFA/MCT+PEI、TACE/RFA/MCT+放疗/生物治疗/分子靶向药物治疗等. TACE联合RFA/MCT治疗的策略是目前比较常用的治疗模式, 这种互补性极强的双模式的序贯应用协同增效, 显著提高肿瘤的局部坏死率和疗效, TACE联合局部微波消融治疗后3年、5年生存率为50%、31%, 疗效显著高于单一TACE治疗[146]. RFA联合索拉非尼和干扰素治疗复发性HCC, 治疗后1、3和 5年总体生存率分别为87.9%、45.1%和12%, 而RFA联合索拉非尼治疗后分别为84.3%、27.4%和6.8%(P<0.05)[147], 表明对于复发性HCC患者, 多种方法联合治疗是安全、协同增效, 不仅提高患者的生活质量, 而且延长患者的总体生存率. HCC术后复发的预防从术前、术中、术后三个环节进行, 针对HCC术后复发原因及高危因素, 依据患者的具体情况, 采用个体化的治疗方案. 对不能手术切除的复发性HCC, 术前采用TACE、放疗、分子靶向药物等降期治疗使肿瘤缩小, 提高再次手术切除率; 术中严格遵守外科手术基本原则, 掌握好手术切缘, 避免术中不必要的出血及输血; 术后抗病毒、预防性TACE、分子靶向药物、免疫和中医药等治疗, 定时、长期随访. HCC术后复发严重影响患者长期生存, 只有深入研究复发转移的机制和围手术期采取严格的防治措施, 才能降低术后肿瘤复发率, 改善术后HCC患者预后.
学科分类: 胃肠病学和肝病学
手稿来源地: 上海市
同行评议报告分类
A级 (优秀): A
B级 (非常好): B, B
C级 (良好): 0
D级 (一般): 0
E级 (差): 0
编辑: 王禹乔 电编:刘继红
| 1. | de'Angelis N, Landi F, Carra MC, Azoulay D. Managements of recurrent hepatocellular carcinoma after liver transplantation: A systematic review. World J Gastroenterol. 2015;21:11185-11198. [PubMed] [DOI] |
| 2. | Wang FS, Fan JG, Zhang Z, Gao B, Wang HY. The global burden of liver disease: the major impact of China. Hepatology. 2014;60:2099-2108. [PubMed] [DOI] |
| 3. | Zou H, Zhu CZ, Wang C, Wang ZS, Ma X, Han B, Wu LQ. Recurrence of Barcelona Clinic Liver Cancer Stage A Hepatocellular Carcinoma After Hepatectomy. Am J Med Sci. 2017;354:262-267. [PubMed] [DOI] |
| 4. | Li D, Kang J, Golas BJ, Yeung VW, Madoff DC. Minimally invasive local therapies for liver cancer. Cancer Biol Med. 2014;11:217-236. [PubMed] [DOI] |
| 7. | Wu JC, Huang YH, Chau GY, Su CW, Lai CR, Lee PC, Huo TI, Sheen IJ, Lee SD, Lui WY. Risk factors for early and late recurrence in hepatitis B-related hepatocellular carcinoma. J Hepatol. 2009;51:890-897. [PubMed] [DOI] |
| 8. | Imamura H, Matsuyama Y, Tanaka E, Ohkubo T, Hasegawa K, Miyagawa S, Sugawara Y, Minagawa M, Takayama T, Kawasaki S, Makuuchi M. Risk factors contributing to early and late phase intrahepatic recurrence of hepatocellular carcinoma after hepatectomy. J Hepatol. 2003;38:200-207. [PubMed] [DOI] |
| 10. | Hayashi M, Shimizu T, Hirokawa F, Inoue Y, Komeda K, Asakuma M, Miyamoto Y, Takeshita A, Shibayama Y, Tanigawa N. Clinicopathological risk factors for recurrence within one year after initial hepatectomy for hepatocellular carcinoma. Am Surg. 2011;77:572-578. [PubMed] |
| 11. | Yeh CN, Lee WC, Jeng LB, Chen MF. Hepatic resection for hepatocellular carcinoma in elderly patients. Hepatogastroenterology. 2004;51:219-223. [PubMed] |
| 12. | Chang CH, Chau GY, Lui WY, Tsay SH, King KL, Wu CW. Long-term results of hepatic resection for hepatocellular carcinoma originating from the noncirrhotic liver. Arch Surg. 2004;139:320-5; discussion 326. [PubMed] [DOI] |
| 13. | Chen JD, Liu CJ, Lee PH, Chen PJ, Lai MY, Kao JH, Chen DS. Hepatitis B genotypes correlate with tumor recurrence after curative resection of hepatocellular carcinoma. Clin Gastroenterol Hepatol. 2004;2:64-71. [PubMed] |
| 15. | Yamamoto J, Kosuge T, Takayama T, Shimada K, Yamasaki S, Ozaki H, Yamaguchi N, Makuuchi M. Recurrence of hepatocellular carcinoma after surgery. Br J Surg. 1996;83:1219-1222. [PubMed] |
| 17. | Hirokawa F, Hayashi M, Asakuma M, Shimizu T, Inoue Y, Uchiyama K. Risk factors and patterns of early recurrence after curative hepatectomy for hepatocellular carcinoma. Surg Oncol. 2016;25:24-29. [PubMed] [DOI] |
| 18. | Geller DA, Tsung A, Marsh JW, Dvorchik I, Gamblin TC, Carr BI. Outcome of 1000 liver cancer patients evaluated at the UPMC Liver Cancer Center. J Gastrointest Surg. 2006;10:63-68. [PubMed] [DOI] |
| 19. | Eguchi S, Takatsuki M, Hidaka M, Soyama A, Tomonaga T, Muraoka I, Kanematsu T. Predictor for histological microvascular invasion of hepatocellular carcinoma: a lesson from 229 consecutive cases of curative liver resection. World J Surg. 2010;34:1034-1038. [PubMed] [DOI] |
| 20. | Sumie S, Kuromatsu R, Okuda K, Ando E, Takata A, Fukushima N, Watanabe Y, Kojiro M, Sata M. Microvascular invasion in patients with hepatocellular carcinoma and its predictable clinicopathological factors. Ann Surg Oncol. 2008;15:1375-1382. [PubMed] [DOI] |
| 21. | Lu XY, Xi T, Lau WY, Dong H, Xian ZH, Yu H, Zhu Z, Shen F, Wu MC, Cong WM. Pathobiological features of small hepatocellular carcinoma: correlation between tumor size and biological behavior. J Cancer Res Clin Oncol. 2011;137:567-575. [PubMed] [DOI] |
| 22. | Esnaola NF, Lauwers GY, Mirza NQ, Nagorney DM, Doherty D, Ikai I, Yamaoka Y, Regimbeau JM, Belghiti J, Curley SA, Ellis LM, Vauthey JN. Predictors of microvascular invasion in patients with hepatocellular carcinoma who are candidates for orthotopic liver transplantation. J Gastrointest Surg. 2002;6:224-32; discussion 232. [PubMed] |
| 25. | 陈 凯, 杨 洪吉, 邓 小凡, 张 宇, 朱 世凯, 赵 冀, 刘 兴超, 陈 云飞. 肝癌根治性切除术后早期复发危险因素分析及预测模型构建. 中华肿瘤防治杂志. 2018;25:344-348. |
| 26. | 黄 晓曦, 江 雪梅, 刘 英, 成 建斌, 陈 小朋, 余 湘南, 林 松挺, 陈 正义. 原发性肝细胞癌术后早期转移复发的相关因素分析. 海南医学杂志. 2016;27:3857-3859. [DOI] |
| 27. | Lv Z, Cai X, Weng X, Xiao H, Du C, Cheng J, Zhou L, Xie H, Sun K, Wu J, Zheng S. Tumor-stroma ratio is a prognostic factor for survival in hepatocellular carcinoma patients after liver resection or transplantation. Surgery. 2015;158:142-150. [PubMed] [DOI] |
| 28. | 胡 继科, 李 雪梅, 张 凡, 谷 保红, 苏 锐良, 马 智军, 陈 昊, 李 玉民. 肝癌术后复发危险因素影响研究进展. 中华肝胆外科杂志. 2018;24:644-648. [DOI] |
| 30. | Walter P, Ron D. The unfolded protein response: from stress pathway to homeostatic regulation. Science. 2011;334:1081-1086. [PubMed] [DOI] |
| 31. | Song DS, Bae SH. Changes of guidelines diagnosing hepatocellular carcinoma during the last ten-year period. Clin Mol Hepatol. 2012;18:258-267. [PubMed] [DOI] |
| 32. | Yan PG, Wang RY, Zhang J, Cong WM, Dong H, Yu HY, Lau WY, Wu MC, Zhou WP. Impact of Preoperative Hepatitis B Virus Levels on Prognosis After Primary and Repeat Hepatectomies for Hepatocellular Carcinoma Patients-a Retrospective Study. J Gastrointest Surg. 2018;22:872-883. [PubMed] [DOI] |
| 37. | Gao J, Inagaki Y, Song P, Qu X, Kokudo N, Tang W. Targeting c-Met as a promising strategy for the treatment of hepatocellular carcinoma. Pharmacol Res. 2012;65:23-30. [PubMed] [DOI] |
| 38. | Van den Bossche J, Van Ginderachter JA. E-cadherin: from epithelial glue to immunological regulator. Eur J Immunol. 2013;43:34-37. [PubMed] [DOI] |
| 40. | Ferroni P, Spila A, D'Alessandro R, Martini F, Iacovone F, Ettorre GM, Vennarecci G, Santoro R, Puoti C, Guadagni F. Platelet activation and vascular endothelial growth factor 165 release in hepatocellular cancer. Clin Chim Acta. 2011;412:450-454. [PubMed] [DOI] |
| 41. | Mima K, Okabe H, Ishimoto T, Hayashi H, Nakagawa S, Kuroki H, Watanabe M, Beppu T, Tamada M, Nagano O, Saya H, Baba H. CD44s regulates the TGF-β-mediated mesenchymal phenotype and is associated with poor prognosis in patients with hepatocellular carcinoma. Cancer Res. 2012;72:3414-3423. [PubMed] [DOI] |
| 42. | 王 代宏, 王 伟, 王 芳元. 联合检测VEGF、OPN对原发性肝癌术后复发转移及预后的意义. 湖北科技学院学报(医学版). 2015;29:280-283. |
| 43. | 蒋 国华, 廖 维甲, 覃 理灵, 梅 铭惠, 陈 谦, 袁 晟光, 刘 杰. 磷脂酰肌醇蛋白多糖-3在肝细胞肝癌的表达及其与术后复发的相关性. 中国实验诊断学. 2011;15:1663-1668. [DOI] |
| 44. | Qin LX, Tang ZY. The prognostic molecular markers in hepatocellular carcinoma. World J Gastroenterol. 2002;8:385-392. [PubMed] [DOI] |
| 46. | Lee JJ, Conneely JB, Smoot RL, Gallinger S, Greig PD, Moulton CA, Wei A, McGilvray I, Cleary SP. Laparoscopic versus open liver resection for hepatocellular carcinoma at a North-American Centre: a 2-to-1 matched pair analysis. HPB (Oxford). 2015;17:304-310. [PubMed] [DOI] |
| 47. | Kim H, Suh KS, Lee KW, Yi NJ, Hong G, Suh SW, Yoo T, Park MS, Choi Y, Lee HW. Long-term outcome of laparoscopic versus open liver resection for hepatocellular carcinoma: a case-controlled study with propensity score matching. Surg Endosc. 2014;28:950-960. [PubMed] [DOI] |
| 49. | 李 涛, 樊 嘉, 钦 伦秀, 周 俭, 孙 惠川, 叶 青海, 邱 双键, 王 鲁, 汤 钊猷. 透明细胞型肝癌术后早期及晚期复发的多因素分析. 中华肝胆外科杂志. 2012;18:578-581. [DOI] |
| 50. | Katz SC, Shia J, Liau KH, Gonen M, Ruo L, Jarnagin WR, Fong Y, D'Angelica MI, Blumgart LH, Dematteo RP. Operative blood loss independently predicts recurrence and survival after resection of hepatocellular carcinoma. Ann Surg. 2009;249:617-623. [PubMed] [DOI] |
| 52. | Ishii Y, Nakasato Y, Kobayashi S, Yamazaki Y, Aoki T. A study on angiogenesis-related matrix metalloproteinase networks in primary hepatocellular carcinoma. J Exp Clin Cancer Res. 2003;22:461-470. [PubMed] |
| 55. | Sun HC, Tang ZY. Preventive treatments for recurrence after curative resection of hepatocellular carcinoma--a literature review of randomized control trials. World J Gastroenterol. 2003;9:635-640. [PubMed] [DOI] |
| 56. | 胡 继科, 李 雪梅, 张 凡, 谷 保红, 苏 锐良, 马 智军, 陈 昊, 李 玉民. 肝癌术后复发危险因素影响研究进展. 中华肝胆外科杂志. 2018;24:644-648. [DOI] |
| 57. | Li Z, Ni RF, Busireddy KK, Jin YH, Zhao X, Li MM, Yang C. Cerebral lipiodol embolism following transcatheter arterial chemoembolization for hepatocellular carcinoma: a report of two cases and literature review. Chin Med J (Engl). 2011;124:4355-4358. [PubMed] |
| 58. | Ashoori N, Paprottka P, Trumm C, Bamberg F, Kolligs FT, Rentsch M, Reiser MF, Jakobs TF. Multimodality treatment with conventional transcatheter arterial chemoembolization and radiofrequency ablation for unresectable hepatocellular carcinoma. Digestion. 2012;85:18-26. [PubMed] [DOI] |
| 61. | Du ZG, Wei YG, Chen KF, Li B. Risk factors associated with early and late recurrence after curative resection of hepatocellular carcinoma: a single institution's experience with 398 consecutive patients. Hepatobiliary Pancreat Dis Int. 2014;13:153-161. [PubMed] |
| 65. | 刘 扬, 王 跃如, 王 龙, 周 波, 宋 振顺, Butterfield Lisa H. 张柏和, 吴孟超. 血液甲胎蛋白mRNA对肝癌术后复发转移的影响: 3年回顾性研究. 中华肝胆外科杂志. 2014;20:697-699. [DOI] |
| 67. | Iguchi T, Shirabe K, Aishima S, Wang H, Fujita N, Ninomiya M, Yamashita Y, Ikegami T, Uchiyama H, Yoshizumi T, Oda Y, Maehara Y. New Pathologic Stratification of Microvascular Invasion in Hepatocellular Carcinoma: Predicting Prognosis After Living-donor Liver Transplantation. Transplantation. 2015;99:1236-1242. [PubMed] [DOI] |
| 68. | Suetsugu A, Nagaki M, Aoki H, Motohashi T, Kunisada T, Moriwaki H. Characterization of CD133+ hepatocellular carcinoma cells as cancer stem/progenitor cells. Biochem Biophys Res Commun. 2006;351:820-824. [PubMed] [DOI] |
| 69. | Yamashita T, Ji J, Budhu A, Forgues M, Yang W, Wang HY, Jia H, Ye Q, Qin LX, Wauthier E, Reid LM, Minato H, Honda M, Kaneko S, Tang ZY, Wang XW. EpCAM-positive hepatocellular carcinoma cells are tumor-initiating cells with stem/progenitor cell features. Gastroenterology. 2009;136:1012-1024. [PubMed] [DOI] |
| 70. | Oishi N, Yamashita T, Kaneko S. Molecular biology of liver cancer stem cells. Liver Cancer. 2014;3:71-84. [PubMed] [DOI] |
| 71. | Sun YF, Xu Y, Yang XR, Guo W, Zhang X, Qiu SJ, Shi RY, Hu B, Zhou J, Fan J. Circulating stem cell-like epithelial cell adhesion molecule-positive tumor cells indicate poor prognosis of hepatocellular carcinoma after curative resection. Hepatology. 2013;57:1458-1468. [PubMed] [DOI] |
| 73. | 袁 琳, 万 磊, 陈 佳佳, 刘 建军, 阚 和平, 谭 永法. 术前TTV、NLR及HBV-DNA定量对预测肝癌术后复发的价值. 现代消化及介入诊疗杂志. 2015;2:99-102. [DOI] |
| 74. | Halazun KJ, Hardy MA, Rana AA, Woodland DC 4th, Luyten EJ, Mahadev S, Witkowski P, Siegel AB, Brown RS Jr, Emond JC. Negative impact of neutrophil-lymphocyte ratio on outcome after liver transplantation for hepatocellular carcinoma. Ann Surg. 2009;250:141-151. [PubMed] [DOI] |
| 75. | 邓 治亮, 孙 建, 区 应亮, 侯 宝华, 简 志祥, 区 金锐. 原发性肝癌术后早期复发密切相关 microRNA 的筛选及应用. 中山大学学报(医学科学版). 2012;33:494-498. |
| 76. | 赵 英安, 李 福军. microRNA 在肝癌复发转移中的研究进展. 中国普外基础与临床杂志. 2018;25:1403-1407. [DOI] |
| 77. | Chan DL, Morris DL, Chua TC. Clinical efficacy and predictors of outcomes of repeat hepatectomy for recurrent hepatocellular carcinoma - a systematic review. Surg Oncol. 2013;22:e23-e30. [PubMed] [DOI] |
| 78. | Cabibbo G, Enea M, Attanasio M, Bruix J, Craxì A, Cammà C. A meta-analysis of survival rates of untreated patients in randomized clinical trials of hepatocellular carcinoma. Hepatology. 2010;51:1274-1283. [PubMed] [DOI] |
| 79. | Zou Q, Li J, Wu D, Yan Z, Wan X, Wang K, Shi L, Lau WY, Wu M, Shen F. Nomograms for Pre-operative and Post-operative Prediction of Long-Term Survival of Patients Who Underwent Repeat Hepatectomy for Recurrent Hepatocellular Carcinoma. Ann Surg Oncol. 2016;23:2618-2626. [PubMed] [DOI] |
| 80. | Chen X, Chen Y, Li Q, Ma D, Shen B, Peng C. Radiofrequency ablation versus surgical resection for intrahepatic hepatocellular carcinoma recurrence: a meta-analysis. J Surg Res. 2015;195:166-174. [PubMed] [DOI] |
| 81. | Wang DY, Liu L, Qi XS, Su CP, Chen X, Liu X, Chen J, Li HY, Guo XZ. Hepatic Re-resection Versus Transarterial Chemoembolization for the Treatment of Recurrent Hepatocellular Carcinoma after Initial Resection: a Systematic Review and Meta-analysis. Asian Pac J Cancer Prev. 2015;16:5573-5578. [PubMed] [DOI] |
| 83. | Hu Z, Zhou J, Li Z, Xiang J, Qian Z, Wu J, Zhang M, Zheng S. Time interval to recurrence as a predictor of overall survival in salvage liver transplantation for patients with hepatocellular carcinoma associated with hepatitis B virus. Surgery. 2015;157:239-248. [PubMed] [DOI] |
| 84. | Fukuhara T, Aikata H, Hyogo H, Honda Y, Morio K, Morio R, Hatooka M, Kobayashi T, Naeshiro N, Kawaoka T, Tsuge M, Hiramatsu A, Imamura M, Kawakami Y, Chayama K. Efficacy of radiofrequency ablation for initial recurrent hepatocellular carcinoma after curative treatment: Comparison with primary cases. Eur J Radiol. 2015;84:1540-1545. [PubMed] [DOI] |
| 85. | Peng ZW, Zhang YJ, Chen MS, Xu L, Liang HH, Lin XJ, Guo RP, Zhang YQ, Lau WY. Radiofrequency ablation with or without transcatheter arterial chemoembolization in the treatment of hepatocellular carcinoma: a prospective randomized trial. J Clin Oncol. 2013;31:426-432. [PubMed] [DOI] |
| 87. | Wang YL, Li MH, Cheng YS, Shi HB, Fan HL. Influential factors and formation of extrahepatic collateral artery in unresectable hepatocellular carcinoma. World J Gastroenterol. 2005;11:2637-2642. [PubMed] [DOI] |
| 88. | Wang K, Liu G, Li J, Yan Z, Xia Y, Wan X, Ji Y, Lau WY, Wu M, Shen F. Early intrahepatic recurrence of hepatocellular carcinoma after hepatectomy treated with re-hepatectomy, ablation or chemoembolization: a prospective cohort study. Eur J Surg Oncol. 2015;41:236-242. [PubMed] [DOI] |
| 89. | 吴 沛宏, 张 福君, 赵 明, 范 卫君, 黄 金华, 顾 仰葵, 李 立. 肝动脉栓塞化疗联合CT导向射频消融术治疗中、晚期肝癌的评价. 中华放射学杂志. 2003;37:901-904. |
| 90. | Lu MD, Yin XY, Xie XY, Xu HX, Xu ZF, Liu GJ, Kuang M, Zheng YL. Percutaneous thermal ablation for recurrent hepatocellular carcinoma after hepatectomy. Br J Surg. 2005;92:1393-1398. [PubMed] [DOI] |
| 91. | Choi D, Lim HK, Rhim H, Kim YS, Yoo BC, Paik SW, Joh JW, Park CK. Percutaneous radiofrequency ablation for recurrent hepatocellular carcinoma after hepatectomy: long-term results and prognostic factors. Ann Surg Oncol. 2007;14:2319-2329. [PubMed] [DOI] |
| 92. | Veltri A, Moretto P, Doriguzzi A, Pagano E, Carrara G, Gandini G. Radiofrequency thermal ablation (RFA) after transarterial chemoembolization (TACE) as a combined therapy for unresectable non-early hepatocellular carcinoma (HCC). Eur Radiol. 2006;16:661-669. [PubMed] [DOI] |
| 93. | Dodd GD, Soulen MC, Kane RA, Livraghi T, Lees WR, Yamashita Y, Gillams AR, Karahan OI, Rhim H. Minimally invasive treatment of malignant hepatic tumors: at the threshold of a major breakthrough. Radiographics. 2000;20:9-27. [PubMed] [DOI] |
| 94. | 张 辉, 徐 新保, 何 晓军, 刘 承利, 张 洪义. 肝动脉栓塞化学治疗联合射频消融与再次手术切除治疗原发性肝癌术后复发的疗效比较. 新乡医学院学报. 2014;31:928-930 [doi: 10.7683/xxyxyxb.2014.11.018]. |
| 99. | Finn RS. Emerging targeted strategies in advanced hepatocellular carcinoma. Semin Liver Dis. 2013;33 Suppl 1:S11-S19. [PubMed] [DOI] |
| 100. | Faivre S, Raymond E, Boucher E, Douillard J, Lim HY, Kim JS, Zappa M, Lanzalone S, Lin X, Deprimo S, Harmon C, Ruiz-Garcia A, Lechuga MJ, Cheng AL. Safety and efficacy of sunitinib in patients with advanced hepatocellular carcinoma: an open-label, multicentre, phase II study. Lancet Oncol. 2009;10:794-800. [PubMed] [DOI] |
| 101. | Aprile G, Bonotto M, Ongaro E, Pozzo C, Giuliani F. Critical appraisal of ramucirumab (IMC-1121B) for cancer treatment: from benchside to clinical use. Drugs. 2013;73:2003-2015. [PubMed] [DOI] |
| 102. | Peng Z, Chen S, Wei M, Lin M, Jiang C, Mei J, Li B, Wang Y, Li J, Xie X, Chen M, Qian G, Kuang M. Advanced Recurrent Hepatocellular Carcinoma: Treatment with Sorafenib Alone or in Combination with Transarterial Chemoembolization and Radiofrequency Ablation. Radiology. 2018;287:705-714. [PubMed] [DOI] |
| 103. | Personeni N, Pressiani T, Santoro A, Rimassa L. Regorafenib in hepatocellular carcinoma: latest evidence and clinical implications. Drugs Context. 2018;7:212533. [PubMed] [DOI] |
| 104. | 甄 作均, 王 峰杰, 范 国勇, 陈 焕伟. 灵芝孢子粉对肝细胞肝癌患者术后细胞免疫功能的影响. 中华肝脏外科手术学电子杂志. 2013;2:31-34. [DOI] |
| 105. | Zou W. Immunosuppressive networks in the tumour environment and their therapeutic relevance. Nat Rev Cancer. 2005;5:263-274. [PubMed] [DOI] |
| 106. | Shevach EM, DiPaolo RA, Andersson J, Zhao DM, Stephens GL, Thornton AM. The lifestyle of naturally occurring CD4+ CD25+ Foxp3+ regulatory T cells. Immunol Rev. 2006;212:60-73. [PubMed] [DOI] |
| 110. | 刘 艳, 温 丽娟, 钟 旭辉. 术后预防性栓塞化疗对乙肝相关小肝癌术后复发风险的影响. 现代消化及介入诊疗杂志. 2018;23:624-627. [DOI] |
| 111. | Torimura T, Ueno T, Taniguchi E, Masuda H, Iwamoto H, Nakamura T, Inoue K, Hashimoto O, Abe M, Koga H, Barresi V, Nakashima E, Yano H, Sata M. Interaction of endothelial progenitor cells expressing cytosine deaminase in tumor tissues and 5-fluorocytosine administration suppresses growth of 5-fluorouracil-sensitive liver cancer in mice. Cancer Sci. 2012;103:542-548. [PubMed] [DOI] |
| 112. | 刘 旭斌, 吴 勇平, 江 红志, 王 鹏, 王 久善, 文 军. 肝癌部分肝叶切除术后残肝断面植入5-氟尿嘧啶缓释剂对肝癌转移复发的影响. 山西医药杂志. 2015;14:1667-1669. |
| 114. | Ng IO, Liu CL, Fan ST, Ng M. Expression of P-glycoprotein in hepatocellular carcinoma. A determinant of chemotherapy response. Am J Clin Pathol. 2000;113:355-363. [PubMed] [DOI] |
| 118. | Shah SA, Cleary SP, Wei AC, Yang I, Taylor BR, Hemming AW, Langer B, Grant DR, Greig PD, Gallinger S. Recurrence after liver resection for hepatocellular carcinoma: risk factors, treatment, and outcomes. Surgery. 2007;141:330-339. [PubMed] [DOI] |
| 119. | 张 岳林, 孙 军辉, 聂 春晖, 陈 黎明, 蔡 丽霞, 何 健娣, 章 丽霞, 王 伟林, 郑 树森. 原发性肝癌根治术后多次 TACE方案预防复发的临床研究. 中国实用医药杂志. 2013;8:1-3. [DOI] |
| 120. | 王 翔翔, 余 华, 熊 杰, 刘 明忠, 孙 建明, 赵 宇. 肝动脉化疗栓塞对原发性肝癌患者术后生存及复发的影响. 中国普外基础与临床杂志. 2012;l9:1204-1206. |
| 123. | 张 庆, 于 德升, 马 克波, 王 学松, 张 斌. 原发性肝癌术后 TACE 治疗次数对患者生存及肿瘤复发的影响. 中国现代普通外科进展杂志. 2018;21:741-743. [DOI] |
| 124. | Wang Z, Ren Z, Chen Y, Hu J, Yang G, Yu L, Yang X, Huang A, Zhang X, Zhou S, Sun H, Wang Y, Ge N, Xu X, Tang Z, Lau W, Fan J, Wang J, Zhou J. Adjuvant Transarterial Chemoembolization for HBV-Related Hepatocellular Carcinoma After Resection: A Randomized Controlled Study. Clin Cancer Res. 2018;24:2074-2081. [PubMed] [DOI] |
| 125. | Poon RT, Fan ST, Lo CM, Liu CL, Ng IO, Wong J. Long-term prognosis after resection of hepatocellular carcinoma associated with hepatitis B-related cirrhosis. J Clin Oncol. 2000;18:1094-1101. [PubMed] [DOI] |
| 126. | Huang G, Lai EC, Lau WY, Zhou WP, Shen F, Pan ZY, Fu SY, Wu MC. Posthepatectomy HBV reactivation in hepatitis B-related hepatocellular carcinoma influences postoperative survival in patients with preoperative low HBV-DNA levels. Ann Surg. 2013;257:490-505. [PubMed] [DOI] |
| 127. | Kubo S, Hirohashi K, Tanaka H, Tsukamoto T, Shuto T, Yamamoto T, Ikebe T, Wakasa K, Nishiguchi S, Kinoshita H. Effect of viral status on recurrence after liver resection for patients with hepatitis B virus-related hepatocellular carcinoma. Cancer. 2000;88:1016-1024. [PubMed] [DOI] |
| 128. | Lu YY, Chen QL, Guan Y, Guo ZZ, Zhang H, Zhang W, Hu YY, Su SB. Transcriptional profiling and co-expression network analysis identifies potential biomarkers to differentiate chronic hepatitis B and the caused cirrhosis. Mol Biosyst. 2014;10:1117-1125. [PubMed] [DOI] |
| 129. | Dimitropoulou D, Karakantza M, Theodorou GL, Leonidou L, Assimakopoulos SF, Mouzaki A, Gogos CA. Serum cytokine profile in patients with hepatitis B e antigen-negative chronic active hepatitis B and inactive hepatitis B virus carriers. World J Gastrointest Pathophysiol. 2013;4:24-27. [PubMed] [DOI] |
| 130. | Chan HL, Tse CH, Mo F, Koh J, Wong VW, Wong GL, Lam Chan S, Yeo W, Sung JJ, Mok TS. High viral load and hepatitis B virus subgenotype ce are associated with increased risk of hepatocellular carcinoma. J Clin Oncol. 2008;26:177-182. [PubMed] [DOI] |
| 131. | An HJ, Jang JW, Bae SH, Choi JY, Cho SH, Yoon SK, Han JY, Lee KH, Kim DG, Jung ES. Sustained low hepatitis B viral load predicts good outcome after curative resection in patients with hepatocellular carcinoma. J Gastroenterol Hepatol. 2010;25:1876-1882. [PubMed] [DOI] |
| 132. | Huang G, Lau WY, Wang ZG, Pan ZY, Yuan SX, Shen F, Zhou WP, Wu MC. Antiviral therapy improves postoperative survival in patients with hepatocellular carcinoma: a randomized controlled trial. Ann Surg. 2015;261:56-66. [PubMed] [DOI] |
| 133. | Huang G, Li PP, Lau WY, Pan ZY, Zhao LH, Wang ZG, Wang MC, Zhou WP. Antiviral Therapy Reduces Hepatocellular Carcinoma Recurrence in Patients With Low HBV-DNA Levels: A Randomized Controlled Trial. Ann Surg. 2018;268:943-954. [PubMed] [DOI] |
| 134. | Ikeda K, Saitoh S, Suzuki Y, Kobayashi M, Tsubota A, Fukuda M, Koida I, Arase Y, Chayama K, Murashima N, Kumada H. Interferon decreases hepatocellular carcinogenesis in patients with cirrhosis caused by the hepatitis B virus: a pilot study. Cancer. 1998;82:827-835. [PubMed] [DOI] |
| 135. | Nishiguchi S, Kuroki T, Nakatani S, Morimoto H, Takeda T, Nakajima S, Shiomi S, Seki S, Kobayashi K, Otani S. Randomised trial of effects of interferon-alpha on incidence of hepatocellular carcinoma in chronic active hepatitis C with cirrhosis. Lancet. 1995;346:1051-1055. [PubMed] [DOI] |
| 138. | Chen C, Wang G. Mechanisms of hepatocellular carcinoma and challenges and opportunities for molecular targeted therapy. World J Hepatol. 2015;7:1964-1970. [PubMed] [DOI] |
| 139. | Bruix J, Qin S, Merle P, Granito A, Huang YH, Bodoky G, Pracht M, Yokosuka O, Rosmorduc O, Breder V, Gerolami R, Masi G, Ross PJ, Song T, Bronowicki JP, Ollivier-Hourmand I, Kudo M, Cheng AL, Llovet JM, Finn RS, LeBerre MA, Baumhauer A, Meinhardt G, Han G; RESORCE Investigators. Regorafenib for patients with hepatocellular carcinoma who progressed on sorafenib treatment (RESORCE): a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet. 2017;389:56-66. [PubMed] [DOI] |
| 140. | Kudo M, Finn RS, Qin S, Han KH, Ikeda K, Piscaglia F, Baron A, Park JW, Han G, Jassem J, Blanc JF, Vogel A, Komov D, Evans TRJ, Lopez C, Dutcus C, Guo M, Saito K, Kraljevic S, Tamai T, Ren M, Cheng AL. Lenvatinib versus sorafenib in first-line treatment of patients with unresectable hepatocellular carcinoma: a randomised phase 3 non-inferiority trial. Lancet. 2018;391:1163-1173. [PubMed] [DOI] |
| 141. | Wang SN, Chuang SC, Lee KT. Efficacy of sorafenib as adjuvant therapy to prevent early recurrence of hepatocellular carcinoma after curative surgery: A pilot study. Hepatol Res. 2014;44:523-531. [PubMed] [DOI] |
| 143. | Liu ZM, Tseng JT, Hong DY, Huang HS. Suppression of TG-interacting factor sensitizes arsenic trioxide-induced apoptosis in human hepatocellular carcinoma cells. Biochem J. 2011;438:349-358. [PubMed] [DOI] |
| 144. | Zhang X, Jia S, Yang S, Yang Y, Yang T, Yang Y. Arsenic trioxide induces G2/M arrest in hepatocellular carcinoma cells by increasing the tumor suppressor PTEN expression. J Cell Biochem. 2012;113:3528-3535. [PubMed] [DOI] |