修回日期: 2019-10-09
接受日期: 2019-10-16
在线出版日期: 2019-11-08
长链非编码RNA(long-chain non-coding RNA, LncRNA)与胃癌发生发展密切相关, LncRNA SNHG14在肿瘤发生过程中发挥癌基因作用, 但其在胃癌中的作用机制尚未阐明. starBase预测显示miR-144-3p可能是SNHG14的靶基因, 但SNHG14是否可通过调控miR-144-3p的表达而参与胃癌发生过程尚未可知.
探讨LncRNA SNHG14是否可通过靶向miR-144-3p调控胃癌细胞增殖与凋亡.
实时荧光定量聚合酶链反应检测人胃黏膜上皮正常细胞与胃癌细胞中SNHG14与miR-144-3p的表达情况. 体外培养人胃癌MGC-803细胞, 随机分为5组: 空白(NC)组、阴性对照(si-con)组、SNHG14小干扰RNA(si-SNHG14)组、SNHG14小干扰RNA+miR-144-3p阴性对照(si-SNHG14+anti-miR-con)组、SNHG14小干扰RNA+miR-144-3p特异性寡核苷酸抑制剂(si-SNHG14+anti-miR-144-3p)组. 甲基噻唑基四唑(methyl thiazolyl tetrazolium, MTT)法检测各组细胞的增殖情况; 流式细胞术检测各组细胞凋亡率; 双荧光素酶报告系统验证SNHG14与miR-144-3p的靶向调节关系. 蛋白免疫印迹法(Western blot)检测细胞中细胞周期蛋白1(cyclinD1)、B淋巴细胞瘤2(B-cell lymphoma-2, Bcl-2)、p21、Bcl-2相关X蛋白(Bcl-2-associated X protein, Bax)、活化的含半胱氨酸的天冬氨酸蛋白水解酶3(cleaved caspase-3)、磷脂酰肌醇激酶(phosphoinositide 3-kinase, PI3K)/蛋白激酶B(protein kinase B, AKT) 信号通路相关蛋白表达.
SNHG14在胃癌细胞中的表达水平显著高于胃黏膜上皮正常细胞(P<0.05), 而miR-144-3p的表达水平显著降低(P<0.05); 与NC组、si-con组比较, si-SNHG14组MGC-803细胞OD值显著降低(P<0.05), 细胞凋亡率显著增高(P<0.05), cyclinD1、Bcl-2、 PI3K的磷酸化(p-PI3K)、AKT的磷酸化(p-AKT)蛋白表达显著降低(P<0.05), p21、Bax、cleaved caspase-3蛋白表达显著升高(P<0.05); 双荧光素酶报告基因显示SNHG14可靶向结合miR-144-3p, 并可负向调控miR-144-3p的表达与活性; 干扰miR-144-3p可部分逆转沉默SNHG14对胃癌细胞增殖、凋亡及PI3K/AKT信号通路的作用.
SNHG14能够通过靶向结合并下调miR-144-3p的表达促进胃癌细胞增殖, 抑制细胞凋亡, 其可能通过激活PI3K/AKT信号通路而发挥作用.
核心提要: 长链非编码RNA(long-chain non-coding RNA, LncRNA)在肿瘤中可能发挥抑癌或促癌作用, LncRNA SNHG14在肿瘤中发挥癌基因作用, 但其在胃癌发生过程中的分子机制尚未完全阐明. 本研究拟寻找LncRNA SNHG14下游调控基因, 并探讨其可能作用机制, 为揭示LncRNA SNHG14在胃癌中的调控网络提供新方向.
引文著录: 李昊天, 裴效瑞, 李洪涛, 郝明利. 长链非编码RNA SNHG14通过靶向miR-144-3p调控胃癌细胞增殖和凋亡的体外实验研究. 世界华人消化杂志 2019; 27(21): 1304-1312
Revised: October 9, 2019
Accepted: October 16, 2019
Published online: November 8, 2019
Long-chain non-coding RNAs (lncRNAs) are closely related to the development of gastric cancer. LncRNA SNHG14 play an oncogene role in tumorigenesis, but its mechanism of action in gastric cancer has not been elucidated. Bioinformatics prediction showed that miR-144-3p may be a target gene of SNHG14, but whether SNHG14 participates in the development of gastric cancer by regulating the expression of microRNA-144-3p (miR-144-3p) is unknown.
To investigate whether the lncRNA SNHG14 can regulate the proliferation and apoptosis of gastric cancer cells by targeting miR-144-3p.
Real-time quantitative polymerase chain reaction was used to detect the expression of SNHG14 and miR-144-3p in normal human gastric epithelial cells and gastric cancer cells. Human gastric cancer MGC-803 cells were cultured in vitro and randomly divided into five groups: NC group, si-con group, si-SNHG14 group, si-SNHG14 + anti-miR-con group, and si-SNHG14 + anti-miR-144-3p group. MTT assay was used to detect the proliferation of cells in each group. Flow cytometry was used to detect the apoptosis of cells. The dual luciferase reporter system was used to validate whether there is a targeted regulatory relationship between SNHG14 and miR-144-3p. The expression of CyclinD1, Bcl-2, p21, Bcl-2-associated X protein (Bax), and PI3K/AKT signaling pathway-related proteins was detected by Western blot.
The expression level of SNHG14 in gastric cancer cells was significantly higher than that in normal gastric epithelial cells (P < 0.05), while the expression level of miR-144-3p was significantly decreased (P < 0.05). Compared with the NC group and si-con group, the proliferation of MGC-803 cells in the si-SNHG14 group was significantly decreased (P < 0.05), and the apoptosis rate was significantly increased (P < 0.05). The expression of p-AKT, CyclinD1, Bcl-2, and p-PI3K protein was significantly decreased (P < 0.05), while the expression of p21, Bax, and cleaved caspase-3 protein was significantly increased (P < 0.05). The dual luciferase reporter assay showed that SNHG14 can bind to miR-144-3p and negatively regulate the expression and activity of miR-144-3p. Interference with miR-144-3p partially reversed the effect of silencing SNHG14 on the proliferation, apoptosis, and PI3K/AKT signaling pathways in gastric cancer cells.
SNHG14 can promote the proliferation of gastric cancer cells and inhibit apoptosis by targeting and down-regulating the expression of miR-144-3p, which may play a role by activating the PI3K/AKT signaling pathway.
- Citation: Li HT, Pei XR, Li HT, Hao ML. Long-chain non-coding RNA SNHG14 regulates proliferation and apoptosis of gastric cancer cells by targeting miR-144-3p. Shijie Huaren Xiaohua Zazhi 2019; 27(21): 1304-1312
- URL: https://www.wjgnet.com/1009-3079/full/v27/i21/1304.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v27.i21.1304
胃癌属于消化道恶性肿瘤之一, 我国胃癌发病率较高, 但胃癌发病机制尚未完全阐明, 研究表明长链非编码RNA(long non-coding RNA, LncRNA)表达异常与胃癌等多种恶性肿瘤有关[1]. 因而积极探寻新型LncRNA为揭示胃癌发病机制提供新方向. 研究表明[2]LncRNA SNHG14可促进胃癌细胞增殖、抑制细胞凋亡. SNHG14可促进结肠癌、卵巢癌细胞增殖及转移[3,4]. starBase预测显示微小RNA-144-3p(microRNA-144-3p, miR-144-3p)可能是SNHG14的靶基因, 研究表明miR-144-3p可抑制胃癌细胞增殖及转移[5]. 研究表明miR-144-3p可抑制肺癌、前列腺癌细胞增殖、侵袭[6,7]. 但SNHG14是否可通过调控miR-144-3p表达从而参与胃癌细胞增殖及凋亡过程尚未可知. 因此, 本研究主要探讨SNHG14对胃癌细胞增殖及凋亡的影响并分析其是否通过靶向下调miR-144-3p而发挥作用.
人胃黏膜上皮正常细胞系GES-1与胃癌细胞MKN-45、BGC-823、MGC-803、HGC-27均购自美国ATCC公司. RPMI 1640培养基、胰蛋白酶、胎牛血清、青霉素及链霉素均购自美国Gibco公司; SNHG14小干扰RNA(si-SNHG14)及无意义阴性对照序列(si-con)、miR-144-3p抑制剂(anti-miR-144-3p)及其阴性对照(anti-miR-con)均购自上海吉玛制药技术有限公司; Lipofectamine2000与Trizol均购自美国Invitrogen公司; 反转录试剂盒与SYBR Green荧光染料均购自美国Thermo Fisher公司; 甲基噻唑基四唑(methyl thiazolyl tetrazolium, MTT)购自武汉艾美捷科技有限公司; 细胞凋亡检测试剂盒购自大连美仑生物技术有限公司; RIPA蛋白裂解液购自美国Sigma公司; 细胞周期蛋白1(cyclin D1)、B淋巴细胞瘤2(B-cell lymphoma-2, Bcl-2)、p21、Bcl-2相关X蛋白(Bcl-2-associated X protein, Bax)、活化的含半胱氨酸的天冬氨酸蛋白水解酶3(cleaved caspase-3)单克隆抗体均购自美国Abcam公司; 磷脂酰肌醇激酶(phosphoinositide 3-kinase, PI3K)及其磷酸化蛋白(p-PI3K)、蛋白激酶B(protein kinase B, AKT)及其磷酸化蛋白(p-AKT)抗体均购自武汉三鹰生物技术有限公司; 辣根过氧化物酶(horseradish peroxidase, HRP)标记的IgG二抗购自武汉博士德生物工程有限公司.
1.2.1 细胞培养、转染及分组: GES-1、MKN-45、BGC-823、MGC-803、HGC-27细胞置于37 ℃恒温水浴锅内溶解, 放入含有10%胎牛血清的RPMI 1640培养基内培养, 待细胞生长融合至60%左右时传代培养. 取对数生长期胃癌MGC-803细胞, 0.25%胰蛋白酶消化, 制备单细胞悬液接种至24孔板(5×103个/mL), 细胞随机分成未经任何处理的细胞(NC)组、阴性对照(si-con)组、SNHG14小干扰RNA(si-SNHG14)组、SNHG14小干扰RNA+miR-144-3p阴性对照(si-SNHG14+anti-miR-con)组、SNHG14小干扰RNA+miR-144-3p特异性寡核苷酸抑制剂(si-SNHG14+anti-miR-144-3p)组, 转染6 h后更换为RPMI 1640培养基, 继续培养48 h收集细胞.
1.2.2 实时荧光定量聚合酶链反应(quantitative real-time polymerase chain reaction, qRT-PCR)检测细胞中SNHG14、miR-144-3p的表达水平: 取各组细胞, RNA提取: 加入Trizol提取细胞总RNA, 冰上5 min, 加入200 μL氯仿, 室温放置5 min, 经12000 g离心15 min, 吸取水相层置于EP试管内, 加入500 μL异丙醇, 室温放置20 min, 相同离心条件下离心15 min, 弃上清, 加入75%乙醇离心5 min, 弃上清, RNA沉于管底, 利用紫外分光光度计检测RNA浓度. SNHG14正向引物5'-GGGTGTTTACGTAGACCAGAACC-3', 反向引物: 5'-CTTCCAAAAGCCTTCTGCCTTAG-3'; β-actin正向引物5'-TGCTGTCCCTGTATGCCTCT-3', 反向引物: 5'-TGATGTCACGCACGATTT-3'; miR-144-3p正向引物5'-TACTGCATCAGGAACTGACTGGA-3', 反向引物: 5'-TACTGCATCAGGAACTGACTGGA-3'; U6正向引物5'-GCTTCGGCAGCACATATACTAAAAT-3', 反向引物: 5'-CGCTTCAGAATTTGCGTGTCAT-3', 引物均由上海生工生物工程股份有限公司合成. 按照反转录试剂盒说明书合成cDNA. qRT-PCR反应条件: 95 ℃ 5 min, 95 ℃ 30 s, 60 ℃ 30 s, 72 ℃ 30 s, 共循环35次. miR-144-3p以U6为内参, SNHG14以β-actin为内参, 反应结束后, 采用 2-ΔΔCt法计算SNHG14、miR-144-3p相对表达量.
1.2.3 MTT检测细胞增殖: 收集转染后各组胃癌MGC-803细胞, 胰蛋白酶消化, 制备细胞悬浮液(3×105个/mL)接种于96孔板(100 μL/孔), 分别于转染24 h、48 h、72 h时加入MTT溶液20 μL, 室温孵育4 h, 弃上清, 分别加入二甲基亚砜(dimethylsulfoxide, DMSO)溶液150 μL, 放入摇床内孵育10 min, 应用酶标仪检测各孔OD值.
1.2.4 流式细胞术检测细胞凋亡: 收集各组对数生长期胃癌MGC-803细胞, 预冷PBS洗涤, 胰蛋白酶消化, 4 ℃条件下经10000 r/min转速离心5 min, PBS洗涤, 加入1 mL结合缓冲液, 相同条件下离心, 弃上清, 加入200 μL结合缓冲液, 加入5 μL 膜联蛋白V-异硫氰酸荧光素与碘化丙锭, 室温避光孵育20 min, 加入400 μL结合缓冲液, 于1 h内置于流式细胞仪检测细胞凋亡率.
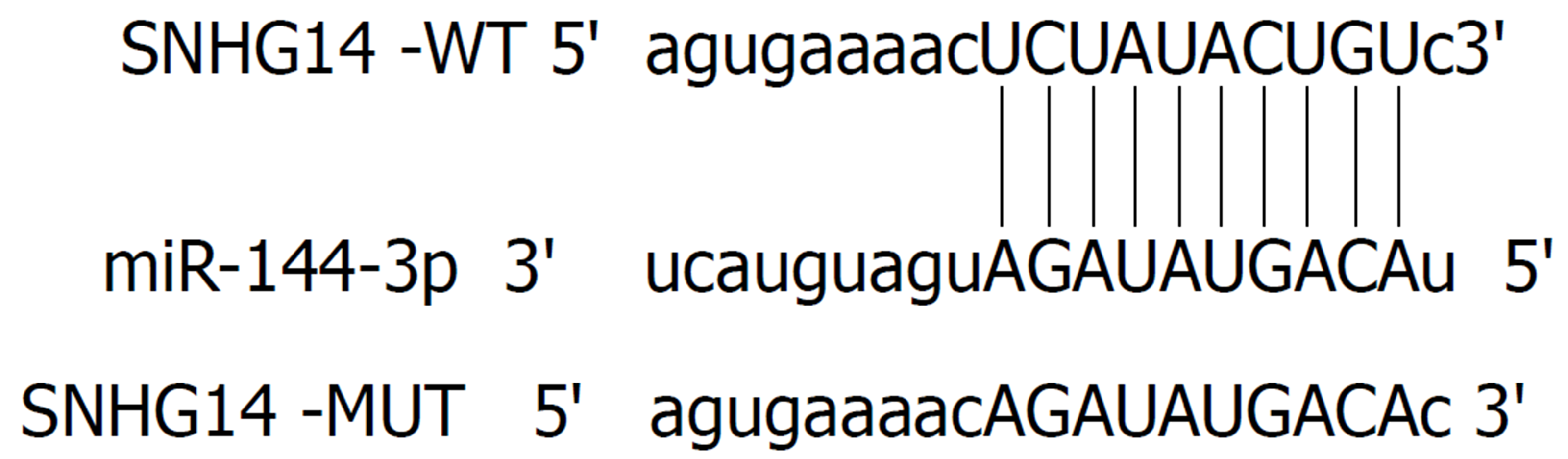
1.2.5 双荧光素酶报告基因检测: starBase靶基因预测SNHG14与miR-144-3p存在结合位点, 将含有结合位点及突变结合位点的SNHG14-3'UTR片段分别插入PGL3荧光素酶报告基因载体, 构建野生型(WT-SNHG14)与突变型(MUT-SNHG14)载体, 将WT-SNHG14、MUT-SNHG14分别与miR-144-3p mimics、miR-NC共转染, 培养箱内培养48 h, 检测各组荧光素酶活性.
1.2.6 Western blot检测cyclinD1、Bcl-2、p21、Bax与PI3K/AKT信号通路相关蛋白表达: 取各组细胞, 加入RIPA蛋白裂解液提取蛋白, BCA定量蛋白, 取30 μg蛋白进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳, 取分离蛋白凝胶转移至PVDF膜, PVDF膜置于脱脂奶粉(50 g/L)中封闭1 h, 加入蛋白一抗(1:1000), 4 ℃孵育24 h, 室温孵育二抗(1:2000)2 h, 滴加ECL显影液, 应用化学发光成像仪曝光成像, 采用ImageJ软件分析蛋白条带灰度值.
统计学处理 利用SPSS 19.0统计学软件分析数据, 两组间比较采用t检验, 多组间比较采用单因素方差分析, 本研究数据均以mean±SD表示, 各组数据均以P<0.05为差异具有统计学意义.
与人胃黏膜上皮正常细胞GES-1相比, 胃癌细胞MKN-45、BGC-823、MGC-803、HGC-27中SNHG14的表达水平显著升高(P<0.05), miR-144-3p的表达水平显著降低(P<0.05), 其中SNHG14在胃癌MGC-803细胞中的表达水平相对较高, 因而选用胃癌MGC-803细胞进行后续研究(表1).
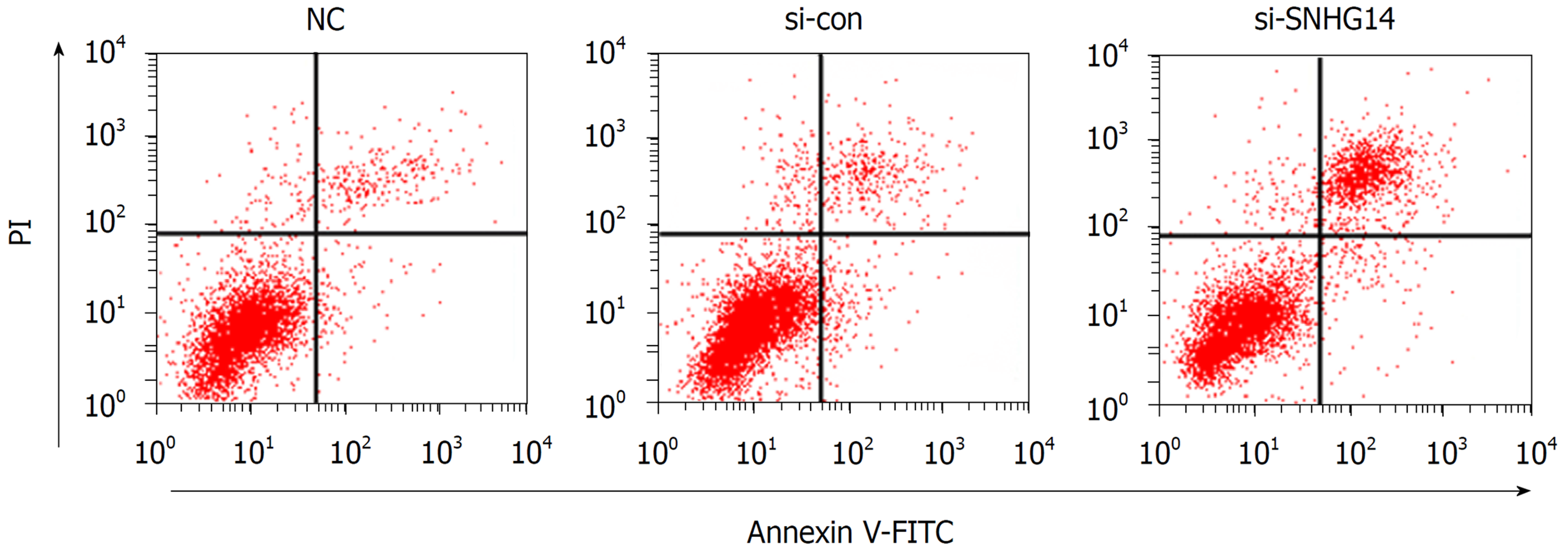
与si-con组相比, si-SNHG14组胃癌MGC-803细胞活力显著降低(P<0.05), 细胞凋亡率显著增加(P<0.05)(图1、表2).
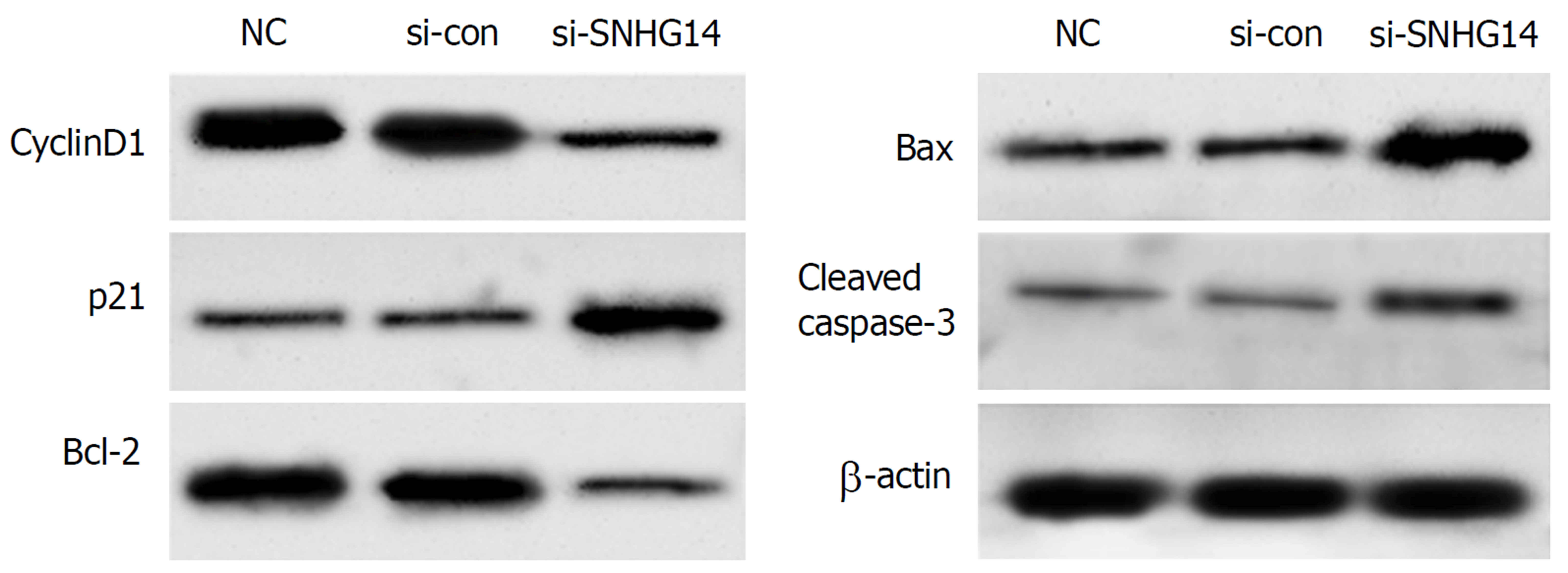
Western blot检测细胞增殖与凋亡相关蛋白表达, 结果显示相较于si-con组, si-SNHG14组胃癌MGC-803细胞中cyclinD1、Bcl-2蛋白表达水平显著降低(P<0.05), p21、Bax、cleaved caspase-3蛋白表达水平显著升高(P<0.05)(图2、表3).
starBase预测显示SNHG14与miR-144-3p存在互补核苷酸序列(图3). 双荧光素酶报告实验结果显示miR-144-3p组(WT-SNHG14)荧光素酶活性显著低于miR-con组(WT-SNHG14)(P<0.05), miR-144-3p组(MUT-SNHG14)与miR-con组(MUT-SNHG14)荧光素酶活性相比差异无统计学意义(表4). qRT-PCR检测结果显示, si-SNHG14组胃癌MGC-803细胞中miR-144-3p的表达水平显著高于si-con组(P<0.05), pcDNA-SNHG14组胃癌MGC-803细胞中miR-144-3p的表达水平显著低于pcDNA组(P<0.05)(表5).
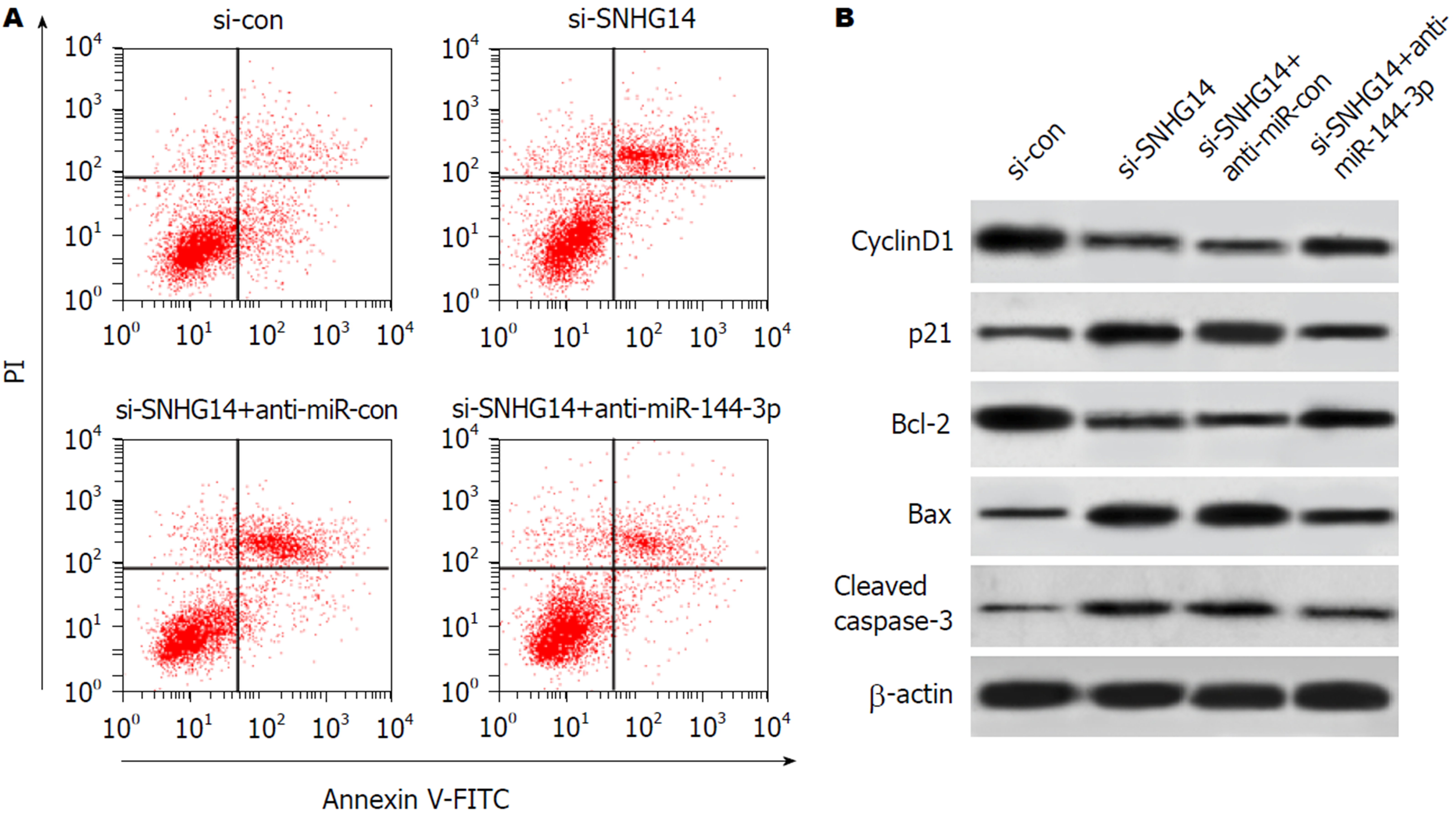
与si-SNHG14+anti-miR-con组相比, si-SNHG14+anti-miR-144-3p组胃癌MGC-803细胞活力显著增强(P<0.05), 细胞凋亡率显著降低(P<0.05), cyclinD1、Bcl-2蛋白表达水平显著升高(P<0.05), p21、Bax、cleaved caspase-3蛋白表达水平显著降低(P<0.05)(图4、表6、表7).
| 组别 | miR-144-3p | 细胞活力(OD 490 nm) | 细胞凋亡率(%) | ||
| 24 h | 48 h | 72 h | |||
| si-con | 1.00±0.08 | 0.42±0.03 | 0.74±0.09 | 1.26±0.09 | 5.29±0.49 |
| si-SNHG14 | 4.06±0.36a | 0.35±0.02a | 0.55±0.06a | 0.85±0.07a | 16.34±1.15a |
| si-SNHG14+anti-miR-con | 3.81±0.43 | 0.33±0.03 | 0.53±0.05 | 0.83±0.08 | 17.68±1.79 |
| si-SNHG14+anti-miR-144-3p | 1.78±0.22c | 0.37±0.05c | 0.67±0.07c | 1.04±0.11c | 11.54±0.94c |
| F值 | 221.364 | 11.426 | 18.770 | 45.905 | 200.279 |
| P值 | 0.000 | 0.000 | 0.000 | 0.000 | 0.000 |
| 组别 | cyclinD1 | p21 | Bcl-2 | Bax | cleaved caspase-3 |
| si-con | 0.89±0.08 | 0.32±0.05 | 0.92±0.08 | 0.34±0.04 | 0.18±0.03 |
| si-SNHG14 | 0.37±0.04a | 0.66±0.07a | 0.47±0.06a | 0.68±0.08a | 0.43±0.05a |
| si-SNHG14+anti-miR-con | 0.35±0.03 | 0.69±0.08 | 0.43±0.05 | 0.71±0.08 | 0.46±0.04 |
| si-SNHG14+anti-miR-144-3p | 0.57±0.06c | 0.48±0.05c | 0.63±0.07c | 0.45±0.06c | 0.33±0.05c |
| F值 | 180.768 | 65.429 | 102.397 | 64.333 | 76.480 |
| P值 | 0.000 | 0.000 | 0.000 | 0.000 | 0.000 |
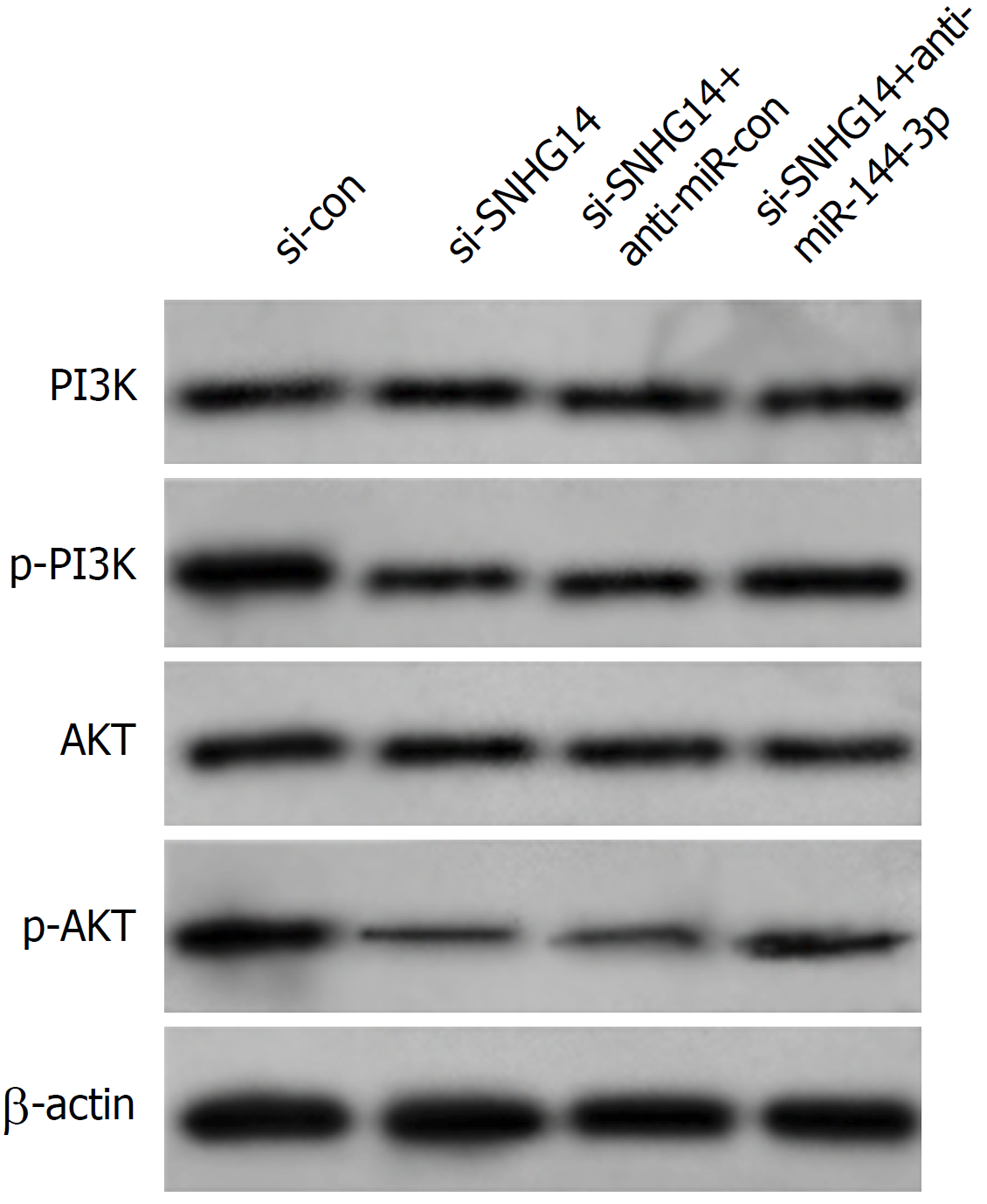
实验结果显示, 与si-con组相比, si-SNHG14组胃癌MGC-803细胞中p-PI3K、p-AKT蛋白表达水平显著降低(P<0.05), si-SNHG14+anti-miR-144-3p组胃癌MGC-803细胞中p-PI3K、p-AKT蛋白表达水平显著高于si-SNHG14+anti-miR-con组(P<0.05)(图5、表8).
LncRNA与miRNA存在相互调控作用并可在肿瘤发生发展过程中发挥重要作用, LncRNA可靶向结合miRNA形成竞争性内源RNA(competing endogenous RNA, ceRNA)进而降低miRNA对靶基因的抑制作用[8,9]. 研究表明LncRNA表达异常与胃癌发生及转移密切相关[10]. 但仍有部分LncRNA在胃癌发生及转移过程中的作用机制尚未完全阐明.
SNHG14在肾透明细胞癌中呈高表达, 并可促进细胞迁移及侵袭[11]. 非小细胞肺癌中SNHG14通过充当miR-340的ceRNA而发挥致癌功能[12]. 研究表明SNHG14还可通过调节miR-206/YWHAZ促进宫颈癌进展[13]. 本研究结果显示SNHG14在胃癌细胞中呈高表达, 干扰SNHG14表达后胃癌细胞增殖能力显著降低, 细胞凋亡率显著增加, 提示干扰SNHG14表达可显著降低胃癌细胞增殖能力, 促进细胞凋亡. 研究报道指出cyclinD1、p21是细胞增殖相关蛋白, Bcl-2、Bax是细胞凋亡相关蛋白, cyclinD1是细胞周期由G1期转化为S期的关键蛋白, 其表达活性降低可促使细胞周期停滞, p21可抑制cyclinD1-CDK复合物从而诱导细胞周期阻滞, Bcl-2表达水平升高可抑制细胞凋亡, Bax表达水平升高可促进细胞凋亡[14,15]. 本研究结果显示干扰SNHG14表达后, cyclinD1、Bcl-2明显减少, p21、Bax、cleaved caspase-3表达显著升高, 提示干扰SNHG14表达可抑制cyclinD1、Bcl-2的表达及促进p21、Bax的表达从而抑制细胞增殖, 促进细胞凋亡.
miR-144-3p在胰腺癌中呈低表达, 上调miR-144-3p表达可抑制细胞侵袭及转移[16]. 研究表明miR-144-3p可通过抑制TMEM16A表达从而抑制骨肉瘤细胞增殖及侵袭[17]. miR-144-3p还可通过下调NFE2L2表达从而抑制宫颈癌细胞增殖及侵袭[18]. 本研究结果显示miR-144-3p在胃癌细胞中的表达水平显著降低, 通过双荧光素酶报告实验结果证实SNHG14可靶向调控miR-144-3p的表达, 进一步研究显示干扰miR-144-3p可部分逆转沉默SNHG14对胃癌细胞的增殖的抑制作用及细胞凋亡的促进作用. 提示干扰SNHG14可通过充当miR-144-3p的ceRNA从而抑制胃癌细胞增殖, 促进细胞凋亡. 研究表明PI3K/AKT信号通路可参与多种肿瘤发生发展进程, p-PI3K可通过激活下游AKT形成p-AKT从而激活下游Bcl-2最终抑制细胞凋亡, 通过抑制PI3K/AKT信号通路激活可促进胃癌细胞凋亡[19]. 本研究结果显示干扰SNHG14表达后胃癌细胞中p-PI3K、p-AKT表达水平显著降低, 提示干扰SNHG14表达可抑制PI3K/AKT信号通路激活. 进一步研究显示干扰miR-144-3p部分逆转沉默SNHG14对胃癌细胞中PI3K/AKT信号通路激活的抑制作用. 提示干扰SNHG14表达可通过上调miR-144-3p表达及抑制PI3K/AKT信号通路激活而促进胃癌细胞凋亡, 抑制细胞增殖.
综上所述, SNHG14能够靶向结合并下调miR-144-3p表达从而促进胃癌细胞增殖, 抑制细胞凋亡, 其作用机制可能与PI3K/AKT信号通路激活有关, 可为胃癌的诊断、治疗及预后评估提供潜在靶点.
胃癌发病机制尚未阐明, 我国胃癌发病率与死亡率逐年增加, 由于早期胃癌患者临床症状不明显导致患者就诊时已处于进展期甚至晚期, 临床采用手术或放化疗技术进行治疗, 效果一般, 近年来, 基因靶向治疗成为多种肿瘤治疗的新手段, 因而寻找胃癌治疗潜在靶点具有重要意义.
本研究首先观察SNHG14在胃癌细胞中的表达, 分析其表达变化对胃癌细胞增殖及凋亡的影响, 通过starBase预测SNHG14下游可能作用的靶基因, 初步分析其对靶基因的调控作用机制, 为进一步阐释SNHG14在胃癌发生发展过程中的作用机制提供新方向.
本研究目标是揭示SNHG14对胃癌细胞增殖及凋亡的影响及其分子机制, 为揭示胃癌的发病机制提供新策略.
本研究采用脂质体转染技术干扰SNHG14对胃癌细胞增殖及凋亡的影响; 实时荧光定量聚合酶链反应技术检测干扰SNHG14的效果; MTT检测干扰SNHG14对胃癌细胞增殖的影响; 流式细胞仪检测干扰SNHG14对胃癌细胞凋亡的影响; 双荧光素酶报告基因实验验证SNHG14与靶基因的调控作用; 抑制靶基因表达进行回复实验以此验证SNHG14对胃癌细胞增殖及凋亡的作用; 采用Western blot法检测干扰SNHG14的表达及抑制靶基因表达对胃癌细胞中PI3K/AKT信号通路的影响.
本研究结果表明SNHG14在胃癌细胞中高表达, 干扰SNHG14的表达可通过上调靶基因的表达从而抑制胃癌细胞增殖及促进细胞凋亡, 其作用机制可能是通过调控PI3K/AKT信号通路而发挥作用.
SNHG14通过抑制靶基因表达从而促进胃癌细胞增殖、抑制细胞凋亡, SNHG14可能作为胃癌基因治疗的潜在靶点.
关于SNHG14在胃癌中的作用机制还需进行体内实验及临床研究分析, 同时还可进一步验证SNHG14靶基因的下游靶mRNA, 拟寻找胃癌中LncRNA-miRNA-mRNA调控机制网络.
学科分类: 胃肠病学和肝病学
手稿来源地: 天津市
同行评议报告分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C, C, C, C
D级 (一般): 0
E级 (差): 0
编辑: 王禹乔 电编:刘继红
| 1. | 侯 婧瑛, 凌 辉, 金 小岩, 罗 信, 李 楚强, 王 凌云. lncRNA-MALAT1通过靶向下调miR-570-3p促进胃癌细胞增殖. 中国病理生理杂志. 2018;34:2145-2152. [DOI] |
| 2. | Liu Z, Yan Y, Cao S, Chen Y. Long non-coding RNA SNHG14 contributes to gastric cancer development through targeting miR-145/SOX9 axis. J Cell Biochem. 2018;119:6905-6913. [PubMed] [DOI] |
| 3. | Di W, Weinan X, Xin L, Zhiwei Y, Xinyue G, Jinxue T, Mingqi L. Long noncoding RNA SNHG14 facilitates colorectal cancer metastasis through targeting EZH2-regulated EPHA7. Cell Death Dis. 2019;10:514. [PubMed] [DOI] |
| 4. | Li L, Zhang R, Li SJ. Long noncoding RNA SNHG14 promotes ovarian cancer cell proliferation and metastasis via sponging miR-219a-5p. Eur Rev Med Pharmacol Sci. 2019;23:4136-4142. [PubMed] [DOI] |
| 5. | Li B, Zhang S, Shen H, Li C. MicroRNA-144-3p suppresses gastric cancer progression by inhibiting epithelial-to-mesenchymal transition through targeting PBX3. Biochem Biophys Res Commun. 2017;484:241-247. [PubMed] [DOI] |
| 6. | Jiang W, Xu Z, Yu L, Che J, Zhang J, Yang J. MicroRNA-144-3p suppressed TGF-β1-induced lung cancer cell invasion and adhesion by regulating the Src-Akt-Erk pathway. Cell Biol Int. 2019;. [PubMed] [DOI] |
| 7. | You B, Zhang KC. MicroRNA-144-3p inhibits cell proliferation and promotes apoptosis in castration-resistant prostate cancer by targeting CEP55. Eur Rev Med Pharmacol Sci. 2018;22:7660-7670. [PubMed] [DOI] |
| 8. | Kondo Y, Shinjo K, Katsushima K. Long non-coding RNAs as an epigenetic regulator in human cancers. Cancer Sci. 2017;108:1927-1933. [PubMed] [DOI] |
| 9. | Maldotti M, Incarnato D, Neri F, Krepelova A, Rapelli S, Anselmi F, Parlato C, Basile G, Dettori D, Calogero R, Oliviero S. The long intergenic non-coding RNA CCR492 functions as a let-7 competitive endogenous RNA to regulate c-Myc expression. Biochim Biophys Acta. 2016;1859:1322-1332. [PubMed] [DOI] |
| 10. | Li J, Gao J, Tian W, Li Y, Zhang J. Long non-coding RNA MALAT1 drives gastric cancer progression by regulating HMGB2 modulating the miR-1297. Cancer Cell Int. 2017;17:44. [PubMed] [DOI] |
| 11. | Liu G, Ye Z, Zhao X, Ji Z. SP1-induced up-regulation of lncRNA SNHG14 as a ceRNA promotes migration and invasion of clear cell renal cell carcinoma by regulating N-WASP. Am J Cancer Res. 2017;7:2515-2525. [PubMed] |
| 12. | Zhang Z, Wang Y, Zhang W, Li J, Liu W, Lu W. Long non-coding RNA SNHG14 exerts oncogenic functions in non-small cell lung cancer through acting as an miR-340 sponge. Biosci Rep. 2019;39:BSR20180941. [PubMed] [DOI] |
| 13. | Ji N, Wang Y, Bao G, Yan J, Ji S. LncRNA SNHG14 promotes the progression of cervical cancer by regulating miR-206/YWHAZ. Pathol Res Pract. 2019;215:668-675. [PubMed] [DOI] |
| 14. | 刘 娟娟, 周 春欢, 赵 娟娟, 夏 英, 韦 四喜, 黄 海. 长链非编码RNA SNHG16对胃癌细胞AGS增殖的影响. 贵州医科大学学报. 2018;43:1370-1385. [DOI] |
| 16. | 罗 和生, 陈 小丽, 田 霞, 黄 晓东. MicroRNA-144-3p在胰腺癌中的表达及其对胰腺癌侵袭转移的影响. 胃肠病学和肝病学杂志. 2018;27:47-50. [DOI] |