修回日期: 2019-06-25
接受日期: 2019-08-02
在线出版日期: 2019-08-08
临床诊疗中急性小肠出血无特异性, 且因小肠活动度大, 迂回曲折, 内镜检查不易操作, 故对小肠出血的诊断仍是临床上的一大挑战.
本案例为一例青年患者发生小肠多发间质瘤合并急性消化道大出血, 在积极纠正休克后, 以腹部电子计算机断层扫描(computed tomography, CT)为导向, 完善急诊小肠镜检查, 而后经过多学科综合会诊讨论迅速制定合理规范治疗方案及后续治疗计划, 挽救患者生命, 使患者获得最大受益.
小肠间质瘤起病隐匿, 缺乏特异性临床表现, 可结合特点联合应用B 超, CT、磁共振成像及相关血管造影, 胃肠镜, 胶囊内镜等检查明确术前诊断、精确临床分期, 经多学科讨论制定规范的治疗方案, 改善患者预后.
核心提要: 临床诊疗中不明原因的消化道出血多为小肠出血, 由于其特有的解剖结构及复杂的病因导致快速诊断困难, 严重时可危及生命. 通过分析该病例的诊治过程, 在稳定生命体征基础上, 可根据疾病特点有效的借助于多种影像学和内镜检查明确病因, 同时需联合多学科讨论, 制定合理规范的治疗方案及后续治疗计划, 对于降低患者死亡率及改善患者预后有重要意义.
引文著录: 马兴彬, 刘丽娟, 牛琼, 尚炳英, 李扬扬, 刘成霞. 以急性消化道大出血为表现的青年小肠多发间质瘤1例并文献复习. 世界华人消化杂志 2019; 27(15): 972-976
Revised: June 25, 2019
Accepted: August 2, 2019
Published online: August 8, 2019
Acute small intestinal bleeding in clinical diagnosis and treatment is not specific, and the diagnosis of small intestinal bleeding is still a major clinical challenge because of its high mobility, tortuosity, and difficulty in endoscopic examination.
This case is a young patient with multiple stromal tumors of the small intestine complicated with acute massive hemorrhage of the digestive tract. After correction of shock, abdominal computed tomography (CT) and emergency enteroscopy were performed, followed by multi-disciplinary team discussion to develop a reasonable and standardized treatment plan and subsequent therapy to save the patient¡¯s life and maximize the benefits of the patient.
Small intestinal stromal tumor has an insidious onset and lacks specific clinical manifestations. According to the characteristics of this disease, B-mode ultrasound, CT, magnetic resonance imaging, digital subtraction angiography, gastrointestinal endoscopy, capsule endoscopy, and other examinations should be used to make a preoperative diagnosis and conduct accurate clinical staging. Multidisciplinary discussion is helpful to develop standardized treatment options to improve the prognosis of patients.
- Citation: Ma XB, Liu LJ, Niu Q, Shang BY, Li YY, Liu CX. Multiple intestinal stromal tumors in a young patient with acute gastrointestinal hemorrhage: A case report and literature review. Shijie Huaren Xiaohua Zazhi 2019; 27(15): 972-976
- URL: https://www.wjgnet.com/1009-3079/full/v27/i15/972.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v27.i15.972
小肠出血疾病的诊断及治疗在临床工作中漏诊、误诊及误治的比率高[1], 其中小肠肿瘤是常见病因, 而胃肠道间质瘤则是最常见的小肠肿瘤[2], 本例为青年患者发生小肠多发间质瘤合并急性消化道大出血实属罕见, 现报道如下.
男, 36岁, 因"黑便伴意识丧失3 d, 再发1 d"于2018-09-16入住滨州医学院附属医院消化内科. 患者入院前3 d无明显诱因出现黑便, 为暗红色稀便, 共5次, 量约750 mL, 伴心慌、大汗, 无呕血, 至当地医院就诊途中出现短暂意识丧失, 持续约30 s逐渐恢复, 于当地住院期间仍有柏油样黑便, 每日1次, 量约150 mL, 给予补液扩容、抑酸、止血等治疗后生命体征相对稳定, 期间完善胃镜提示"慢性浅表性胃炎", 完善腹部电子计算机断层扫描(computed tomography, CT)提示腹部多发肿物. 入本院前1 d前患者再次出现暗红色血便2次, 夹杂黑色血凝块, 量约300 mL, 伴心慌、大汗, 为求进一步诊疗急诊入住滨州医学院附属医院. 既往史无特殊.
T: 37.2 ℃, P: 84次/分, R: 15次/分, BP: 130/98 mmHg, 偏胖体型, 贫血貌, 睑结膜苍白, 腹软, 腹部未触及显著肿物, 全腹无压痛及反跳痛, 肠鸣音8次/分, 余查体未见明显阳性体征.
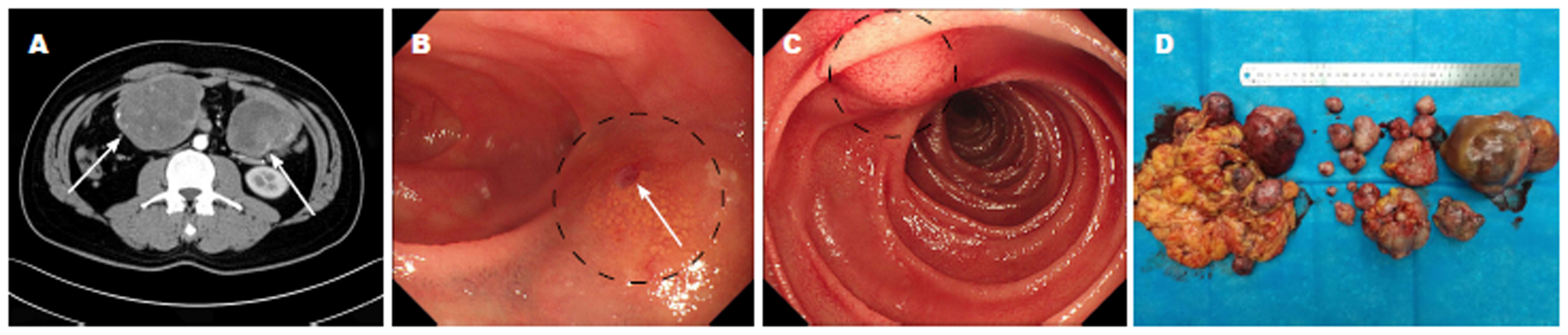
血常规: WBC 7.5×109/L, Hb 84 g/L, HCT 23%, PLT 223×109/L; CEA: 0.61 ng/mL, 余未见显著异常. 胸部+腹部平扫、强化: 双肺炎症、腹部多发病变. 腹腔内可见多个混杂密度影, 大小约2-10 cm不等, 呈不均匀显著强化, 部分可见液化灶、钙化灶, 包膜相对完整(图1A), 腹膜后未见肿大淋巴结.
不明原因消化道大出血: 消化系统肿瘤并出血?
患者入院后给予补液、奥曲肽50 μg/h持续微量泵泵入, 卡络磺钠、血凝酶止血, 艾司奥美拉唑抑酸, 保持内环境稳定及营养支持等治疗, 入院当天夜间再次出现暗红色血便3次, 共约300 mL, 伴乏力, 无心慌、头晕等不适, 复查血常规提示Hb降至72 g/L, 于次日给予输注去白悬浮红细胞2.5 U, 当天于夜间再次出现血便2次, 共约150 mL, 生命体征尚稳定. 为进一步明确病变及出血情况, 排除禁忌症第3 d行肠道准备后行急诊单气囊小肠镜检查, 于空肠、十二指肠水平段分别见4处黏膜下隆起, 镜下评估约2.0-2.5 cm, 其中最大者表面可见一处溃疡, 有血痂形成(图1B、C), 并行内镜下止血治疗. 因肠道内残留血液严重影响观察, 经肛进镜回肠末端约50 cm未见器质性病变. 患者于第4 d行全院多学科综合会诊, 考虑患者小肠多发恶性间质瘤可能性大, 目前虽相对稳定, 但不除外再次突发大出血可能, 病情允许下可行急诊手术治疗, 待术后病理, 必要时追加靶向治疗药物等综合治疗.
患者入院第5 d于滨州医学院附属医院肝胆外科行剖腹探查术, 术中探查见: 探查屈氏韧带40 cm处有直径约10 cm大小肿块, 浸润侵犯小肠壁约8 cm包绕相应小肠系膜血管, 切开肠管见肿瘤浸润侵透黏膜层, 局部溃疡形成并可见活动性渗血, 将包括肿瘤在内的部分小肠壁一并切除, 行断端吻合, 其余可见多枚质硬肿物. 大网膜及肠系膜可见大小约0.5-7 cm大小不等肿块10余枚, 均予以完整切除. 探查壁层腹膜可见多发质韧结节, 切除结节一枚送检. 探查腹腔其余重要脏器未见转移结节, 术后大体标本(图1D). 术后标本部分肿瘤剖开切面呈囊实性, 囊性区内容血块, 并见坏死.
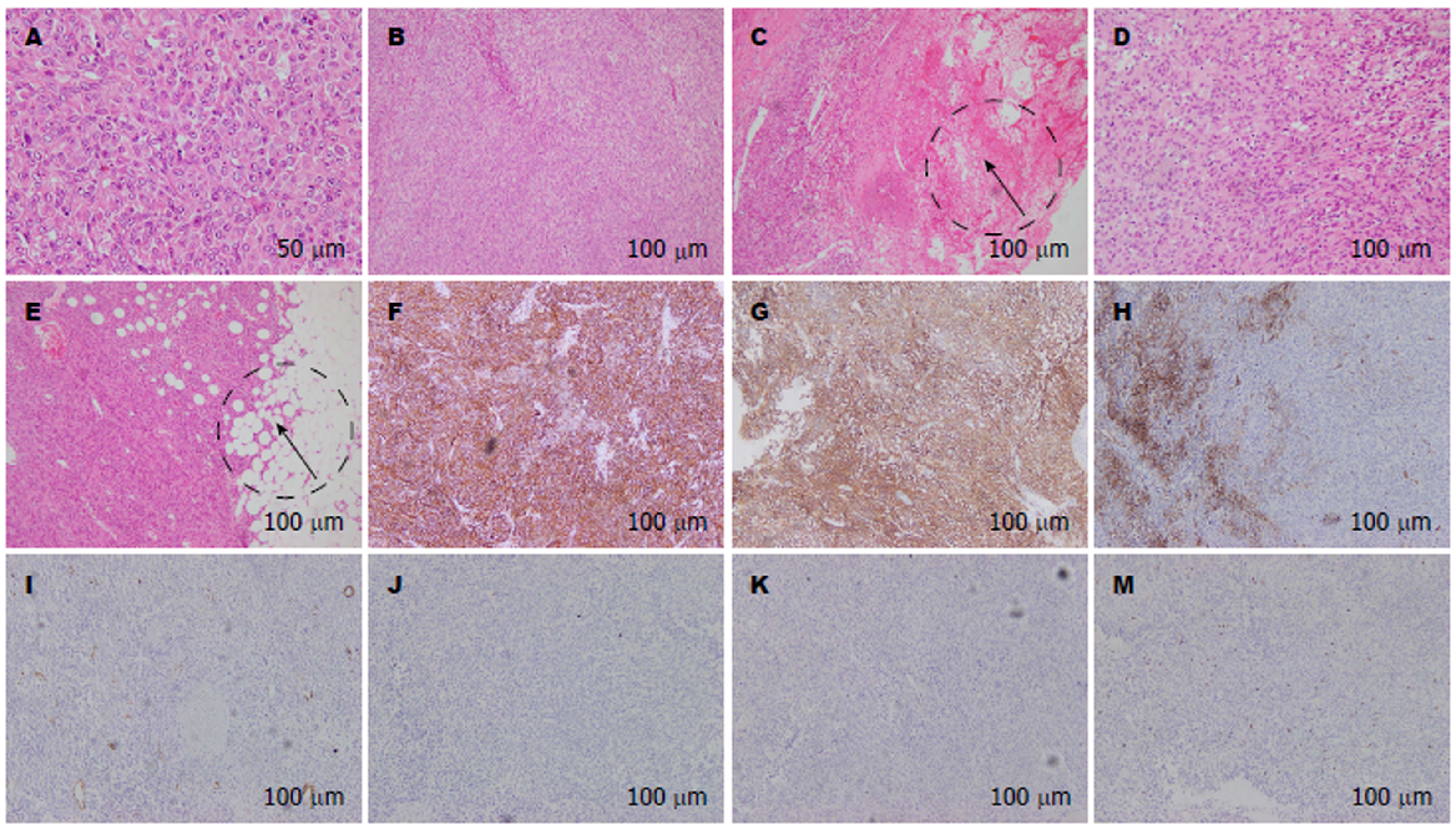
术后病理示(小肠、腹壁、网膜、腹膜)考虑胃肠道间质瘤, 上皮样细胞-梭形细胞混合型, 多发性(图2 A-E), 肿瘤长径0.3-12.5 cm, 核分裂像>5个/50HPF, 大者肿瘤有出血、坏死. 免疫组化结果(图2F-K): CD117+, DOG-1+, CD34灶+, S-100-, SMA-, Desmin-, Ki-67约2%. 网膜、腹膜与小肠病变同源, 结合小肠间质瘤体积大且坏死, 网膜或腹膜体积小无坏死, 考虑小肠病变为原发灶可能. 术后口服甲磺酸伊马替尼400 mg/d治疗, 于第14 d恢复良好出院.
胃肠道多发间质瘤并出血.
胃肠道出血以上消化道和结直肠疾病较多见, 小肠出血的发病率仅占消化道出血的3%-5%[1]. 小肠出血检查方法多样, 但由于小肠冗长, 弯曲度大, 常规项目不能对小肠进行全面检查, 小肠出血疾病的诊断及治疗在临床工作中始终存在盲区, 临床上常规检查阳性率低, 其漏诊、误诊及误治的比率较高. 小肠出血的病因与胃肠道其他部位出血的病因类似, 主要有肿瘤、炎症性病变、憩室及血管病变[2,3]等. 国内外临床研究显示, 小肠肿瘤是小肠出血患者的首要病因, 而胃肠道间质瘤则是最常见的小肠肿瘤, 大多数引发出血的间质瘤是良性的, 其引起的消化道出血多与黏膜相关性溃疡有关[4].
胃肠间质瘤(gastrointestinal stromal tumor, GIST)是胃肠道最常见的间叶源性肿瘤, 目前认为其主要来源于Cajal间质细胞[5], GIST可发生于消化道任何部位, 以单发灶为主, 约占全消化道肿瘤的1%-3%[6]. GIST可发生于各年龄段, 中老年偏多, 40岁以下罕见[7], 本例GIST患者年龄36岁, 病灶位于小肠, 且呈多发性, 共10余枚, 临床上较罕见.
GIST临床特征可以根据肿瘤的解剖位置、大小和侵袭性而变化, 而小肠间质瘤起病隐匿, 缺乏特异性临床表现, 鉴于上述特点, 能否早期诊断、术前临床分期是否准确直接影响到治疗方案的确定和预后的判断, 因此术前诊断至关重要.
超声显像具有简便易行、无创、无辐射、实时动态观察肠管蠕动等优点, 并可进行超声引导下穿刺活检而明确诊断. 有研究显示, 超声对大于2 cm的小肠肿瘤的显示率可达91.7%, 但易受胃肠道气体干扰, 产生漏诊及定位错误[8]. 腹部CT检查操作简便且无创, 检出率、定位准确率高, 及时了解肿瘤的大小、形态、与临近组织的关系、转移, 对良恶性诊断具有参考价值, 且可为小肠镜进镜提供线索. 但CT易受小肠间质瘤溃疡面血管破裂的大小及肠内容物重叠影响[9]. GIST在磁共振成像(magnetic resonance imaging, MRI)上主要表现为类圆形或不规则肿块, 平扫T1W1上呈均匀或不均匀低信号, 如果瘤体内有出血可呈高信号, T2W1上呈均匀或不均匀高信号, 如果瘤体内有液化坏死, 则呈高低混杂信号, 瘤体增强扫描后, 呈轻中度不均匀强化, 静脉期较动脉期强化程度略高[10]. 数字减影血管造影(digital subtraction angiography, DSA)往往在GIST合并消化道出血, 且出血达到1.5-2.0 mL/min以上, 血管造影方能显示出血部位. 文献报道出血活动期DSA检出率为59.3%-62.5%[11,12], 而非持续性出血或大面积黏膜糜烂出血者检出率低, 且不能显示小肠形态及小肠与出血之间关系. 胶囊内镜因其无创手段, 常作为小肠疾病检查一线方法, 但易受肠内情况干扰、不能反复检查、不能取活检, 仅作为一种无创筛查手段[13]. 小肠镜因其可操控性、图像清晰、可在内镜下活检及治疗等优势, 目前是临床诊断常用手段. 内镜下的GIST具有黏膜下肿瘤的特点, 呈半球状隆起, 可形成桥形皱襞. 但常规内镜难以诊断和辨别GIST的良恶性, 且GIST多起源于固有肌层, 普通内镜下活检几乎无法取到病变组织, 不适当的活检可能引起肿瘤的破溃、出血和增加肿瘤播散的危险性[14]. 期间我们通过CT影像学发现病灶, 完善小肠CT成像及单气囊小肠镜检查进一步明确病变位置及性质的推测.
因GIST具有潜在恶性的特点, 因此首选治疗方式是手术将其完整切除[15]. 而小肠间质瘤恶性程度较胃间质瘤高, 且易复发转移, 据统计GIST术后1年、3年及5年无病生存率分别为95%、83%及74%, 亚组分析提示小肠及直肠GIST更易复发[16], 原发高危GIST患者的中位复发时间约为术后2年, 对传统放化疗不敏感. 手术联合分子靶向的新治疗模式使GIST患者从中获益, 提高了患者生存率. 甲磺酸伊马替尼(imatinib mesylate, IM)是一种选择性kit/PDGFRA受体酪氨酸激酶抑制剂, 作为新一代的分子靶向治疗药物, 为无法切除、复发或转移的GIST患者带来希望[17]. 本例患者术后病理核分裂像>5个/50HPF, Ki-67约2%, 大者肿瘤有出血、坏死. 根据NIH 2008版(中国共识改良版)危险度评估[18], 患者属于高危险度分级, 而具有中高危复发风险的患者作为辅助治疗的适应人群, 给予IM 400 mg/d, 持续3年. 应每3 mo进行CT或MRI检查, 持续3年, 然后每6 mo 1次, 直至5年, 5年后每年随访1次. 笔者已对该患者建立完整的病历档案, 进行系统的随访.
综合本病例分析, 对于不明原因的消化道出血患者, 在生命体征稳定的情况下, 借助于无创或微创检查明确初步病因, 同时联合多学科讨论, 迅速判断病情, 制定合理规范的治疗方案及后续治疗计划, 对于降低患者死亡率及改善患者预后有重要意义.
学科分类: 胃肠病学和肝病学
手稿来源地: 山东省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C, C
D级 (一般): 0
E级 (差): 0
编辑: 马亚娟 电编:刘继红
| 1. | Kuo JR, Pasha SF, Leighton JA. The Clinician's Guide to Suspected Small Bowel Bleeding. Am J Gastroenterol. 2019;114:591-598. [PubMed] [DOI] |
| 2. | Ohmiya N, Nakagawa Y, Nagasaka M, Tahara T, Shibata T, Nakamura M, Hirooka Y, Goto H, Hirata I. Obscure gastrointestinal bleeding: diagnosis and treatment. Dig Endosc. 2015;27:285-294. [PubMed] [DOI] |
| 3. | Kovacs TO. Small Bowel Bleeding. Curr Treat Options Gastroenterol. 2005;8:31-38. [PubMed] |
| 4. | Popivanov G, Tabakov M, Mantese G, Cirocchi R, Piccinini I, D'Andrea V, Covarelli P, Boselli C, Barberini F, Tabola R, Pietro U, Cavaliere D. Surgical treatment of gastrointestinal stromal tumors of the duodenum: a literature review. Transl Gastroenterol Hepatol. 2018;3:71. [PubMed] [DOI] |
| 5. | Adela Avila S, Peñaloza J, González F, Abdo I, Rainville I, Root E, Carrero Valenzuela RD, Garber J. Dysphagia, melanosis, gastrointestinal stromal tumors and a germinal mutation of the KIT gene in an Argentine family. Acta Gastroenterol Latinoam. 2014;44:9-15. [PubMed] |
| 6. | Beham AW, Schaefer IM, Schüler P, Cameron S, Ghadimi BM. Gastrointestinal stromal tumors. Int J Colorectal Dis. 2012;27:689-700. [PubMed] [DOI] |
| 7. | Hakimé A, Le Cesne A, Deschamps F, Farouil G, Boudabous S, Aupérin A, Domont J, Debaere T. A role for adjuvant RFA in managing hepatic metastases from gastrointestinal stromal tumors (GIST) after treatment with targeted systemic therapy using kinase inhibitors. Cardiovasc Intervent Radiol. 2014;37:132-139. [PubMed] [DOI] |
| 8. | Fujita M, Manabe N, Honda K, Murao T, Osawa M, Kawai R, Akiyama T, Shiotani A, Haruma K, Hata J. Usefulness of Ultrasonography for Diagnosis of Small Bowel Tumors: A Comparison Between Ultrasonography and Endoscopic Modalities. Medicine (Baltimore). 2015;94:e1464. [PubMed] [DOI] |
| 9. | Liu B, Ramalho M, AlObaidy M, Busireddy KK, Altun E, Kalubowila J, Semelka RC. Gastrointestinal imaging-practical magnetic resonance imaging approach. World J Radiol. 2014;6:544-566. [PubMed] [DOI] |
| 10. | Jiang ZX, Zhang SJ, Peng WJ, Yu BH. Rectal gastrointestinal stromal tumors: imaging features with clinical and pathological correlation. World J Gastroenterol. 2013;19:3108-3116. [PubMed] [DOI] |
| 11. | Tan KK, Wong D, Sim R. Superselective embolization for lower gastrointestinal hemorrhage: an institutional review over 7 years. World J Surg. 2008;32:2707-2715. [PubMed] [DOI] |
| 12. | Chen YT, Sun HL, Luo JH, Ni JY, Chen D, Jiang XY, Zhou JX, Xu LF. Interventional digital subtraction angiography for small bowel gastrointestinal stromal tumors with bleeding. World J Gastroenterol. 2014;20:17955-17961. [PubMed] [DOI] |
| 13. | Rey JF. The future of capsule endoscopy. Keio J Med. 2013;62:41-46. [PubMed] |
| 14. | Joensuu H, Hohenberger P, Corless CL. Gastrointestinal stromal tumour. Lancet. 2013;382:973-983. [PubMed] [DOI] |
| 15. | Lamba G, Gupta R, Lee B, Ambrale S, Liu D. Current management and prognostic features for gastrointestinal stromal tumor (GIST). Exp Hematol Oncol. 2012;1:14. [PubMed] [DOI] |
| 16. | Bischof DA, Kim Y, Dodson R, Jimenez MC, Behman R, Cocieru A, Fisher SB, Groeschl RT, Squires MH, Maithel SK, Blazer DG, Kooby DA, Gamblin TC, Bauer TW, Quereshy FA, Karanicolas PJ, Law CH, Pawlik TM. Conditional disease-free survival after surgical resection of gastrointestinal stromal tumors: a multi-institutional analysis of 502 patients. JAMA Surg. 2015;150:299-306. [PubMed] [DOI] |
| 17. | Grignol VP, Termuhlen PM. Gastrointestinal stromal tumor surgery and adjuvant therapy. Surg Clin North Am. 2011;91:1079-1087. [PubMed] [DOI] |
| 18. | 中国临床肿瘤学会胃肠间质瘤专家委员会. 中国胃肠间质瘤诊断治疗共识(2017年版). 肿瘤综合治疗电子杂志. 2018;4:31-43. [DOI] |