修回日期: 2019-05-14
接受日期: 2019-06-05
在线出版日期: 2019-06-28
胃癌(gastric cancer, GC)是常见的消化系统肿瘤之一, 而肿瘤化疗耐药是制约GC癌治疗效果的瓶颈, 探索逆转GC化疗耐药机制对于GC的治疗具有重大意义.
探讨敲低miR-214表达对GC细胞SGC-7901/DDP顺铂耐药性、迁移以及上皮间质转化(epithelial mesenchymal transformation, EMT)的影响, 并讨论初步作用机制.
采用LipofectamineTM2000法转染miR-214 inhibitor至SGC-7901/DDP细胞后, CCK-8法评估细胞对顺铂耐药性的改变; 划痕试验检测细胞迁移能力; 免疫印迹法检测细胞中E-钙黏蛋白(E-cad)、波形蛋白(Vimentin)和N-钙黏蛋白(N-cad), 以及NF-κB与Bcl-2蛋白表达水平.
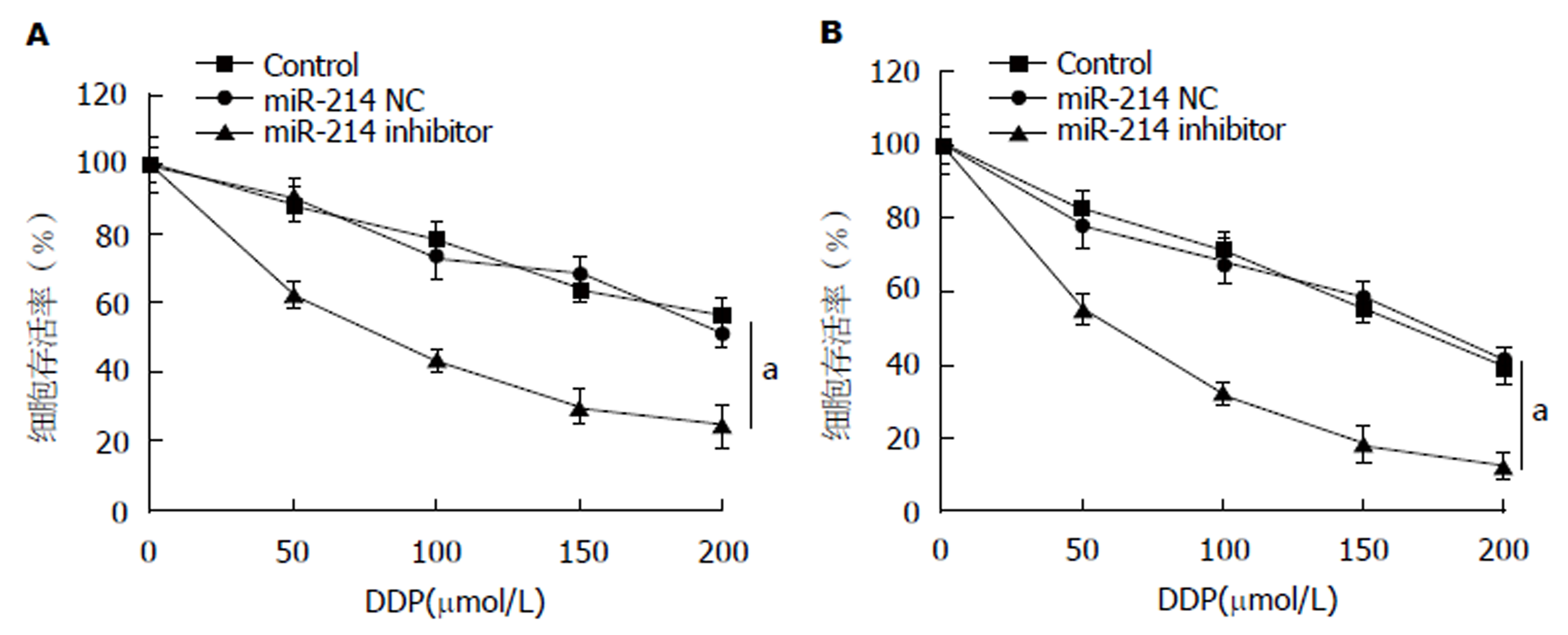
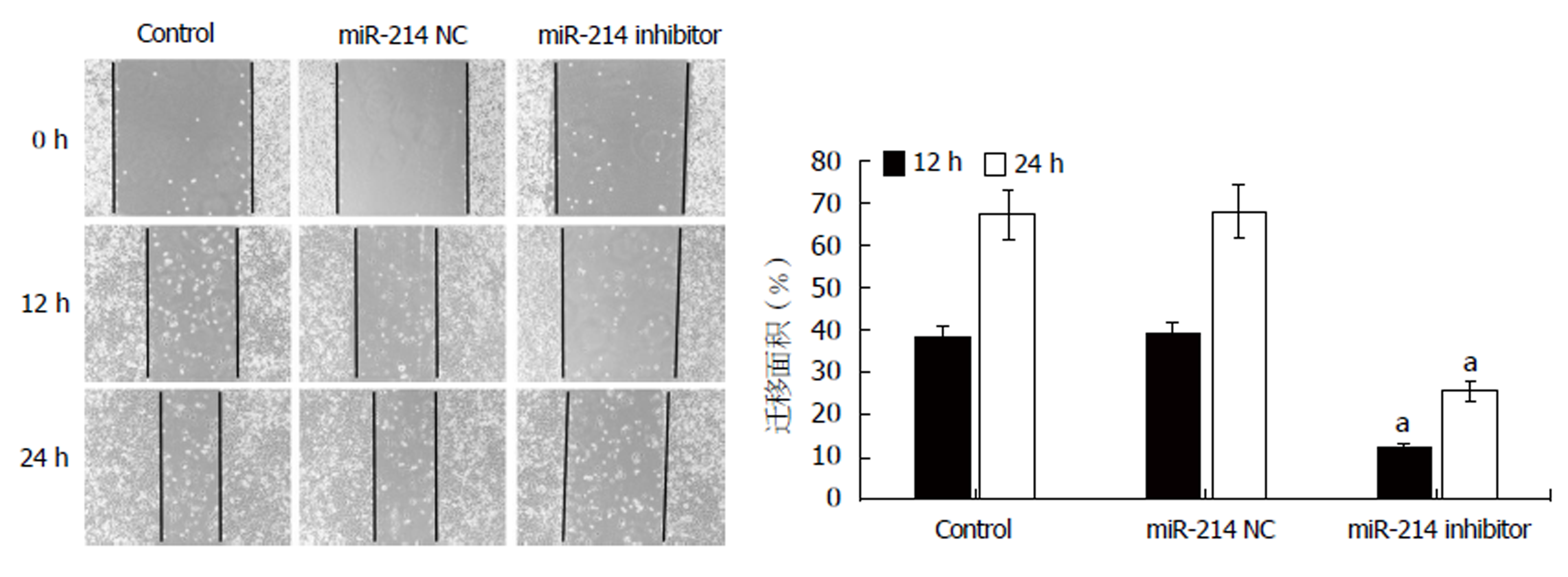
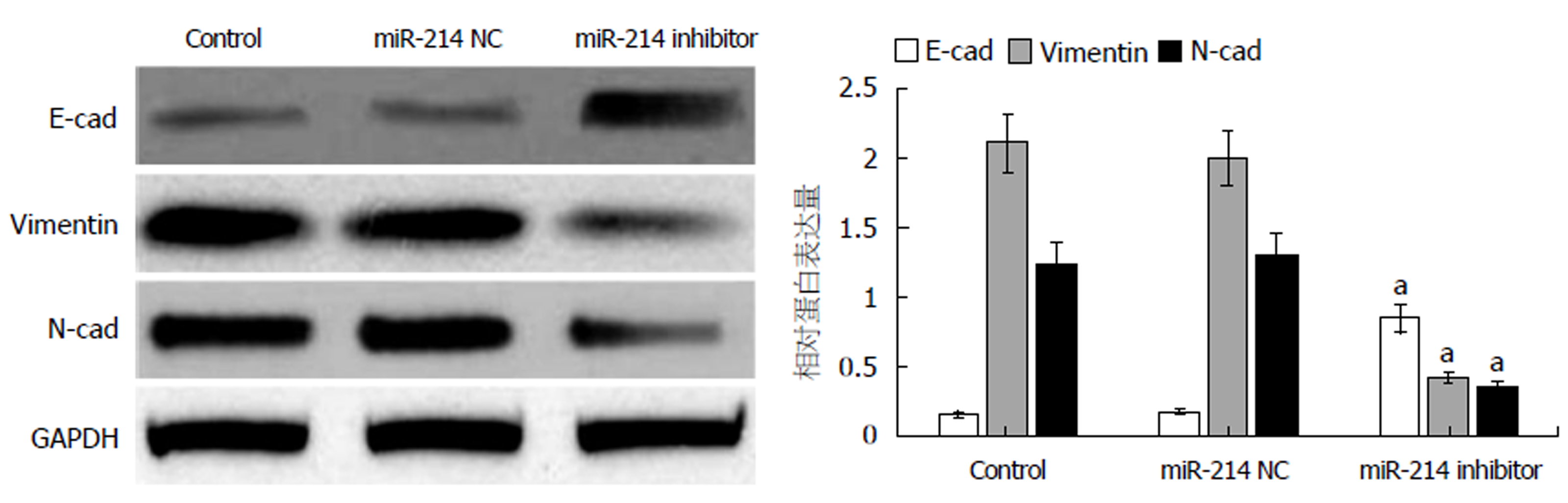
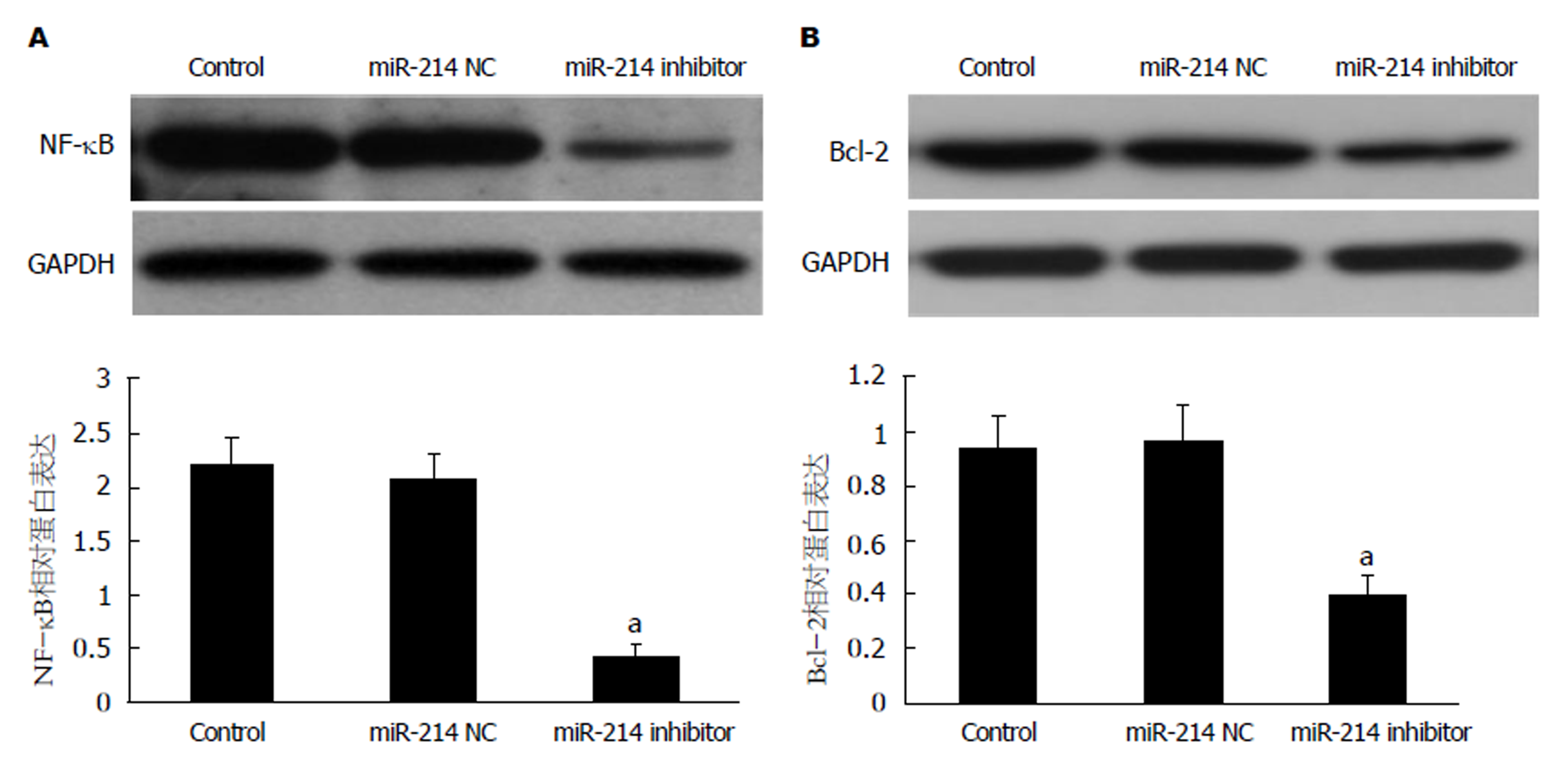
转染miR-214 inhibitor后, SGC-7901/DDP细胞对顺铂耐药性明显降低(P<0.05); 且细胞迁移能力明显降低(P<0.05), E-cad蛋白表达显著升高(P<0.05), Vimentin与N-cad蛋白表达均显著降低(均P<0.05). 另外, SGC-7901/DDP细胞中NF-κB与Bcl-2的表达明显降低(均P<0.05).
下调miR-214表达具有降低GCSGC-7901/DDP细胞对顺铂耐药性, 抑制细胞迁移与EMT的作用. 而这种作用可能与下调NF-κB与Bcl-2的表达有关.
核心提要: 铂类药物为主的化疗是治疗胃癌的常用手段之一, 而化疗耐药制约着化疗的最终疗效. 本研究发现, 下调SGC-7901/DDP细胞miR-214表达后, 顺铂耐药性、细胞迁移与上皮间质转化均降低; 同时, NF-κB与Bcl-2的表达也明显降低.
引文著录: 朱艳, 刘玮丽, 吴明东, 庄永卫, 叶淑芳, 施旭红. 下调miRNA-214表达抑制胃癌SGC-7901/DDP细胞顺铂耐药、迁移和上皮间质转化. 世界华人消化杂志 2019; 27(12): 742-747
Revised: May 14, 2019
Accepted: June 5, 2019
Published online: June 28, 2019
Gastric cancer (GC) is one of the common tumors of the digestive system, and resistance to chemotherapy is the bottleneck that restricts the therapeutic effect of chemotherapy in GC. Therefore, it is of great significance to explore the mechanism of reversal of chemotherapy resistance.
To investigate the effect of miRNA-214 (miR-214) knockdown on cisplatin resistance, cell migration, and epithelial mesenchymal transformation (EMT) in GC SGC-7901/DDP cells, and to explore the preliminary mechanism.
After transfection of SGC-7901/DDP cells with miR-214 inhibitor using the LipofectamineTM2000 method, the change of cell resistance to cisplatin was evaluated by the CCK-8 assay, cell migration was evaluated by wound healing assay, and the protein expression levels of E-cadherin (E-cad), Vimentin, N-cadherin (N-cad), NF-κB, and Bcl-2 were detected by Western blot.
After transfection with miR-214 inhibitor, the resistance of SGC-7901/DDP cells to cisplatin was significantly reduced (P < 0.05), and the ability of cell migration was obviously decreased (P < 0.05). The expression level of E-cad protein was significantly increased (P < 0.05), while the expression levels of Vimentin and N-cad proteins were significantly decreased (P < 0.05). Moreover, the expression levels of NF-κB and Bcl-2 protein in SGC-7901/DDP cells were significantly decreased (P < 0.05).
Down-regulation of miR-214 can reduce the resistance of SGC-7901/DDP cells to cisplatin and inhibit cell migration and EMT. This effect may be related to the down-regulation of NF-κB and Bcl-2 expression.
- Citation: Zhu Y, Liu YL, Wu MD, Zhuang YW, Ye SF, Shi XH. Downregulation of miRNA-214 inhibits cisplatin resistance, cell migration, and epithelial interstitial transformation in gastric cancer SGC-7901/DDP cells. Shijie Huaren Xiaohua Zazhi 2019; 27(12): 742-747
- URL: https://www.wjgnet.com/1009-3079/full/v27/i12/742.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v27.i12.742
胃癌(gastric cancer, GC)是常见的消化系统恶性肿瘤之一, 据2018年肿瘤年报显示, 我国GC发病率位于所有恶性肿瘤中的第五位, 死亡率位于所有恶性肿瘤中的第三位[1]. 且, 随着人们饮食结构的变化, 以及现代生活压力的增加, GC的发病年龄呈现低龄化趋势[2]. GC常规治疗手段是化疗或者GC切除术后辅以化疗方式[3]. 虽然大部分GC患者对化疗呈现出较好的初始反应, 但很快就易出现获得性耐药, 而再次化疗效果极不理想[4]. 即便是化疗敏感的GC患者也易进展为化疗耐药性GC患者; 而这种获得性耐药往往是多药耐药, 对其他具有不同分子结构和作用靶点的抗肿瘤药物也往往存在交叉性耐药, 此时更换或联合其他种类化疗药物也难以使患者获益[5]. 因此, 逆转GC细胞对化疗的耐药性的研究, 不仅是急需解决的临床治疗课题, 还具有重大的社会意义.
在肿瘤的研究中, 许多与GC化疗药物敏感性的靶点受到miRNAs的调控[6]. miR-214作为miRNAs中的一员, 不但被报道可以调节包含GC细胞在内的多种癌细胞的增殖、侵袭和迁移[7,8]; 而且miR-214表达还与骨肉瘤、卵巢癌和舌鳞状细胞癌等癌细胞的顺铂耐药性相关[9-11]. 尽管miR-214已被证明在多种肿瘤的发生及发展中具有调控功能, 但其对GC顺铂耐药中的具体作用尚不清楚. 本研究讨论敲低miR-214对GC顺铂耐药株SGC-7901/DDP的耐药性、迁移与上皮间质转化(epithelial-mesenchymal transition, EMT)的影响, 并讨论其可能的初步机制.
人GC顺铂耐药SGC-7901/DDP细胞购自中国科学院上海生物细胞研究所; 胎牛血清购自美国Gibco公司; RPMI-1640培养基购自美国Hyclone公司; CCK-8试剂盒购自碧云天生物技术有限公司; E-cadherin (E-cad)抗体购自美国Acam公司; Vimentin、NF-κB和 Bcl-2抗体均购自美国Santa Cruz公司; N-cadherin (N-cad)抗体购自美国BD公司; miR-214 NC和miR-214 inhibitor由上海吉玛公司合成; 其他试剂为国产分析纯.
1.2.1 细胞培养与转染: 将人GC顺铂耐药SGC-7901/DDP细胞培养于含10%胎牛血清的RPMI-1640培养基中, 在37 ℃、5%CO2的培养箱中培养, 待细胞融合至80%-90%时, 按照LipofectamineTM2000试剂盒说明书进行转染, 实验共分为三组: 对照组(Control), 阴性对照组(miR-214 NC)和miRNA-214下调组(miR-214 inhibitor), 阴性对照组与沉默组分别转染miR-214 NC与miR-214 inhibitor, 48 h后更换培养基, 继续培养细胞, 备用.
1.2.2 细胞存活率检测: 严格按照CCK-8试剂盒说明书操作, 将SGC-7901/DDP细胞和已转染miR-214 NC与miR-214 inhibitor的SGC-7901/DDP细胞按照5×104的密度接种到96孔板中, 分别加入终浓度分别为50 μmol/L、100 μmol/L和200 μmol/L的顺铂, 分别再继续培养24 h与48 h. 达到时间终点时, 每孔加入10 μL CCK-8溶液, 在培养箱中孵育2 h, 用酶标仪在450 nm波长处测量吸光度(OD值). 计算细胞存活率, 细胞存活率=处理组OD/对照组OD值×100%.
1.2.3 细胞迁移能力: 收集SGC-7901/DDP细胞和已转染miR-214 NC与miR-214 inhibitor的SGC-7901/DDP细胞, 将其接种至6孔板, 待细胞达到单细胞层完全融合时, 采用无菌10 μL枪头划痕, 并采用无菌生理盐水冲洗细胞2次, 然后置于37 ℃、5%CO2的培养箱中继续培养12 h和24 h. 导致显微镜拍照记录细胞在划痕开始时和划痕后12 h与24 h的细胞图像, 采用IPP软件计算细胞迁移面积.
1.2.4 免疫印迹法: 收集SGC-7901/DDP细胞和已转染miR-214 NC与miR-214 inhibitor的SGC-7901/DDP细胞, 然后分别加入预冷的细胞裂解液, 4 ℃下12000×g离心15 min, 收集上清液. BCA蛋白浓度测定试剂盒进行蛋白浓度测定后, 取50 μg蛋白与5×SDS上样缓冲液一起进行SDS-PAGE电泳, 然后再电转至合适大小的PVDF膜, 加入5%脱脂牛奶, 室温下封闭1 h, 加入一抗稀释液, 室温下摇床孵育1 h, 4 ℃孵育过夜, TBST漂洗5 min×3次, 加入相应二抗, 37 ℃孵育1 h, TBST洗涤5 min×3次, 采用ECL电化学发光显色, 采用Image J软件对蛋白条带进行定量分析.
统计学处理 采用SPSS 18.0统计软件对实验数据进行分析, 计量资料采用mean±SD表示, 多样本均数比较采用单因素方差分析后LSD-t检验, 以P<0.05为差异具有统计学意义.
CCK-8法结果(图1)显示, 与Control组或miR-214 NC组相比, 转染miR-214 inhibitor 24 h(图1A)或48 h(图1B)后, SGC-7901/DDP细胞对顺铂的耐药性均降低, 差异均有统计学意义(均P<0.05). 其中与Control组相比, 转染miR-214 NC 24 h(图1A)或48 h(图1B)后, SGC-7901/DDP细胞对顺铂的耐药性无影响, 差异均无统计学意义(均P>0.05).
划痕试验结果(图2)显示, 与Control组或miR-214 NC组相比, 转染miR-214 inhibitor后, SGC-7901/DDP细胞迁移面积明显降低, 差异具有统计学意义(P<0.05). 其中与Control组相比, 转染miR-214 NC后, SGC-7901/DDP细胞迁移面积无明显变化, 差异无统计学意义(P>0.05).
Western blot结果显示(图3), 与Control组或miR-214 NC组相比, 转染miR-214 inhibitor后, SGC-7901/DDP细胞中E-cad蛋白表达显著上升(P<0.05), Vimentin与N-cad蛋白表达均显著下降(均P<0.05); 其中与Control组相比, 转染miR-214 NC后, 上述相关蛋白均无显著变化(均P>0.05).
2.4 下调miR-214抑制SGC-7901/DDP细胞中NF-κB与Bcl-2蛋白表达 Western blot结果显示(图4), 与Control组或miR-214 NC组相比, 转染miR-214 inhibitor后, SGC-7901/DDP细胞中NF-κB(图4A)与Bcl-2(图4B)的表达均明显下调, 差异均有统计学意义(均P<0.05). 其中与Control组相比, 转染miR-214 NC后, SGC-7901/DDP细胞中NF-κB(图4A)与Bcl-2(图4B)的表达无明显差异(均P>0.05).
GC以化疗或者GC切除术后辅以基础化疗作为主要的治疗手段[3]. 顺铂是常用的广谱的肿瘤化疗药物之一, 广泛应用于头颈部肿瘤、GC、肺癌、乳腺癌和卵巢癌等各类肿瘤的临床治疗. 但在临床上, 大多数化疗GC患者会出现顺铂耐药, 而, 顺铂耐药也是GC患者临床治疗失败的主要原因[4,5]. 而miRNAs的差异表达在GC的顺铂化疗耐药中发挥重要作用[6,12]. 如miR-129在GC化疗耐药组织中低表达; 而过表达miR-129后, GC细胞对顺铂的耐药性得到逆转, 造成对顺铂的敏感性明显提高[12]. miR-214作为总多miRNAs的一员, 参与调控骨肉瘤、卵巢癌和舌鳞状细胞癌细胞的顺铂耐药性[9-11]. 而在GC耐药细胞中改变miR-214表达是否对顺铂耐药产生影响尚不清楚. 本研究在GC顺铂耐药细胞SGC-7901/DDP中通过转染miR-214 inhibitor后, 发现, 敲低miR-214表达能降低SGC-7901/DDP细胞对顺铂的耐药性, 抑制细胞的迁移与EMT.
EMT是指细胞通过特定程序转化为具有间质表型细胞的生物学过程[12]. 在此过程中伴随着上皮细胞标志物E-钙黏蛋白(E-cadherin)的表达减少和N-钙黏蛋白(N-cadherin)表达增加, 以及间质细胞标志物波形蛋白(Vimentin)增加等EMT的标志物的改变[13]. 多项研究表明[13,14], EMT在肿瘤的迁移与侵袭中发挥着重要的作用, 当肿瘤细胞出现间充质转化后, 失去细胞极性, 降低与基底膜的连接性, 从而具有降解细胞外基质、高迁移能力与侵袭能力的间质表型; 而抑制EMT能抑制肿瘤细胞迁移. 本研究中, 发现敲低miR-214表达能降低SGC-7901/DDP细胞的迁移与敲低miR-214降低SGC-7901/DDP细胞EMT进程相关.
NF-κB是一种核内转录调节因子. 研究发现, 在顺铂耐药的肿瘤细胞中, NF-κB和Bcl-2高表达, 而抑制NF-κB和Bcl-2表达, 能够使多种肿瘤细胞对化疗药物的敏感性增高[15,16]. 另外, 抑制NF-κB和Bcl-2表达能使GC细胞迁移与EMT降低[17]. Bcl-2的调节位点上有NF-κB的结合位点, 受NF-κB的调控, 与NF-κB具有协同作用[18]. 我们研究结果显示, 下调miR-214表达后, SGC-7901/DDP细胞中的NF-κB与Bcl-2蛋白明显降低, 提示敲低miR-214抑制SGC-7901/DDP细胞顺铂耐药性可能与抑制NF-κB与Bcl-2蛋白表达相关. 下调miR-214如何抑制NF-κB与Bcl-2表达, 还需要进一步进行研究验证.
总之, 下调miR-214的表达能够抑制GC顺铂耐药株SGC-7901/DDP对顺铂的耐药性, 同时使得细胞迁移能力下降, 并促进EMT作用, 可能与其抑制NF-κB与Bcl-2蛋白表达的作用有关.
胃癌(gastric cancer, GC)是常见的消化系统恶性肿瘤之一. 而化疗是治疗GC常规治疗手段之一. 而GC患者化疗容易出现获得性化疗耐药. 因此, 研究逆转GC化疗耐药性的靶点和调控信号机制, 是当今治疗GC急需解决的重要的临床课题.
在肿瘤的研究中, 许多miRNAs在调控肿瘤细胞的化疗耐药性中发挥着重要作用. miR-214作为总多miRNAs中的一员, 可以促进多种癌细胞包含GC细胞的增殖、侵袭和迁移, 另外, miR-214还参与调控骨肉瘤细胞、卵巢癌细胞和舌鳞状细胞癌细胞对顺铂耐药性的改变. 尽管miR-214已被证明在多种肿瘤的发生及发展中具有调控功能, 但其对GC顺铂耐药中的具体作用尚不清楚.
本研究采用GC顺铂耐药SGC-7901/DDP细胞, 然后通过转染miR-214 inhibitor, 下调miR-214表达后, 观察SGC-7901/DDP细胞迁移、上皮间质转化与顺铂耐药性的变化, 并分析其初步作用机制.
SGC-7901/DDP细胞转染miR-214 inhibitor后, 通过CCK8法评估敲低miR-214是否影响细胞对顺铂耐药性; 通过划痕实验评估敲低miR-214是否影响细胞迁移能力; 免疫印迹法评估敲低miR-214是否影响细胞上皮间质转化标志物表达, 以及NF-κB与Bcl-2表达水平.
敲低miR-214后, SGC-7901/DDP细胞对顺铂耐药性明显降低; 敲低miR-214后, SGC-7901/DDP细胞迁移能力下降; 敲低miR-214后, SGC-7901/DDP细胞上皮间质转化标志物表达发生了改变, 表现为E-cad蛋白表达显著上升, Vimentin与N-cad蛋白表达显著下降; 同时, 敲低miR-214后, SGC-7901/DDP细胞NF-κB与Bcl-2的表达明显降低.
敲低miR-214具有抑制SGC-7901/DDP细胞对顺铂耐药性、细胞迁移与上皮间质转化的作用. 而这种作用可能与下调NF-κB与Bcl-2的表达有关.
本研究提示, 下调miR-214能逆转GCSGC-7901/DDP细胞对顺铂的耐药性, 为GC顺铂耐药提供了一定的研究靶点. 本研究下步将先检查临床样本GC耐药组织中miR-214表达, 并采用GC耐药细胞建立GC移植荷瘤鼠在动物实验上检验下调miR-214后, GC顺铂耐药性是否发生逆转.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C, C
D级 (一般): 0
E级 (差): E
编辑: 崔丽君 电编:刘继红
| 1. | Bray F, Ferlay J, Soerjomataram I, Siegel RL, Torre LA, Jemal A. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 2018;68:394-424. [PubMed] [DOI] |
| 2. | Sung H, Siegel RL, Rosenberg PS, Jemal A. Emerging cancer trends among young adults in the USA: analysis of a population-based cancer registry. Lancet Public Health. 2019;4:e137-e147. [PubMed] [DOI] |
| 3. | Choi AH, Kim J, Chao J. Perioperative chemotherapy for resectable gastric cancer: MAGIC and beyond. World J Gastroenterol. 2015;21:7343-7348. [PubMed] [DOI] |
| 4. | Hayase S, Yamada L, Ujiie D, Nirei A, Tada T, Hanayama H, Monma T, Saze Z, Ohki S, Kono K. Clinical usefulness of ramucirumab plus paclitaxel for unresectable and recurrent gastric cancer. Fukushima J Med Sci. 2019;65:6-12. [PubMed] [DOI] |
| 5. | Yu P, Du Y, Cheng X, Yu Q, Huang L, Dong R. Expression of multidrug resistance-associated proteins and their relation to postoperative individualized chemotherapy in gastric cancer. World J Surg Oncol. 2014;12:307. [PubMed] [DOI] |
| 6. | Yang X, Zhao Q, Yin H, Lei X, Gan R. MiR-33b-5p sensitizes gastric cancer cells to chemotherapy drugs via inhibiting HMGA2 expression. J Drug Target. 2017;25:653-660. [PubMed] [DOI] |
| 7. | Li HL, Liang S, Cui JH, Han GY. Targeting of GSK-3¦Â by miR-214 to facilitate gastric cancer cell proliferation and decrease of cell apoptosis. Eur Rev Med Pharmacol Sci. 2018;22:127-134. [PubMed] [DOI] |
| 8. | Zhang K, Zhang M, Jiang H, Liu F, Liu H, Li Y. Down-regulation of miR-214 inhibits proliferation and glycolysis in non-small-cell lung cancer cells via down-regulating the expression of hexokinase 2 and pyruvate kinase isozyme M2. Biomed Pharmacother. 2018;105:545-552. [PubMed] [DOI] |
| 9. | Song YD, Li DD, Guan Y, Wang YL, Zheng J. miR-214 modulates cisplatin sensitivity of osteosarcoma cells through regulation of anaerobic glycolysis. Cell Mol Biol (Noisy-le-grand). 2017;63:75-79. [PubMed] [DOI] |
| 10. | Yang H, Kong W, He L, Zhao JJ, O’Donnell JD, Wang J, Wenham RM, Coppola D, Kruk PA, Nicosia SV, Cheng JQ. MicroRNA expression profiling in human ovarian cancer: miR-214 induces cell survival and cisplatin resistance by targeting PTEN. Cancer Res. 2008;68:425-433. [PubMed] [DOI] |
| 11. | Yu ZW, Zhong LP, Ji T, Zhang P, Chen WT, Zhang CP. MicroRNAs contribute to the chemoresistance of cisplatin in tongue squamous cell carcinoma lines. Oral Oncol. 2010;46:317-322. [PubMed] [DOI] |
| 12. | Lu C, Shan Z, Li C, Yang L. MiR-129 regulates cisplatin-resistance in human gastric cancer cells by targeting P-gp. Biomed Pharmacother. 2017;86:450-456. [PubMed] [DOI] |
| 13. | Zhang Z, Che X, Yang N, Bai Z, Wu Y, Zhao L, Pei H. miR-135b-5p Promotes migration, invasion and EMT of pancreatic cancer cells by targeting NR3C2. Biomed Pharmacother. 2017;96:1341-1348. [PubMed] [DOI] |
| 14. | Wu TJ, Xu B, Zhao GH, Luo J, Luo C. IL-37 suppresses migration and invasion of gallbladder cancer cells through inhibition of HIF-1¦Á induced epithelial-mesenchymal transition. Eur Rev Med Pharmacol Sci. 2018;22:8179-8185. [PubMed] [DOI] |
| 15. | Yu S, Gong LS, Li NF, Pan YF, Zhang L. Galangin (GG) combined with cisplatin (DDP) to suppress human lung cancer by inhibition of STAT3-regulated NF-κB and Bcl-2/Bax signaling pathways. Biomed Pharmacother. 2018;97:213-224. [PubMed] [DOI] |
| 16. | Chen PM, Cheng YW, Wu TC, Chen CY, Lee H. MnSOD overexpression confers cisplatin resistance in lung adenocarcinoma via the NF-κB/Snail/Bcl-2 pathway. Free Radic Biol Med. 2015;79:127-137. [PubMed] [DOI] |
| 17. | Zhou P, Wang C, Hu Z, Chen W, Qi W, Li A. Genistein induces apoptosis of colon cancer cells by reversal of epithelial-to-mesenchymal via a Notch1/NF-κB/slug/E-cadherin pathway. BMC Cancer. 2017;17:813. [PubMed] [DOI] |
| 18. | Ren L, Li Z, Dai C, Zhao D, Wang Y, Ma C, Liu C. Chrysophanol inhibits proliferation and induces apoptosis through NF-κB/cyclin D1 and NF-κB/Bcl-2 signaling cascade in breast cancer cell lines. Mol Med Rep. 2018;17:4376-4382. [PubMed] [DOI] |