修回日期: 2018-01-19
接受日期: 2018-01-29
在线出版日期: 2018-03-08
观察粪菌移植(fecal microbiota transplantation, FMT)与5-氨基水杨酸(5-aminosalicylic acid, 5-ASA)在小鼠实验性结肠炎模型中的疗效.
将40只6周龄左右的♂C57BL/6小鼠, 随机分为2组, 正常组(8只)和模型组(32只), 适应性喂养2 wk后, 模型组连续自由饮用3%葡聚糖硫酸钠(dextran sulfate sodium, DSS)5 d, 建立实验性结肠炎模型, 于第6天更换为纯净水, A组自由饮用纯净水, 适应性喂养3 d后, 将模型组随机分为4组, 每组8只, 分别为: 模型对照组、FMT组、5-ASA组、联合组(FMT+5-ASA), FMT组、5-ASA组及联合组于第9、11、13天粪便给予粪菌滤液、5-ASA灌肠液及粪菌滤液与5-ASA的混合液灌肠, 其余两组给予生理盐水灌肠. 每日进行小鼠的疾病活动指数评分(disease active index, DAI), 于第14天处死小鼠, 采集血液标本行IL-10检测, 测量结肠长度, 留取结肠组织行HE染色, 并评估组织损伤指数(histological index, HI).
与模型组相比, 5-ASA组与联合组均取得较好的疗效, DAI评分、HI评分较治疗前明显降低, 差异有统计学意义(P<0.05), 但仍高于空白对照组(P<0.05), FMT组的DAI评分、HI评分较前有治疗前有所缓解, 但其与模型对照组差异无统计学意义(P<0.05); 5-ASA组与联合组的IL-10水平高于模型对照组(P<0.05), 而FMT组的IL-10水平较模型对照组增加, 但差异无统计学意义(P>0.05).
FMT在小鼠结肠炎模型中确实有一定疗效, 但仍不如氨基水杨酸制剂, 其与氨基水杨酸制剂的联合使用也并没有取得更好的效果, 可能与治疗方式、治疗周期等因素有关.
核心提要: 溃疡性结肠炎(ulcerative colitis, UC)是一种病因不明的慢性非特异性炎症, 其治疗价格昂贵且疗效不佳, 粪菌移植(fecal microbiota transplantation, FMT)在UC中的疗效是近几年的研究热点, 而本研究则是观察FMT与传统药物疗效的对比, 并研究其可能的机制.
引文著录: 曾翠, 余红璐, 陈正莲, 杨歆睿, 熊枝繁. 粪菌移植与5-氨基水杨酸在小鼠实验性结肠炎中的疗效观察. 世界华人消化杂志 2018; 26(7): 411-417
Revised: January 19, 2018
Accepted: January 29, 2018
Published online: March 8, 2018
To evaluate the efficacy of fecal microbiota transplantation (FMT) and 5-aminosalicylic acid (5-ASA) in the treatment of experimental colitis in a mouse model.
Forty 6-wk-old male C57BL/6 mice were randomly divided into either a normal group (8 rats) or a model group (32 rats). After 2 wk of feeding, the model group was continuously treated with 3% dextran sulfate sodium (DSS) for 5 d to establish an experimental colitis model. After adaptive feeding for 3 d, the model group was further randomly divided into four groups (8 rats in each group): a model control group, an FMT group, a 5-ASA group, and a combination group (FMT + 5-ASA). The FMT group, 5-ASA group, and combination group were given fecal filtrate, 5-ASA enema solution, and fecal filtrate plus 5-ASA enema solution on the 9th, 11th, and 13th days, respectively. The other two groups were given physiological salt solution enema. Mice were sacrificed on the 14th day, and blood samples were collected for interleukin-10 (IL-10) detection. Colon length was measured, and colon tissues were harvested for hematoxylin and eosin (HE) staining to evaluate histological index (HI).
Compared with the model group, the 5-ASA group and the combination group achieved better curative effect. The disease activity index (DAI) score and HI score in the two groups were significantly lower than those before treatment (P < 0.05), but still higher than those in the normal control group (P < 0.05). The DAI score and HI score in the FMT group were improved compared with those before treatment, but there was no significant difference between the FMT group and the model control group (P > 0.05). The level of IL-10 in the FMT group was higher than that in the model control group (P < 0.05), but the difference was not statistically significant (P > 0.05).
FMT in the mouse colitis model does have a certain effect, but is still not as good as aminosalicylic acid formulations. The combined use of aminosalicylic acid formulations and FMT does not result in better results, which may be related to the treatment mode, treatment cycle and other factors.
- Citation: Zeng C, Yu HL, Chen ZL, Yang XR, Xiong ZF. Efficacy of fecal microbiota transplantation and 5-aminosalicylic acid in management of experimental colitis in mice. Shijie Huaren Xiaohua Zazhi 2018; 26(7): 411-417
- URL: https://www.wjgnet.com/1009-3079/full/v26/i7/411.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v26.i7.411
溃疡性结肠炎(ulcerative colitis, UC)是一种病因不明确的慢性非特异性炎症性肠病. UC的具体发病机制仍不明确, 目前认为其发病与遗传因素、环境因素、肠道黏膜屏障功能障碍、感染因素等多种因素有关[1]. 目前治疗UC的传统三大类药物有氨基水杨酸制剂、糖皮质激素、免疫抑制剂, 近年来随着UC发病机制的研究, 益生菌、生物制剂等药物也用于UC的治疗, 但目前现有药物治疗效果有限, 仍有部分患者不能达到缓解, 并且上述药物有效的患者, 在高昂的药费和病情反复折磨下, 给他们带来了极大的身心痛苦.
粪菌移植(fecal microbiota transplantation, FMT)将健康人肠道菌群移植到病人肠道内, 进而重建病人肠道菌群[2]. Scaldaferri等[3]为了评估临床缓解和粪便移植之间的关系, 进行Meta分析, 结果表明FMT可诱导患者临床缓解, 但其有效性并不显著. 本研究通过建立小鼠实验性结肠炎模型, 分别采取不同的治疗方案, 观察FMT的治疗作用以及5-氨基水杨酸(5-aminosalicylic acid, 5-ASA)与其疗效对比.
1.1.1 实验动物: 6-7周龄C57BL/6♂SPF级小鼠40只, 平均体质量17 g左右, 购自湖北省实验动物中心. 实验动物许可证号: SCXK(鄂)2015-0018. 小鼠饲养于华中科技大学附属梨园医院老年医药学研究所动物房内, 室温维持在18℃-22℃, 相对湿度维持在50%-60%, 自然光照, 每日更换水和饲料, 隔日更换垫料.
1.1.2 试剂: 葡聚糖硫酸钠(DSS, MW: 36000-50000, 美国MP BIO公司); 美沙拉嗪又名5-氨基水杨酸(5-ASA, 玛雅试剂有限公司); 尿粪隐血测试盒(南京建成生物工程研究所); IL-10 ELISA试剂盒(欣博盛生物科技有限公司).
1.2.1 动物模型建立: 将40只C57BL/6小鼠随机分为对照组(A组, 8只)和模型组(S组, 32只), 适应性喂养2 wk后, 对照组自由饮用纯净水, 模型组自由饮用3%DSS溶液5 d后, 建立小鼠UC模型, 之后更换为纯净水3 d, 将模型组采用随机数字表法分为4组, 每组8只, 分别为模型对照组(B组)、FMT组(C组)、5-ASA组(D组)、联合组(E组), 分别于实验第9、11、13天分别给予生理盐水、粪菌滤液、5-ASA灌肠液及粪菌滤液与5-ASA的混合液灌肠, 同时空白对照组也给予生理盐水灌肠.
1.2.2 药品的制备: (1)3%DSS(W/V)溶液: 称取3 gDSS粉剂, 溶解于100 mL去离子水中, 使其充分溶解至溶液透明; (2)5-ASA灌肠液的制备: 每只小鼠使用量为100 mg/kg, 小鼠体质量按20 g计算, 每只小鼠需100×0.02 = 2 mg, 小鼠灌肠液体量为0.5 mL, 因此, 将20 mg 5-ASA溶于5 mL生理盐水中; (3)粪菌滤液的制备[4,5]: 收集正常对照组的C57BL/6小鼠的2-4 h大便若干, 于5倍的生理盐水中, 经过搅拌、过滤获得混悬液, 再经过重复的离心、洗涤, 最后的沉淀即为提纯的粪便微生物, 将沉淀加入3倍的生理盐水, 轻轻的上下混匀即得到; (4)粪菌滤液与5-ASA混合灌肠液的制备: 将60 mg氨基水杨酸制剂溶于按上述(3)所制15 mL的粪菌滤液中.
1.2.3 灌肠: 小鼠取俯卧位, 将直径2 mm硅胶灌肠管末端涂抹液体石蜡油, 向上轻抬小鼠尾巴, 将灌肠管自小鼠肛门轻轻插入, 插入深度4-5 cm, 将小鼠倒立, 缓慢注入各组所用灌肠液体0.5 mL后, 停留10 s后缓慢拔出硅胶管, 棉球按压小鼠肛门, 继续保持小鼠倒立1 min后, 放回笼中. 如小鼠反应剧烈, 可使用4%水合氯醛(10 μL/g)麻醉.
1.2.4 标本的采集与处理: 于实验第14天时, 腹腔注射20%乌拉坦(0.05 mL/10 g)麻醉小鼠, 摘除小鼠一侧眼球采集动静脉混合血约1.5 mL, 置于无菌干燥3 mL EP管中, 室温静置约2 h自然凝固后, 以2000 r/min离心15 min, 分离血清, -20℃冰箱中保存, 以备IL-10的ELISA检测. 采血完成后断颈处死小鼠, 将小鼠固定, 迅速沿腹中线打开腹腔, 取完整的盲肠至直肠肠段, 并拍照记录结肠长度. 沿肠系膜纵行剪开肠道, 用生理盐水冲洗肠腔, 清洗干净后, 每只小鼠相同部位留取2部分组织, 保存于40 g/L甲醛溶液中. 然后依次修块、脱水、浸蜡、包埋、切片等程序制备石蜡切片, 并行HE染色.
1.2.5 观察指标: 每日观察小鼠的进食、活动、毛发等一般情况, 每日称取小鼠体质量, 并收集小鼠粪便, 观察粪便性状及隐血情况, 进行小鼠疾病活动指数评分(disease active index, DAI)[6], 小鼠的DAI评分有体质量下降百分比、大便性状和粪便隐血情况三者的总和. 光学显微镜观察小鼠结肠组织HE染色切片, 并评估组织损伤指数(histological index, HI)[7]. 自-20℃冰箱中取出小鼠血清, 参照ELISA试剂盒说明书进行IL-10检测.
统计学处理 采用SPSS20.0统计软件, 数据以mean±SD表示, 组间对应指标差异性检验采用单因素方差分析, P<0.05为差异具有统计学意义.
空白对照组小鼠活动度正常, 毛发光泽, 体质量保持每日稳步增长, 大便呈颗粒状. 模型组小鼠在饮用DSS溶液后第3天, 逐渐出现懒动、食欲下降、毛发粗糙、体质量减轻、腹泻、肉眼血便等表现. 在分别给予不同治疗后, 模型对照组小鼠体质量进一步下降、懒动、腹泻、肉眼血便等, FMT组、5-ASA组、联合组的小鼠逐渐恢复活动, 体质量有不同程度的回升, 大便由稀便变为糊状便, 部分恢复为颗粒状, 肉眼血便消失等表现.
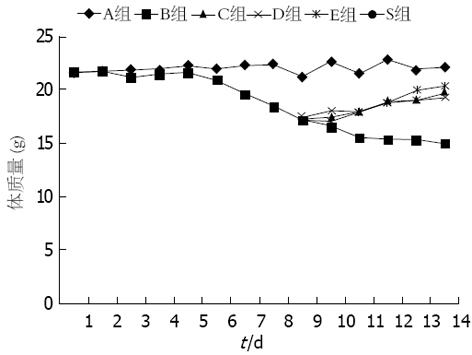
在造模前各组小鼠体质量差异无统计学意义(P>0.05), 在给予DSS诱导后, 模型组小鼠体质量较造模前明显下降, 差异有统计学意义(P<0.05, 图1). 模型对照组、FMT组、5-ASA组、联合组在治疗前各组小鼠体质量差异无统计学意义(P>0.05), 治疗完成后, 与空白对照组相比, 模型对照组体质量逐渐下降, 差异有统计学意义(P<0.05, 图1), FMT组、5-ASA组及联合组体质量较治疗前明显增加, 与空白对照组的差异无统计学意义(P>0.05, 图1, 表1); 与模型对照组相比, FMT组、5-ASA组及联合组体质量明显增加, 差异有统计学意义(P<0.05); 3组治疗组之间体质量差异并不显著(P>0.05).
| 分组 | 终体质量 (kg) | 结肠长度 (cm) | HI评分 (分) | DAI评分 (分) |
| 对照组 | 22.21 ± 2.16 | 7.93 ± 0.66 | 2.25 ± 1.58 | 0.37 ± 0.52 |
| 模型组 | 14.99 ± 2.32 | 5.39 ± 0.72 | 16.63 ± 4.60 | 7.00 ± 1.51 |
| 5-ASA组 | 19.77 ± 2.11 | 6.66 ± 0.98 | 8.87 ± 2.69 | 5.00 ± 2.20 |
| FMT组 | 19.32 ± 2.47 | 5.86 ± 0.65 | 11.50 ± 5.93 | 5.87 ± 2.75 |
| 联合组 | 20.37 ± 0.83 | 6.33 ± 0.82 | 10.00 ± 4.34 | 4.37 ± 1.59 |
各组小鼠治疗前DAI评分差异无统计学意义(P>0.05), 经过治疗后, 与正常对照组相比, 其余四组DAI评分均较高, 差异有统计学意义(P<0.05); 与模型对照组比较, FMT组、5-ASA组及联合组的小鼠减轻程度、大便性状及隐血恢复情况较治疗前明显好转, 其中联合组DAI评分最低, 与模型对照组差异有统计学意义(P<0.05), 其余两组虽然DAI评分有所下降, 但与模型对照组差异无统计学意义(P>0.05).
处死后, 与空白对照组相比, 其余四组的结肠长度明显短于空白对照组(P<0.05, 表1); 与模型对照组相比, 联合组与5-ASA组结肠长度长于模型对照组(P<0.05), FMT组与模型对照组长度差异不大(P>0.05).
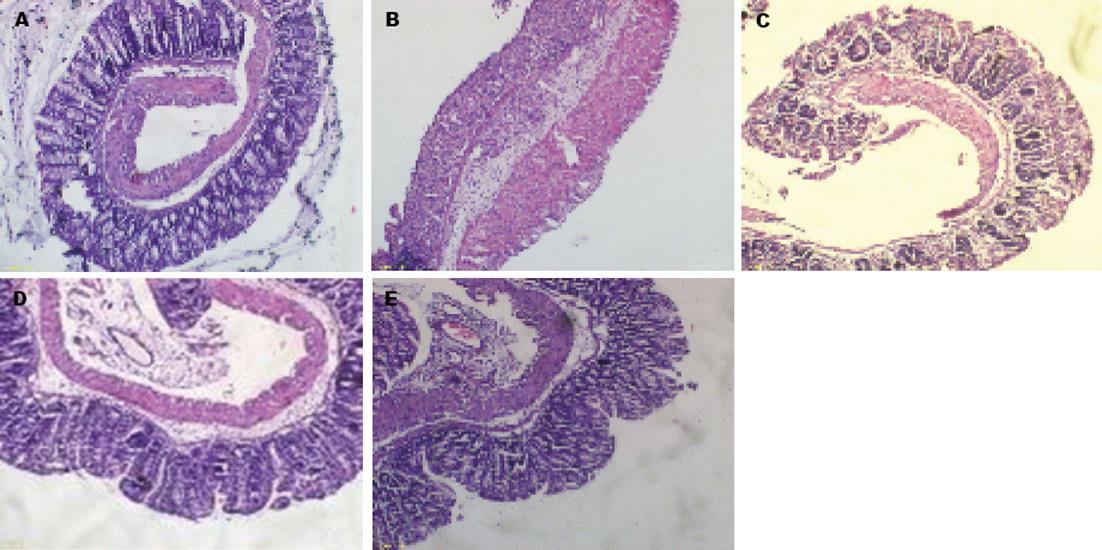
通过给予不同治疗方案, 空白对照组小鼠结肠上皮完整, 隐窝结构规则, 可见少量炎症细胞浸润. 模型对照组小鼠黏膜上皮可见明显的溃疡形成, 黏膜上皮隐窝数量及结构改变, 排列紊乱, ±状细胞明显减少, 固有层可见大量炎症细胞浸润, 黏膜下层可见大量炎症细胞浸润及水肿, 各治疗组HI评分明显高于空白对照组(P<0.05, 图2), 5-ASA组及联合治疗组结肠组织损伤程度较模型对照组明显缓解(P<0.05), FMT组较模型对照组有所缓解, 但差异无统计学意义(P>0.05).
与空白对照组相比, 模型对照组IL-10明显下降, 差异有统计学意义(P<0.05), 5-ASA组、FMT组、联合组的IL-10与空白对照组差异不显著(P>0.05); 与模型对照组相比, 5-ASA组与联合治疗组IL-10水平较模型对照组明显增加, 差异有统计学意义(P<0.05), FMT组较模型对照增加, 但差异无统计学意义(P = 0.54); 3组治疗之间差异并不显著(P>0.05).
UC的病因目前仍不明确, 目前认为与遗传易感性、免疫因素、环境因素及肠道菌群紊乱等相关, 其中肠道菌群失调是近几年研究热点. 大量研究显示[8,9], UC患者肠道菌群多样性减低, 优势菌数量减少, 而致病菌数量增加. FMT正是通过重塑肠道菌群, 可能还参与宿主肠道黏膜免疫反应等途径达到治疗效果. 已有人通过建立抗生素引起的小鼠肠道菌群紊乱以及黏膜受损的模型, 证实FMT能重塑肠道菌群和修复黏膜屏障功能[10]. 在小鼠实验性结肠炎的模型中, 也有大量研究证实[11,12], FMT可以抑制促炎因子, 重调淋巴细胞比例, 进而恢复小鼠紊乱的免疫系统. FMT在UC患者中的疗效也褒贬不一, 有报道[4]其缓解率为0%-63%. 有部分研究[13-15]证实, FMT可以使患者达到内镜和组织学缓解, 但是也有部分患者治疗后无明显改善. 在本研究中, FMT在小鼠实验性结肠炎中疗效欠佳, 并没有如预期中效果明显, 但由于实验周期较短, 也无法估计后期小鼠的疗效.
细胞因子在UC发病中占据重要角色, 他分为促炎因子和抗炎因子. 常见的促炎因子有IL-1、IL-6、IL-8、TNF-α, 抗炎因子有IL-4、IL-10. 其中IL-10主要由调节性T细胞(regulatory cell, Treg)分泌, 研究发现[16], UC患者肠道黏膜IL-10明显增加, 提示肠道黏膜炎症时, Treg细胞趋化至肠黏膜局部, 通过分泌IL-10发挥抑炎作用. 而在小鼠UC模型中也显示[17], Treg细胞可能是通过促进IL-10等抗炎因子的分泌来抑制肠道炎症反应, 从而使小鼠腹泻症状改善. 已有相关研究显示[18,19], UC患者Treg细胞明显低于健康成人, 在动物实验中也证实这一点, 这进一步加重UC患者的肠道炎症. 在一项动物实验中也证实IL-10与小鼠结肠炎的发生有着密切关联[20]. 已有数据显示[16], IL-10水平随着疾病活动度加重而减少. 综上所述, 可得出IL-10在小鼠UC的发生和发展中均起到重要作用. 本研究也证实这一点, 在模型组小鼠血清中, IL-10较正常对照组水平明显降低, 而通过不同治疗后均有所升高.
本研究通过3%DSS诱导小鼠急性UC模型, 造模成功后随机分组, 观察不同治疗措施所取得效果. 研究发现在给予不同治疗下, FMT组、5-ASA组及联合治疗组小鼠体质量逐渐上升, 大便性状及潜血情况逐渐好转, 结肠黏膜损伤程度较模型对照组明显好转, 其中联合治疗组与5-ASA组对于缓解症状及结肠黏膜损伤恢复的效果均优于FMT组. 提示三种治疗方案均有一定效果, 但相对其他两种方案, FMT组疗效略差, 这可能与治疗周期、给药方式、给药频率等各方面因素有关, 仍需进一步研究.
总之, FMT对于小鼠实验性结肠炎确实有一定的治疗作用, 其与5-ASA联合治疗也并未取得更好的疗效, 对于FMT在UC患者中的应用仍需进一步研究证实其疗效.
溃疡性结肠炎(ulcerative colitis, UC)是一种病因不明确的慢性非特异性炎症性肠病, 其具体发病机制仍不 明确. 目前治疗UC的传统三大类药物有氨基水杨酸制剂、糖皮质激素、免疫抑制剂, 近年来随着UC发病机制研究, 益生菌、生物制剂等药物也用于UC的治疗, 但目前现有药物治疗效果有限, 仍有部分患者不能达到缓解, 并且上述药物有效的患者, 在高昂的药费和病情反复折磨下, 给他们带来了极大的身心痛苦. 粪菌移植(fecal microbiota transplantation, FMT)在近几年来比较热门, 有大量研究证实其在UC患者中取得较好的疗效, 但其机制目前仍不清楚, 本研究则是进一步观察其在小鼠实验性结肠炎中的疗效以及其机制.
本研究是观察FMT在小鼠实验性结肠炎中的疗效以及其可能的机制, 还观察FMT是否可以作为一种辅助治疗措施应用于结肠炎的治疗.
本研究旨在观察FMT的效果, 并期望与传统药物的联合使用能取得更好的效果, 为临床上UC病人的治疗提供一个新思路.
本研究选用C57/BL6小鼠为研究对象, 使用葡聚糖硫酸钠建立小鼠实验性结肠炎模型后, 随机分为空白对照组、模型对照组、5-ASA组、FMT组、联合(5-ASA+FMT)组, 粪便采用对应的灌肠液进行灌肠, 灌肠结束后处死, 通过观察小鼠每日的大便性质及隐血情况、体质量和检测小鼠结肠长度、病变处的组织HE染色观察、血清IL-10检测, 分析各组小鼠采取不同治疗措施的疗效观察.
本研究证实FMT在小鼠实验性结肠炎模型中有一定疗效, 但其效果仍不如5-ASA, 并且其与5-ASA联合治疗也没有取得更好的效果, 一方面可能由于样本量过少, 另一方面可能受灌肠剂的制备、治疗周期等因素影响.
本研究中发现FMT并不如预期取得更好的效果, 不过影响其治疗的因素较多, 比如治疗周期、供体来源、粪菌滤液的配制、治疗方式等等.
本研究的样本量过少, 不能完全反映各小组的实际疗效, 并且未对小鼠灌肠前后肠道菌群进行分析, 不能观察灌肠后是否有肠道菌群的组成改变, 在未来的研究中, FMT与5-ASA制剂的联合可进一步调整, 并进一步分析肠道菌群变化及病变部位肠道黏膜炎症因子改变, 并可额外设立一组小鼠作为供体小鼠.
学科分类: 胃肠病学和肝病学
手稿来源地: 山东省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): C, C
D级 (一般): 0
E级 (差): 0
编辑: 闫晋利 电编:闫晋利
| 2. | Brandt LJ, Aroniadis OC. An overview of fecal microbiota transplantation: techniques, indications, and outcomes. Gastrointest Endosc. 2013;78:240-249. [PubMed] [DOI] |
| 3. | Scaldaferri F, Pecere S, Petito V, Zambrano D, Fiore L, Lopetuso LR, Schiavoni E, Bruno G, Gerardi V, Laterza L. Efficacy and Mechanisms of Action of Fecal Microbiota Transplantation in Ulcerative Colitis: Pitfalls and Promises From a First Meta-Analysis. Transplant Proc. 2016;48:402-407. [PubMed] [DOI] |
| 4. | Anderson JL, Edney RJ, Whelan K. Systematic review: faecal microbiota transplantation in the management of inflammatory bowel disease. Aliment Pharmacol Ther. 2012;36:503-516. [PubMed] [DOI] |
| 5. | Kunde S, Pham A, Bonczyk S, Crumb T, Duba M, Conrad H Jr, Cloney D, Kugathasan S. Safety, tolerability, and clinical response after fecal transplantation in children and young adults with ulcerative colitis. J Pediatr Gastroenterol Nutr. 2013;56:597-601. [PubMed] [DOI] |
| 6. | Sha S, Liang J, Chen M, Xu B, Liang C, Wei N, Wu K. Systematic review: faecal microbiota transplantation therapy for digestive and nondigestive disorders in adults and children. Aliment Pharmacol Ther. 2014;39:1003-1032. [PubMed] [DOI] |
| 7. | 申 凤鸽. 食醋对小鼠溃疡性结肠炎的预防作用及机制研究. 长春: 吉林大学 2016; . |
| 8. | Nishikawa J, Kudo T, Sakata S, Benno Y, Sugiyama T. Diversity of mucosa-associated microbiota in active and inactive ulcerative colitis. Scand J Gastroenterol. 2009;44:180-186. [PubMed] [DOI] |
| 9. | Nemoto H, Kataoka K, Ishikawa H, Ikata K, Arimochi H, Iwasaki T, Ohnishi Y, Kuwahara T, Yasutomo K. Reduced diversity and imbalance of fecal microbiota in patients with ulcerative colitis. Dig Dis Sci. 2012;57:2955-2964. [PubMed] [DOI] |
| 10. | Li M, Liang P, Li Z, Wang Y, Zhang G, Gao H, Wen S, Tang L. Fecal microbiota transplantation and bacterial consortium transplantation have comparable effects on the re-establishment of mucosal barrier function in mice with intestinal dysbiosis. Front Microbiol. 2015;6:692. [PubMed] |
| 11. | Tian Z, Liu J, Liao M, Li W, Zou J, Han X, Kuang M, Shen W, Li H. Beneficial Effects of Fecal Microbiota Transplantation on Ulcerative Colitis in Mice. Dig Dis Sci. 2016;61:2262-2271. [PubMed] [DOI] |
| 12. | Dalmasso G, Cottrez F, Imbert V, Lagadec P, Peyron JF, Rampal P, Czerucka D, Groux H, Foussat A, Brun V. Saccharomyces boulardii inhibits inflammatory bowel disease by trapping T cells in mesenteric lymph nodes. Gastroenterology. 2006;131:1812-1825. [PubMed] [DOI] |
| 13. | Borody TJ, Warren EF, Leis S, Surace R, Ashman O. Treatment of ulcerative colitis using fecal bacteriotherapy. J Clin Gastroenterol. 2003;37:42-47. [PubMed] |
| 14. | Rossen NG, Fuentes S, van der Spek MJ, Tijssen JG, Hartman JH, Duflou A, Löwenberg M, van den Brink GR, Mathus-Vliegen EM, de Vos WM. Findings From a Randomized Controlled Trial of Fecal Transplantation for Patients With Ulcerative Colitis. Gastroenterology. 2015;149:110-118. e4. [PubMed] [DOI] |
| 15. | Suskind DL, Singh N, Nielson H, Wahbeh G. Fecal microbial transplant via nasogastric tube for active pediatric ulcerative colitis. J Pediatr Gastroenterol Nutr. 2015;60:27-29. [PubMed] [DOI] |
| 16. | 岳 文杰, 刘 懿, 徐 薇, 董 乐, 罗 晓婷, 蒋 蔚茹, 孙 旭, 钟 良, 刘 杰. 溃疡性结肠炎(UC)肠黏膜中IL-2、IL-4、IL-17和IL-10的表达特点及其与疾病活动度的关系. 复旦学报(医学版). 2012;39:454-459, 488. |
| 17. | Xu Z, Wei C, Zhang RU, Yao J, Zhang D, Wang L. Epigallocatechin-3-gallate-induced inhibition of interleukin-6 release and adjustment of the regulatory T/T helper 17 cell balance in the treatment of colitis in mice. Exp Ther Med. 2015;10:2231-2238. [PubMed] [DOI] |
| 19. | Chao K, Zhong BH, Zhang SH, Gong XR, Yao JY, Chen MH. Imbalance of CD4(+) T cell subgroups in ulcerative colitis. Zhonghua Yixue Zazhi. 2011;91:1605-1608. [PubMed] |
| 20. | Zhang D, Wei C, Yao J, Cai X, Wang L. Interleukin-10 gene-carrying bifidobacteria ameliorate murine ulcerative colitis by regulating regulatory T cell/T helper 17 cell pathway. Exp Biol Med (Maywood). 2015;240:1622-1629. [PubMed] [DOI] |