修回日期: 2018-10-05
接受日期: 2018-10-19
在线出版日期: 2018-11-18
探讨腹腔热灌注化疗对胃癌(gastric cancer, GC)腹膜转移患者的临床疗效及免疫功能和预后的影响.
回顾性分析2010-06/2013-03期间郑州大学第一附属医院收治的113例GC腹膜转移患者, 按治疗方法不同分为观察组和对照组, 观察组54例, 对照组59例. 对照组患者采用常规静脉化疗进行治疗, 观察组患者采用腹腔热灌注化疗进行治疗. 比较治疗6 mo后两组患者的临床疗效、复发转移相关指标、肿瘤标志物、T淋巴细胞亚群、生存质量及化疗后不良反应发生的情况.
观察组总有效率和疾病控制率均显著高于对照组, 差异有统计学意义(P<0.05). 血清糖链抗原199(carbohydrate antigen 199, CA199)、CA724和癌胚抗原(carcino embryonic antigen, CEA)的水平均明显低于对照组患者, 差异具有统计学意义(P<0.05). 治疗后观察组患者血清血管内皮生长因子(vascular endothelial growth factor, VEGF)、骨桥蛋白(osteopontin, OPN)、可溶性凋亡因子(soluble apoptotic factor, sFas)和基质金属蛋白酶-9(matrix metalloproteinase-9, MMP-9)水平均显著低于对照组, 差异有统计学意义(P<0.05). 治疗后观察组外周血CD3+、CD4+、CD4+/CD8+、B细胞均显著高于对照组, 而CD8+和NK细胞显著低于对照组, 差异均有统计学意义(P<0.05). 观察组患者治疗后的KPS评分改善情况、2年复发率、3年生存率和5年生存率均显著优于对照组患者, 差异均有统计学意义(P<0.05). 两组患者化疗后的不良反应发生率无统计学差异(P>0.05).
腹腔热灌注化疗能提高GC患者化疗的临床疗效, 更好地控制肿瘤标志物和复发转移相关指标, 改善患者的免疫功能和患者生存质量, 而不增加不良反应的发生, 值得在临床上进一步推广应用.
核心提要: 腹腔热灌注化疗能提高胃癌患者化疗的临床疗效, 更好地控制肿瘤标志物和复发转移相关指标, 改善患者的免疫功能和患者生存质量, 而不增加不良反应的发生, 值得在临床上进一步推广应用.
引文著录: 张永玺, 马望, 吴志宏. 腹腔热灌注化疗对胃癌腹膜转移患者的临床疗效及免疫功能和预后的影响. 世界华人消化杂志 2018; 26(32): 1893-1900
Revised: October 5, 2018
Accepted: October 19, 2018
Published online: November 18, 2018
To evaluate the clinical efficacy of intraperitoneal hyperthermic perfusion chemotherapy for patients with gastric cancer (GC) peritoneal metastasis and its impact on immune function and prognosis.
A retrospective analysis was performed of 113 patients with GC treated at the First Affiliated Hospital of Zhengzhou University between June 2010 and March 2013. The patients were randomly divided into an observation group (54 cases) and a control group (59 cases). Patients in the control group were treated with conventional intravenous chemotherapy, and patients in the observation group were treated with intraperitoneal hyperthermic perfusion chemotherapy. The clinical efficacy, related indicators of recurrence and metastasis, tumor markers, T-lymphocyte subsets, quality of life, and occurrence of adverse reactions after chemotherapy was compared between the two groups of patients.
The total effective rate and disease control rate in the observation group were significantly higher than those in the control group (P < 0.05). The levels of serum carbohydrate antigen 199 (CA199), CA724, and carcinoembryonic antigen (CEA) were significantly lower in the observation group than in the control group (P < 0.05). After treatment, serum vascular endothelial growth factor (VEGF), osteopontin (OPN), soluble apoptotic factor (sFas), and matrix metalloproteinase-9 (MMP-9) levels were significantly lower in the observation group than in the control group (P < 0.05). CD3+ T cells, CD4+ T cells, CD4+/CD8+ ratio, and B cells in the peripheral blood were significantly higher in the observation group than in the control group, while CD8+ T cells and NK cells were significantly lower than those of the control group (P < 0.05). The improvement of KPS score after treatment, the recurrence rate at 2 years, the 3-year survival rate, and the 5-year survival rate were significantly better in the observation group than in the control group (P < 0.05). The incidence of adverse reactions after chemotherapy was not statistically different between the two groups (P > 0.05).
Peritoneal hyperthermic perfusion chemotherapy can improve clinical efficacy, tumor markers and related indicators of recurrence and metastasis, as well as the patient's immune function and quality of life of patients with GC peritoneal metastasis, without increasing the incidence of adverse reactions.
- Citation: Zhang YX, Ma W, Wu ZH. Clinical efficacy of intraperitoneal hyperthermic perfusion chemotherapy for patients with gastric cancer peritoneal metastasis: Impact on immune function and prognosis. Shijie Huaren Xiaohua Zazhi 2018; 26(32): 1893-1900
- URL: https://www.wjgnet.com/1009-3079/full/v26/i32/1893.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v26.i32.1893
胃癌(gastric cancer, GC)是最常见的消化道肿瘤之一, 其死亡率位于全球癌症死亡率的第三位[1]. 我国也是GC高发的国家, 但我国早期GC的检出率低于10%, 大部分患者确诊时肿瘤细胞浸润至黏膜下层[2]. GC细胞种植转移至腹膜会导致患者形成恶性腹水, 严重影响患者的生活质量和预后[3]. 腹腔热灌注化疗是一种结合了热疗、腹腔灌洗和化疗的新技术, 经过实践和研究已经证实腹腔热灌注化疗针对腹腔恶性肿瘤和恶性腹水的治疗方面具有其独特的优势[4]. 本研究通过对113例GC患者进行回顾性研究, 探讨腹腔热灌注化疗对GC腹膜转移的临床疗效及免疫功能和预后的影响, 现报道如下.
选择2010-06/2013-03期间郑州大学第一附属医院收治的113例GC腹膜转移患者进行回顾性分析. 纳入标准: (1)患者经病理学确诊为GC, 且腹腔有大量积液; (2)腹水检测癌细胞为阳性; (3)患者入院时的KPS(Karnofsky)评分在40-70分之间. 排除标准: (1)有严重的心肝肾相关疾病; (2)有化疗禁忌症无法进行化疗的患者; (3)预计生存期小于3 mo的患者. 纳入本研究的患者按治疗方法不同分为观察组和对照组, 观察组54例, 对照组59例. 观察组和对照组患者的一般资料无统计学差异(P>0.05), 有可比性(表1).
| 指标 | 对照组(n = 59) | 观察组(n = 54) | t/χ2 | P |
| 年龄(岁) | 53.39 ± 9.13 | 53.98 ± 9.56 | 0.335 | 0.738 |
| 性别(例) | 0.884 | 0.347 | ||
| 男 | 32 | 34 | ||
| 女 | 27 | 20 | ||
| 体重(kg) | 55.75 ± 11.67 | 56.12 ± 11.23 | 0.172 | 0.864 |
| KPS评分 | 60.87 ± 10.02 | 59.94 ± 9.45 | 0.508 | 0.613 |
| 病理类型(例) | 0.072 | 0.965 | ||
| 腺癌 | 46 | 42 | ||
| 黏液性腺癌 | 8 | 8 | ||
| 印戒细胞癌 | 5 | 4 | ||
| 病变部位(例) | 0.937 | 0.626 | ||
| 胃体 | 9 | 5 | ||
| 胃底 | 13 | 13 | ||
| 胃窦 | 37 | 36 | ||
| T分期 | 0.292 | 0.589 | ||
| T1+T2 | 19 | 20 | ||
| T3+T4 | 40 | 34 | ||
| N分期 | 0.234 | 0.629 | ||
| N2 | 30 | 25 | ||
| N3 | 29 | 29 | ||
| 病理分级(例) | 0.425 | 0.808 | ||
| 高分化 | 9 | 6 | ||
| 中分化 | 17 | 16 | ||
| 低分化 | 33 | 32 |
所有患者均由相同手术团队进行标准的GCD2根治术. 对照组患者术后采用FOLFOX4方案进行常规静脉化疗: 第1天静脉滴注奥沙利铂200 mg(赛诺菲制药有限公司, 50 mg/瓶, 国药准字J20150117), 第1-5天均静脉滴注5-氟尿嘧啶(南通精华制药股份有限公司, 250 mg/支, 国药准字H32022246)500 mg/d及亚叶酸钙(哈尔滨三联药业股份有限公司, 100 mg/支, 国药准字H20034073)300 mg/d, 每个疗程间隔4 wk, 治疗共持续6个疗程. 观察组患者手术关闭腹腔前在腹腔左右两侧留置灌注管, 于术后1-2 d进行腹腔热灌注化疗. 热灌注化疗开始前清理灌注管内残留的组织和凝血块, 连接热灌注化疗仪, 将含有50 mg顺铂(江苏豪森药业股份有限公司, 6 mL:20 mg, 国药准字H20040813)的生理盐水3 L加热至38 ℃, 并以100 mL/min的速度进行灌注治疗, 监测患者的各项生命指标, 继续加热药液至43 ℃, 逐渐提高灌注速度至300 mL/min, 维持灌注1-1.5 h, 治疗过程中使患者腹腔内化疗液维持在2 L以上, 并根据患者情况给予镇痛和解痉治疗. 灌注结束后, 保留1 L左右的化疗液在患者腹腔内, 使化疗液从连接于灌注管上的引流袋缓慢流出, 7 d后除去灌注管. 根据患者情况, 在术后2-3 wk采用FOLFOX4方案化疗, 每个疗程间隔4 wk, 治疗共持续6个疗程.
观察指标: (1)治疗6个周期后, 比较两组患者的临床疗效: 根据WHO实体瘤疗效评价标准进行疗效评价: 完全缓解(complete response, CR): 肿瘤灶完全消失, 肿瘤标志物水平在正常范围内, 并维持4 wk以上; 部分缓解(partial response, PR): 肿瘤灶直径降低大于30%, 且维持4 wk以上; 疾病稳定(stable disease, SD): 肿瘤灶直径降低小于30%或增加小于20%; 疾病进展(progressive disease, PD): 肿瘤灶直径增加超过20%或大于5 cm或出现新的肿瘤灶, 总有效率 = (CR例数+PR例数)/总例数×100%, 疾病控制率 = (CR例数+PR例数+SD例数)/总例数×100%. (2)比较两组患者治疗前和治疗后3 mo血清糖链抗原(cancer antigen, CA)199、CA125、CA724和癌胚抗原(carcino embryonic antigen, CEA)水平的变化: 收集患者的空腹静脉血, 分离血清, 全自动免疫发光仪检测CA199、CA125、CA724水平, 酶联免疫吸附试验(enzyme linked immunosorbent assay, ELISA)检测CEA水平. (3)比较两组患者治疗前和治疗后3 mo复发转移相关指标的变化: 收集患者的空腹静脉血, 分离血清, ELISA检测血管内皮生长因子(vascular endothelial growth factor, VEGF)、骨桥蛋白(osteopontin, OPN)、可溶性凋亡因子(soluble factor-related apoptosis, sFas)和基质金属蛋白酶-9(matrix metalloprotein 9, MMP-9)水平. (4)比较两组患者外周血T淋巴亚群: 抽取治疗前后患者的空腹静脉血, 抗凝后采用流式细胞术外周血中T淋巴细胞亚群(CD3+、CD4+和CD8+)、B细胞和自然杀伤(natural killer, NK)细胞的水平. (5)比较两组患者治疗后的生存质量: 采用KPS评分对患者的生存质量进行评估, KPS评分增加10分以上为提高, KPS评分变化小于10分为稳定, KPS评分降低10分为降低; 同时对患者进行定期随访, 记录患者复发和存活的情况, 随访时间为5年. (6)比较两组患者治疗后化疗引起的恶心呕吐、骨髓抑制、肝肾功能损害等不良反应发生情况.
统计学方法 采用SPSS 20.0软件进行数据分析, 计数资料采用频数和百分率(%)表示, 组间采用χ2检验比较差异; 计量数据采用mean±SD表示, 组间采用t检验比较差异, 应用Kaplan-Meier法绘制总体生存曲线, 并采用Log-rank检验计算风险比(hazard ratio, HR)及其95%置信区间和P值, 以P<0.05为差异有统计学意义.
观察组的总有效率和疾病控制率均显著高于对照组, 差异具有统计学意义(P<0.05)(表2).
| 分组 | CR | PR | SD | PD | 总有效率 | 疾病控制率 |
| 观察组 | 15 (27.78) | 21 (38.89) | 10 (18.52) | 8 (14.81) | 36 (66.67) | 46 (85.19) |
| 对照组 | 9 (15.25) | 18 (30.51) | 13 (22.03) | 19 (32.20) | 27 (45.76) | 40 (67.80) |
| χ2 | 4.994 | 4.688 | ||||
| P | 0.025 | 0.030 |
治疗前两组患者血清CA199、CA724、CA125和CEA水平无显著性差异(P>0.05). 观察组患者血清CA199、CA724和CEA的水平均明显低于对照组患者, 差异具有统计学意义(P<0.05)(表3).
| 分组 | CA199 (U/mL) | CEA (mg/mL) | CA125 (U/mL) | CA724 (KU/L) | ||||
| 治疗前 | 治疗后 | 治疗前 | 治疗后 | 治疗前 | 治疗后 | 治疗前 | 治疗后 | |
| 观察组 | 56.41 ± 5.87 | 22.28 ± 3.53 | 27.15 ± 7.26 | 11.26 ± 3.02 | 71.89 ± 15.37 | 32.56 ± 7.56 | 49.35 ± 4.81 | 12.36 ± 2.87 |
| 对照组 | 56.89 ± 13.35 | 29.53 ± 8.65 | 27.36 ± 7.09 | 13.11 ± 4.33 | 72.13 ± 16.23 | 34.79 ± 7.96 | 49.03 ± 4.52 | 16.45 ± 4.26 |
| t | 0.244 | 5.737 | 0.155 | 2.612 | 0.081 | 1.524 | 0.365 | 5.930 |
| P | 0.808 | <0.001 | 0.877 | 0.011 | 0.936 | 0.131 | 0.716 | <0.001 |
治疗前两组患者血清VEGF、OPN、sFas和MMP-9水平无显著性差异(P>0.05). 观察组患者血清VEGF、OPN、sFas和MMP-9水平均显著低于对照组, 差异有统计学意义(P<0.05)(表4).
| 分组 | VEGF (pg/mL) | OPN (pg/mL) | sFas (pg/mL) | MMP-9 (ng/mL) | ||||
| 治疗前 | 治疗后 | 治疗前 | 治疗后 | 治疗前 | 治疗后 | 治疗前 | 治疗后 | |
| 观察组 | 135.57 ± 13.29 | 94.56 ± 12.39 | 81.03 ± 8.26 | 41.26 ± 4.89 | 145.89 ± 16.88 | 72.56 ± 8.95 | 411.35 ± 58.81 | 140.14 ± 26.87 |
| 对照组 | 134.72 ± 14.35 | 103.25 ± 15.67 | 81.36 ± 8.74 | 52.06 ± 5.16 | 143.93 ± 17.23 | 82.79 ± 9.65 | 413.03 ± 62.13 | 150.77 ± 28.26 |
| t | 0.211 | 3.250 | 0.206 | 11.395 | 0.610 | 5.827 | 0.147 | 2.045 |
| P | 0.833 | 0.002 | 0.837 | <0.001 | 0.543 | <0.001 | 0.883 | 0.043 |
治疗前两组患者外周血T淋巴细胞群、B细胞和NK细胞的水平无显著性差异(P>0.05). 治疗后观察组外周血CD3+、CD4+、CD4+/CD8+、B细胞均显著高于对照组, 而CD8+和NK细胞显著低于对照组, 差异均有统计学意义(P<0.05)(表5).
| 分组 | CD3+ (%) | CD4+ (%) | CD8+ (%) | CD4+/CD8+ | B细胞 (%) | NK细胞 (%) | ||||||
| 治疗前 | 治疗后 | 治疗前 | 治疗后 | 治疗前 | 治疗后 | 治疗前 | 治疗后 | 治疗前 | 治疗后 | 治疗前 | 治疗后 | |
| 观察组 | 41.81 ± 3.87 | 56.48 ± 6.53 | 33.65 ± 3.56 | 46.96 ± 5.09 | 38.85 ± 2.14 | 28.72 ± 2.51 | 0.87 ± 0.19 | 0.90 ± 0.17 | 4.65 ± 0.56 | 5.96 ± 1.09 | 16.85 ± 4.14 | 15.96 ± 4.28 |
| 对照组 | 41.45 ± 3.69 | 42.17 ± 6.65 | 33.39 ± 3.67 | 31.81 ± 4.13 | 38.47 ± 2.06 | 37.36 ± 2.28 | 0.85 ± 0.20 | 1.54 ± 0.24 | 4.49 ± 0.47 | 3.81 ± 1.13 | 16.47 ± 4.06 | 25.72 ± 4.51 |
| t | 0.505 | 11.534 | 0.382 | 17.278 | 0.960 | 19.174 | 0.545 | 16.462 | 1.637 | 10.291 | 0.492 | 11.801 |
| P | 0.615 | <0.001 | 0.703 | <0.001 | 0.339 | <0.001 | 0.587 | <0.001 | 0.105 | <0.001 | 0.624 | <0.001 |
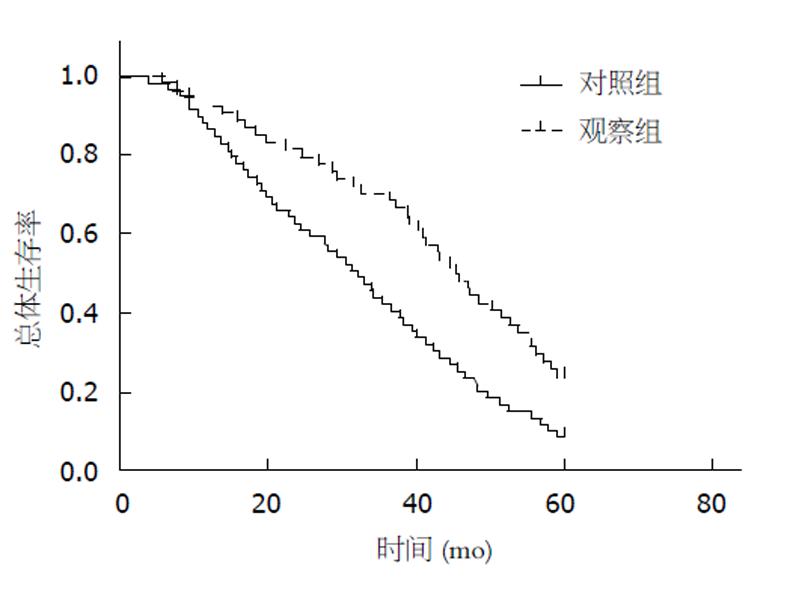
观察组患者治疗后的KPS评分改善情况、2年复发率、3年生存率和5年生存率均显著优于对照组患者, 差异均有统计学意义(P<0.05)(表6).
| 分组 | KPS评分 | 2年复发率 | 1年生存率 | 3年生存率 | 5年生存率 | ||
| 提高 | 稳定 | 降低 | |||||
| 观察组 | 34 (62.96) | 12 (22.22) | 8 (14.81) | 5 (9.26) | 50 (92.59) | 38 (64.41) | 13 (24.07) |
| 对照组 | 17 (28.81) | 30 (50.85) | 12 (20.34) | 15 (25.42) | 51 (86.44) | 25 (42.37) | 5 (8.47) |
| χ2 | 13.987 | 5.058 | 1.124 | 8.959 | 5.123 | ||
| P | <0.001 | 0.025 | 0.289 | 0.003 | 0.024 | ||
观察组治疗后白细胞减少、血小板减少、恶心呕吐等不良反应发生率与对照组相比无显著性差异(P>0.05)(表7).
| 分组 | 白细胞减少 | 血红蛋白减少 | 血小板减少 | 恶心呕吐 | 肾功能异常 | 肝功能异常 |
| 观察组 | 8 (14.81) | 12 (22.22) | 6 (11.11) | 15 (27.78) | 5 (9.26) | 5 (9.26) |
| 对照组 | 6 (10.17) | 10 (16.95) | 5 (8.47) | 21 (35.59) | 2 (3.39) | 4 (6.78) |
| χ2 | 0.561 | 0.500 | 0.223 | 0.793 | 1.672 | 0.237 |
| P | 0.454 | 0.479 | 0.637 | 0.373 | 0.196 | 0.627 |
腹腔种植转移是晚期GC主要的转移方式之一, 也是导致多数患者进行GC根治术治疗后仍预后不良的主要原因[5]. 由于传统的静脉化疗方式对腹膜转移患者的疗效不佳, 而单纯向腹腔内给予化疗药物也达不到满意的杀灭腹腔中游离癌细胞的效果[6]. 因此, 研究更理想的治疗GC腹膜转移的化疗方案已经成为肿瘤研究的热点.
越来越多的研究表明GC的腹膜转移需要多种方式的综合性治疗[7]. GC腹腔转移患者常规化疗仅有少部分化疗药物可以穿过血浆-腹膜屏障进入腹腔, 化疗药物在腹膜局部无法达到有效浓度, 故治疗效果欠佳[8]. 腹腔热灌注化疗作为一种新兴的辅助治疗手段, 已在多种恶性肿瘤腹膜转移的治疗中取得了良好的效果[9,10]. 本研究结果显示观察组的总有效率和疾病控制率均显著高于对照组, 表明腹腔热灌注化疗对GC腹膜转移的临床疗效优于常规静脉化疗. 腹腔热灌注化疗是将腹腔内的肿瘤组织和游离癌细胞与高浓度的化疗药物直接接触, 提高了化疗药物对肿瘤细胞的杀伤作用[11]. 而且腹腔热灌注化疗过程中的热效应也可以通过使癌细胞膜蛋白变性和破坏染色体等作用杀死癌细胞, 与化疗药物起到协同作用[12]. GC患者血清的肿瘤标志物CEA、CA125、CA199和CA724均是检测肿瘤进展和治疗效果的重要指标[13]. 本研究结果显示观察组患者血清CA199、CA724和CEA的水平均明显低于对照组患者, 表明腹腔热灌注化疗辅助治疗后对GC腹腔转移患者的肿瘤标志物控制效果优于常规静脉化疗. 腹腔热灌注化疗灌注过程中稀释了患者术后腹腔中残留的肿瘤细胞, 并通过机械性的冲刷作用将肿瘤细胞带离腹腔[14]. 而且腹腔热灌注化疗时化疗药物与热效应产生协同作用, 增加了化疗药物对肿瘤细胞的渗透性, 从而提高了化疗的敏感性[15]. 以上这些原因都可能使得腹腔热灌注化疗对GC细胞的杀伤作用增强, 更好的控制了肿瘤标志物水平. VEGF、OPN、sFas和MMP-9等细胞因子参与肿瘤的血管生成和侵袭转移等多个重要步骤, 与GC的复发转移密切相关[16]. 本研究结果显示观察组患者血清患者血清VEGF、OPN、sFas和MMP-9水平均显著低于对照组, 表明腹腔热灌注化疗可能通过降低GC患者VEGF、MMP-9等细胞因子的分泌, 减少GC的复发转移. 腹腔热灌注化疗不仅可以机械性清除腹腔内残留的游离肿瘤细胞, 而且使肿瘤细胞暴露在高浓度的化疗药物中, 提高了对肿瘤细胞的杀伤作用, 两者均能减少种植转移的几率. 另外, 在腹腔热灌注化疗过程中化疗药物还可经门静脉吸收, 杀灭入肝的肿瘤细胞或癌栓, 抑制肿瘤的转移扩散[17]. Liu等[18]研究表明腹腔热灌注化疗对GC并恶性腹水的患者临床疗程好, 能有效控制患者的肿瘤标志物水平. 与本研究的结果一致.
GC的发生发展及预后与患者的免疫功能状况密切相关[19]. 免疫细胞(包括T淋巴细胞、B细胞、NK细胞)是机体免疫系统的重要组成部分, 在机体抗肿瘤免疫中发挥关键的作用[20]. 本研究结果显示治疗后观察组外周血CD3+、CD4+、CD4+/CD8+、B细胞均显著高于对照组, 而CD8+和NK细胞显著低于对照组, 表明腹腔热灌注化疗可能通过影响T淋巴细胞、B细胞等免疫细胞的水平, 提高机体抗肿瘤免疫功能. 静脉化疗在降低肿瘤负荷和缓解肿瘤细胞诱导的细胞免疫抑制的同时, 对患者机体免疫系统也进行非选择性攻击, 抑制了患者的细胞免疫功能. 而腹腔热灌注化疗可明显减少化疗药物对骨髓的抑制作用. 研究表明, 腹腔热灌注化疗中肿瘤细胞被加热后, 能合成热休克蛋白刺激机体产生特异性免疫反应[21]. 而且腹腔热灌注化疗对腹腔肿瘤细胞的杀伤作用更强, 进一步减轻了患者的肿瘤负荷, 进而下调了促肿瘤的免疫细胞, 增强机体的免疫应答[22]. 而且机体存在的"腹膜-血浆屏障"限制了腹膜对大分子化疗药物的吸收, 使得腹腔内能维持较高的药物浓度, 而外周血内化疗药物的浓度则较低, 因而腹腔热灌注化疗对外周免疫细胞的影响较小. 但观察组采用腹腔热灌注化疗联合静脉化疗对患者进行治疗, 可能在某阶段会对NK细胞的数量有抑制作用, 但是否对NK细胞的活性产生不良影响从而加重免疫抑制仍需进一步研究.
GC腹膜转移患者的预后较差, 临床上通常采用肿瘤细胞减灭术和化疗进行治疗. 但对GC腹膜转移患者进行手术时, 脱落的肿瘤细胞易种植于腹膜表面生长, 并迅速在腹腔内复发, 严重影响患者的后续治疗和预后[23]. KPS评分是评估肿瘤患者健康状况和能否耐受抗肿瘤治疗的重要标准. 本研究结果显示观察组患者治疗后的KPS评分改善情况、2年复发率、3年生存率和5年生存率均显著优于对照组患者, 表明腹腔热灌注化疗能改善GC腹膜转移患者的生存质量和预后. 临床前研究表明, 腹腔化疗能预防肿瘤转移动物模型的腹腔转移. 腹腔热灌注化疗具有化疗和热疗的协同作用, 增强了对腹腔肿瘤细胞的杀灭作用, 大大降低了游离肿瘤细胞在腹腔种植转移的可能性. 最近, 一项国外的多中心临床研究证实, 接受腹腔热灌注化疗辅助治疗的GC患者可以明显延长其生存期[24]. 为了明确腹腔热灌注化疗对患者的安全性, 本研究分析了GC腹膜转移患者治疗后不良反应的发生率. 本研究结果显示观察组治疗后白细胞减少、血小板减少、恶心呕吐等不良反应发生率与对照组相比无显著性差异, 表明腹腔热灌注化疗在增加对GC腹膜转移患者临床疗效的同时, 不增加不良反应的发生, 安全可靠. 张跃等研究表明腹腔热灌注化疗与常规静脉化疗相比, 对进展期GC患者的不良反应发生率无明显影响[25]. 与本文研究结果一致.
总之, 腹腔热灌注化疗能提高GC患者化疗的临床疗效, 更好地控制肿瘤标志物和复发转移相关指标, 改善患者的免疫功能和患者生存质量, 而不增加不良反应的发生, 值得在临床上进一步推广应用.
胃癌(gastric cancer, GC)是最常见的消化道肿瘤之一, GC细胞种植转移至腹膜形成恶性腹水, 严重影响患者的生活质量和预后. 腹腔热灌注化疗针对腹腔恶性肿瘤和恶性腹水的治疗方面具有独特的优势.
本文对113例GC患者进行回顾性研究, 观察腹腔热灌注化疗后患者的临床疗效、复发转移相关指标、肿瘤标志物、T淋巴细胞亚群、生存质量及化疗后不良反应发生的情况.
本文回顾性研究了113例GC患者, 探讨腹腔热灌注化疗对GC腹膜转移的临床疗效及免疫功能和预后的影响, 对指导其临床应用具有重要意义.
回顾性分析2010-06/2013-03期间郑州大学第一附属医院收治的113例GC腹膜转移患者, 观察患者腹腔热灌注化疗后的临床疗效, 血清血清糖链抗原199(carbohydrate antigen 199, CA199)、CA724和癌胚抗原(carcinoembryonic antigen, CEA)、血管内皮生长因子(vascular endothelial growth factor, VEGF)、骨桥蛋白(osteopontin, OPN)、可溶性凋亡因子(soluble apoptotic factor, sFas)和基质金属蛋白酶-9(matrix metalloproteinase-9, MMP-9)水平, T淋巴细胞亚群, 生存质量及化疗后不良反应发生的情况.
本研究结果表明观察组的临床疗效显著优于于对照组, 且下调血清肿瘤标志物CA199、CA724、CEA和复发转移相关指标VEGF、OPN、sFas和MMP-9水平, 改善患者的T淋巴细胞和B细胞抗肿瘤免疫功能和患者生存质量, 而不增加不良反应的发生.
腹腔热灌注化疗能提高GC患者化疗的临床疗效, 更好地控制肿瘤标志物和复发转移相关指标, 改善患者的免疫功能和患者生存质量, 而不增加不良反应的发生, 值得在临床上进一步推广应用.
本研究表明腹腔热灌注化疗能提高GC患者化疗的临床疗效, 改善患者的免疫功能和患者生存质量, 但本研究样本量少, 仍需临床长期大样本的研究进一步证实.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): C, C
D级 (一般): 0
E级 (差): 0
编辑: 崔丽君 电编:张砚梁
| 1. | Torre LA, Sauer AM, Chen MS Jr, Kagawa-Singer M, Jemal A, Siegel RL. Cancer statistics for Asian Americans, Native Hawaiians, and Pacific Islanders, 2016: Converging incidence in males and females. CA Cancer J Clin. 2016;66:182-202. [PubMed] [DOI] |
| 3. | Hato S, Iwasaki Y, Mizusawa J, Terashima M, Katai H, Yoshikawa T, Ito S, Kaji M, Fujita J, Hirao M. Effectiveness and limitations of staging laparoscopy for peritoneal metastases in advanced gastric cancer from the results of JCOG0501: A randomized trial of gastrectomy with or without neoadjuvant chemotherapy for type 4 or large type 3 gastric cancer. J Cli Oncol. 2017;35:9. [DOI] |
| 4. | Ji ZH, Peng KW, Yu Y, Li XB, Yonemura Y, Liu Y, Sugarbaker PH, Li Y. Current status and future prospects of clinical trials on CRS + HIPEC for gastric cancer peritoneal metastases. Int J Hyperthermia. 2017;33:562-570. [PubMed] [DOI] |
| 5. | Van Cutsem E, Sagaert X, Topal B, Haustermans K, Prenen H. Gastric cancer. Lancet. 2016;388:2654-2664. [PubMed] [DOI] |
| 6. | Ishigami H, Yamaguchi H, Yamashita H, Asakage M, Kitayama J. 662PGastrectomy after response to intraperitoneal and systemic chemotherapy for gastric cancer with peritoneal metastasis or positive peritoneal cytology. Ann Oncol. 2017;28. [DOI] |
| 7. | Yonemura Y, Canbay E, Li Y, Coccolini F, Glehen O, Sugarbaker PH, Morris D, Moran B, Gonzaletz-Moreno S, Deraco M. A comprehensive treatment for peritoneal metastases from gastric cancer with curative intent. Eur J Surg Oncol. 2016;42:1123-1131. [PubMed] [DOI] |
| 8. | Chia CS, You B, Decullier E, Vaudoyer D, Lorimier G, Abboud K, Bereder JM, Arvieux C, Boschetti G, Glehen O; BIG RENAPE Group. Patients with Peritoneal Carcinomatosis from Gastric Cancer Treated with Cytoreductive Surgery and Hyperthermic Intraperitoneal Chemotherapy: Is Cure a Possibility? Ann Surg Oncol. 2016;23:1971-1979. [PubMed] [DOI] |
| 9. | van der Kaaij RT, Braam HJ, Boot H, Los M, Cats A, Grootscholten C, Schellens JH, Aalbers AG, Huitema AD, Knibbe CA. Treatment of Peritoneal Dissemination in Stomach Cancer Patients With Cytoreductive Surgery and Hyperthermic Intraperitoneal Chemotherapy (HIPEC): Rationale and Design of the PERISCOPE Study. JMIR Res Protoc. 2017;6:e136. [PubMed] [DOI] |
| 10. | Frøysnes IS, Larsen SG, Spasojevic M, Dueland S, Flatmark K. Complete cytoreductive surgery and hyperthermic intraperitoneal chemotherapy for colorectal peritoneal metastasis in Norway: Prognostic factors and oncologic outcome in a national patient cohort. J Surg Oncol. 2016;114:222-227. [PubMed] [DOI] |
| 11. | Murata S, Yamamoto H, Naitoh H, Yamaguchi T, Kaida S, Shimizu T, Shiomi H, Naka S, Tani T, Tani M. Feasibility and safety of hyperthermic intraperitoneal chemotherapy using 5-fluorouracil combined with cisplatin and mitomycin C in patients undergoing gastrectomy for advanced gastric cancer. J Surg Oncol. 2017;116:1159-1165. [PubMed] [DOI] |
| 12. | Ellison LM, Man Y, Stojadinovic A, Xin H, Avital I. Cytoreductive surgery and hyperthermic intraperitoneal chemotherapy in treatment of gastric cancer with peritoneal carcinomatosis. Chin J Cancer Res. 2017;29:86-92. [PubMed] [DOI] |
| 13. | Hoskovec D, Varga J, Dytrych P, Konecna E, Matek J. Peritoneal lavage examination as a prognostic tool in cases of gastric cancer. Arch Med Sci. 2017;13:612-616. [PubMed] [DOI] |
| 14. | Murata S, Yamamoto H, Shimizu T, Naitoh H, Yamaguchi T, Kaida S, Takebayashi K, Miyake T, Tani T, Tani M. 5-fluorouracil combined with cisplatin and mitomycin C as an optimized regimen for hyperthermic intraperitoneal chemotherapy in gastric cancer. J Surg Oncol. 2018;117:671-677. [PubMed] [DOI] |
| 15. | Wu HT, Peng KW, Ji ZH, Sun JH, Zhang Q, Yang XJ, Huang CQ, Li Y. Cytoreductive surgery plus hyperthermic intraperitoneal chemotherapy with lobaplatin and docetaxel to treat synchronous peritoneal carcinomatosis from gastric cancer: Results from a Chinese center. Eur J Surg Oncol. 2016;42:1024-1034. [PubMed] [DOI] |
| 16. | 王 宗樾, 张 宛越, 葛 万灵, 刘 传亮, 张 天鹏, 刘 明见, 孟 凡杰. 腹腔热灌注化疗对胃癌手术患者复发转移相关指标及肿瘤标志物的影响. 海南医学院学报. 2016;22:3053-3055. [DOI] |
| 17. | Goéré D, Passot G, Gelli M, Levine EA, Bartlett DL, Sugarbaker PH, Glehen O. Complete cytoreductive surgery plus HIPEC for peritoneal metastases from unusual cancer sites of origin: results from a worldwide analysis issue of the Peritoneal Surface Oncology Group International (PSOGI). Int J Hyperthermia. 2017;33:520-527. [PubMed] [DOI] |
| 18. | Liu X, Qiu H, Liu J, Chen S, Xu D, Li W, Zhan Y, Li Y, Chen Y, Zhou Z. Combined preoperative concentrations of CEA, CA 19-9, and 72-4 for predicting outcomes in patients with gastric cancer after curative resection. Oncotarget. 2016;7:35446-35453. [PubMed] [DOI] |
| 19. | Yamaguchi T, Fushida S, Yamamoto Y, Tsukada T, Kinoshita J, Oyama K, Miyashita T, Tajima H, Ninomiya I, Munesue S. Tumor-associated macrophages of the M2 phenotype contribute to progression in gastric cancer with peritoneal dissemination. Gastric Cancer. 2016;19:1052-1065. [PubMed] [DOI] |
| 20. | Tsai HF, Hsu PN. Cancer immunotherapy by targeting immune checkpoints: mechanism of T cell dysfunction in cancer immunity and new therapeutic targets. J Biomed Sci. 2017;24:35. [PubMed] [DOI] |
| 21. | Seshadri RA, Glehen O. The Role of Hyperthermic Intraperitoneal Chemotherapy in Gastric Cancer. Indian J Surg Oncol. 2016;7:198-207. [PubMed] [DOI] |
| 22. | Ni X, Wu P, Wu J, Ji M, Tian B, Jiang Z, Sun Y, Xing X, Jiang J, Wu C. Hyperthermic intraperitoneal perfusion chemotherapy and response evaluation in patients with gastric cancer and malignant ascites. Oncol Lett. 2017;14:1691-1696. [PubMed] [DOI] |
| 23. | Nie RC, Chen S, Yuan SQ, Chen XJ, Chen YM, Zhu BY, Qiu HB, Peng JS, Chen YB. Significant Role of Palliative Gastrectomy in Selective Gastric Cancer Patients with Peritoneal Dissemination: A Propensity Score Matching Analysis. Ann Surg Oncol. 2016;23:3956-3963. [PubMed] [DOI] |
| 24. | Passot G, Vaudoyer D, Villeneuve L, Kepenekian V, Beaujard AC, Bakrin N, Cotte E, Gilly FN, Glehen O. What made hyperthermic intraperitoneal chemotherapy an effective curative treatment for peritoneal surface malignancy: A 25-year experience with 1,125 procedures. J Surg Oncol. 2016;113:796-803. [PubMed] [DOI] |