修回日期: 2018-09-17
接受日期: 2018-09-26
在线出版日期: 2018-10-28
初步探讨慢性乙型肝炎(hepatitis B virus, HBV)患者目前采用的丙氨酸氨基转移酶正常值上限(upper limit of normal, ULN)下调的必要性.
收集非活动性乙肝表面抗原(hepatitis B surface antigen, HBsAg)携带者及接受抗病毒治疗慢性HBV患者715例, 病毒DNA均低于检测值下限, 其中非活动性HBsAg携带者组57例(携带组), 慢性HBV抗病毒治疗组455例(肝炎组), ALT低于2 ULN经肝穿活检后抗病毒治疗组203例(其中ALT<1 ULN 133例, ALT 1-2 ULN 70例)(肝穿组). 收集患者年龄、性别、体重、肝功能、血糖、血脂、血常规、乙肝病毒感染血清学标志物、乙肝病毒DNA定量、甲胎蛋白、肝胆脾B超等相关数据. 肝穿组收集肝组织炎症分级、纤维化分期及抗病毒治疗1年后肝功能数据.
全部患者(n = 715)ALT水平中位数为19 IU/L, 95%百分位数为31.2 IU/L(95%CI: 30-34 IU/L), 95%百分位数男性为34 IU/L(95%CI: 31-35 IU/L), 女性为26.2 IU/L(95%CI: 25-30 IU/L). 肝穿组患者抗病毒治疗后ALT值下降显著, 中位数由37 IU/L降至23 IU/L, 具显著统计学差异(F = 111.497, P = 0.000).根据4种不同ALT正常值上限, 肝脏显著炎症(≥G2)的检出率分别为0, 38.78%, 63.27%和84.69%. 以ROC分析ALT对肝组织学显著炎症的评估价值, AUC值(Az)为0.751, 对ALT与肝组织学炎症程度作Logistic回归分析, P值为0.331.
目前应用的ALT正常值上限对评估慢性HBV是偏高的, 似乎存在下调的必要性.
核心提要: 血清丙氨酸氨基转移酶(alanine amino-transferase, ALT)是评价和随访肝病及肝细胞损伤的一个有效的实验室指标, 如果ALT正常值范围偏高, 肝病相关死亡风险则增加. 国际上多项研究表明, 目前ALT正常值上限设定过高, 应予以下调.本项目针对慢性乙型肝炎(hepatitis B virus, HBV)这一特殊患者群体进行研究, 结果表明应用目前的ALT正常值上限对评估慢性HBV是偏高的, 似乎存在下调的必要性.
引文著录: 涂文辉, 朱伟君, 钱峰, 张继明, 朱传武. 慢性乙型肝炎患者丙氨酸氨基转移酶正常值上限下调必要性初步探讨. 世界华人消化杂志 2018; 26(30): 1765-1771
Revised: September 17, 2018
Accepted: September 26, 2018
Published online: October 28, 2018
To explore the necessity of lowering the upper limit of normal of alanine aminotransferase (ALT) in patients with chronic hepatitis B (CHB).
A total of 715 CHB patients with undetectable HBV DNA were studied. Of them, 57 were inactive HBsAg carriers (carrier group), 455 were those who previously met antiviral criterion and achieved viral and biochemical response (hepatitis group), and 203 underwent liver biopsy due to their baseline ALT less than 2 times the upper limit of normal (ULN) and accepted antiviral treatment (including 133 cases with ALT < 1 x ULN and 70 cases with ALT 1-2 x ULN) (biopsy group). Clinical data including age, gender, weight, liver function, blood glucose, blood lipids, routine blood parameters, HBV markers, HBV DNA, alpha fetoprotein, and ultrasound findings were collected. Inflammation grade, fibrosis stage and liver function data were also collected for patients in the biopsy group after one year of antiviral therapy.
ALT median value was 19 IU/L and the 95% percentile was 31.2 IU/L (95%CI: 30-34 IU/L) in all patients (n = 715). The 95% percentile was 34 IU/L in males (95%CI: 31-35 IU/L), and 26.2 IU/L in females (95%CI: 25-30 IU/L). ALT value decreased significantly in the biopsy group after antiviral treatment, and median ALT decreased from 37 IU/L to 23 IU/L, which showed a significant difference (F = 111.497, P = 0.000). Based on four different ALT ULN, the detection rates of significant inflammation (≥G2) were 0, 38.78%, 63.27% and 84.69%, respectively, in the biopsy group. When ROC was used to analyze ALT and significant histological inflammation, the AUC value was 0.751. Logistic regression analysis showed that ALT was not associated with significant histological inflammation (P = 0.331).
The current ALT ULN is relatively high for assessment of liver inflammation in patients with CHB, and there may be a necessity to lower the threshold.
- Citation: Tu WH, Zhu WJ, Qian F, Zhang JM, Zhu CW. Necessity of lowering the upper limit of normal of alanine aminotransferase in patients with chronic hepatitis B. Shijie Huaren Xiaohua Zazhi 2018; 26(30): 1765-1771
- URL: https://www.wjgnet.com/1009-3079/full/v26/i30/1765.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v26.i30.1765
自从2002年意大利学者Prati等[1]报道丙氨酸氨基转移酶(alanine aminotransferase, ALT)正常值上限值(upper limit of normal, ULN)设定偏高以来, 国外关于ALT正常值上限下调的相关研究逐步增多.在对健康体检人员、献血者、青少年、肝组织学正常人群的研究中, 排除ALT相关影响因素后, 通过计算95%百分位数, 均认为ALT正常值上限应下调[2-5]. 来自美国、澳大利亚关于儿童、青少年非酒精性脂肪肝、丙型肝炎的研究也认为, 使用下调后的ALT正常值上限, 肝病检出率明显增高[4,6].
2006年《美国慢性乙型肝炎病毒感染处理流程》明确提出, 将ALT正常值上限设为男性30 IU/L, 女性19 IU/L[7].《2016年美国胃肠病学会临床指南: 异常肝生化指标的评估》建议真正健康人群ALT正常值上限范围: 男性为29-33 IU/L, 女性为19-25 IU/L, 超出范围者应进一步检查评估[8].《2018AASLD指南: 慢性乙型肝炎的预防、诊断和治疗(更新版)》建议健康成人的ALT正常值上限: 男性为29-33 IU/L, 女性为19-25 IU/L, 进行治疗决策时, 将正常值上限设定为男性35 IU/L, 女性25 IU/L[9].美国肝病学界在过去十余年间一直在进行ALT正常值上限的调整中, 可见ALT正常值上限的设定仍存在争议.
考虑到社会、经济及心理等多方面因素, 国内关于ALT正常值上限调整持谨慎态度, 主要是考虑到整体人群. 本研究从慢性乙型肝炎(hepatitis B virus, HBV)这一特殊群体出发, 排除影响ALT水平的相关因素, 进一步排除病毒DNA因素, 来探讨在这一特殊人群中ALT正常值真实水平.
本研究共纳入非活动性乙肝表面抗原(hepatitis B surface antigen, HBsAg)携带者及接受抗病毒治疗慢性HBV患者715例, 均来自于2013-02/2017-02在台州市立医院就诊或住院患者. 入选标准: (1)患者HBsAg阳性病史均超过6 mo, 诊断符合我国《慢性乙型肝炎防治指南(2010年和2015年版)》中慢性HBV诊断标准; (2)血清HBsAg阳性, HBeAg阴性, HBV DNA低于检测下限, 1年内连续随访3次以上, 每次至少间隔3 mo, ALT均在正常值范围内(本院ULN值, 男≤60 IU/L, 女≤45 IU/L), 为非活动性HBsAg携带者, 该组患者定义为携带组; (3)慢性HBV患者病情发作后(治疗前HBeAg阳性患者, HBV DNA≥1×105拷贝/mL, HBeAg阴性患者, HBV DNA≥1×104拷贝/mL, 发病时ALT>2 ULN)给予核苷(酸)类似物抗病毒治疗1年以上, HBsAg阳性, HBV DNA均低于检测值下限, ALT均在正常值范围内, 1年内至少随访2次, 该组患者定义为肝炎组; (4)慢性HBV患者ALT<2 ULN, 行肝穿刺活检术, 肝组织炎症≥G2者给予核苷(酸)类似物抗病毒治疗1年以上, HBsAg阳性, HBV DNA均低于检测值下限, ALT均在正常值范围内, 1年内至少随访2次, 该组患者定义为肝穿组. 排除标准: 合并其他病毒性肝炎(甲、丙、丁、戊型), 人类免疫缺陷病毒感染, 酒精性肝病、自身免疫性肝病、胆汁淤积性肝病、遗传代谢性肝病、肝硬化和肝脏肿瘤, 以及空腹血糖、血总胆固醇、血甘油三酯、血常规明显异常者.
1.2.1 实验室指标检测: 血常规采用深圳迈瑞6800全自动血常规分析仪进行检测. 肝功能采用日本日立7600型全自动生化分析仪检测(试剂盒购自上海和光纯耀化学有限公司). HBV血清标志物检测采用ELISA法(试剂购自上海科华生物工程股份有限公司). HBV DNA采用实时荧光定量PCR检测法(美国ABI7300plus荧光定量PCR仪, 上海科华HBV DNA定量分析试剂盒)测定, 其检测下限为5×102拷贝/mL.
1.2.2 肝脏病理检查: 患者均签署知情同意书, 在超声引导下行肝穿刺活检术.采用16G活检针(BARD公司)经皮肝穿获取肝组织, 立即用10%福尔马林液固定, 石蜡包埋切片, 以苏木素-伊红染色后镜下阅片. 肝组织长度≥1.5 cm, 汇管区数量≥6个. 肝组织炎症程度G0-G4分级按照《病毒性肝炎防治方案》[10]进行. 由两位病理医师双盲阅片, 意见不一致时, 由第三位高年资病理医师审核、讨论确定诊断.
统计学处理 全部数据均以统计软件SPSS 18.0分析完成. 计量资料采用中位数及95%百分位数表示, 部分95%百分位数标注95%可信区间, 部分计量资料做正态性检验. 抗病毒治疗前后ALT水平比较采用单因素方差分析. 计数资料分析采用Pearson χ2检验. 血生化指标与肝组织学显著炎症相关性采用Logistic回归分析, 血生化指标评估肝组织学显著炎症采用ROC分析, P<0.05为差异具统计学意义.
共入组慢性HBV感染者715例, 男性478例, 女性237例, 其中携带组57例, 肝炎组455例, 肝穿组203例.在肝穿组中, 68例ALT<0.5 ULN, 0.5 ULN≤ALT≤1 ULN者65例, 1 ULN<ALT<2 ULN者70例; 肝组织炎症程度<G2者42例, ≥G2者161例; 98例ALT<1 ULN者肝组织炎症程度≥G2. 年龄、ALT、AST、总胆红素、白蛋白、球蛋白、γ-GT、ALP、血糖、血脂水平等基线资料见表1.
| 参数 | 携带组(n = 57) | 肝炎组(n = 455) | 肝穿组(n = 203) | 合计(n = 715) |
| 性别(例, 男/女) | 20/37 | 310/145 | 148/55 | 478/237 |
| 年龄(岁) | 35/54 | 44/66 | 41/60 | 43/64 |
| 总胆红素(μmol/L) | 15.1/25.5 | 16.0/29.7 | 14.7/26.4 | 15.4/28.1 |
| 白蛋白(g/L) | 47.2/50.2 | 46.8/51.5 | 43.6/49.7 | 46.2/51.1 |
| 球蛋白(g/L) | 29.3/36.2 | 29.5/36.3 | 28.0/37.2 | 29.0/36.6 |
| ALT(IU/L) | 17.0/29.1 | 19.0/29.0 | 22.0/39.6 | 19.0/31.2 |
| AST(IU/L) | 20.0/31.1 | 20.0/29.0 | 23.0/32.0 | 21.0/30.0 |
| γ-GT(U/L) | 13.0/27.0 | 17.0/43.2 | 29.0/82.0 | 19.0/59.0 |
| ALP(U/L) | 70.0/191.8 | 81.0/128.0 | 70.0/119.8 | 77.0/124.2 |
| 血糖(mmol/L) | 4.6/5.7 | 5.0/6.2 | 4.8/6.0 | 4.9/6.1 |
| 总胆固醇(mmol/L) | 3.9/5.1 | 4.3/5.5 | 4.2/5.8 | 4.2/5.5 |
| 甘油三酯(mmol/L) | 1.0/1.3 | 1.0/1.8 | 1.0/2.2 | 1.0/1.9 |
在全部715例研究对象中, 总体ALT中位数、最小值、最大值、95%百分位数、95%可信区间, 以及按性别分类的分析结果见表2.
| 分类 | 中位数 | 最小值 | 最大值 | 95%百分位数 | 95%CI | |
| 下限 | 上限 | |||||
| ALT(总) | 19 | 5 | 52 | 31.2 | 30 | 34 |
| ALT(男) | 20 | 6 | 52 | 34 | 31 | 35 |
| ALT(女) | 15 | 5 | 40 | 26.2 | 25 | 30 |
在ALT<1 ULN患者中, 共有98例患者肝活检提示肝脏具有显著炎症(≥G2). 治疗前ALT中位数为37 IU/L, 95%百分位数为59.1 IU/L, 治疗后中位数为23 IU/L, 95%百分位数为35.0 IU/L. 单因素方差分析显示, 治疗前后ALT水平具有显著性统计学差异(F = 111.497, P = 0.000).
采用四种不同的ALT正常值上限, 即目前常用的正常值上限(男≤60 IU/L, 女≤45 IU/L)、操作手册的正常值上限(ALT≤40 IU/L)、本研究的正常值上限(男≤35 IU/L, 女≤27 IU/L)和Prati研究的正常值上限(男≤30 IU/L, 女≤19 IU/L), 对本研究中ALT<1 ULN、肝活检具有显著炎症(≥G2)的98例患者进行分析, 肝脏显著炎症检出率的比较见表3.
| ALT正常值上限 | 显著炎症(≥G2)检出率 | Pearson χ2 | P值 |
| 男≤60 IU/L, 女≤45 IU/L | 0 | 155.982 | 0.000 |
| 按操作手册ALT≤40 IU/L | 38.78% | ||
| 本研究男≤35 IU/L, 女≤27 IU/L | 63.27% | ||
| Prati研究男≤30 IU/L, 女≤19 IU/L | 84.69% |
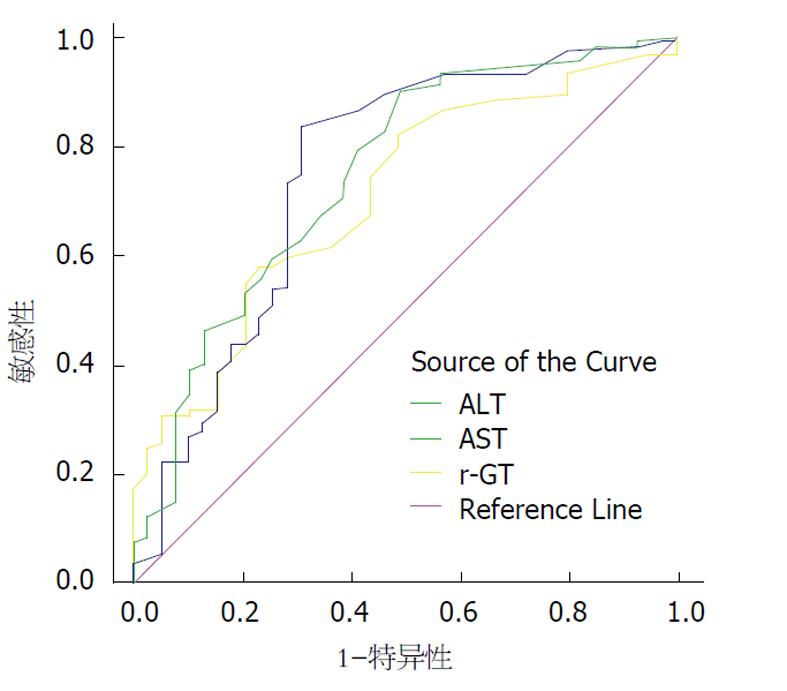
将ALT、AST、γ-GT与肝脏显著炎症(≥G2)作Logistic回归分析, P值分别为0.331, 0.177和0.049; 用ROC分析ALT、AST、γ-GT评估肝脏显著炎症(≥G2)的价值, AUC值(Az)分别为0.751, 0.749和0.709(图1).
血清ALT是评价和随访肝病及肝细胞损伤的一个有效的实验室指标, 其适用性超过肝穿刺活检及目前在研的Micro-RNA、GP73等指标.因不同实验室采用的商业试剂盒及参考人群不同, ALT正常值上限差异较大.目前临床常用的ALT参考值范围是根据美国临床试验室标准化协会(Clinical and Laboratory Standards Institute, CLSI)方法, 基于100-200个小样本调查表制定的. 该方法没有排除非酒精性肝病及其他肝病, 没有排除其他影响ALT及其调节因素, 并且因样本量小, 无法代表总的健康人群, 所以ALT正常值上限常常被质疑[3]. 目前国内ALT检测多按说明书标准操作, 应用加入磷酸吡哆醛的方法以提高酶的活性, 说明书推荐的ALT参考值为40 IU/L. 但各级临床检验中心推荐的参考值为男性60 IU/L, 女性45 IU/L, 这一标准考虑了研究群体的95%百分位数, 但针对于慢性HBV患者特殊群体, 这一标准是偏高的, 容易造成患者的漏诊.
既往大多数观点认为, ALT水平"正常者"肝穿活检时炎症较轻, 预后良好. 但很多研究表明, 在ALT正常的慢性HBV患者中, 肝脏活体组织检查发现, 约28%-37%的患者伴有不同程度的炎性坏死或肝纤维化改变, 其中61.8%的HBeAg阴性感染者有显著的肝脏损伤[11-13]. 这对目前ALT正常值上限反映肝损伤的准确性提出了挑战. Kim等[2]报道, ALT水平和肝病相关死亡率呈正相关, ALT正常值范围偏高者, 肝病相关死亡风险是增加的. 相较于ALT<20 IU/L组, 20-29 IU/L及30-39 IU/L组, 调整后的肝病死亡相对风险系数(adjusted relative risks, ARR)男性分别是2.9和9.5, 女性分别是3.8和6.6. 可见, ALT正常值上限设定过高, 将造成患者肝病死亡风险的增高.
2006年以色列Kariv等[3]研究表明, 在普通健康人群中, ALT正常值上限应为37.5 IU/L. 该研究样本取自以色列马卡比医疗保健服务中心(Maccabi Health Care Services), 该研究排除了影响ALT的相关调节因素, 如: 血糖、血胆固醇、甘油三酯、体重指数、谷草转氨酶、r-谷氨酰转肽酶、血红蛋白、用药史及基础肝病等, 筛选出17496例真正意义的"健康人群"进行分析. 研究表明ALT正常值上限应从52 IU/L调整为37.5 IU/L. Prati等[14]报道慢性丙型肝炎病毒学持续应答者, ALT正常值上限男、女均为30 IU/L, 显著低于治疗前所采用的ALT正常值上限.
本研究关注慢性HBV患者这一特殊群体, 排除了血糖、血脂、脂肪肝及其他肝病等对ALT的影响, 并进一步排除HBV DNA对检测结果的影响, 对715例患者的数据分析显示, ALT正常值95%百分位数为31.2 IU/L(95%CI: 30-34 IU/L), 男性为34 IU/L(95%CI: 31-35 IU/L), 女性为26.2 IU/L(95%CI: 25-30 IU/L), 因此建议将慢性HBV患者ALT正常值上限调整为男性35 IU/L, 女性27 IU/L, 这与以色列、韩国、美国等国的研究结果是一致的[3,5,15].
对ALT小于正常值上限, 即男性<60 IU/L, 女性<45 IU/L, 经肝穿活检证实炎症活动度大于G2(n = 98)的患者进行抗病毒治疗, 治疗前ALT中位数为37 IU/L, 95%百分位数为59.1 IU/L, 治疗后中位数为23 IU/L, 95%百分位数为35 IU/L, 治疗前后具有显著统计学差异(F = 111.497, P = 0.000).表明该部分患者按原正常值范围, 易造成肝炎患者的漏诊, 延误治疗时机. 抗病毒药物本身对ALT无任何影响, 抗病毒治疗后ALT明显下降, 分析其原因, 应归为病毒得以控制后肝内炎症获得缓解的缘故.
国外报道对于ALT在正常范围内的献血者, 应用不同ALT正常值上限定义, 异常ALT从4%增加到18%, 存在14%的变化范围; 对于ALT正常范围内的慢性丙肝患者, 应用不同ALT正常值上限定义, 异常ALT从16%增加到27%, 存在11%的变化范围; 干扰素治疗慢性丙肝患者, 应用不同ALT 正常值上限定义, 应答率从25%上升至42%, 存在17%的变化范围[16]. 本研究对98例ALT正常者结合肝穿刺活检结果, 采用不同ALT正常值上限标准, 分析ALT超出正常值上限时, 肝脏显著炎症(≥G2)的检出率分别为0%, 38.78%, 63.27%和84.69%, 随着ALT正常值上限的降低, 肝脏显著炎症的检出率逐步上升. 这从侧面反映了降低ALT正常值上限可以提高目标治疗患者的筛查率. 当然, 本组患者肝穿刺活检指征把握严格, 考虑了患者的年龄、HBeAg抗原状态及滴度、肝纤维化指标、肝脏超声(含肝脏硬度值测定)、乙肝家族史及相应肝病体征等, 综合分析后再建议行肝穿活检术, 故肝脏显著炎症的阳性率较高.
多个样本比较的秩和检验分析显示, 肝穿活检后予以抗病毒治疗患者ALT水平显著下降, 但仍高于携带组及肝炎组, 差异均具统计学意义(P = 0.000).表明这部分患者经抗病毒治疗后, 获得免疫控制的水平可能低于携带组及肝炎组, 肝内可能仍存在轻微炎症.
我们进一步研究了低水平ALT与肝组织显著炎症(≥G2)之间的关系, 通过Logistic回归分析及ROC分析表明, 低水平ALT对于肝内炎症的预测价值不大(P = 0.331, Az = 0.751). 国内研究表明, 在乙肝病毒自然史中, 随着ALT水平的增加, 肝内炎症活动度呈逐步上升趋势[17]. 但在本研究中, 对ALT在正常范围内或轻度增高患者, ALT水平和肝穿炎症分级无明显对应关系, 难以用ALT直接判断肝组织学炎症. 但比较而言, γ-GT对于肝脏显著炎症具有一定的预测价值(P = 0.049, Az = 0.709), 这与既往的报道一致[18]. 当然, ALT正常值上限下调, 势必造成肝功能异常患者数量增加. 对于这部分患者, 可以密切随访, 也可以考虑行肝穿刺活检术. 肝脏炎症显著者给予抗病毒治疗, 炎症程度轻者仍可随访观察. 本研究也存在一定的不足, 主要为入组患者数量仍然偏少, 样本量不够大. 也缺少体重指数(body mass index, BMI)数据, 尚不能完全排除肥胖、轻度脂肪肝等因素的干扰. 另外, 每家医院使用试剂的ALT标准值不一样, 试剂的同质化也是目前需要解决的问题.
总之, 本研究可以得出以下结论: (1)针对乙肝表面抗原阳性人群, ALT正常值上限似乎存在下调的必要性, 旨在发现更多需要治疗的患者; (2)应用目前ALT正常值上限, 易造成部分慢性HBV患者的漏诊, 建议将ALT 正常值上限设为男性35 IU/L, 女性27 IU/L; (3)ALT在正常值范围内或轻度升高的情况下, ALT与肝组织炎症无显著相关性, 不能用于预测肝组织炎症程度, 也不能用于指导抗病毒治疗时机选择.
自从2002年意大利学者Prati等报道丙氨酸氨基转移酶(alanine aminotransferase, ALT)正常值上限值(upper limit of normal, ULN)设定偏高以来, 国际上在对健康体检人员、献血者、青少年、肝组织学正常人群的研究中, 排除ALT相关影响因素后, 通过计算95%百分位数, 均认为ALT正常值上限应下调. 《2018AASLD指南: 慢性乙型肝炎(hepatitis B virus, HBV)的预防、诊断和治疗(更新版)》建议健康成人ALT正常值上限: 男性为29-33 IU/L, 女性为19-25 IU/L, 进行治疗决策时, 将正常值上限设定为男性35 IU/L, 女性25 IU/L.
考虑到社会、经济及心理多方面因素, 国内关于ALT正常值上限调整持谨慎态度, 主要是考虑到整体人群. 本研究从慢性HBV这一特殊群体出发, 排除影响ALT水平的相关因素, 以探讨这一特殊人群中ALT正常值的真实水平.
确定在慢性HBV患者群体中, ALT正常值上限的真实水平.
收集非活动性乙肝表面抗原(hepatitis B surface antigen, HBsAg)携带者及接受抗病毒治疗慢性HBV患者715例, 病毒DNA均低于检测下限, 其中非活动性HBsAg携带者组57例(携带组), 慢性HBV抗病毒治疗组455例(肝炎组), ALT低于2 ULN经肝穿活检后抗病毒治疗组203例(肝穿组). 分析715例患者ALT水平, 通过计算95%百分位数确定ALT正常值上限.肝穿组ALT<1 ULN患者, 比较抗病毒治疗前后ALT水平变化情况. 通过使用不同ULN标准, 比较肝脏显著炎症的检出率. 应用回归分析及ROC分析, 评估ALT与肝脏显著炎症的相关性.
应用目前ALT正常值上限评估慢性HBV, 易造成部分患者的漏诊, 建议ALT正常值上限设定为男性35 IU/L, 女性27 IU/L. 肝穿组患者抗病毒治疗后ALT值下降显著, 中位数由37 IU/L降至23 IU/L. 根据4种不同ALT正常值上限, 肝脏显著炎症(≥G2)的检出率分别为0, 38.78%, 63.27%和84.69%. ALT在正常值范围内或轻度升高的情况下, ALT与肝组织学炎症无显著相关性, 不能用于预测肝组织炎症程度, 也不能用于指导抗病毒治疗时机选择.
本研究发现在慢性HBV患者群体中, 目前使用的ALT正常值上限设定过高, 易造成肝炎患者的漏诊, 似乎存在下调的必要性.
本研究表明, ALT正常值上限在慢性HBV患者中似乎存在下调的必要性.但本研究也存在一定的不足之处, 主要为样本量不够大. 另外缺乏BMI数据, 难以完全排除肥胖、轻度脂肪肝等因素的干扰, 后期仍需要完整数据的大样本研究来确定慢性HBV患者中ALT正常值上限的真实水平.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C, C, C
D级 (一般): 0
E级 (差): 0
编辑: 崔丽君 电编:张砚梁
| 1. | Prati D, Taioli E, Zanella A, Della Torre E, Butelli S, Del Vecchio E, Vianello L, Zanuso F, Mozzi F, Milani S. Updated definitions of healthy ranges for serum alanine aminotransferase levels. Ann Intern Med. 2002;137:1-10. [PubMed] [DOI] |
| 2. | Kim HC, Nam CM, Jee SH, Han KH, Oh DK, Suh I. Normal serum aminotransferase concentration and risk of mortality from liver diseases: prospective cohort study. BMJ. 2004;328:983. [PubMed] [DOI] |
| 3. | Kariv R, Leshno M, Beth-Or A, Strul H, Blendis L, Kokia E, Noff D, Zelber-Sagie S, Sheinberg B, Oren R. Re-evaluation of serum alanine aminotransferase upper normal limit and its modulating factors in a large-scale population study. Liver Int. 2006;26:445-450. [PubMed] [DOI] |
| 4. | Van der Poorten D, Kenny DT, Butler T, George J. Liver disease in adolescents: A cohort study of high-risk individuals. Hepatology. 2007;46:1750-1758. [PubMed] [DOI] |
| 5. | Lee JK, Shim JH, Lee HC, Lee SH, Kim KM, Lim YS, Chung YH, Lee YS, Suh DJ. Estimation of the healthy upper limits for serum alanine aminotransferase in Asian populations with normal liver histology. Hepatology. 2010;51:1577-1583. [PubMed] [DOI] |
| 6. | Schwimmer JB, Dunn W, Norman GJ, Pardee PE, Middleton MS, Kerkar N, Sirlin CB. SAFETY study: alanine aminotransferase cutoff values are set too high for reliable detection of pediatric chronic liver disease. Gastroenterology. 2010;138:1357-1364; 1364.e1-1364.e2. [PubMed] [DOI] |
| 7. | Keeffe EB, Dieterich DT, Han SH, Jacobson IM, Martin P, Schiff ER, Tobias H, Wright TL. A treatment algorithm for the management of chronic hepatitis B virus infection in the United States: an update. Clin Gastroenterol Hepatol. 2006;4:936-962. [PubMed] [DOI] |
| 8. | Kwo PY, Cohen SM, Lim JK. ACG Clinical Guideline: Evaluation of Abnormal Liver Chemistries. Am J Gastroenterol. 2017;112:18-35. [PubMed] [DOI] |
| 9. | Terrault NA, Lok ASF, McMahon BJ, Chang KM, Hwang JP, Jonas MM, Brown RS Jr, Bzowej NH, Wong JB. Update on prevention, diagnosis, and treatment of chronic hepatitis B: AASLD 2018 hepatitis B guidance. Hepatology. 2018;67:1560-1599. [PubMed] [DOI] |
| 11. | Hu KQ, Schiff ER, Kowdley KV, Min AD, Shiffman ML, Lee WM, Goodman ZD, Dau LO, Peschell KJ, Fagan EA. Histologic evidence of active liver injury in chronic hepatitis B patients with normal range or minimally elevated alanine aminotransferase levels. J Clin Gastroenterol. 2010;44:510-516. [PubMed] [DOI] |
| 12. | Kumar M, Sarin SK, Hissar S, Pande C, Sakhuja P, Sharma BC, Chauhan R, Bose S. Virologic and histologic features of chronic hepatitis B virus-infected asymptomatic patients with persistently normal ALT. Gastroenterology. 2008;134:1376-1384. [PubMed] [DOI] |
| 13. | Lin CL, Liao LY, Liu CJ, Yu MW, Chen PJ, Lai MY, Chen DS, Kao JH. Hepatitis B viral factors in HBeAg-negative carriers with persistently normal serum alanine aminotransferase levels. Hepatology. 2007;45:1193-1198. [PubMed] [DOI] |
| 14. | Prati D, Shiffman ML, Diago M, Gane E, Rajender Reddy K, Pockros P, Farci P, O'Brien CB, Lardelli P, Blotner S. Viral and metabolic factors influencing alanine aminotransferase activity in patients with chronic hepatitis C. J Hepatol. 2006;44:679-685. [PubMed] [DOI] |
| 15. | Ruhl CE, Everhart JE. Upper limits of normal for alanine aminotransferase activity in the United States population. Hepatology. 2012;55:447-454. [PubMed] [DOI] |
| 16. | Piton A, Poynard T, Imbert-Bismut F, Khalil L, Delattre J, Pelissier E, Sansonetti N, Opolon P. Factors associated with serum alanine transaminase activity in healthy subjects: consequences for the definition of normal values, for selection of blood donors, and for patients with chronic hepatitis C. MULTIVIRC Group. Hepatology. 1998;27:1213-1219. [PubMed] [DOI] |