修回日期: 2017-12-20
接受日期: 2017-12-27
在线出版日期: 2018-01-28
分析局部枸橼酸抗凝(regional citrate anticoagulation, RCA)在血浆吸附联合血浆置换(plasma adsorption plus plasma exchange, PA+PE)治疗高危出血倾向肝衰竭中的可行性与安全性.
收集2016-10/2017-07四川大学华西医院感染性疾病中心收治的采用RCA行PA+PE治疗的高危出血倾向肝衰竭患者的临床资料, 回顾性分析治疗效果与枸橼酸蓄积、电解质及酸碱变化. 当血总钙(Catot)与离子钙(Caion)的比值(Catot/Caion)≥2.5时, 判定发生了枸橼酸蓄积.
7例患者存活2例, 死亡5例. 共完成24例次RCA的PA+PE治疗. PA治疗期间体外Caion浓度为0.28 mmol/L±0.09 mmol/L. 45.8%(11/24)例次治疗在PA治疗期间发生了枸橼酸蓄积; 至PE治疗末, 全部例次治疗均出现了枸橼酸蓄积. 治疗后2 h, 仍有41.7%(10/24)例次治疗存在枸橼酸蓄积, 但已较PE治疗末明显减少(P<0.01); 至第2天晨, 全部例次治疗均不再存在枸橼酸蓄积. 治疗期间及治疗后无新发出血, 原有出血未恶化; 主要不良反应为碱中毒和一过性低Caion血症及高Catot血症.
肝衰竭患者仍具有一定程度的代谢枸橼酸和耐受枸橼酸蓄积的能力. RCA在PA联合PE治疗肝衰竭患者中可能具有一定的可行性及安全性.
核心提要: 本研究发现肝衰竭患者仍具有一定程度的枸橼酸代谢能力. 局部枸橼酸抗凝在血浆吸附联合血浆置换治疗肝衰竭中仍具有一定的可行性及安全性, 可在密切监测患者生命体征与内环境状态、保障患者安全的前提下谨慎开展.
引文著录: 马元吉, 陈芳, 许艳, 白浪, 唐红. 局部枸橼酸抗凝在血浆吸附联合血浆置换治疗高危出血倾向肝衰竭患者中的应用. 世界华人消化杂志 2018; 26(3): 165-173
Revised: December 20, 2017
Accepted: December 27, 2017
Published online: January 28, 2018
To analyze the feasibility and safety of regional citrate anticoagulation (RCA) during plasma adsorption (PA) plus plasma exchange (PE) therapy for patients with liver failure at high risk of bleeding.
This was a retrospective study conducted at the Center of Infectious Diseases, West China Hospital of Sichuan University from October 2016 to July 2017. The clinical data of patients with liver failure at high risk of bleeding who received RCA during PA plus PE therapy were collected. The therapeutic effects, citrate accumulation, electrolytes, and acid-base changes were retrospectively analyzed. Citrate accumulation was defined as the total calcium (Catot) to ionized calcium (Caion) ratio (Catot/Caion) ≥ 2.5.
Of the seven patients included, two survived and five died. Twenty four sessions of RCA for PA plus PE therapy were accomplished. The mean Caionin vitro during PA therapy was 0.28 mmol/L ± 0.09 mmol/L. Citrate accumulation occurred in 45.8% (11/24) of sessions during PA therapy and in all the sessions at the end of PE therapy. Although citrate accumulation still occurred in 41.7% (10/24) of sessions 2 h after PE therapy, it had been decreased obviously when compared with that at the end of PE therapy (P < 0.01) and it was not present by the next morning. No new bleeding occurred and the original bleeding did not deteriorate during and after PA plus PE therapy. The main side effects were alkalosis and transient low level of Caion and high level of Catot.
Patients with liver failure still have certain ability to metabolize citrate and tolerate citrate accumulation. RCA may be feasible and safe in the PA plus PE therapy for patients with liver failure.
- Citation: Ma YJ, Chen F, Xu Y, Bai L, Tang H. Application of regional citrate anticoagulation during plasma adsorption and plasma exchange for patients with liver failure at high risk of bleeding. Shijie Huaren Xiaohua Zazhi 2018; 26(3): 165-173
- URL: https://www.wjgnet.com/1009-3079/full/v26/i3/165.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v26.i3.165
肝衰竭是临床常见的严重肝病症候群, 病情进展快, 病死率高[1-3]. 人工肝支持系统治疗(简称人工肝治疗)是肝衰竭的重要治疗方法之一[3,4]. 为保障体外循环装置的顺利运行, 临床实践中常采用肝素或低分子肝素抗凝[4], 但其诱发出血及血小板减少等不良反应可能危及患者生命安全, 在活动性出血的患者中更存在使用禁忌. 局部枸橼酸抗凝(regional citrate anticoagulation, RCA)仅在体外抗凝, 不影响体内凝血机制, 虽然存在代谢紊乱风险, 但在高危出血倾向和活动性出血患者中可能仍有一定的应用价值. 本研究回顾性分析了四川大学华西医院感染性疾病中心采用RCA行血浆吸附联合血浆置换(plasma adsorption plus plasma exchange, PA+PE)治疗高危出血倾向的肝衰竭病例7例, 现将结果报道如下.
1.1.1 患者: 回顾性分析2016-10/2017-07四川大学华西医院感染性疾病中心收治的采用RCA行PA+PE治疗的高危出血倾向肝衰竭病例7例, 其中男性5例, 女性2例, 年龄26-64岁; 患者均符合2012年《肝衰竭诊治指南》中的诊断标准[3], 均被诊断为乙型肝炎病毒相关性慢加急性肝衰竭. 人工肝治疗前总胆红素(total bilirubin, TB)435.9-689.3 μmol/L, 凝血酶原时间国际标准化比值(International Normalized Ratio, INR)1.68-3.02, 终末期肝病模型(Model for End-Stage Liver Disease, MELD)评分19-33分(表1). 经超声或计算机扫描诊断出肝炎后肝硬化5例. 人工肝治疗时所有患者均为高危出血倾向者: (1)均为肝衰竭患者; (2)均合并近期发生的出血: 合并脑出血1例(人工肝治疗前6 d发生), 合并消化道出血5例, 其中仍有黑便2例、已转为褐色便1-2 d者2例, 合并反复内痔出血1例. 脑出血患者昏睡, 另2例患者存在Ⅱ肝性脑病. 5例患者正在治疗感染, 其中原发性腹膜炎5例, 肺炎2例.
| 指标 | 治疗前结果 | 下降率 (%) | |
| 治疗前与后 | 治疗前与第2天晨 | ||
| 血红蛋白 (g/L) | 100 ± 15 | 10.8 ± 6.8 | 3.0 ± 6.4 |
| 血小板 (×109/L) | 75 ± 39 | 22.4 ± 21.0 | 20.7 ± 15.0 |
| 白细胞 (×109/L) | 7.61 ± 4.34 | 1.8 ± 22.3 | 12.0 ± 22.3 |
| INR | 2.40 ± 0.43 | 24.1 ± 12.2 | 15.3 ± 13.5 |
| 总胆红素 (µmol/L) | 390.7 ± 140.1 | 48.7 ± 5.8 | 13.4 ± 19.5 |
| 直接胆红素 (µmol/L) | 275.5 ± 104.5 | 48.3 ± 6.0 | 16.3 ± 9.8 |
| 谷丙转氨酶 (IU/L) | 121 ± 105 | 35.6 ± 9.3 | 25.7 ± 16.0 |
| 谷草转氨酶 (IU/L) | 122 ± 87 | 38.6 ± 7.3 | 16.7 ± 9.4 |
| 碱性磷酸酶 (IU/L) | 150 ± 49 | 28.4 ± 6.8 | 7.5 ± 13.1 |
| 谷氨酰胺转肽酶 (IU/L) | 58 ± 50 | 29.1 ± 18.9 | 16.3 ± 24.8 |
| 白蛋白 (g/L) | 32.6 ± 4.3 | 7.1 ± 9.0 | -0.3 ± 9.6 |
| 球蛋白 (g/L) | 30.0 ± 8.3 | 15.5 ± 10.5 | 11.8 ± 7.7 |
| 总胆汁酸 (µmol/L) | 298.8 ± 74.8 | 18.5 ± 15.3 | 27.3 ± 12.7 |
| 肌酐 (µmol/L) | 74 ± 23 | 5.3 ± 12.6 | 2.5 ± 19.2 |
| 血氨 (mmol/L) | 69 ± 31 | 13.5 ± 34.3 | -28.7 ± 61.0 |
| 钠 (mmol/L) | 131.1 ± 5.3 | -3.2 ± 2.4 | -2.1 ± 2.1 |
| 钾 (mmol/L) | 3.44 ± 0.52 | -8.8 ± 9.3 | -6.3 ± 12.7 |
| 氯 (mmol/L) | 95.4 ± .7.7 | 1.2 ± 6.7 | 0.2 ± 5.6 |
| MELD评分 | 26 ± 4 | 24.9 ± 7.8 | 11.7 ± 10.5 |
1.1.2 仪器与耗材: 采用金宝双腔静脉导管通过右侧颈内静脉(导管长115 mm)或右侧股静脉(导管长200 mm)建立静脉通路. 使用贝朗Diapact CRRT及其CVVH模式管路、三通接头、贝尔克血浆分离器MPS05、博新血浆胆红素吸附柱DX350、健帆血液灌流器HA330-Ⅱ等组成治疗模式.
1.2.1 治疗方案: 在内科综合治疗的基础上, 所有患者均接受PE+PA模式的人工肝治疗. 生理盐水2000 mL预冲管路及MPS05, 生理盐水2500 mL、3500 mL分别预冲DX350、HA330-Ⅱ, 聚明胶肽500 mL及10%氯化钾15 mL预冲DX350串联HA330-Ⅱ组成的PA治疗单元[5]. CRRT机设置为后稀释CVVH模式、血流速度130 mL/min、置换液速度1800 mL/h、超滤速度0 mL/h. 首先进行PA治疗2 h, 然后通过三通接头采用空气回血法将灌流器内血浆回入患者体内, 最后完成新鲜或普通冰冻血浆1500 mL的PE治疗.
1.2.2 抗凝方案: 初始方案均为深静脉导管采血端接三通泵入4%枸橼酸钠100 mL/h、回血端接三通泵入10%葡萄糖酸钙8 mL/h. 根据血气分析所测体内外离子钙(Caion)水平调节枸橼酸钠与葡萄糖酸钙的泵速, 维持血浆分离器后Caion在0.4 mmol/L以下、体内Caion在0.6 mmol/L以上. 拟定当所测体内Caion低于0.6 mmol/L或患者出现低钙血症表现时, 临时缓慢静脉注射10%葡萄糖酸钙10 mL.
1.2.3 监测方案: 根据文献报道, 采用血总钙(Catot)与Caion的比值(Catot/Caion)评估患者体内枸橼酸水平, 当Catot/Caion≥2.5时, 判定患者发生了枸橼酸蓄积[6]. 人工肝治疗前后及第2天晨监测血常规、血生化与静脉血血气分析; 人工肝治疗后2 h检测静脉血电解质与血气分析; PA治疗1-2 h或疑似体外循环凝血时, 先检测血浆分离器后静脉血血气分析(检测体外循环Caion), 然后在暂停泵入枸橼酸5-8 s后检测血浆分离器前静脉血血气分析(检测体内Caion), 采血后即刻恢复泵入枸橼酸, 根据检测结果决定是否调整抗凝方案. 人工肝治疗期间及治疗后8 h持续心电监护监测患者生命体征.
1.2.4 观察指标: (1)治疗效果: 人工肝治疗前后肝功能改善情况、疾病转归及患者预后; (2)RCA的有效性: 观察人工肝治疗的完成情况, 体外循环Caion水平; (3)RCA的安全性: 观察人工肝治疗前后患者体内钙及酸碱状态的变化, 观察枸橼酸蓄积发生情况及其转归.
统计学处理 所有数据应用SPSS17.0版统计软件分析, 图片采用GraphPad Prism 6制作. 计量资料采用mean±SD表达并用单因素方差分析统计, 计数资料采用频率表达并用χ2检查统计. P<0.05为有差异有统计学意义.
7例患者分别完成2-5次RCA的PA+PE治疗, 总计24例次, 均全部完成. 每次人工肝治疗前后患者胆红素平均降低48.7%±5.8%、INR平均降低24.1%±12.2%、MELD评分平均降低24.9%±7.8%, 至第2天晨仍显示出效果, 胆红素平均降低13.4%±19.5%、INR平均降低15.3%±13.5%、MELD评分平均降低11.7%±10.5%(表1).
7例患者共完成24例次RCA的PA+PE治疗, PA治疗期间体外循环平均Caion浓度为0.28 mmol/L±0.09 mmol/L(0.11-0.45 mmol/L). 顺利完成22例次; 1例次出现滤前压升高至200-220 mmHg, 跨膜压<20 mmHg, 体外Caion为0.22 mmol/L, 体内Caion为0.78 mmol/L, 因体外循环动脉压持续-200-(-250) mmHg, 采血不佳, 予降低置换液速度为1500 mL/h、并在血浆分离器前持续静滴平衡液近500 mL下完成治疗, 未发生破膜报警; 1例次出现跨膜压升高至60-70 mmHg, 滤前压160-180 mmHg, 体外Caion为0.45 mmol/L, 体内Caion为0.99 mmol/L, 予加快枸橼酸泵速至110 mmol/L后完成治疗, 跨膜压、滤前压未继续升高, 无肉眼破膜, 但CRRT机发出漏血报警.
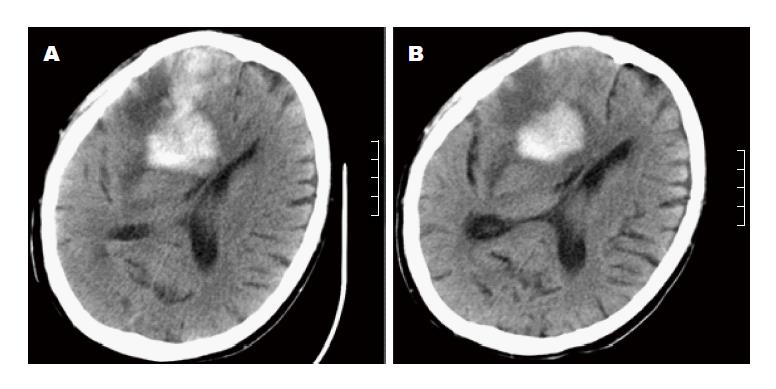
2.3.1 出血情况的变化: 每次人工肝治疗期间及治疗后24 h内均无新发出血, 原有出血亦未加重. 脑出血患者在完成人工肝治疗4次时复查头部影像, 结果提示颅内出血较人工肝治疗前有好转(图1). 经内科综合治疗及人工肝治疗, 2例患者病情好转出院, 随访3 mo仍存活, 肝功均恢复正常; 5例患者病情最终仍恶化, 出现肝肾综合征、肝性脑病或感染性休克等严重并发症, 其中2例患者在住院期间死亡, 3例患者自动出院, 至随访3 mo时均已死亡.
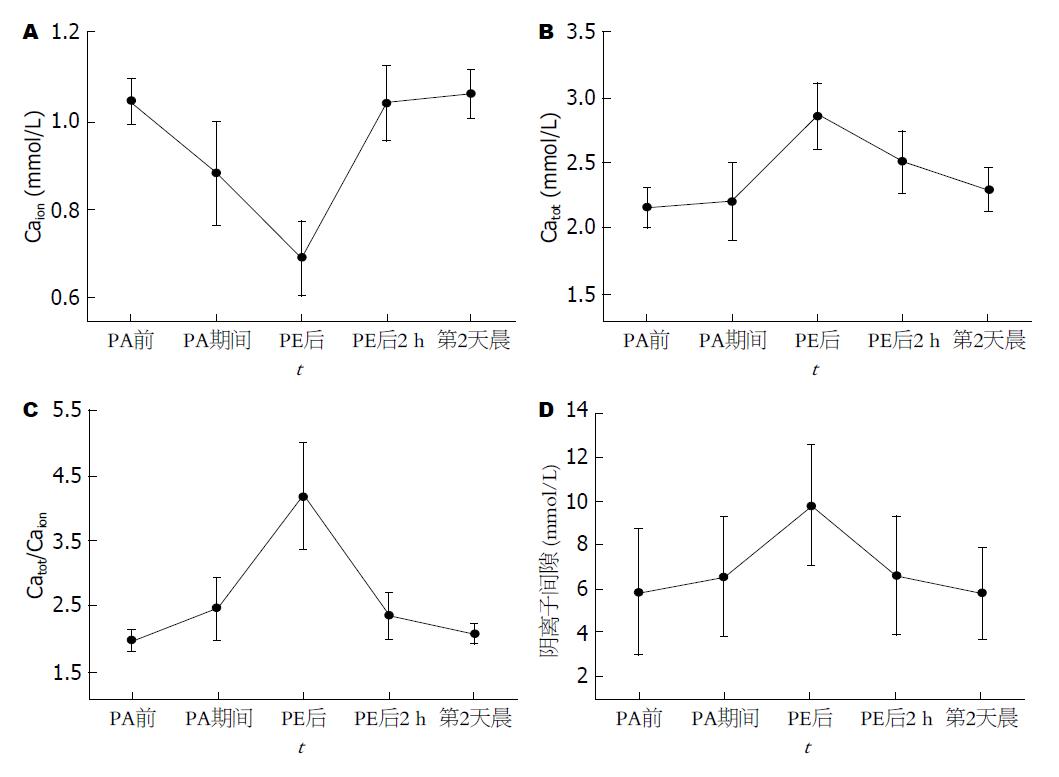
2.3.2 血钙变化与枸橼酸蓄积的发生: 人工肝治疗前后患者体内血钙水平波动明显(表2, 图2). PA治疗期间和PE治疗末体内Caion分别降至0.88 mmol/L±0.12 mmol/L和0.69 mmol/L±0.09 mmol/L, 均明显低于治疗前1.05 mmol/L±0.05 mmol/L的体内Caion水平(P<0.01). 人工肝治疗结束后2 h, 体内Caion水平已恢复至1.04 mmol/L±0.09 mmol/L, 与治疗前体内Caion水平及第2天晨的体内Caion水平(1.06 mmol/L±0.06 mmol/L)相比, 均无显著性差异(P>0.05).
| PA前 | PA期间 | PE后 | PE后2 h | 第2天晨 | |
| Catot (mmol/L) | 2.16±0.15c | 2.21±0.29 | 2.86±0.26bd | 2.51±0.24bd | 2.30±0.18a |
| Caion (mmol/L) | 1.05±0.05 | 0.88±0.12bd | 0.69±0.09bd | 1.04±0.09 | 1.06±0.06 |
| Catot/Caion | 2.07±0.15 | 2.54±0.47bd | 4.23±0.79bd | 2.43±0.34bc | 2.17±0.15 |
| Catot/Caion≥2.5 (是/否) | 0/24 | 11/13bd | 24/0bd | 10/14bd | 0/24 |
| 阴离子间隙 (mmol/L) | 5.8±2.9 | 6.5±2.8 | 9.8±2.7bd | 6.6±2.7 | 5.8±2.1 |
| pH | 7.44±0.03d | 7.43±0.03d | 7.43±0.03d | 7.47±0.06b | 7.47±0.03b |
| HCO3- (mmol/L) | 25.5±5.0 | 25.3±4.5 | 25.8±4.1 | 26.4±4.4 | 27.0±3.8 |
| PCO2 (mmHg) | 38.7±6.1 | 39.0±6.0 | 39.1±5.1 | 37.3±8.9 | 37.8±4.6 |
| 乳酸 (mmol/L) | 2.6±0.5 | 2.9±1.9 | 2.9±1.7 | 2.9±0.6 | 2.7±0.6 |
PA治疗期间Caion浓度均不低于0.6 mmol/L. PE治疗末出现2例次Caion浓度低于0.6 mmol/L, 分别为0.48 mmol/L和0.51 mmol/L, 均予临时缓推葡萄碳酸钙10 mL. 人工肝治疗期间, 患者未发生低钙血症相关临床症状.
因泵入葡萄糖酸钙补充Caion, 人工肝治疗期间血Catot逐渐升高, 但人工肝治疗结束后2 h体内Catot水平已较PE治疗末体内Catot水平明显降低(2.51 mmol/L±0.24 mmol/L vs 2.86 mmol/L±0.26 mmol/L, P<0.01); 至第2天晨, 虽然体内Catot水平(2.30 mmol/L±0.18 mmol/L)仍高于治疗前水平(P<0.05), 但已明显低于人工肝治疗结束后2 h水平(P<0.01), 且已恢复至正常参考值水平(2.1-2.7 mmol/L).
人工肝治疗期间Catot/Caion逐渐升高, PA治疗期间和PE治疗末Catot/Caion分别升高至2.54±0.47和4.23±0.79, 均明显高于治疗前的Catot/Caion(2.07±0.15) (P<0.01). 人工肝治疗结束后2 h Catot/Caion(2.43±0.34)虽然仍明显高于治疗前水平(P<0.01), 但较PE治疗末Catot/Caion明显降低(P<0.01); 至第2天晨, Catot/Caion进一步降低至2.17±0.15, 明显低于人工肝治疗结束后2 h Catot/Caion(P<0.05), 与治疗前相比已无显著性差异(P>0.05). 人工肝治疗期间, 静脉血阴离子间隙的变化与Catot/Caion的变化趋势一致(表2, 图2).
人工肝治疗期间, 45.8%(11/24)例次的PA治疗发生了枸橼酸蓄积(Catot/Caion≥2.5); 至PE治疗末, 全部例次人工肝治疗均出现了枸橼酸蓄积. 人工肝治疗后2 h, 虽然仍有41.7%(10/24)例次的治疗存在枸橼酸蓄积, 但已较PE治疗末明显减少(P<0.01); 至第2天晨, 全部例次治疗均不再存在枸橼酸蓄积.
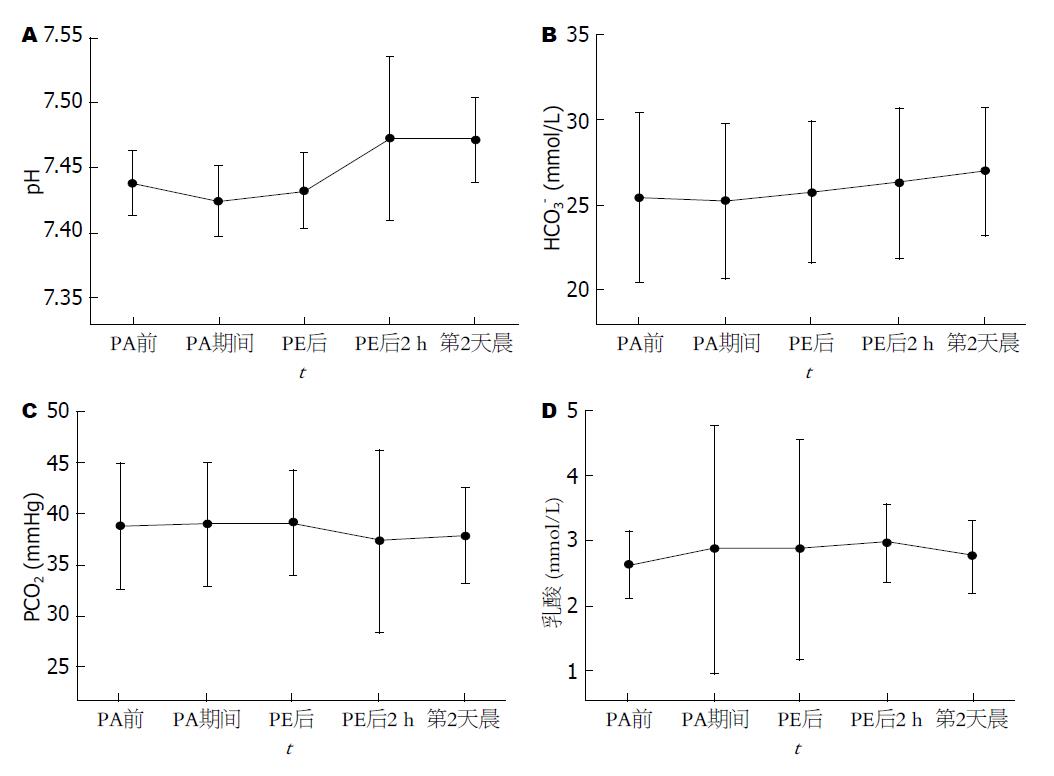
2.3.3 血液酸碱度与血乳酸变化: 人工肝治疗前后患者体内血液酸碱度与血乳酸波动详如表2, 图3. 人工肝治疗结束后2 h静脉血pH值升高至7.47±0.06, 明显高于治疗前所测值7.44±0.03(P<0.01). 第2天晨的pH值仍维持于7.47±0.03, 明显高于治疗前水平; 但与人工肝治疗后2 h相比, 两者间差异并无统计学意义(P>0.05).
本回顾性研究首次分析了RCA在PA+PE治疗高危出血倾向的肝衰竭中的有效性与安全性, 发现RCA可有效维持体外循环功能; 患者未出现新发出血, 原有出血未恶化; 虽然在人工肝治疗期间发生了枸橼酸蓄积, 但治疗结束后2 h已明显减少, 至第2天晨已无枸橼酸蓄积存在. 治疗期间主要内环境紊乱为碱中毒和一过性低Caion血症及高Catot血症.
枸橼酸钠通过与凝血过程中多个部位起作用的凝血因子Ⅳ-Caion-螯合, 降低血Caion水平从而实现抗凝. 研究显示, Caion浓度在0.56 mmol/L及其以上时凝血功能不受影响, Caion浓度为0.2-0.4 mmol/L是RCA行血液净化治疗的最佳体外Caion水平[7]. 虽然RCA增加了低Caion血症的发生[8,9], 但可以明显减少出血和肝素相关性血小板减少症[8-12], 使体外循环具有更好的组织相容性和更长的使用寿命[10,13], RCA并不影响危重症患者预后[10]. 因此, RCA已成为连续性肾脏替代治疗的首选抗凝方式[14]. 目前还未见有采用RCA行PE联合或不联合PA模式的人工肝治疗的研究报道. 本研究成功地在高危出血倾向的肝衰竭中采用了RCA行PA+PE治疗, 拓展了肝衰竭时RCA的人工肝治疗模式适应证, 为高危出血倾向肝衰竭患者的体外循环抗凝提供了可选的有效方案. 本研究中有2例次治疗发生了体外循环凝血. 其中1例次治疗抗凝不足, 我们采用增加枸橼酸钠泵速实现了有效抗凝; 根据枸橼酸钠抗凝原理, 通过减慢血流速度间接增加体外循环枸橼酸钠浓度亦可实现抗凝目的. 另1例次治疗尽管达到了抗凝要求, 但仍发生了凝血, 考虑与采血不佳所致滤过分数过高、体外循环衰竭有关[15].
虽然枸橼酸钠在人体内经过代谢后成为正常存在的物质, 但在危重症患者中实施RCA仍有一定的风险, 可能导致枸橼酸蓄积(枸橼酸盐代谢不全)、代谢性碱中毒(代谢产物碳酸氢盐代谢不全)、低Caion血症(补钙不足或枸橼酸蓄积)、高Catot血症及高钠血症等不良反应[14,16]. 研究显示, 危重症合并急性肾损伤患者和健康人具有非常相似的枸橼酸代谢能力及过程, 而危重症伴肝硬化的患者代谢枸橼酸的能力较不伴肝硬化者差, 尽管如此, 经过一段时间后, 两组间的枸橼酸代谢产物并无明显区别[17,18]. 肝衰竭患者在顺利接受连续性静脉静脉血液透析、持续缓慢低效血液透析、分子吸附再循环系统、成分血浆分离吸附系统、血浆置换序贯连续性静脉静脉血液滤过等治疗时[6,19-24], 因血液净化治疗均内含透析技术, 该技术的弥散功能可有效清除包括枸橼酸盐在内的水溶性小分子物质, 可减轻患者自身代谢枸橼酸的负荷, 这可能是肝衰竭患者在采用内含透析技术的人工肝治疗模式时能较好地耐受RCA的重要原因.
本研究成功地在高危出血倾向的肝衰竭中采用了RCA行PA+PE治疗, 治疗技术不含透析和滤过; 抗凝泵入患者体内的枸橼酸和用于保存血液制品通过血浆置换带入患者体内的枸橼酸均需要通过患者自身的代谢能力代谢为碳酸氢盐、二氧化碳及水. 本研究发现, 肝衰竭患者的枸橼酸代谢虽有滞后, 但未发现枸橼酸蓄积可持续至第2天, 提示肝衰竭患者仍具有一定程度的枸橼酸代谢能力. 类似的代谢特点也在肝硬化患者中被发现[18,22]. 研究显示, 血浆置换治疗虽然给肝衰竭患者带来了一定量的枸橼酸负荷, 但患者仍然可从该治疗中获益[25-28]. 事实上, 枸橼酸是人体生理代谢产物, 其本身可能是无毒的, 但需关注其诱发的代谢紊乱[6]. 因此, 枸橼酸蓄积对肝衰竭患者的影响可能并不大, RCA在肝衰竭患者中仍有一定的安全性, 肝衰竭确非RCA的绝对禁忌证[14,29].
虽然多个研究提示RCA并不增加出血[8-12], 但若在RCA期间补充Caion不足, 仍可能导致患者Caion浓度低于0.6 mmol/L. 本研究就有2例次治疗在PE治疗末出现了Caion浓度低于0.6 mmol/L, 虽然患者无低钙相关临床症状, 也无新发出血或原有出血恶化, 但可能已影响了体内凝血机制[7], 仍有诱发出血的风险. 因此, 在肝衰竭患者中实施RCA时应积极监测患者的生命体征与内环境状态, 通过血生化、血气分析等反复评估患者的酸碱状态、Caion水平、Catot/Caion水平等, 在确保患者安全的前提下实现体外循环局部抗凝, 保障人工肝治疗的顺利实施[29,30].
总之, 我们的研究发现肝衰竭患者仍具有一定程度的枸橼酸代谢能力, 并非RCA的绝对禁忌证. RCA在PA联合PE治疗肝衰竭患者中可能仍具有一定的可行性及安全性, 可在密切监测患者生命体征与内环境状态、保障患者安全的前提下谨慎开展.
肝衰竭病情进展快, 病死率高. 人工肝治疗是肝衰竭的重要治疗手段之一. 为保障体外循环装置的顺利运行, 临床实践中常采用肝素或低分子肝素抗凝, 但其诱发出血及血小板减少等不良反应威胁了肝衰竭患者的生命安全, 在活动性出血的患者中更存在使用禁忌. 局部枸橼酸抗凝仅在体外抗凝, 不影响体内凝血机制, 当存在肝素或低分子肝素使用禁忌时, 采用局部枸橼酸抗凝可能是保障肝衰竭患者获得及时的人工肝治疗的重要方法之一. 本研究初步探讨局部枸橼酸抗凝在高危出血倾向和活动性出血患者中的有效性及安全性.
本研究初步探讨了局部枸橼酸抗凝在高危出血倾向和活动性出血患者中的有效性及安全性, 为拟行人工肝治疗但因存在肝素或低分子肝素使用禁忌的患者提供了可选择的抗凝方案, 有利于保障患者获得及时的人工肝治疗.
本研究的主要目标为初步了解局部枸橼酸抗凝在高危出血倾向和活动性出血患者中的有效性及安全性. 本研究发现局部枸橼酸抗凝可有效维持体外循环功能, 肝衰竭患者仍具有一定程度的枸橼酸代谢能力. 本研究的结果为今后进一步开展随机对照试验评价局部枸橼酸抗凝在人工肝治疗肝衰竭中的有效性及安全性提供了初步依据.
本研究为回顾性临床研究, 研究对象为高危出血倾向和活动性出血的肝衰竭患者. 首先收集上述因存在肝素或低分子肝素使用禁忌而采用局部枸橼酸抗凝行人工肝治疗肝衰竭患者的临床资料, 然后通过分析数据评价局部枸橼酸抗凝的有效性及安全性.
本研究为初步了解了局部枸橼酸抗凝在人工肝治疗高危出血倾向和活动性出血的肝衰竭中的有效性及安全性. 本研究发现局部枸橼酸抗凝可有效维持体外循环功能, 肝衰竭患者仍具有一定程度的枸橼酸代谢能力. 本研究为拟行人工肝治疗但因存在肝素或低分子肝素使用禁忌的患者提供了可选择的抗凝方案, 有利于保障患者获得及时的人工肝治疗. 本研究的结果也为今后进一步开展随机对照试验评价局部枸橼酸抗凝在人工肝治疗肝衰竭中的有效性及安全性提供了初步依据.
(1)局部枸橼酸抗凝可有效维持体外循环功能; (2)肝衰竭患者仍具有一定程度的枸橼酸代谢能力; (3)局部枸橼酸抗凝在血浆吸附联合血浆置换治疗肝衰竭患者中可能仍具有一定的可行性及安全性; (4)肝衰竭并非局部枸橼酸抗凝的绝对禁忌证; (5)局部枸橼酸抗凝仅在体外抗凝, 不影响体内凝血机制, 虽然存在代谢紊乱风险, 但在高危出血倾向和活动性出血患者中可能仍有一定的应用价值; (6)局部枸橼酸抗凝可在密切监测患者生命体征与内环境状态、保障患者安全的前提下谨慎开展; (7)接受血浆吸附及血浆置换治疗的患者均发生了枸橼酸蓄积, 但治疗结束后2 h已明显减少, 至第2天晨已无枸橼酸蓄积存在. 治疗期间主要内环境紊乱为碱中毒; (8)本研究为拟行人工肝治疗但因存在肝素或低分子肝素使用禁忌的患者提供了可选择的抗凝方案.
本研究为回顾性研究, 需要前瞻性研究进一步验证研究结果. 本研究所采用的抗凝方案是基于连续性肾脏替代治疗急性肾损伤的局部枸橼酸抗凝方案制订的, 尚需要进一步优化以更适用于肝衰竭患者, 以期既能满足体外循环抗凝需求又能保障患者生命安全. 研究方向: 今后应开展更多临床研究评价局部枸橼酸抗凝在各种模式的人工肝治疗伴或不伴出血的肝衰竭患者中的有效性及安全性, 并进一步研究枸橼酸蓄积对肝衰竭患者预后的影响. 最佳方法: 前瞻性队列研究及随机对照试验研究.
手稿来源: 自由投稿
学科分类: 胃肠病学和肝病学
手稿来源地: 四川省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C, C
D级 (一般): D
E级 (差): 0
编辑: 闫晋利 电编:杜冉冉
| 1. | Sarin SK, Choudhury A. Acute-on-chronic liver failure: terminology, mechanisms and management. Nat Rev Gastroenterol Hepatol. 2016;13:131-149. [PubMed] [DOI] |
| 5. | Chen J, Huang J, Chen Y, Lu Y, Li L. A clinical study on the treatment of severe hepatitis by a combined artificial liver. Hepatogastroenterology. 2012;59:2273-2275. [PubMed] [DOI] |
| 6. | Schultheiß C, Saugel B, Phillip V, Thies P, Noe S, Mayr U, Haller B, Einwächter H, Schmid RM, Huber W. Continuous venovenous hemodialysis with regional citrate anticoagulation in patients with liver failure: a prospective observational study. Crit Care. 2012;16:R162. [PubMed] [DOI] |
| 7. | James MF, Roche AM. Dose-response relationship between plasma ionized calcium concentration and thrombelastography. J Cardiothorac Vasc Anesth. 2004;18:581-586. [PubMed] |
| 8. | Zhang Z, Hongying N. Efficacy and safety of regional citrate anticoagulation in critically ill patients undergoing continuous renal replacement therapy. Intensive Care Med. 2012;38:20-28. [PubMed] [DOI] |
| 10. | Liu C, Mao Z, Kang H, Hu J, Zhou F. Regional citrate versus heparin anticoagulation for continuous renal replacement therapy in critically ill patients: a meta-analysis with trial sequential analysis of randomized controlled trials. Crit Care. 2016;20:144. [PubMed] [DOI] |
| 12. | Liu J, Wang C, Zhao H, Zhang J, Ma J, Hou Y, Zou H. Anticoagulant therapies versus heparin for the prevention of hemodialysis catheter-related complications: systematic review and meta-analysis of prospective randomized controlled trials. Int J Clin Exp Med. 2015;8:11985-11995. [PubMed] |
| 13. | Hofbauer R, Moser D, Frass M, Oberbauer R, Kaye AD, Wagner O, Kapiotis S, Druml W. Effect of anticoagulation on blood membrane interactions during hemodialysis. Kidney Int. 1999;56:1578-1583. [PubMed] [DOI] |
| 14. | Kellum JA, Lameire N, Aspelin P, Barsoum RS, Burdmann EA, Goldstein SL, Herzog CA, Joannidis M, Kribben A, Levey AS. Kidney Disease: Improving Global Outcomes (KDIGO) Acute Kidney Injury Work Group. KDIGO Clinical Practice Guideline for Acute Kidney Injury. Kidney Int. 2012;Suppl 2:1-138. |
| 15. | Zhang L, Tanaka A, Zhu G, Baldwin I, Eastwood GM, Bellomo R. Patterns and Mechanisms of Artificial Kidney Failure during Continuous Renal Replacement Therapy. Blood Purif. 2016;41:254-263. [PubMed] [DOI] |
| 16. | Khadzhynov D, Schelter C, Lieker I, Mika A, Staeck O, Neumayer HH, Peters H, Slowinski T. Incidence and outcome of metabolic disarrangements consistent with citrate accumulation in critically ill patients undergoing continuous venovenous hemodialysis with regional citrate anticoagulation. J Crit Care. 2014;29:265-271. [PubMed] [DOI] |
| 17. | Zheng Y, Xu Z, Zhu Q, Liu J, Qian J, You H, Gu Y, Hao C, Jiao Z, Ding F. Citrate Pharmacokinetics in Critically Ill Patients with Acute Kidney Injury. PLoS One. 2013;8:e65992. [PubMed] [DOI] |
| 18. | Kramer L, Bauer E, Joukhadar C, Strobl W, Gendo A, Madl C, Gangl A. Citrate pharmacokinetics and metabolism in cirrhotic and noncirrhotic critically ill patients. Crit Care Med. 2003;31:2450-2455. [PubMed] [DOI] |
| 19. | Slowinski T, Morgera S, Joannidis M, Henneberg T, Stocker R, Helset E, Andersson K, Wehner M, Kozik-Jaromin J, Brett S. Safety and efficacy of regional citrate anticoagulation in continuous venovenous hemodialysis in the presence of liver failure: the Liver Citrate Anticoagulation Threshold (L-CAT) observational study. Crit Care. 2015;19:349. [PubMed] [DOI] |
| 20. | Lahmer T, Messer M, Rasch S, Beitz A, Schnappauf C, Schmid RM, Huber W. Sustained low-efficiency dialysis with regional citrate anticoagulation in medical intensive care unit patients with liver failure: A prospective study. J Crit Care. 2015;30:1096-1100. [PubMed] [DOI] |
| 21. | Faybik P, Hetz H, Mitterer G, Krenn CG, Schiefer J, Funk GC, Bacher A. Regional citrate anticoagulation in patients with liver failure supported by a molecular adsorbent recirculating system. Crit Care Med. 2011;39:273-279. [PubMed] [DOI] |
| 22. | Meijers B, Laleman W, Vermeersch P, Nevens F, Wilmer A, Evenepoel P. A prospective randomized open-label crossover trial of regional citrate anticoagulation vs. anticoagulation free liver dialysis by the Molecular Adsorbents Recirculating System. Crit Care. 2012;16:R20. [PubMed] [DOI] |
| 23. | Sentürk E, Esen F, Ozcan PE, Rifai K, Pinarbaşi B, Cakar N, Telci L. The treatment of acute liver failure with fractionated plasma separation and adsorption system: Experience in 85 applications. J Clin Apher. 2010;25:195-201. [PubMed] [DOI] |
| 25. | Qin G, Shao JG, Wang B, Shen Y, Zheng J, Liu XJ, Zhang YY, Liu YM, Qin Y, Wang LJ. Artificial liver support system improves short- and long-term outcomes of patients with HBV-associated acute-on-chronic liver failure: a single-center experience. Medicine (Baltimore). 2014;93:e338. [PubMed] [DOI] |
| 26. | Larsen FS, Schmidt LE, Bernsmeier C, Rasmussen A, Isoniemi H, Patel VC, Triantafyllou E, Bernal W, Auzinger G, Shawcross D. High-volume plasma exchange in patients with acute liver failure: An open randomised controlled trial. J Hepatol. 2016;64:69-78. [PubMed] [DOI] |
| 27. | 冯 志华, 聂 青和, 白 宪光, 白 雪帆, 周 永兴, 贾 战生, 郝 春秋. 膜式血浆置换治疗慢性重症肝炎肝功能衰竭疗效. 世界华人消化杂志. 2002;10:638-641. [DOI] |
| 28. | 杨 黎冰, 仝 静, 祖 晓满, 王 春峰. MELD、Child-Pugh、SOFA评分系统在血浆置换治疗慢加急性肝衰竭中的应用. 世界华人消化杂志. 2017;25:1963-1967. [DOI] |