修回日期: 2018-09-12
接受日期: 2018-09-18
在线出版日期: 2018-10-18
探讨利拉鲁肽联合维生素E对非酒精性脂肪肝(nonalcoholic fatty liver disease, NAFLD)小鼠肝损伤和胰岛素抵抗的改善作用和潜在的机制.
C57BL/6小鼠分为对照组, NAFLD小鼠模型组, 利拉鲁肽治疗组、利拉鲁肽联合维生素E治疗组. 收集各组小鼠血液和肝组织并进行生化和病理检测; 并应用Western blotting检测各组小鼠肝组织IRS-1磷酸化水平.
利拉鲁肽抑制高脂饮食诱导的小鼠体重增加、肥胖、肝细胞肿胀、肝脂质蓄积和胶原纤维沉积、血浆游离脂肪酸、甘油三酯、胆固醇、血清丙氨酸氨基转移酶、天门冬氨酸氨基转移酶、葡萄糖和胰岛素水平以及胰岛素抵抗稳态模型值. Western blotting结果表明, 利拉鲁肽通过激活IRS-1信号通路增加NAFLD小鼠对胰岛素的敏感性. 此外, 维生素E与利拉鲁肽在抗NAFLD具有协同作用.
本研究揭示利拉鲁肽联合维生素E是治疗NAFLD有吸引力的治疗策略.
核心提要: 利拉鲁肽联合维生素E在改善高脂饮食诱导的非酒精性脂肪性肝病小鼠肥胖参数、代谢参数、肝损伤和抑制高脂饮食诱导的肝胰岛素抵抗方面具有协同作用.
引文著录: 宣宁昕, 俞文芹. 利拉鲁肽联合维生素E改善抗非酒精性脂肪肝小鼠肝损伤和胰岛素抵抗的作用及机制研究. 世界华人消化杂志 2018; 26(29): 1688-1695
Revised: September 12, 2018
Accepted: September 18, 2018
Published online: October 18, 2018
To investigate whether liraglutide combined with vitamin E protects against liver injury and insulin resistance in mice with nonalcoholic fatty liver disease (NAFLD) and explore the underlying mechanisms.
C57BL/6 mice were divided into a control group, an NAFLD model group, a liraglutide treated group, and a liraglutide combined with vitamin E treated group. Peripheral blood samples and liver tissues of mice in each group were collected for biochemical and pathological estimations, respectively. Western blot was applied to detect the phosphorylation level of IRS-1 in liver tissues of mice in each group.
Liraglutide attenuated high fat diet (HFD)-induced weight gain, obesity, hepatocellular ballooning, liver lipid accumulation, and collagen fibril deposition and reduced plasma free fatty acid (FFA), triglyceride (TG), total cholesterol (TC), alanine aminotransferase, aspartate aminotransferase, glucose, and insulin levels and homeostasis model of insulin resistance (HOMA-IR) value in mice with NAFLD. Western blot analysis showed that liraglutide increased the sensitivity to insulin by activating the IRS-1 signaling pathway in NAFLD mice. Further, vitamin E and liraglutide had a synergistic anti-NAFLD effect.
This study reveals that liraglutide combined with vitamin E is an attractive therapeutic strategy for the treatment of NAFLD.
- Citation: Xuan NX, Yu WQ. Liraglutide combined with vitamin E alleviates liver injury and insulin resistance in mice with nonalcoholic fatty liver disease. Shijie Huaren Xiaohua Zazhi 2018; 26(29): 1688-1695
- URL: https://www.wjgnet.com/1009-3079/full/v26/i29/1688.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v26.i29.1688
非酒精性脂肪性肝病(nonalcoholic fatty liver disease, NAFLD)指排除饮酒、肝炎病毒等因素, 因代谢异常所致的以肝细胞脂肪变性和脂质蓄积为主要特征的慢性肝疾病. 从全球范围看, NAFLD影响约30%成年人口[1]; 其中, 在欧美等发达国家NAFLD的患病率约25%-30%[2], 虽然我国NAFLD患病率相较西方发达国家低, 但由于近年来人们生活方式和饮食结构的改变, 造成NAFLD的患病率已至15%-20%[3], 尤其以腹型肥胖为特征的人群NAFLD的患病率更是高达75%-100%[4]; 并且, 目前NAFLD已呈现低龄化趋势[5]; 因此, NAFLD己经成为一个世界性公共卫生问题. 目前临床上尚无特效治疗NAFLD的药物, 报道称利拉鲁肽联合维生素E能用于NAFLD的治疗[6], 而关于利拉鲁肽联合维生素E抗NAFLD机制尚未完全清楚, 因此本研究以利拉鲁肽联合维生素E治疗抗NAFLD小鼠, 以寻求其潜在的机制.
1.1.1 实验动物: 40只6 wk龄SPF级C57BL/6小鼠, 饲养于模拟昼夜交替的22-25 ℃环境中, 标准饮水、饮食.
1.1.2 实验试剂: 利拉鲁肽注射液(诺和力)购自丹麦诺和诺德公司;维生素E购自浙江医药股份有限公司; 小鼠胰岛素ELISA试剂盒购自武汉艾美捷科技有限公司; 小鼠丙氨酸氨基转移酶、天门冬氨酸氨基转移酶、高密度脂蛋白-胆固醇、低密度脂蛋白-胆固醇、 游离脂肪酸、甘油、乳酸、血糖、总胆固醇和甘油三脂试剂盒均购自南京建成生物工程研究所有限公司; p-IRS-1(Tyr608)、p-IRS-1(Ser307)、 IRS-1抗体购自美国Cell Signaling Technology公司; β-actin抗体购自江苏碧云天生物技术有限公司.
1.2.1 NAFLD小鼠模型建立与分组: 40只C57BL/6小鼠, 随机分为对照组, 模型组, 利拉鲁肽治疗组、利拉鲁肽联合维生素E治疗组, 每组10只小鼠. 对照组采用普通饲料喂养连续喂养12 wk; 模型组采用高脂饲料(60%普通饲料、35%猪油、5%胆固醇)连续喂养12 wk; 利拉鲁肽治疗组、利拉鲁肽联合维生素E治疗组采用高脂饲料连续喂养12, 但在第8周末利拉鲁肽治疗组每只分别灌胃250 mg/kg·d维生素E, 利拉鲁肽联合维生素E治疗组每只灌胃250 mg/kg·d维生素E和腹腔注射0.6 mg/kg·d利拉鲁肽.
1.2.2 体成分测定: 3%戊巴比妥钠(0.2 mL/100g)麻醉小鼠, 在麻醉状态下, 通过微电脑断层扫描(micro-CT, INVEON, Siemens, TN, 美国), 用自带软件计算对体成分和体重进行分析.
1.2.3 代谢测定: 单独安置小鼠于代谢笼24 h, 测量食物和水的摄入量. 并测量呼吸交换率(RER), 用(VCO2/VO2)表示.
1.2.4 肝功能血液生化检测: 喂养结束后, 3%戊巴比妥钠(0.2 mL/100 g)麻醉小鼠, 收集小鼠下腔静脉血. 血清丙氨酸氨基转移酶(alanine aminotransferase, ALT)、天门冬氨酸氨基转移酶(aspartate aminotransferase, AST)、游离脂肪酸(free fatty acid, FFA)、甘油(glycerol) 、乳酸(lactate)空腹血糖( fasting blood glucose, FBG)、胆固醇(total cholesterol, TC)和甘油三脂(total triglycerides, TG)通过全自动生化分析仪测定; 空腹胰岛素(fasting insulin, FINS) 通过ELISA法测定, 并计算胰岛素抵抗指数(homeostasis assessment of insulin resistance, HOMA-IR) = FBG×FINS/22.5. 葡萄糖耐量试验(glucose tolerance test, GTT) 在喂养高脂饮食12 wk后禁食10 h后, 小鼠体内注射1.5 g葡萄糖/kg后测定; 胰岛素耐受测试(insulin tolerance test, ITT)在非禁食小鼠注射0.5 IU/kg胰岛素后测定.
1.2.5 肝组织TC、TG检测: 喂养结束后, 3%戊巴比妥钠(0.2 mL/100 g)麻醉小鼠, 分离肝组织. 称取100 mg肝组织, 置于1 mL无水乙醇的匀浆介质中, 制备成10%的肝组织匀浆. 4 ℃条件下以12000×g/min离心10 min, 收集上清液. 上清液中TG和TC含量通过全自动生化分析仪测定.
1.2.6 组织切片制备: 取小鼠白色脂肪组织(white adipose tissue, WAT)、褐色脂肪组织(brown adipose tissue, BAT)和肝组织, 脱水, 10%的福尔马林固定, 包埋于新鲜的石蜡中.
1.2.7 油红O染色: 取5 μm厚度的小鼠肝组织切片, 经脱蜡水化后, 10%多聚甲醛固定30min, 双蒸水洗涤30 s, 0.05%Triton-100透膜10 min, 60%异丙醇浸泡30 s, 油红O染色30 min, 60%异丙醇漂洗1 min, 显微镜下拍照.
1.2.8 HE染色: 取5 μm厚度肝组织切片, 经脱蜡水化后, 苏木素染色液浸泡 5 min, 双蒸水洗涤1 min后, 1%盐酸酒精分化30 s, 1%Na2HPO4·12H2O溶液返蓝1 s, 双蒸水洗涤1 min, 1%伊红染色液浸泡3 min, 酒精梯度脱水, 二甲苯透明, 中性树胶封片, 显微镜下观察并拍片.
1.2.9 Masson染色: 取5 μm厚度肝组织切片, 经脱蜡水化后, Weigert苏木精液染核5 min, Masson丽春红复染5 min, 2%冰醋酸浸洗5 s, 1%磷钼酸水溶液分化2 min, 苯胺蓝染色5 min, 0.2%冰醋酸浸洗10 s, 酒精梯度脱水, 二甲苯透明, 中性树胶封片, 显微镜下观察并拍片.
1.2.10 Western blot检测: 肝组织匀浆后, 4℃条件下加入裂解液裂解30 min并12000×g/min离心10 min萃取总蛋白质. 蛋白质经BCA蛋白定量后进行SDS-PAGE电泳, 蛋白电转至PVDF膜. PVDF膜加入5%脱脂牛奶室温放置1 h, 加入相应的一抗, 4 ℃孵育过夜, 随后室温加入对应二抗1 h, 化学发光法显色, 曝光于胶片上, 用Image J进行灰度分析.
统计学处理 实验结果录入SPSS 17.0统计软件处理, 实验结果采用mean±SD表示, 多组间数据的两两比较采用方差分析后post hoc Tukey's test检验, 以P<0.05认定为差异有显著性差异.
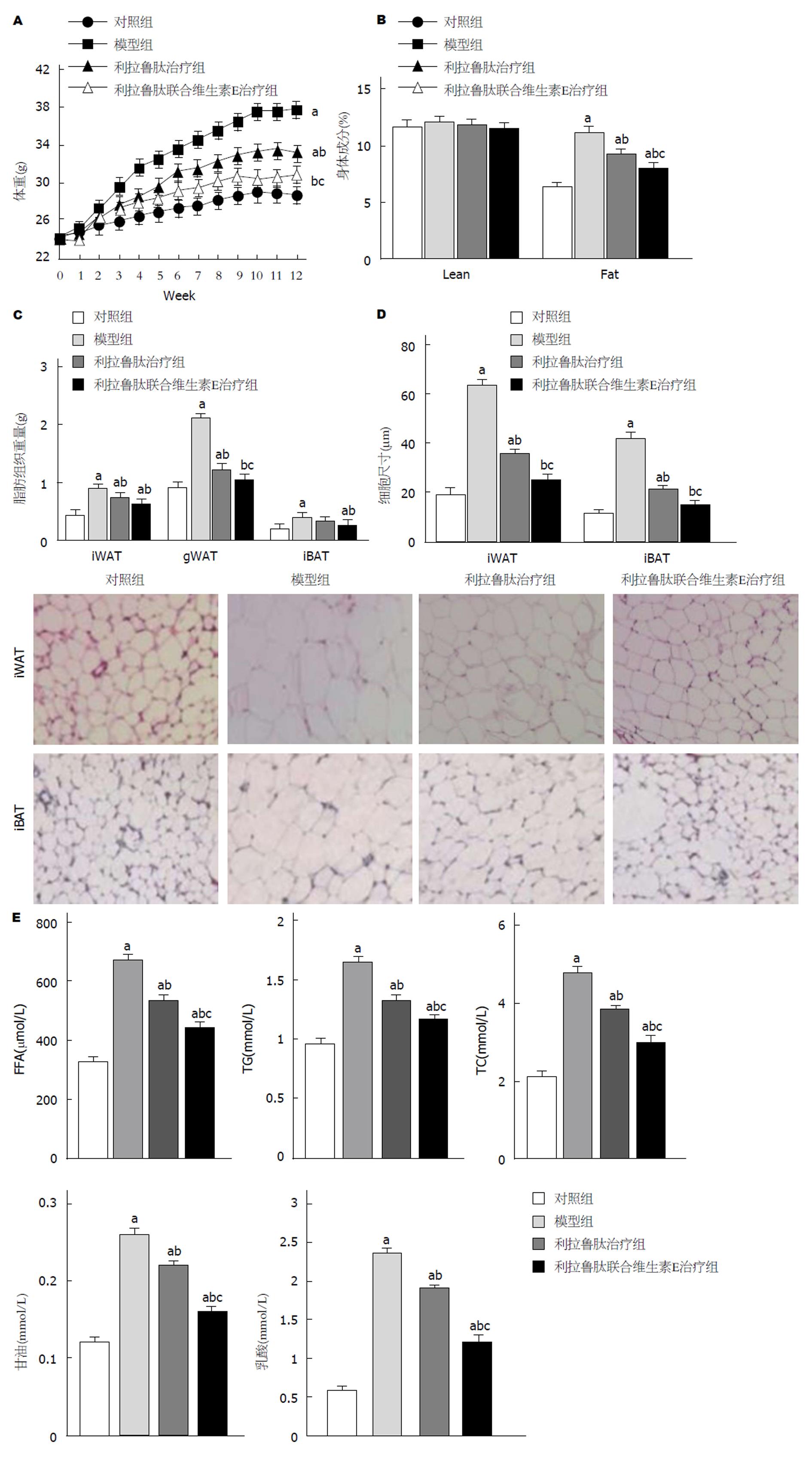
利拉鲁肽或利拉鲁肽联合维生素E均能显著抑制NAFLD小鼠体重质量(图1A)和脂肪质量(均P<0.05)(图1B); 改善NAFLD小鼠脂肪组织形态和组织学形态(均P<0.05), 减少鼠蹊部和肩胛部的脂肪细胞直径(均P<0.05)(图1D); 抑制NAFLD小鼠血浆FFA、TG、TC、甘油和乳酸水平(均P<0.05)(图1E), 且维生素E与利拉鲁肽具有协同作用(均P<0.05). 此外, 利拉鲁肽联合维生素E能抑制鼠蹊部脂肪、性腺部脂肪和肩胛部脂肪质量(均P<0.05).
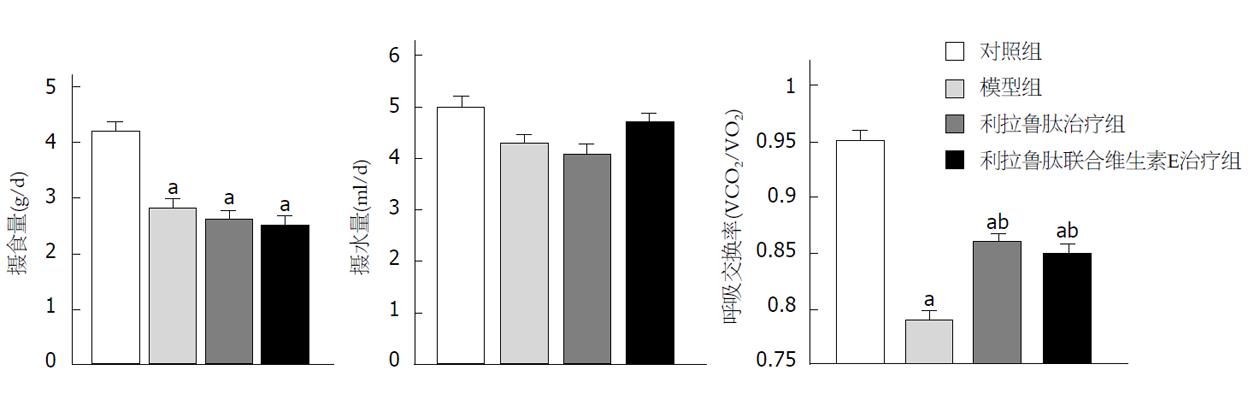
对照组相比, 高脂饮食组小鼠食物摄入量的显著降低(P<0.05); 水摄入量无显著差异(均P>0.05); 与对照组相比, 模型组小鼠的RER显著降低(P<0.05), 与模型组相比, 利拉鲁肽组、利拉鲁肽联合维生素E组小鼠RER显著升高(均P<0.05)(图2).
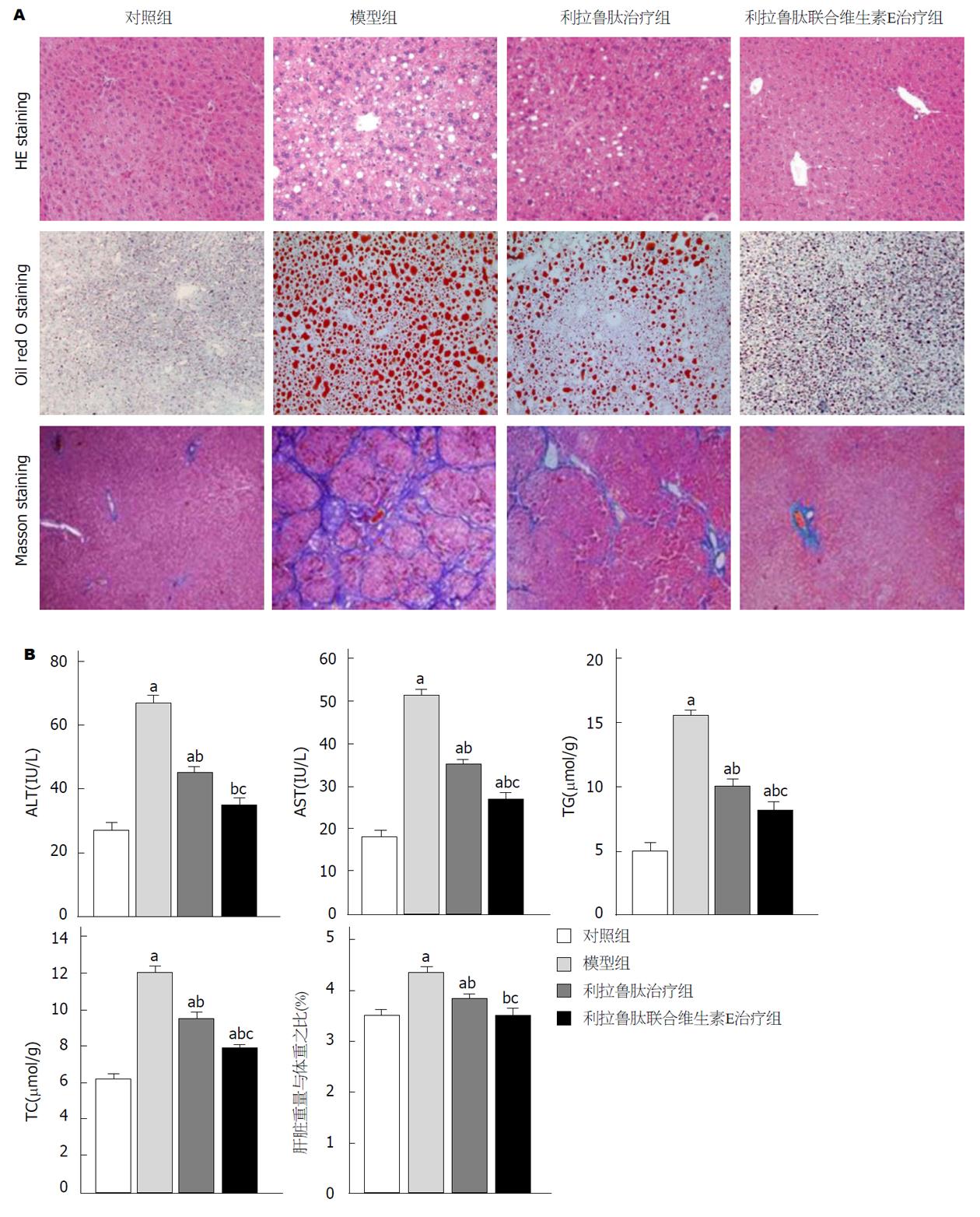
与对照组相比, 模型组小鼠的肝细胞膨胀、炎性细胞浸润、肝细胞脂滴沉积和胶原纤维的沉积, 与模型组相比, 利拉鲁肽或者利拉鲁肽联合维生素E均能抑制这一现象(图3A). 与对照组相比, 模型组小鼠血浆ALT和AST水平、肝TC和TG水平、小鼠肝指数(肝脏重量与体重之比)均显著升高(均P<0.05), 与模型组相比, 利拉鲁肽或利拉鲁肽联合维生素E组以上指标均明显降低(均P<0.05)(图3B), 且维生素E与利拉鲁肽对高脂饮食诱导的小鼠的肝损伤起的保护作用具有协同作用(P<0.05)(图3).
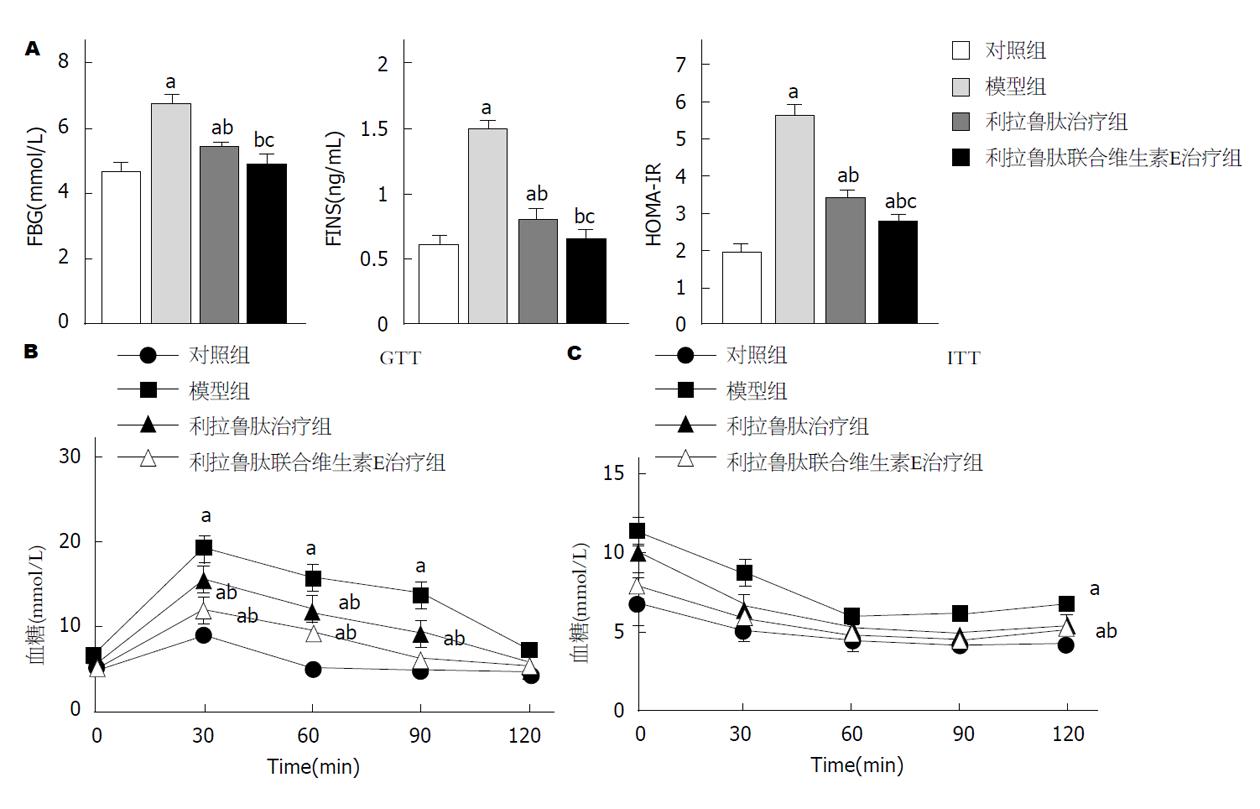
与对照组相比, 模型组小鼠空腹血糖、胰岛素和HOMA-IR值明显升高(均P<0.05); 与模型组相比, 利拉鲁肽或利拉鲁肽联合维生素E治疗后以上指标均明显降低(均P<0.05)(图4A). GTT和ITT结果暗示, 利拉鲁肽组或利拉鲁肽联合维生素E组小鼠能清除葡萄糖或者胰岛素造成的血浆葡萄糖后葡萄糖(图4B和C). 另外, 本实验发现维生素E与利拉鲁肽在改善血清清除和提高胰岛素敏感性方面具有协同作用.
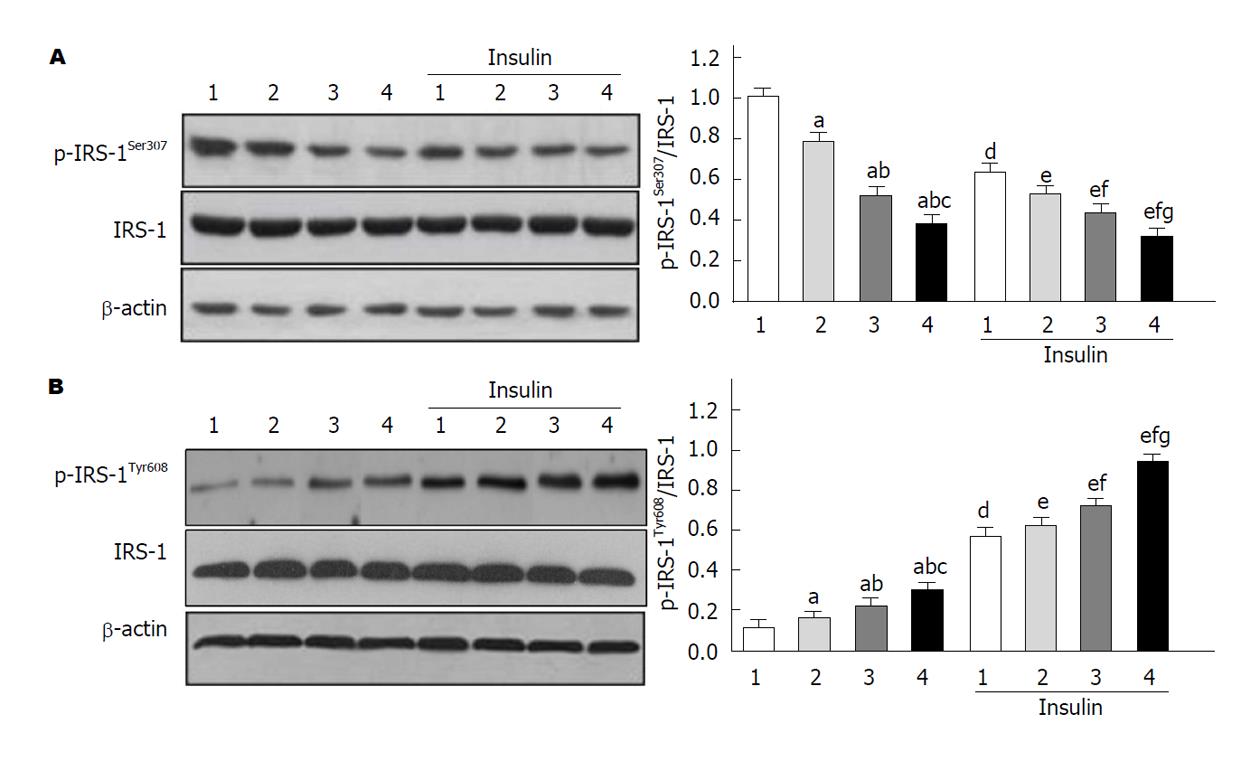
Western blotting显示(图5), 利拉鲁肽或利拉鲁肽联合维生素E治疗的高脂饮食小鼠激活了胰岛素信号, 表现为IRS-1(Tyr608)磷酸化激活(P<0.05)以及IRS-1(Ser307)磷酸化减少(P<0.05); 且, 腹腔注射胰岛素显著诱导胰岛素信号激活(P<0.05), 利拉鲁肽或者利拉鲁肽联合维生素E治疗后进一步增强(P<0.05). 另外, 维生素E与利拉鲁肽在胰岛素信号激活方面具有协同效应.
NAFLD主要由胰岛素抵抗(insulin resistance, IR)诱发的以肝脏脂质蓄积为特征的肝细胞炎症和应激性肝损伤[4,7], 且通常伴发腹型肥胖、高血脂等[4,8]. 本研究发现, 利拉鲁肽或利拉鲁肽联合维生素E能抑制高脂饮食小鼠肥胖, 原因可能是利拉鲁肽或利拉鲁肽联合维生素E抑制高脂饮食诱导脂肪生成与加快脂肪燃烧相关.
目前较为成熟NAFLD的发病机制是"二次打击"学说. 第一次打击主要由胰岛素抵抗造成肝脂质沉积[9], 第二次打击主要由氧化应激和脂质过氧化引起的肝细胞的脂质炎症反应、细胞损伤、坏死和纤维化[10]. 众多文献表明[11,12], TC与TG的异常升高有助于NAFLD的进展. 高脂饮食促进血液中游离FFA增多, 过量循环FFA使得 TG、TC和脂肪酸合成增多[13], 且FFA高水平可引起胰岛素抵抗, 使肝脏脂质代谢紊乱, 最终导致肝脂质沉积[14]. 另外, FFA水平过高, 会造成过量氧自由基(reactive oxygen species, ROS)生成, 随之引起的脂质过氧化反应和内质网应激反应, 造成肝脏损伤[15]. 在本研究中, 模型组小鼠FFA、TG、TC、脂肪酸、血糖、胰岛素和HOMA-IR值升高, 而利拉鲁肽或利拉鲁肽联合维生素E能抑制以上指标. 利拉鲁肽为胰高血糖素样肽-1类似物, 可通过抑制TG、TC和氧化低密度脂蛋白的合成从而改善肝脏的脂质代谢[16]. 而维生素E与利拉鲁肽之所以具有协同作用, 原因可能为维生素E作为抗氧化剂在联合抗NAFLD的过程中抑制ROS生成和减轻脂质过氧化反应和内质网应激反应, 缓解的脂质过氧化反应和内质网应激反应会减轻肝损伤促使功能恢复, 最终反馈调控肝细胞脂质代谢, 造成更低水平的FFA、TG、TC、脂肪酸、血糖、胰岛素和HOMA-IR值, 最终抑制NAFLD.
总之, 拉鲁肽联合维生素E在治疗NAFLD具有协同作用, 其机制可能与抑制脂质过氧化反应和内质网应激反应, 减轻肝损伤和抑制胰岛素抵抗相关.
非酒精性脂肪性肝病(nonalcoholic fatty liver disease, NAFLD)是一个世界性公共卫生问题, 严重威胁着人类生命健康. 近些年其发病率呈现逐年上升趋势, 且发病年龄也呈低龄化趋势.
目前尚有治疗NAFLD的特效药物. 目前, 临床上有使用利拉鲁肽联合维生素E治疗NAFLD. 但关于利拉鲁肽联合维生素E治疗NAFLD的机制尚未清楚.
研究利拉鲁肽联合维生素E对高脂饮食诱导的NAFLD小鼠的肥胖、肝损伤和胰岛素抵抗的治疗作用和分析其机制.
采用高脂饮食建立NAFLD小鼠模型, 应用体成分测定、代谢测定、血液和肝组织生化和病理检测观察利拉鲁肽联合维生素E对NAFLD小鼠肥胖参数、代谢参数、肝损伤参数、肝胰岛素抵抗参数的改善作用以及应用Western blot检测肝组织胰岛素信号通路评估其相关机制.
利拉鲁肽联合维生素E在改善高脂饮食诱导的小鼠肥胖参数、代谢参数、肝损伤和肝胰岛素抵抗方面具有协同作用.
利拉鲁肽联合维生素E在改善NAFLD小鼠肝损伤和胰岛素抵抗具有协同作用, 本研究结果为利拉鲁肽联合维生素E用于治疗NAFLD提供实验依据.
本研究发现拉鲁肽联合维生素E对高脂饮食诱导的NAFLD小鼠减轻肝损伤和抑制胰岛素抵抗具有协同作用. 未来将进一步研究拉鲁肽联合维生素E对高脂饮食诱导的NAFLD小鼠肝脂代谢和内质网应激反应的影响, 为利拉鲁肽联合维生素E用于治疗NAFLD提供更多的实验依据.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): C
D级 (一般): 0
E级 (差): 0
编辑: 崔丽君 电编:张砚梁
| 1. | Wree A, Broderick L, Canbay A, Hoffman HM, Feldstein AE. From NAFLD to NASH to cirrhosis-new insights into disease mechanisms. Nat Rev Gastroenterol Hepatol. 2013;10:627-636. [PubMed] [DOI] |
| 2. | Neuschwander-Tetri BA, Clark JM, Bass NM, Van Natta ML, Unalp-Arida A, Tonascia J, Zein CO, Brunt EM, Kleiner DE, McCullough AJ. Clinical, laboratory and histological associations in adults with nonalcoholic fatty liver disease. Hepatology. 2010;52:913-924. [PubMed] [DOI] |
| 3. | Ofosu A, Ramai D, Reddy M. Non-alcoholic fatty liver disease: controlling an emerging epidemic, challenges, and future directions. Ann Gastroenterol. 2018;31:288-295. [PubMed] [DOI] |
| 4. | Kim JY, Cho J, Yang HR. Biochemical Predictors of Early Onset Non-Alcoholic Fatty Liver Disease in Young Children with Obesity. J Korean Med Sci. 2018;33:e122. [PubMed] [DOI] |
| 5. | Hartmann P, Schnabl B. Risk factors for progression of and treatment options for NAFLD in children. Clin Liver Dis (Hoboken). 2018;11:11-15. [PubMed] [DOI] |
| 6. | Banini BA, Sanyal AJ. Nonalcoholic Fatty Liver Disease: Epidemiology, Pathogenesis, Natural History, Diagnosis, and Current Treatment Options. Clin Med Insights Ther. 2016;8:75-84. [PubMed] |
| 7. | Yan H, Gao YQ, Zhang Y, Wang H, Liu GS, Lei JY. Chlorogenic acid alleviates autophagy and insulin resistance by suppressing JNK pathway in a rat model of nonalcoholic fatty liver disease. J Biosci. 2018;43:287-294. [PubMed] [DOI] |
| 8. | Zhao ZY, Liu D, Cao WJ, Sun M, Song MS, Wang W, Wang YX. Association between IgG N-glycans and Nonalcoholic Fatty Liver Disease in Han Chinese. Biomed Environ Sci. 2018;31:454-458. [PubMed] [DOI] |
| 9. | Guo CH, Chen WL, Liao CH, Huang K, Chen PY, Yang CP. Effects of Chinese Medicinal Formula BNG-1 on Phosphodiesterase 3B Expression, Hepatic Steatosis, and Insulin Resistance in High Fat Diet-induced NAFLD Mice. Int J Med Sci. 2018;15:1194-1202. [PubMed] [DOI] |
| 10. | Tilg H, Moschen AR, Szabo G. Interleukin-1 and inflammasomes in alcoholic liver disease/acute alcoholic hepatitis and nonalcoholic fatty liver disease/nonalcoholic steatohepatitis. Hepatology. 2016;64:955-965. [PubMed] [DOI] |
| 11. | Czech MP. Insulin action and resistance in obesity and type 2 diabetes. Nat Med. 2017;23:804-814. [PubMed] [DOI] |
| 12. | Csak T, Ganz M, Pespisa J, Kodys K, Dolganiuc A, Szabo G. Fatty acid and endotoxin activate inflammasomes in mouse hepatocytes that release danger signals to stimulate immune cells. Hepatology. 2011;54:133-144. [PubMed] [DOI] |
| 13. | Staehr P, Hother-Nielsen O, Landau BR, Chandramouli V, Holst JJ, Beck-Nielsen H. Effects of free fatty acids per se on glucose production, gluconeogenesis, and glycogenolysis. Diabetes. 2003;52:260-267. [PubMed] [DOI] |
| 14. | Samuel VT, Shulman GI. Mechanisms for insulin resistance: common threads and missing links. Cell. 2012;148:852-871. [PubMed] [DOI] |
| 15. | Wu W, Hu X, Zhou X, Klenotic PA, Zhou Q, Lin Z. Myeloid deficiency of CCN3 exacerbates liver injury in a mouse model of nonalcoholic fatty liver disease. J Cell Commun Signal. 2018;12:389-399. [PubMed] [DOI] |
| 16. | Zhao XY, Zhang LL, Suolang QZ, Yang GY, Li L, Li SB, Chen WW. Liraglutide protects against nonalcoholic fatty liver disease in ApoE knockout mice with high-fat diet and silenced Acrp30 by increasing AMPK. Zhonghua Gan Zang Bing Za Zhi. 2014;22:849-853. [PubMed] [DOI] |