修回日期: 2018-08-10
接受日期: 2018-08-21
在线出版日期: 2018-09-08
分析比较四种胃活检幽门螺旋杆菌(Helicobacter pylori, H. pylori)检测方法, 旨在找出一种敏感性, 特异性高且操作便捷的检测方法.
选取490例胃黏膜活检组织标本, 采用快速尿激酶法(rapid urease test, RUT)、荧光定量聚合酶链反应(fluorescence quantitative polymerase chain reaction, qPCR)、硼酸亚甲蓝法和免疫组织化学法(immunohistochemistry, IHC)进行检测, 观察H. pylori的显示情况, 对阳性率进行χ2检验.
RUT、qPCR、硼酸亚甲蓝法和IHC在490例标本中的H. pylori阳性检出率分别为18.98%、63.88%、32.04%和38.16%, 差异具有统计学意义(P<0.005).
IHC检测H. pylori阳性组织, 镜检为H. pylori呈黄褐色而周围胃黏膜组织细胞核呈蓝色, 对比强烈, 更为直观, 有助于实验者获取具有潜在临床应用价值的形态学信息, 且实验操作对仪器、实验人员无特殊要求. 故建议将IHC检测胃活检H. pylori作为指导临床诊断H. pylori感染、实行H. pylori除菌治疗和疗效判断的依据之一.
核心提要: 快速尿激酶法、荧光定量聚合酶链反应、硼酸亚甲蓝法和免疫组织化学法(immunohistochemistry, IHC)对490例胃黏膜标本进行幽门螺旋杆菌(Helicobacter pylori, H. pylori)感染检测.除却特异性和敏感性高, IHC还具备无特殊仪器要求、价格适中、结果便于回顾等优点, 故建议将IHC检测胃活检H. pylori作为指导临床诊断H. pylori感染的依据之一.
引文著录: 陈小岩, 俞训彬, 陈晓琼, 陈泳, 梁玮. 胃组织活检幽门螺旋杆菌检测方法比较. 世界华人消化杂志 2018; 26(25): 1499-1504
Revised: August 10, 2018
Accepted: August 21, 2018
Published online: September 8, 2018
To figure out a method to detect Helicobacter pylori (H. pylori) infection that is of high sensitivity and specificity as well as clinically easy-handling by comparing four common H. pylori detection methods.
Four hundred and ninety gastric mucosa biopsies were tested separately by the rapid urease test (RUT), fluorescence quantitative polymerase chain reaction (qPCR), methylene blue staining, and immunohis-tochemistry (IHC). Positive rates obtained by the different methods were analyzed by the χ2 test.
The positive rates of H. pylori obtained by RUT, qPCR, methylene blue staining, and IHC were 18.98%, 63.88%, 32.04%, and 38.16%, respectively, which were statistically different (P < 0.005).
IHC provides a visual scene for observers, and there is a sharp contrast for IHC images between H. pylori infected and surrounding areas. This feature can facilitate researchers to obtain morphological information with potential clinical value. Furthermore, IHC protocols are friendly to instruments and operators. Hence, we recommend that IHC be used to detect H. pylori in gastric biopsies for diagnosing H. pylori infection and determining H. pylori treatment.
- Citation: Chen XY, Yu XB, Chen XQ, Chen Y, Liang W. Comparison of tests for detecting Helicobacter pylori in gastric biopsy. Shijie Huaren Xiaohua Zazhi 2018; 26(25): 1499-1504
- URL: https://www.wjgnet.com/1009-3079/full/v26/i25/1499.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v26.i25.1499
作为胃癌高发区, 2015年中国胃癌新增病例数约68万例, 死亡数约50万例, 均居恶性肿瘤发病率和死亡率第二位[1], 且多数胃癌患者确诊时已处于晚期, 预后差, 早期确诊并进行治疗对患者有益[2]. 2017年, 第五次全国幽门螺杆菌感染处理共识报告(以下简称第五共识)更是将根除H. pylori作为局部阶段(LuganoⅠ/Ⅱ期)胃黏膜相关淋巴组织(mucosal associated lymphoid tissue, MALT)淋巴瘤的一线治疗; 根除幽门螺旋杆菌(Helicobacter pylori, H. pylori)可显著改善胃黏膜炎症反应, 阻止或延缓胃黏膜萎缩[3-5]. 因此, H. pylori感染的诊断和治疗对上述疾病的诊断和治疗至关重要. 依赖胃镜取材的侵入性H. pylori感染的检测方法包括组织学检测[HE、硼酸亚甲蓝染色、免疫组织化学法(immunohistochemistry, IHC)等]、微生物培养、RUT, 上述检测方法各有优缺点[6-8]. 当前社会工作压力大, 生活节奏快, 胃病患者逐年增加.为满足临床诊断需求, 寻找一种高敏感性和特异性的H. pylori检测方法显得十分必要. 本研究对490例胃黏膜活检组织标本采用采用快速尿激酶法(rapid urease test, RUT)、荧光定量聚合酶链反应(fluorescence quantitative polymerase chain reaction, qPCR)硼酸亚甲蓝染色法及IHC进行检测, 旨在找到敏感性和特异性高又便于临床操作的检测方法.
选取2014-08-06/2014-11-11于福建省福州市省立医院就诊的患者胃黏膜活检组织标本, 共490例.慢性浅表性胃炎47例, 其中男性26例, 女性21例; 年龄17-62岁, 平均年龄37.7岁±9.7岁; 萎缩性胃炎443例, 其中男性214例, 女性229例; 年龄19岁-81岁, 平均年龄51.7岁±10.8岁. 胃镜活检部位均在胃窦部, 每例均钳取3块以上标本. 一块用于IHC检测、HE染色和硼酸亚甲蓝染色, 标本需经10%中性福尔马林固定, 常规石蜡包埋, 4 μm厚连续切片备用; 其余两块新鲜组织标本分别用于RUT和qPCR检测, qPCR检测所用标本需放入液氮冻存待用. 本研究已经本院伦理委员会批准同意. 已告知所有研究对象及其家属本研究的流程及相关事宜, 所有家属及研究对象本人已签订同意书, 并表示自愿参与本研究.
RUT试剂盒购自福建三强生物化工有限公司; 微生物DNA提取试剂盒购自QIAGEN公司; H. pylori qPCR试剂盒购自中山大学达安基因股份有限公司; H. pylori抗体(克隆号: MX014)和硼酸亚甲蓝试剂购自福州迈新生物技术开发有限公司.
RUT、qPCR、硼酸亚甲蓝法和IHC操作步骤均严格按照试剂盒说明书进行, 其中IHC采用MaxVisionTM/HRP一步法染色.
所有检测方法的结果均为定性判断. RUT: 试剂颜色由淡黄色变为淡粉色/粉红色则判定为H. pylori阳性. qPCR: 在质控品正常反应的前提下, 样品的增长曲线呈S型判定为H. pylori阳性. 特殊染色法: 在组织背景为蓝色的前提下, 在胃小凹、腺腔或间质中观察到散在、簇状、点状分布的弯曲状、S状、螺旋状、球状蓝色细菌(硼酸亚甲蓝染色法)/棕黄色细菌(IHC)判定为H. pylori阳性. 组织学染色法结果均由两名高年资病理医师采用双盲法独立阅片并取均值.
统计学处理 采用SPSS 22.0统计软件进行数据分析. 采用配对设计的χ2检验进行不同方法之间的检出率比较. P<0.05为差异有统计学意义.
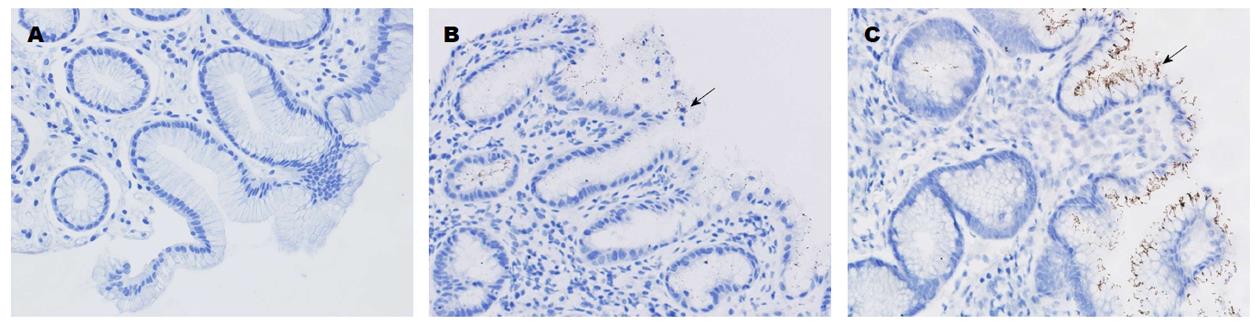
490例活检病例中, 187例IHC阳性, 303例IHC阴性. 经统计和分析发现H. pylori IHC阳性主要分布于胃小凹腺腔内、黏膜表面黏液中以及与细胞膜相连的界泡和固有层中, 以弯曲状、S状、螺旋状呈散在、簇状、点状分布. 偶见H. pylori形态为球形, 此形态H. pylori主要存在于上皮细胞细胞层和胃黏膜固有层. 而IHC检测H. pylori结果为阴性的病例, 镜检未见棕黄色菌体(图1).
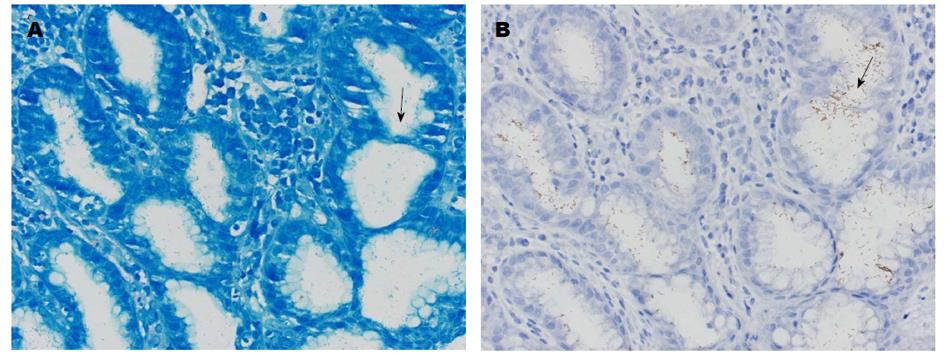
RUT、qPCR、硼酸亚甲蓝染色法和IHC阳性检出率分别为18.98%、63.88%、32.04%和38.16%. 硼酸亚甲蓝染色法和IHC阳性表达见图2. IHC与RUT、qPCR和硼酸亚甲蓝染色法的检出率均有显著差异, 结果有统计学意义(表1和2). 四种方法中qPCR的阳性检出率性最高, 其次是IHC, RUT阳性检出率最低; 相比硼酸亚甲蓝染色法, IHC法H. pylori形态更易观察, 敏感性和特异性更高.
| 胃活检组织 | 阳性率 | ||
| 阳性例数 | 阴性例数 | ||
| RUT | 93 | 397 | 18.98% |
| qPCR | 313 | 177 | 63.88% |
| 硼酸亚甲蓝法 | 157 | 333 | 32.04% |
| IHC | 187 | 303 | 38.16% |
自证实H. pylori与慢性胃炎、胃溃疡、胃癌等的发生密切相关以来, H. pylori感染的检测已成为确定临床治疗方法的必检项目, 因此亟需一种相对准确、可靠且经济实用的检测方法.
根据第五共识: 临床上应用的侵入性H. pylori检测方法中, RUT是最为推荐的方法[9]; 活动性炎症反应的存在高度提示H. pylori感染, 如常规组织学染色未发现H. pylori, 可进行特殊染色检查[10]. 目前常用的特殊染色法, 包括Warthin-Starry银染法、硼酸亚甲蓝法和IHC[11,12]. 由于Warthin-Starry银染法存在染液配置和实验步骤繁琐等缺点, 故本文不做讨论. qPCR因其高特异性和敏感性近年来备受关注[13]. 因此, 本实验选取的RUT、qPCR、硼酸亚甲蓝法和IHC这四种检测方法进行分析比较.
虽然RUT有操作简便、试剂便宜的优点, 但除H. pylori外, 消化道中还有其他常见细菌可产生尿素酶[14], 从而影响实验结果, 且RUT检测受标本内细菌密度、试剂灵敏度和RUT反应时间等影响, 漏检率较高[15]. 而硼酸亚甲蓝法中, H. pylori菌体与周围的组织背景对比不明显, 判读不易, 漏诊率也不低. Schabereiter等[13]人的实验表明: qPCR对活检组织中的H. pylori敏感性和特异性高达100%和98%, 该结果与本实验中"qPCR对H. pylori的阳性检出率最高"的现象相符. 但近期文献表明, qPCR的实验结果, 很大程度取决于实验人员的操作、仪器、反应试剂和分析数据所用软件的选择[15], 因此, qPCR对仪器、操作人员的要求比起其他检测方法要高许多, 上述几点出现任何纰漏都可能造成假阳性或假阴性结果. 此外, qPCR还存在诸多不便之处, 例如: 使用的材料在提取DNA前要超低温保存和运输、原材料不能长期保存、操作过程中需要使用液氮不够简便和安全、微生物DNA提取试剂盒费用昂贵、提取的DNA保存不当会影响实验结果[16]等. 反观IHC, 其检测结果与qPCR检测结果具有一定的一致性: IHC使用的一抗是单克隆抗H. pylori IgG, 特异性高[7], 且结果中H. pylori呈黄褐色而周围胃黏膜组织细胞核呈蓝色, 对比强烈, 更为直观, 有助于实验者获取具有潜在临床应用价值的形态学信息. , 尽管在490例胃黏膜活检的检测中, IHC的阳性检出率为38.16%, 低于qPCR, 敏感性稍显不足, 但IHC具备无特殊仪器要求、价格适中、标本包埋为蜡块后可长期保存、便于回顾等优点, 适用于各大医疗检测场所. 实验中126例qPCR和IHC检测结果不一致的病例, qPCR检测结果是否存在假阳性, 由于技术、费用限制, 尚待进一步研究考证.
Wang等[17]对224位胃病患者进行研究分析后更是建议对于不明原因的胃炎或前期进行过H. pylori根除手术的患者, IHC应作为常规检测方法. 而本实验通过对490例胃黏膜活检进行检测, 结果分析表明: IHC检测H. pylori感染具有特异性和敏感性较高、操作安全、容易判读、无特殊仪器要求等优点, 这些都是其他检测方法无法企及的, 故笔者建议将IHC检测H. pylori作为指导临床诊断H. pylori感染、实行H. pylori除菌治疗和疗效判断的依据之一.
据统计, 2015年中国胃癌新增病例数和因胃癌死亡数均居我国恶性肿瘤发病率和死亡率前列, 早期确诊并进行治疗对患者有益. 而临床上, 目前仍缺少一种敏感性和特异性高、便于临床操作的检测方法.
通过快速尿激酶法(rapid urease test, RUT)、荧光定量聚合酶链反应(fluorescence quantitative polymerase chain reaction, qPCR)、硼酸亚甲蓝法和免疫组织化学法(immunohistochemistry, IHC)这四种常用检测方法操作、仪器需求和实验结果的比较, 选择一种敏感、特异、操作简便的检测方法.
在RUT、qPCR、硼酸亚甲蓝法和IHC这四种检测方法中, 找到一种敏感、特异、操作简便的检测方法, 为临床检测和患者提供更好的服务.
RUT、qPCR、硼酸亚甲蓝法和IHC分别检测490例胃黏膜样本中幽门螺旋杆菌(Helicobacter pylori, H. pylori)感染情况, 采用配对设计的χ2检验对结果进行数据统计分析.
研究达到预期目标, RUT、qPCR、硼酸亚甲蓝法和IHC在490例标本中的H. pylori阳性检出率分别为18.98%、63.88%、32.04%和38.16%. IHC在敏感性、特异性较优的前提下, 还具备便于操作、对仪器无特殊要求、结果便于回顾等优点.
建议将IHC检测H. pylori作为指导临床诊断H. pylori感染的依据之一.
在条件允许的情况下, 未来可以对实验中126例qPCR和IHC检测结果不符的病例, 进行测序, 在更深层次探讨qPCR和IHC检测的准确性及临床意义.
学科分类: 胃肠病学和肝病学
手稿来源地: 福建省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): 0
D级 (一般): D
E级 (差): 0
编辑: 崔丽君 电编:张砚梁
| 1. | Chen W, Zheng R, Baade PD, Zhang S, Zeng H, Bray F, Jemal A, Yu XQ, He J. Cancer statistics in China, 2015. CA Cancer J Clin. 2016;66:115-132. [PubMed] [DOI] |
| 3. | Liu WZ, Xie Y, Lu H, Cheng H, Zeng ZR, Zhou LY, Chen Y, Wang JB, Du YQ, Lu NH; Chinese Society of Gastroenterology, Chinese Study Group on Helicobacter pylori and Peptic Ulcer. Fifth Chinese National Consensus Report on the management of Helicobacter pylori infection. Helicobacter. 2018;23:e12475. [PubMed] [DOI] |
| 4. | Venerito M, Malfertheiner P. Preneoplastic conditions in the stomach: always a point of no return? Dig Dis. 2015;33:5-10. [PubMed] [DOI] |
| 5. | Zhou L, Lin S, Ding S, Huang X, Jin Z, Cui R, Meng L, Li Y, Zhang L, Guo C. Relationship of Helicobacter pylori eradication with gastric cancer and gastric mucosal histological changes: a 10-year follow-up study. Chin Med J (Engl). 2014;127:1454-1458. [PubMed] |
| 6. | Atkinson NS, Braden B. Helicobacter pylori Infection: Diagnostic Strategies in Primary Diagnosis and After Therapy. Dig Dis Sci. 2016;61:19-24. [PubMed] [DOI] |
| 7. | Lee JY, Kim N. Diagnosis of Helicobacter pylori by invasive test: histology. Ann Transl Med. 2015;3:10. [PubMed] [DOI] |
| 8. | Tian XY, Zhu H, Zhao J, She Q, Zhang GX. Diagnostic performance of urea breath test, rapid urea test, and histology for Helicobacter pylori infection in patients with partial gastrectomy: a meta-analysis. J Clin Gastroenterol. 2012;46:285-292. [PubMed] [DOI] |
| 9. | Uotani T, Graham DY. Diagnosis of Helicobacter pylori using the rapid urease test. Ann Transl Med. 2015;3:9. [PubMed] [DOI] |
| 10. | Panarelli NC, Ross DS, Bernheim OE, Landzberg ZB, Schuetz AN, Jenkins SG, Landzberg BR, Jessurun J, Yantiss RK. Utility of ancillary stains for Helicobacter pylori in near-normal gastric biopsies. Hum Pathol. 2015;46:397-403. [PubMed] [DOI] |
| 11. | Batts KP, Ketover S, Kakar S, Krasinskas AM, Mitchell KA, Wilcox R, Westerhoff M, Rank J, Gibson J, Mattia AR. Appropriate use of special stains for identifying Helicobacter pylori: Recommendations from the Rodger C. Haggitt Gastrointestinal Pathology Society. Am J Surg Pathol. 2013;37:e12-e22. [PubMed] [DOI] |
| 12. | 中华医学会. 临床技术操作规范•病理学分册(第1版). 北京: 人民军医出版社 2004; 140-141. |
| 13. | Schabereiter-Gurtner C, Hirschl AM, Dragosics B, Hufnagl P, Puz S, Kovách Z, Rotter M, Makristathis A. Novel real-time PCR assay for detection of Helicobacter pylori infection and simultaneous clarithromycin susceptibility testing of stool and biopsy specimens. J Clin Microbiol. 2004;42:4512-4518. [PubMed] [DOI] |
| 14. | Mobley HL, Island MD, Hausinger RP. Molecular biology of microbial ureases. Microbiol Rev. 1995;59:451-480. [PubMed] |
| 15. | Archimandritis A, Tzivras M, Sougioultzis S, Papaparaskevas I, Apostolopoulos P, Avlami A, Davaris PS. Rapid urease test is less sensitive than histology in diagnosing Helicobacter pylori infection in patients with non-variceal upper gastrointestinal bleeding. J Gastroenterol Hepatol. 2000;15:369-373. [PubMed] [DOI] |
| 16. | Cukier HN, Pericak-Vance MA, Gilbert JR, Hedges DJ. Sample degradation leads to false-positive copy number variation calls in multiplex real-time polymerase chain reaction assays. Anal Biochem. 2009;386:288-290. [PubMed] [DOI] |
| 17. | Wang XI, Zhang S, Abreo F, Thomas J. The role of routine immunohistochemistry for Helicobacter pylori in gastric biopsy. Ann Diagn Pathol. 2010;14:256-259. [PubMed] [DOI] |