修回日期: 2018-07-27
接受日期: 2018-08-01
在线出版日期: 2018-08-28
研究H2S对大鼠胃缺血再灌注(gastric ischemia-reperfusion, GI-R)引发氧化应激的影响及可能机制.
实验采用夹闭腹主动脉30 min再灌注1 h的方法建立大鼠GI-R损伤模型. 在此基础上, 提前给予大鼠不同浓度NaHS腹腔注射14 d预处理后, Image J分析胃黏膜损伤大体面积, 采用HE染色测定胃黏膜损伤深度. 分别通过试剂盒和Western blot方法检测胃黏膜组织中氧化应激相关指标.
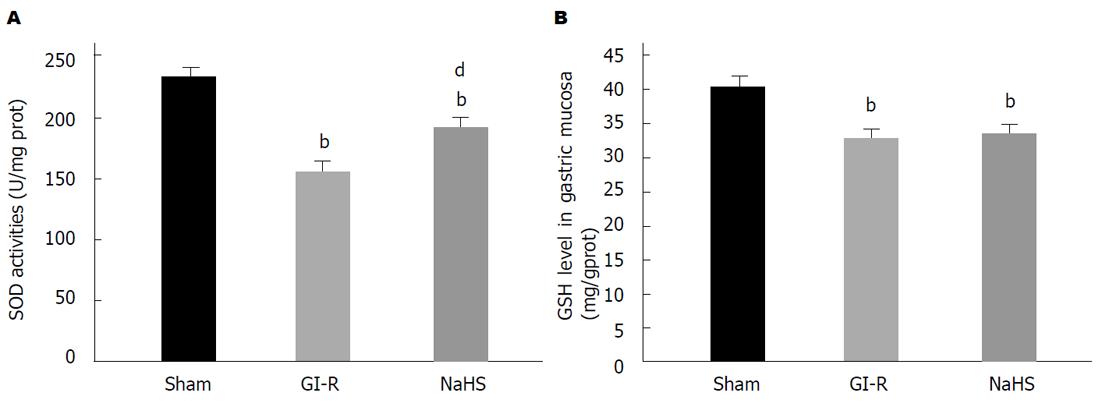
不同浓度的NaHS对GI-R后胃黏膜损伤的影响不同, 其中10 μmol/L NaHS预处理尽管不影响大鼠血浆中H2S浓度, 但显著减少GI-R诱发的胃黏膜面积和损伤深度. 与GI-R组相比, NaHS预处理组中丙二醛, H2O2水平以及XOD, gp91phox, p67phox表达明显降低, 同时, 还原性谷胱甘肽水平和SOD活性显著增加.
外源性H2S通过减少GI-R引起的氧化应激, 对胃黏膜起保护作用.
核心提要: 各种应激因素可引起胃黏膜缺血性改变, 从而引发胃黏膜损伤, 其机制与胃的缺血再灌注密切相关. 本研究表明外源给予H2S处理可有效降低胃缺血再灌注(gastric ischemia-reperfusion, GI-R)引起的氧化应激, 从而对抗GI-R保护胃黏膜.
引文著录: 崔洁, 邹吉贺, 刘磊, 石玥, 乔伟丽, 闫长栋. H2S对缺血再灌注引发胃黏膜损伤的作用研究. 世界华人消化杂志 2018; 26(24): 1448-1454
Revised: July 27, 2018
Accepted: August 1, 2018
Published online: August 28, 2018
To assess the effect of H2S on oxidative stress in gastric mucosal injury induced by gastric ischemia-reperfusion (GI-R) in rats.
GI-R was induced in rats by clamping the celiac artery for 30 min followed by 1 h reperfusion. Based on this, the rats were intraperitoneally pre-injected with different concentrations of NaHS for 14 d. Image J software and HE staining were employed to analyze the gastric mucosal damage area and deep damage, respectively. Oxidative stress indexes of the gastric mucosa were detected using commercial kits and Western blot.
The effects of different concentrations of NaHS on gastric mucosal injury induced by GI-R were different. Pretreatment with 10 μmol/L NaHS significantly reduced the area and depth of gastric mucosal injury induced by GI-R, with no effect on plasma H2S. Compared with the GI-R group, pretreatment with NaHS significantly decreased the levels of malondialdehyde and H2O2 as well as the expression of XOD, gp91phox, and p67phox, but increased the level of reduced glutathione and the activity of SOD.
Exogenous H2S can protect the gastric mucosa by reducing oxidative stress induced by GI-R.
- Citation: Cui J, Zou JH, Liu L, Shi Y, Qiao WL, Yan CD. Effect of H2S on gastric ischemia-reperfusion injury in rats. Shijie Huaren Xiaohua Zazhi 2018; 26(24): 1448-1454
- URL: https://www.wjgnet.com/1009-3079/full/v26/i24/1448.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v26.i24.1448
胃缺血再灌注(gastric ischemia-reperfusion, GI-R)损伤是临床最常见的组织器官损伤之一, 其发生与胃黏膜氧自由基生成过多, 细胞内钙超载, 胃酸分泌增加以及胃循环功能障碍等多种因素有关[1-3]. 因此, 防治GI-R损伤一直是研究关注的重点.
我们的前期研究结果表明, 外源性给予硫化氢(hydrogen sulfide, H2S)可通过激活KATP通道有效减轻GI-R引起的胃黏膜损伤[4]. 然而, 缺血再灌注过程中炎症因子释放以及活性氧的生成所诱发的细胞凋亡是导致胃黏膜损伤的重要原因之一. 内源性的H2S可通过氧化应激通路减轻GI-R损伤[5]. 因此, 外源给予H2S减轻GI-R的作用机制有待进一步的阐明. 已有的研究表明, H2S在心脏、肾脏等多种器官缺血再灌注损伤中发挥抗炎、抗氧化以及抗凋亡的作用[6-9]. 鉴于氧自由基过量生成是GI-R诱发胃黏膜损伤的首要机制之一. 因此, 本实验采用大鼠GI-R损伤模型, 给予外源性的H2S干预, 探讨H2S在GI-R损伤过程中的调控机制.
健康雄性200-250 gSD大鼠, 由徐州医科大学实验动物中心提供. 大鼠随机分为3组, 术前禁食24 h: (1)假手术(sham)组: 开腹分离大鼠腹主动脉, 不夹闭, 1 h 30 min后将胃取出用于实验; (2)GI-R组: 术前腹腔注射生理盐水预处理大鼠14 d, 开腹分离其腹主动脉, 动脉夹夹闭30 min模拟胃缺血, 松开动脉夹模拟复灌1 h后[10]将胃取出用于实验; (3)NaHS组: 术前给予大鼠NaHS腹腔注射预处理14 d, 开腹分离腹主动脉, 动脉夹夹闭动脉夹夹闭30 min模拟胃缺血, 松开动脉夹模拟复灌1 h后将胃取出用于实验.
NaHS购自美国Sigma公司, 溶于生理盐水中使用. 总超氧岐化酶SOD试剂盒, 丙二醛(malondialdehyde, MDA)试剂盒, 还原性谷胱甘肽(reduced glutathione, GSH)测定试剂盒, H2O2测定试剂盒以及BCA蛋白浓度测定试剂盒均购自南京建成生物工程研究所. 黄嘌呤氧化酶(Xanthine Oxidase, XOD), 烟酰胺腺嘌呤二核苷磷酸氧化酶(Nicotinamide adenine dinucleotide phosphate oxidases, NOX)亚基p67, p47及p22抗体购自美国SantaCruz Biotechnology. NOXgp91和SOD抗体购自美国Abcom公司. 山羊抗鼠和山羊抗兔二抗购自北京中杉金桥生物技术有限公司. 蛋白提取试剂盒购自南京碧云天生物技术研究所. 聚偏氟乙烯(PVDF)膜购自美国Millipore公司. 其他试剂为国产分析纯.
1.2.1 大鼠GI-R模型制备: 采用腹腔注射戊巴比妥钠(50 mg/kg)的方法麻醉大鼠后, 将其固定于37 ℃手术台上, 沿腹白线行开腹手术, 分离腹主动脉, 动脉夹将其夹闭模拟胃缺血30 min后, 松开恢复主动脉血流模拟胃复灌1 h.
1.2.2 大鼠GI-R胃黏膜大体损伤面积测定: 大鼠GI-R模型完成后将胃取出, 用组织剪将胃沿胃大弯剪开, 并用生理盐水冲洗干净后将胃展平固定, 拍照, 利用ImageJ图像处理软件中自由选择工具对胃黏膜的损伤部位和腺胃区总面积进行选择和面积测定并计算胃黏膜大体损伤面积, 即胃黏膜大体损伤面积(%) = 腺胃区黏膜出血和糜烂区域大小/腺胃区总面积.
1.2.3 大鼠GI-R胃黏膜病理损伤深度测定: 取5 mm大鼠胃体部(包括胃大、小弯)胃壁组织, 固定切片后, 行HE染色, 参考Mascuda的标准[11]采用显微镜下计算胃黏膜损伤深度的方法, 即: 正常为0分; 表层上皮损伤为1分; 胃黏膜浅层充血和水肿为2分; 胃黏膜深层充血、出血及水肿为3分; 胃黏膜浅层腺体紊乱或坏死为4分; 胃黏膜深层的坏死与溃疡为5分.
1.2.4 血浆中H2S浓度测定: 根据已发表论文[4,5], 采用比色法测定血浆中H2S浓度, 并用NaHS标准曲线校正.
1.2.5 Western blotting测定胃黏膜组织中蛋白表达: 参照BCA试剂盒操作方法提取胃黏膜中总蛋白, 并测定蛋白浓度. 利用SDS-聚丙烯酰胺凝胶电泳将等量蛋白样品分离后转移到甲醛预处理过的PVDF膜上, 牛奶封闭, 加一抗, 4 ℃孵育过夜, PBS冲洗, 二抗室温孵育1 h, NBT/BCIP显色. 利用ImageJ图像分析软件计算蛋白表达灰度值以表示目的蛋白相对表达量.
胃黏膜组织中MDA, GSH, H2O2含量测定以及SOD活性测定均参照试剂盒说明操作.
统计学处理 数据用GraphPad Prism 5.0统计分析软件进行统计学分析, 所有数据以mean±SD表示, 多组间比较采用方差分析, P<0.05代表差异具有统计学意义.
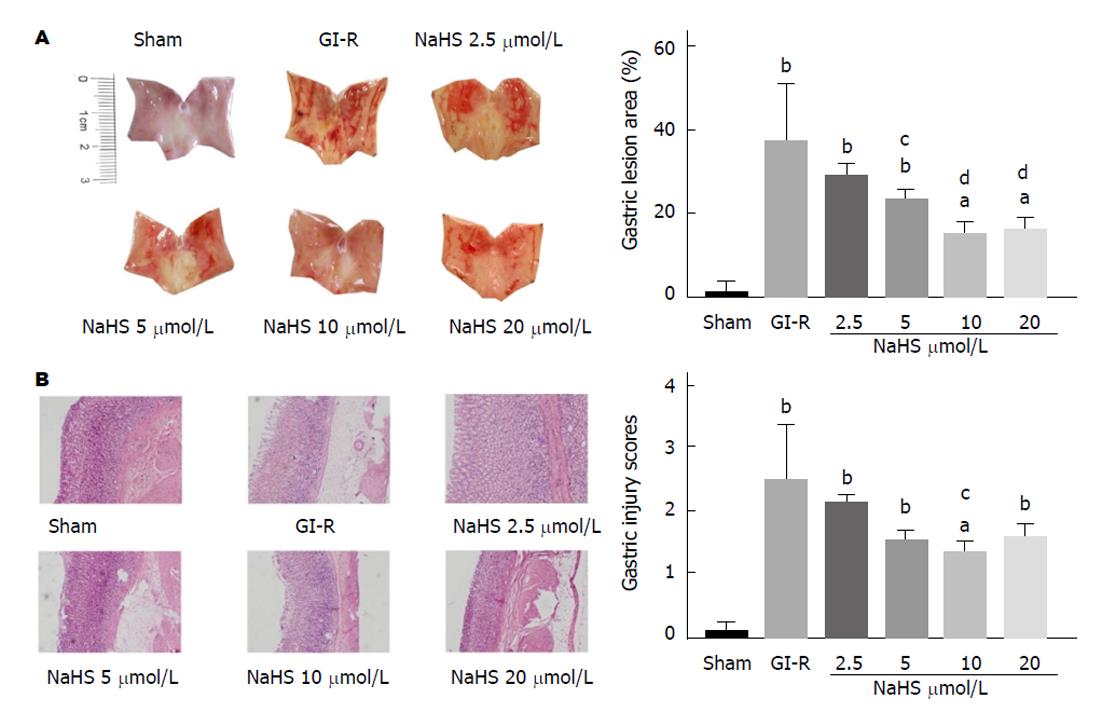
GI-R引起的胃黏膜损伤包括损伤大体面积以及HE染色显示的组织损伤. Sham组中胃黏膜表面以及组织内部未见明显异常. 如图1A所示, GI-R组中胃黏膜表明可见明显出血、水肿, 甚至有片状坏死区域, 同时HE染色显示, GI-R导致胃黏膜组织表层及内部出血、腺体排列紊乱甚至糜烂, 并伴有炎症细胞的浸润(见图1B). 给予NaHS预处理后, GI-R引起的胃黏膜损伤随NaHS浓度的增加而逐渐减轻, 其中以10 μmol/L的NaHS作用最为显著(图1), 因此以下按照10 μmol/L的NaHS预处理探讨外源性H2S减轻GI-R引起胃黏膜损伤的具体机制.
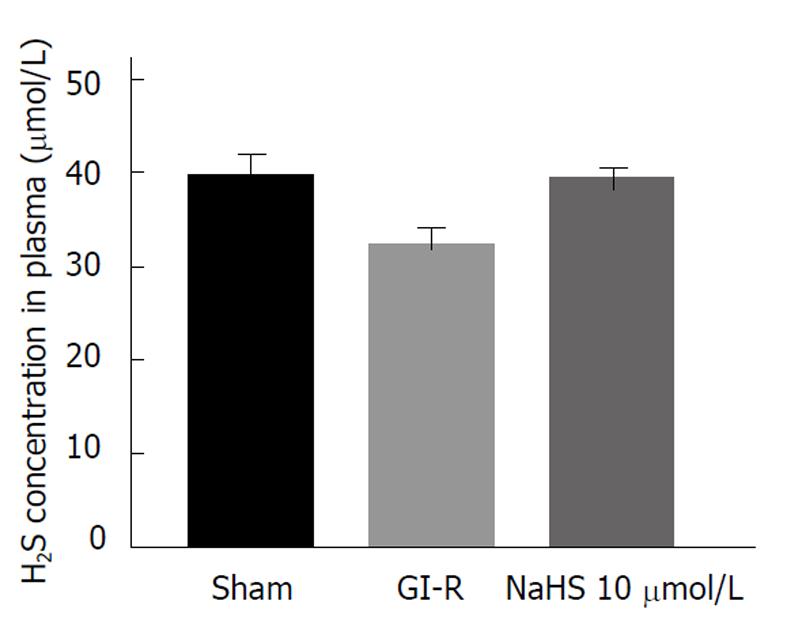
与Sham组比较, 血浆中H2S浓度在GI-R中稍有降低, 但没有统计学差异. 此外, 外源性给予GI-R大鼠10 μmol/L的NaHS预处理对其血浆中H2S浓度无明显影响作用(图2).
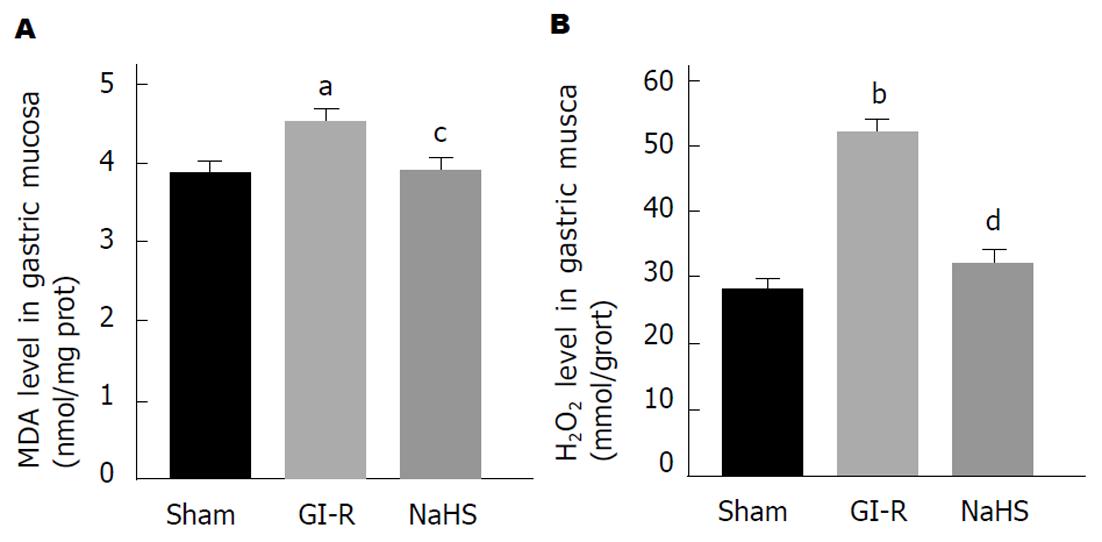
如图3所示, 与Sham组比较, GI-R显著增加大鼠胃黏膜组织中MDA和H2O2含量, 然而, NaHS预处理大鼠可明显抑制GI-R引起的胃黏膜组织中MDA和H2O2水平增高.
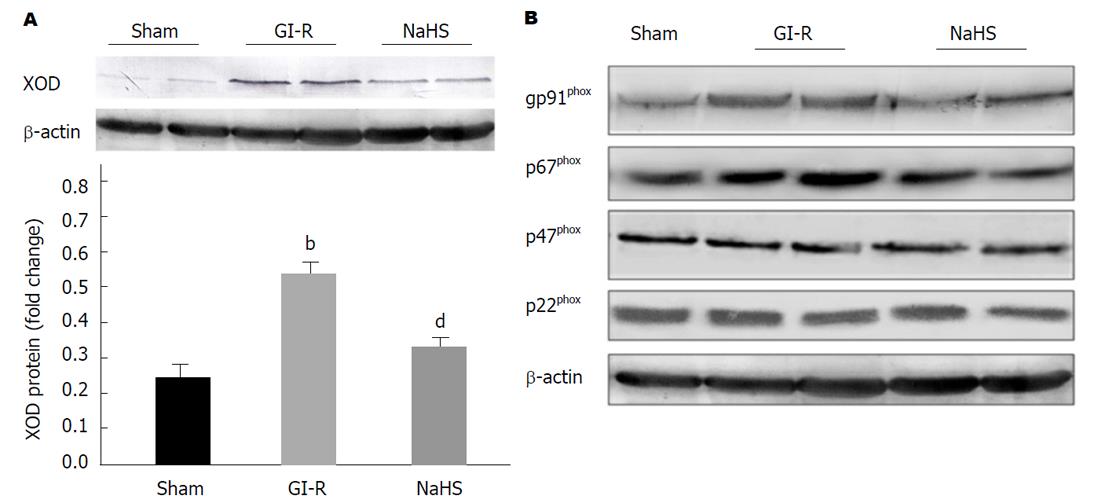
Sham组大鼠胃黏膜组织中XOD含量较少, GI-R处理后明显促使胃黏膜组织中XOD表达增加. 然而, GI-R增加XOD表达受NaHS预处理抑制明显(见图4A). 如图4B所示, 与sham组比较, GI-R对NOX亚基gp91phox和p67phox表达增加显著, 而对p47phox和p22phox影响无明显差异. 与此同时, NaHS预处理大鼠14 d后, GI-R对gp91phox和p67phox表达增加受到明显抑制, 同样对p47phox和p22phox的蛋白表达无明显影响.
缺血再灌注损伤是临床上常见的组织器官损伤, 如何有效的减轻缺血再灌注引发的组织器官损伤是科研人员研究的重点和亟待解决的问题. H2S作为机体中的信号分子, 在许多的生理病理过程中发挥作用. 有研究表明, 外源性给予H2S前体NaHS可通过KATP通道减轻GI-R后的胃黏膜损伤[4]. 同时, 利用内源性H2S合成抑制剂可增强胃黏膜中的氧化应激过程加重GI-R损伤[5]. 我们的研究结果显示, 外源性给予H2S前体NaHS预处理的浓度不同, 其对抗GI-R引起的胃黏膜损伤面积的效果有所差别. 低浓度的NaHS对胃黏膜的保护作用不明显, 然而, 10 μmol/L和20 μmol/L的NaHS预处理均能显著对抗GI-R损伤, 起到保护胃黏膜的作用(图1A). 同样的, 不同浓度的NaHS对胃黏膜病理深度损伤得分也不尽相同, 10 μmol/L的NaHS预处理显著保护胃黏膜, 明显减轻GI-R所引起的胃黏膜深层充血、水肿甚至糜烂及炎症细胞浸润等(图1B). 因此, 采用10 μmol/L的NaHS预处理探讨外源性H2S保护胃黏膜对抗GI-R损伤的具体机制.
血浆中高浓度的H2S能够舒张血管, 从而改变血流和血压来影响器官功能[12,13]. 胃黏膜血流量增加可有效降低缺血再灌注引起的损伤. 然而, 本实验结果显示, NaHS预处理以及GI-R处理后大鼠血浆中H2S浓度与Sham组没有明显变化. 这提示, 10 μmol/L NaHS预处理大鼠14 d对胃黏膜的保护作用是通过其他作用机制实现的.
已有的研究表明, H2S在多种器官缺血再灌注损伤中起抗氧化作用: H2S通过对抗大鼠心肌细胞内氧自由基产生降低心肌缺血大鼠的死亡率[14,15]; H2S能够清除脑组织中氧自由基从而保护神经元对抗脑缺血再灌注损伤[16,17]; H2S通过减少氧化应激减轻缺血再灌注引起的急性肾损伤[6]. H2S可通过改善胃微循环、抗氧化以及传入感觉神经保护胃黏膜组织[18]. 目前研究发现, 氧化应激、白细胞浸润以及NO释放减少等均参与GI-R引发的胃黏膜损伤过程, 其中, 过多产生氧自由基引发的氧化应激是GI-R损伤的关键影响机制[1,2]. H2O2是导致氧化应激的重要的活性氧成分, 在GI-R后含量显著增高. MDA作为脂质过氧化的重要产物, 其在胃黏膜组织中缺血再灌注后水平也显增加. 这是由于GI-R处理致使胃氧自由基的主要来源蛋白之一XOD表达升高, 而抗氧化系统作用降低, 如SOD活性降低, GSH含量减少, 进而导致胃黏膜组织中氧化与抗氧化作用失衡诱发氧化应. NOX家族在胃肠道中表达正常时产生一定量的活性氧, 从而在细胞或亚细胞水平发挥不同的生物学功能[19]. NOX的p67phox亚基及其催化亚基gp91phox在GI-R处理后表达明显增高, 然而其p47phox和p22phox亚基表达受GI-R影响不明显. 给予H2S预处理后可有效的逆转这一情况, 减少H2O2和MDA在GI-R后胃黏膜中的含量, 进而减轻由于氧化应激诱发的组织损伤. 一方面, H2S明显减少XOD蛋白表达, 进而对抗GI-R引起的氧化应激. 另一方面, H2S可通过增加SOD酶的活性增强胃黏膜组织中的抗氧化作用, 进而对抗氧化产生的自由基在其内部产生的负面作用.
总之, 外源性H2S通过减少氧自由基来源和增强抗氧化系统对胃黏膜组织起保护作用, 进而有效对抗由GI-R引发氧化应激导致的胃黏膜损伤.
胃肠道的血管性疾病可引发胃黏膜损伤, 其损伤机制与胃的缺血再灌注密切相关. 同时, 心、肝、肺、肾等器官损伤均可引起胃黏膜缺血性改变, 从而引发胃黏膜损伤. 已有的研究表明胃缺血再灌注(gastric ischemia-reperfusion, GI-R)损伤的机制包括氧化应激、白细胞浸润及一氧化氮等有关. 因此, 如何防治GI-R损伤相关疾病可对临床提供理论基础.
在GI-R损伤机制中, 本研究重点研究信号分子H2S对胃黏膜组织中氧化应激通路的影响, 这对于可预见性的预防GI-R引发黏膜损伤具有重要意义.
本论文以外源性H2S预处理对GI-R引发黏膜损伤的作用为主要研究目标, 从而表明H2S对抗氧化应激通路实现胃黏膜的保护作用, 这对于临床用药提供一定的理论基础.
本研究通过夹闭大鼠腹腔动脉, 恢复血流再灌注的方法模拟GI-R造成胃黏膜损伤. 此模型的损伤可以达到黏膜基层. 在此基础上我们分别给予大鼠2.5, 5, 10以及20 μmol/L H2S的外源性供体NaHS腹腔注射预处理14 d, 再行GI-R模型. 结束后, 将大鼠胃取出并沿胃大弯剪开, 用生理盐水冲去内容物, 展开固定拍照, 利用ImageJ软件进行面积测定, 从而计算损伤面积, 即胃黏膜大体损伤面积(%) = 腺胃区粘膜出血和糜烂区域大小/腺胃区总面积. 胃壁切片后行HE染色, 参考Mascuda的标准计算胃黏膜损伤深度. 然后取NaHS效果最佳组进行后续实验. 根据试剂盒测定血浆中H2S浓度, 胃黏膜组织中MDA, GSH, H2O2含量测定以及SOD活性. Western blot测胃黏膜组织中XOD以及NOX亚基gp91phox, p67phox, p47phox及p22phox的蛋白表达. 数据以均数±标准差表示, 并用单因素方差进行统计学分析. P<0.05代表差异具有统计学意义.
我们研究结果表明5、10以及20 μmol/L NaHS预处理明显减少由缺血再灌注引起的胃黏膜损伤面积, 其中10 μmol/L NaHS预处理明显减轻胃黏膜损伤深度. 采用10 μmol/L NaHS预处理后再行GI-R的结果显示, 不影响大鼠血浆中H2S含量, 但是明显抑制由缺血再灌注引起的胃黏膜组织中MDA和H2O2含量增加, 同时减少XOD和NOX亚基gp91phox和p67phox表达, 增加GSH含量, 提供SOD活性. 提示外源性H2S可对抗GI-R损伤.
氧化应激是胃黏膜缺血再灌注损伤的关键机制之一, 外源性H2S预处理可通过减少氧化应激对抗GI-R引起的胃黏膜损伤. 一方面, H2S可减少导致氧化应激的活性氧来源; 另一方面, H2S可通过增加胃黏膜组织中的抗氧化途径减轻氧化应激. 因此, 外源给予H2S预处理可有效的减少活性氧产生, 对胃黏膜起到保护作用. 这对各种应激因素引发的胃黏膜损伤用药提供一定理论基础.
本研究的研究深度还有所欠缺, 未来以期在分子水平及基因水平阐明H2S作用的内在机制.
手稿来源地: 江苏省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C, C
D级 (一般): 0
E级 (差): 0
编辑: 崔丽君 电编:张砚梁
| 1. | Naito Y, Takagi T, Katada K, Tomatsuri N, Mizushima K, Handa O, Kokura S, Yagi N, Ichikawa H, Yoshikawa T. Gastric peroxisome proliferator activator receptor-γ expression and cytoprotective actions of its ligands against ischemia-reperfusion injury in rats. J Clin Biochem Nutr. 2011;48:170-177. [PubMed] [DOI] |
| 2. | Nakagiri A, Sunamoto M, Murakami M. NADPH oxidase is involved in ischaemia/reperfusion-induced damage in rat gastric mucosa via ROS production--role of NADPH oxidase in rat stomachs. Inflammopharmacology. 2007;15:278-281. [PubMed] [DOI] |
| 3. | Çimen O, Çimen FK, Gülapoğlu M, Bilgin AÖ, Çekiç AB, Eken H, Süleyman Z, Bilgin Y, Altuner D. The effect of metyrosine on oxidative gastric damage induced by ischemia/reperfusion in rats. Biochemical and histopathological evaluation. Acta Cir Bras. 2018;33:259-267. [PubMed] [DOI] |
| 4. | Zou JH, Qiao WL, Wang GM, Ma HJ, Qi YJ, Sun H, Yan CD. Exogenous hydrogen sulfide attenuates gastric ischemia-reperfusion injury via activation of K(ATP) channel. Sheng Li Xue Bao. 2012;64:27-32. [PubMed] |
| 5. | Cui J, Liu L, Zou J, Qiao W, Liu H, Qi Y, Yan C. Protective effect of endogenous hydrogen sulfide against oxidative stress in gastric ischemia-reperfusion injury. Exp Ther Med. 2013;5:689-694. [PubMed] [DOI] |
| 6. | Azizi F, Seifi B, Kadkhodaee M, Ahghari P. Administration of hydrogen sulfide protects ischemia reperfusion-induced acute kidney injury by reducing the oxidative stress. Ir J Med Sci. 2016;185:649-654. [PubMed] [DOI] |
| 7. | Wallace JL, Caliendo G, Santagada V, Cirino G, Fiorucci S. Gastrointestinal safety and anti-inflammatory effects of a hydrogen sulfide-releasing diclofenac derivative in the rat. Gastroenterology. 2007;132:261-271. [PubMed] [DOI] |
| 8. | Kimura Y, Goto Y, Kimura H. Hydrogen sulfide increases glutathione production and suppresses oxidative stress in mitochondria. Antioxid Redox Signal. 2010;12:1-13. [PubMed] [DOI] |
| 9. | Pan TT, Neo KL, Hu LF, Yong QC, Bian JS. H2S preconditioning-induced PKC activation regulates intracellular calcium handling in rat cardiomyocytes. Am J Physiol Cell Physiol. 2008;294:C169-C177. [PubMed] [DOI] |
| 10. | Pena-Mercado E, Garcia-Lorenzana M, Arechaga E, la Rosa CH, Beltran NE. Gastric mucosa injury quantification in an ischemia - Reperfusion experimental model. Conf Proc IEEE Eng Med Biol Soc. 2016;2016:2303-2306. [PubMed] [DOI] |
| 11. | Masuda E, Kawano S, Nagano K, Tsuji S, Takei Y, Hayashi N, Tsujii M, Oshita M, Michida T, Kobayashi I. Role of endogenous endothelin in pathogenesis of ethanol-induced gastric mucosal injury in rats. Am J Physiol. 1993;265:G474-G481. [PubMed] [DOI] |
| 12. | Li X, Du J, Jin H, Geng B, Tang C. Sodium hydrosulfide alleviates pulmonary artery collagen remodeling in rats with high pulmonary blood flow. Heart Vessels. 2008;23:409-419. [PubMed] [DOI] |
| 13. | Zhao W, Zhang J, Lu Y, Wang R. The vasorelaxant effect of H(2)S as a novel endogenous gaseous K(ATP) channel opener. EMBO J. 2001;20:6008-6016. [PubMed] [DOI] |
| 14. | Meng G, Wang J, Xiao Y, Bai W, Xie L, Shan L, Moore PK, Ji Y. GYY4137 protects against myocardial ischemia and reperfusion injury by attenuating oxidative stress and apoptosis in rats. J Biomed Res. 2015;29:203-213. [PubMed] [DOI] |
| 15. | Feng A, Ling C, Xin-Duo L, Bing W, San-Wu W, Yu Z, Yu-Lan H, You-En Z. Hydrogen Sulfide Protects Human Cardiac Fibroblasts Against H2O2-induced Injury Through Regulating Autophagy-Related Proteins. Cell Transplant. 2018;8. [PubMed] [DOI] |
| 16. | Yu Q, Lu Z, Tao L, Yang L, Guo Y, Yang Y, Sun X, Ding Q. ROS-Dependent Neuroprotective Effects of NaHS in Ischemia Brain Injury Involves the PARP/AIF Pathway. Cell Physiol Biochem. 2015;36:1539-1551. [PubMed] [DOI] |
| 17. | Woo CW, Kwon JI, Kim KW, Kim JK, Jeon SB, Jung SC, Choi CG, Kim ST, Kim J, Ham SJ. The administration of hydrogen sulphide prior to ischemic reperfusion has neuroprotective effects in an acute stroke model. PLoS One. 2017;12:e0187910. [PubMed] [DOI] |
| 18. | Magierowski M, Magierowska K, Hubalewska-Mazgaj M, Sliwowski Z, Pajdo R, Ginter G, Kwiecien S, Brzozowski T. Exogenous and Endogenous Hydrogen Sulfide Protects Gastric Mucosa against the Formation and Time-Dependent Development of Ischemia/Reperfusion-Induced Acute Lesions Progressing into Deeper Ulcerations. Molecules. 2017;22. [PubMed] [DOI] |
| 19. | Aviello G, Knaus UG. NADPH oxidases and ROS signaling in the gastrointestinal tract. Mucosal Immunol. 2018;11:1011-1023. [PubMed] [DOI] |