修回日期: 2017-12-07
接受日期: 2017-12-12
在线出版日期: 2018-01-18
套细胞淋巴瘤(mantle cell lymphoma, MCL)是一类以染色体t(11;14)(q13;q32)易位和cyclin D1过度表达为特征的非霍奇金淋巴瘤亚型. MCL以老年男性多见, 大多数患者在发现时已处于晚期, 常伴淋巴结外浸润, 尤其以胃肠道浸润常见. 多发性淋巴瘤性息肉病是MCL浸润胃肠道的典型表现, 浸润部位以结肠最常见. 本文报道1例53岁的老年女性MCL患者, 诊断为经典型MCL两年, 予以6周期的联合化疗取得完全缓解后, 出现迟发性结直肠浸润, 临床表现为间歇性血便. 内镜表现为较少见的黏膜皱襞脑回样增厚, 伴糜烂、出血和浅小溃疡. 活检组织免疫组化染色显示: 淋巴样浸润的结肠黏膜中cyclin D1、CD5、CD19、CD20、CD21、CD43、CD79a、Bcl-2、PAX-5和SOX11(分散)均为阳性, 而CD2、CD3、CD7、CD10、CD23、Bcl-6、c-myc和Mum-1均为阴性. 增殖指数Ki-67约为15%.
核心提要: 本文报道1例套细胞淋巴瘤化疗完全缓解后出现迟发性结直肠浸润, 患者出现便血, 内镜表现为少见的黏膜皱襞脑回样增厚. 免疫组织化学染色有助于疾病诊断, Ki-67可用于预后评估, R-CHOP化疗或干细胞移植为主要治疗方法.
引文著录: 盛佳琪, 刘莲, 刘聪, 黎培员. 套细胞淋巴瘤迟发性结直肠脑回样浸润1例并文献复习. 世界华人消化杂志 2018; 26(2): 137-142
Revised: December 7, 2017
Accepted: December 12, 2017
Published online: January 18, 2018
Mantle cell lymphoma (MCL), characterized by t (11; 14) (q13; q32) translocation and cyclin D1 overexpression, is still a challenging subtype of non-Hodgkin's lymphoma. The majority of MCL cases are discovered in male elderly people and in advanced stages with extranodal infiltration especially the gastrointestinal tract. Multiple lymphomatous polyposis is a typical manifestation of MCL infiltrating the gastrointestinal tract, and the colon is the most commonly involved site. In this paper, we report a case of MCL with late onset colorectal infiltration in a 53-year-old female patient presenting with gyrus-like thickened mucosal folds instead of multiple polyps as revealed by colonoscopic examination. Remarkably, the patient developed colorectal infiltration presenting with intermittent bloody stool after being diagnosed with classical MCL for two years and treated with several cycles of combined chemotherapy. Immunohistochemical staining showed that the lymphoid infiltrate in the colorectal mucosa was positive for cyclin D1, CD5, CD19, CD20, CD21, CD43, CD79a, Bcl-2, PAX-5, and SOX11 (scattered), but negative for CD2, CD3, CD7, CD10, CD23, Bcl-6, c-myc, and Mum-1. The Ki-67 proliferation index was around 15%.
- Citation: Sheng JQ, Liu L, Liu C, Li PY. Mantle cell lymphoma with late onset gyrus-like colorectal infiltration: A rare case and literature review. Shijie Huaren Xiaohua Zazhi 2018; 26(2): 137-142
- URL: https://www.wjgnet.com/1009-3079/full/v26/i2/137.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v26.i2.137
套细胞淋巴瘤(mantle cell lymphoma, MCL)是一类小B细胞性非霍奇金淋巴瘤, 仅占非霍奇金淋巴瘤的3%-10%. 因其有很强的淋巴结外部位浸润倾向, 预后多不佳, 中位生存期只有3-5年[1,2]. 其中, 胃肠道是最常见的淋巴结外浸润部位[3]. 从十二指肠到直肠, MCL浸润常表现为多发性淋巴瘤息肉病(multiple lymphomatous polyposis, MLP), 这是MCL最具代表性和特征性的内镜表现, 而在胃中可以观察到各种类型的病变[1,4-6]. 形态学、免疫组织化学及分子特征被认为是MCL诊断的必要条件. 肿瘤细胞通常表达cyclin D1、CD5、CD20, 常伴Bcl-1重排[4,5,7]. 而且, MCL细胞表面通常也会表达T-cell标志物CD5, 但CD10却是阴性[7]. 在此, 我们报告并讨论1例从直肠到降乙结肠交界有着特殊内镜表现的套细胞淋巴瘤病例. 而且, 这个患者是在多次联合化疗后出现迟发性结直肠浸润.
患者, 女, 53岁, 因"间断血便1 wk"入院. 既往有经典型套细胞淋巴瘤(Ⅳa期)病史, 表现为纵膈上下浅表及深部淋巴结多发肿大, 无胃肠道症状, 经右侧颈部淋巴结活检免疫组织化学染色确诊. 骨髓活检提示骨髓增生减低(30%), 流式细胞免疫分型见3.3%单克隆成熟B淋巴细胞, 检测出免疫球蛋白重链(immunoglobulin heavy chain, IgH)单克隆性重排基因片段. 患者确诊后共接受6次EDOCH联合化疗(依托泊苷、多柔比星、长春新碱、环磷酰胺、地塞米松), 最后2个周期联合使用了抗CD20单克隆抗体, 化疗后获得完全缓解1年余.
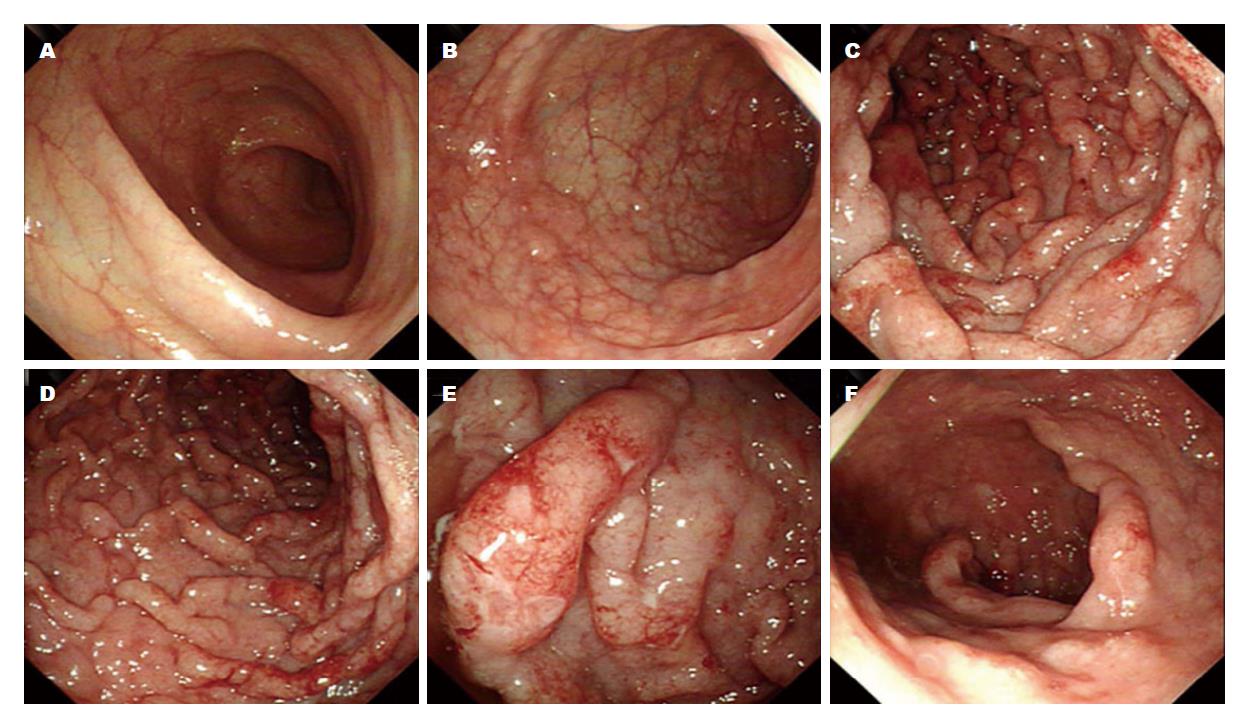
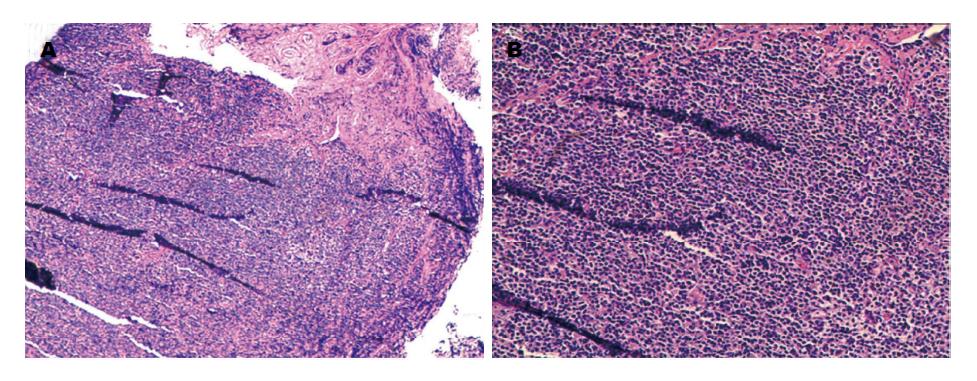
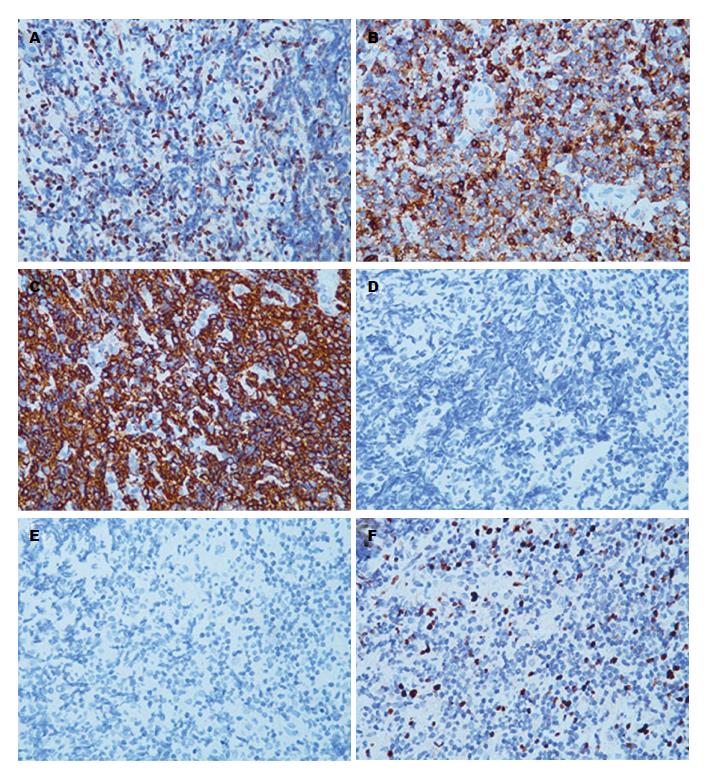
此次入院患者浅表淋巴结未触及肿大, 腹部未触及肿块. 实验室检测显示: 患者轻度贫血, 血红蛋白107 g/L(正常, 115-150 g/L), 正色素正细胞性; 乳酸脱氢酶偏高, 234 U/L(正常, 135-214 U/L). 影像学未显示纵膈及腹腔淋巴结肿大. 结肠镜检查显示, 直肠至乙状结肠, 结肠袋显示不清, 黏膜皱壁呈稀疏脑回样改变, 伴弥漫性充血和水肿; 部分黏膜表面有糜烂、出血, 部分直肠黏膜可见浅小溃疡, 覆白苔(图1). 病变组织活检HE染色, 可见结肠黏膜中有大量小到中等大小的淋巴瘤细胞浸润, 核稍不规则(图2). 免疫组织化学染色显示: cyclin D1(+), CD5(+), CD20(+)(图3A-C, 400×); CD19(+), CD21(+), CD43(+), CD79a(+), Bcl-2(+), PAX-5(+), SOX11(分散+); CD2(-), CD3(-), CD7(-), CD10(-)(图3D, 400×), CD23(-)(图3E, 400×), Bcl-6(-), c-myc(-), Mum-1(-). 增殖指数Ki-67约15%(图3F, 400×).
结合患者病史、内镜检查及组织病理学特征, 患者诊断为MCL结直肠浸润. 随后患者又接受了两个周期的氟达拉滨、环磷酰胺和抗CD20单克隆抗体联合化疗, 再次获得完全缓解. 随访至今, 患者无胃肠道症状, 拒绝复查肠镜, 影像学检查未发现肿大淋巴结.
MCL多见于老年男性, 确诊时中位年龄达67岁(47-86岁), 大部分患者(82.9%)确诊时已有较大进展(Lugano Ⅳ期)[1]. 胃肠道, 尤其是结直肠, 是MCL淋巴结外浸润常见的部位[4-6]. 其他浸润部位包括骨髓、脾、肝、肾、咽淋巴环、外周血、皮肤、舌头和输尿管等[1,3]. MCL浸润胃肠临床症状主要表现为腹痛、黑便、血便、体质量减轻及腹泻[4,8,9]. 本例患者确诊为MCL Ⅳa期, 但初发时无胃肠道症状, 也未行胃肠镜检查, 患者接受联合化疗和生物治疗后完全缓解.
患者MCL浸润胃肠道需同原发性胃肠道MCL相鉴别, 后者更为罕见, 仅占原发性胃肠道淋巴瘤的2%[10], 具有高度侵袭性, 生存率较继发性胃肠道MCL更低[11]. 原发性胃肠道淋巴瘤病变仅侵犯胃肠道黏膜, 或可累及其最邻近的肠系膜淋巴结, 外周及纵膈淋巴结、外周血、肝脾均无浸润表现[12]. 本例患者MCL化疗完全缓解后又出现胃肠道浸润, 虽无明显外周血及淋巴结浸润表现, 仍应考虑为继发性胃肠道MCL.
内镜及内镜活检是确诊胃肠道MCL常用的辅助检查. 根据内镜特征, 胃肠道MCL的病变大体分为以下6个亚型: (1)隆起型(孤立的或少于10个凸起病变形成的肿瘤结节; 类似于黏膜下肿瘤, 其顶部可伴有溃疡; (2)黏膜皱襞增厚型(黏膜皱襞增厚, 似大脑脑回; 通常只见于胃黏膜); (3)MLP(10个以上多发小息肉, 伴或不伴大息肉)[8]; (4)溃疡型(孤立或多发的溃疡凹陷性病变); (5)浅表型(黏膜颜色和/或形态改变); (6)混合型(这五种亚型的组合)[1,4]. 临床上以多发性淋巴瘤息肉病多见. 但胃肠道MCL内镜表现同其他类型淋巴瘤相比, 并无特异性, 还需同息肉、肿瘤、炎性溃疡相鉴别. 本例患者MCL结肠镜表现类似于黏膜皱襞增厚型, 明显的脑回样改变, 伴部分黏膜糜烂、出血和浅小溃疡. 这种表现的MCL浸润通常发生在胃黏膜, 而在直肠和结肠中尚未见报道.
内镜活检对胃肠道MCL诊断有重要意义. MCL形态学特征表现为一群小到中型的肿瘤细胞, 核仁明显且不规则, 一个或多个, 胞质少[7]. 但仅以形态学特征为依据不足以诊断MCL, 免疫组织化学染色特征更有意义. 肿瘤细胞通常表达B细胞抗原(CD19、CD20、CD22和CD79a), 但CD10和CD23抗原常为阴性. 特别的是, 这些细胞也有T细胞抗原CD5的异常表达. 另一个常见的阳性标志物是CD43[4,5,7]. 此外, Ki-67指数较高(超过40%)的患者总生存期明显缩短(中位值15 mo). 相比之下, Ki-67指数在10%-40%之间及低于10%的患者有更长的中位生存期, 分别为30 mo和42 mo[13]. 本例患者结直肠样本的免疫组织化学染色结果符合MCL特征, 可以明确诊断. 其Ki-67指数为15%, 预测了一个相对较长的中位生存期. 此外, 细胞遗传学检测也有必要, 更有助于确诊MCL. MCL患者常有染色体t(11;14)(q13;q32)易位, 导致11号染色体上Bcl-1位点重排, 伴cyclin D1抗原过度表达. 后者干扰肿瘤细胞的细胞周期(G1期)和促进肿瘤进展[4,5,7,14].
尽管近年来新的治疗方法不断出现, 但胃肠道MCL治疗效果仍然不佳. CHOP(环磷酰胺、多柔比星、长春新碱、泼尼松)作为晚期MCL的传统化疗方法, 现已被R-CHOP(抗CD20单克隆抗体联合CHOP)所取代, 后者有更高的总缓解率和完全缓解率, 分别为94% vs 75%(P = 0.0054)和34% vs 7%(P = 0.00024), 两者之间的无进展生存期和药物毒性没有明显差异[15]. 对于晚期患者, 可以考虑自体或同种异体干细胞移植. 自体干细胞移植因其毒性相对较轻, 可作为65-70岁患弥漫性MCL老年患者的一线治疗方法[16]. 常规化疗或自体干细胞移植未能达到缓解或复发的患者, 同种异体干细胞移植可作为补救疗法, 改善临床预后[17].
总之, 本文报道了1例MCL迟发浸润结直肠的病例. 内镜表现为一种少见于结直肠的脑回样改变, 局部伴糜烂、出血和浅溃疡. 免疫组织化学染色有助于诊断, Ki-67可用于预后评估. R-CHOP化疗或干细胞移植仍是目前主流的治疗方法.
套细胞淋巴瘤(mantle cell lymphoma, MCL)患者化疗完全缓解后出现迟发性结直肠浸润, 内镜表现特殊.
综合既往MCL病史、内镜及组织活检免疫组织化学染色考虑MCL浸润结直肠.
需同其他类型非霍奇金淋巴瘤、原发性胃肠道淋巴瘤相鉴别.
常有染色体t(11;14)(q13;q32)易位, Bcl-1位点重排.
全身多发淋巴结肿大, 代谢增高, 浸润胃肠道时内镜下可观察到多种形态改变, 多表现为多发息肉, 此例表现为少见的脑回样黏膜皱襞增厚.
B细胞抗原(CD19、CD20、CD22和CD79a)阳性, 但CD10和CD23抗原常为阴性, CD5、CD43及cyclin D1阳性.
R-CHOP化疗或干细胞移植为主流治疗方法.
胃肠道MCL有一些报道, 但MCL迟发浸润结直肠且呈脑回样改变未见报道.
套细胞淋巴瘤(MCL): 是一类小B细胞性非霍奇金淋巴瘤, 较为少见, 易于浸润胃肠道等淋巴结外部位, 预后多不佳. 主要特征为染色体t(11;14)(q13;q32)易位和cyclin D1过表达.
胃肠道特殊病变需注意淋巴瘤可能, 推荐进行相关免疫组织化学染色检查.
手稿来源: 自由投稿
学科分类: 胃肠病学和肝病学
手稿来源地: 湖北省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C, C
D级 (一般): D
E级 (差): 0
编辑: 闫晋利 电编:杜冉冉
| 1. | Iwamuro M, Okada H, Kawahara Y, Shinagawa K, Morito T, Yoshino T, Yamamoto K. Endoscopic features and prognoses of mantle cell lymphoma with gastrointestinal involvement. World J Gastroenterol. 2010;16:4661-4669. [PubMed] [DOI] |
| 2. | Daniel F, Assi HI, Karaoui W, El Cheikh J, Bannoura S, Nassif S. A Single Mass Forming Colonic Primary Mantle Cell Lymphoma. Case Rep Gastrointest Med. 2016;2016:2561507. [PubMed] [DOI] |
| 3. | Freeman C, Berg JW, Cutler SJ. Occurrence and prognosis of extranodal lymphomas. Cancer. 1972;29:252-260. [PubMed] [DOI] |
| 4. | Vetro C, Bonanno G, Giulietti G, Romano A, Conticello C, Chiarenza A, Spina P, Coppolino F, Cunsolo R, Raimondo FD. Rare gastrointestinal lymphomas: The endoscopic investigation. World J Gastrointest Endosc. 2015;7:928-949. [PubMed] [DOI] |
| 5. | Ghimire P, Wu GY, Zhu L. Primary gastrointestinal lymphoma. World J Gastroenterol. 2011;17:697-707. [PubMed] [DOI] |
| 6. | Yu H, Wang Y, Peng L, Lia A, Zhang Y. Endoscopic manifestations of primary colorectal lymphoma. Hepatogastroenterology. 2014;61:76-78. [PubMed] |
| 7. | Weisenburger DD, Armitage JO. Mantle cell lymphoma-- an entity comes of age. Blood. 1996;87:4483-4494. [PubMed] |
| 8. | Isaacson PG, MacLennan KA, Subbuswamy SG. Multiple lymphomatous polyposis of the gastrointestinal tract. Histopathology. 1984;8:641-656. [PubMed] [DOI] |
| 9. | Fraga M, Lloret E, Sanchez-Verde L, Orradre JL, Campo E, Bosch F, Piris MA. Mucosal mantle cell (centrocytic) lymphomas. Histopathology. 1995;26:413-422. [PubMed] [DOI] |
| 10. | Morton JE, Leyland MJ, Vaughan Hudson G, Vaughan Hudson B, Anderson L, Bennett MH, MacLennan KA. Primary gastrointestinal non-Hodgkin's lymphoma: a review of 175 British National Lymphoma Investigation cases. Br J Cancer. 1993;67:776-782. [PubMed] [DOI] |
| 11. | Dasappa L, Suresh Babu MC, Sirsath NT, Suresh TM, Govind Babu K, Sathyanarayna V, Lokesh KN, Lakshmaiah KC. Primary gastrointestinal mantle cell lymphoma: a retrospective study. J Gastrointest Cancer. 2014;45:481-486. [PubMed] [DOI] |
| 12. | Vetro C, Romano A, Amico I, Conticello C, Motta G, Figuera A, Chiarenza A, Di Raimondo C, Giulietti G, Bonanno G. Endoscopic features of gastro-intestinal lymphomas: from diagnosis to follow-up. World J Gastroenterol. 2014;20:12993-13005. [PubMed] [DOI] |
| 13. | Tiemann M, Schrader C, Klapper W, Dreyling MH, Campo E, Norton A, Berger F, Kluin P, Ott G, Pileri S. Histopathology, cell proliferation indices and clinical outcome in 304 patients with mantle cell lymphoma (MCL): a clinicopathological study from the European MCL Network. Br J Haematol. 2005;131:29-38. [PubMed] [DOI] |
| 14. | Weisenburger DD, Sanger WG, Armitage JO, Purtilo DT. Intermediate lymphocytic lymphoma: immunophenotypic and cytogenetic findings. Blood. 1987;69:1617-1621. [PubMed] |
| 15. | Lenz G, Dreyling M, Hoster E, Wörmann B, Dührsen U, Metzner B, Eimermacher H, Neubauer A, Wandt H, Steinhauer H. Immunochemotherapy with rituximab and cyclophosphamide, doxorubicin, vincristine, and prednisone significantly improves response and time to treatment failure, but not long-term outcome in patients with previously untreated mantle cell lymphoma: results of a prospective randomized trial of the German Low Grade Lymphoma Study Group (GLSG). J Clin Oncol. 2005;23:1984-1992. [PubMed] [DOI] |
| 16. | Metzner B, Müller TH, Gebauer W, Casper J, Kraemer D, Rosien B, Schumann-Binarsch S, Thole R, Köhne CH, Dreyling M. Long-term clinical and molecular remissions in patients with mantle cell lymphoma following high-dose therapy and autologous stem cell transplantation. Ann Hematol. 2014;93:803-810. [PubMed] [DOI] |
| 17. | Khouri IF, Lee MS, Saliba RM, Jun G, Fayad L, Younes A, Pro B, Acholonu S, McLaughlin P, Katz RL. Nonablative allogeneic stem-cell transplantation for advanced/recurrent mantle-cell lymphoma. J Clin Oncol. 2003;21:4407-4412. [PubMed] [DOI] |