修回日期: 2018-04-17
接受日期: 2018-04-25
在线出版日期: 2018-05-08
构建野生型HBx(wild-type HBx, wt-HBx)和自然突变体HBx(truncated HBx, tHBxΔ35)重组慢病毒表达载体, 建立稳定转染细胞株, 观察wt-HBx和tHBxΔ35对肝细胞增殖和凋亡的影响.
构建TOPO3.1- wt-HBx和TOPO3.1-tHBxΔ35重组慢病毒载体; 与3个质粒包装系统用磷酸钙方法共同转染到人293T细胞, 包装成病毒颗粒, 分别感染肝细胞LO2和MIHA, 并进行荧光和Western blot法检验细胞中wt-HBx和tHBxΔ35的表达情况. 用细胞计数, 细胞活力测定, 集落形成实验, 流式细胞仪等方法检测对肝细胞增殖和凋亡效应的影响.
重组慢病毒载体及稳定转染细胞株构建成功, 转染后wt-HBx和tHBxΔ35在细胞中表达明显变化; tHBxΔ35过表达细胞的增殖速度明显高于wt-HBx组和CTRL对照组, 而感染wt-HBx组的肝细胞增殖速度比CTRL对照组和tHBxΔ35组增殖速度慢(P<0.05); tHBxΔ35可能通过促进细胞S期的合成而刺激细胞增殖, 而wt-HBx 可能通过捕获细胞的G0/G1期而抑制细胞增殖. 但tHBxΔ35, wt-HBx在肝细胞的凋亡率是很低的.
HBx对肝细胞具有抑制增殖的作用, 而tHBxΔ35对肝细胞具有促进增殖的作用.
核心提要: 乙型肝炎病毒(hepatitis B virus, HBV)编码HBx蛋白在原发性肝癌发展中发挥重要的作用. 在肝癌组织中, HBx 羧基末端频繁易丢失35个氨基酸, 形成自然突变体HBx(truncated HBx, tHBxΔ35); 本研究主要探讨HBx和tHBxΔ35对正常肝细胞增殖的影响. 结果发现HBx对肝细胞具有抑制增殖的作用, 而tHBxΔ35对肝细胞具有促进增殖的作用.
引文著录: 朱冉旭, 羊东晔, 司徒伟基. HBx蛋白及其羧基末端缺失35个氨基酸的突变体对正常肝细胞增殖的影响. 世界华人消化杂志 2018; 26(13): 760-768
Revised: April 17, 2018
Accepted: April 25, 2018
Published online: May 8, 2018
To construct lentiviral vectors expressing human wild-type HBx (wt-HBx) and truncated HBx (tHBxΔ35) and study the effect of wt-HBx and tHBxΔ35 on the proliferation and apoptosis of normal liver cell lines.
Lentiviral vectors TOPO3.1-wt-HBx and TOPO3.1-tHBxΔ35 were constructed and transfected into 293T cells with three packaging plasmids. The supernatants were collected to infect LO2 and MIHA cells, respectively. The expression of wt-HBx and tHBxΔ35 was detected by fluorescence microscopy and western blot analysis. The effect of HBx and tHBxΔ35 on the proliferation, cell cycle, and apoptosis was analyzed by cell counting, MTS, and flow cytometry, respectively.
The recombinant lentiviral vectors were successfully constructed. The proliferation of liver cells infected with tHBxΔ35 was significantly increased, compared with HBx or CTRL infected cells, while the proliferation of liver cells infected with HBx was decreased compared with tHBxΔ35 or CTRL infected cells (P < 0.05). tHBxΔ35 improved the number of cells in S phase, while HBx induced G0/G1-S cell cycle arrest. The effect of tHBxΔ35 or HBx on apoptosis was mild.
HBx can inhibit the proliferation of hepatocytes, while tHBxΔ35 can improve the proliferation of liver cells.
- Citation: Zhu RX, Yang DY, Seto WK. Impact of wild-type and carboxyl-terminal truncated hepatitis B virus X on hepatocyte proliferation. Shijie Huaren Xiaohua Zazhi 2018; 26(13): 760-768
- URL: https://www.wjgnet.com/1009-3079/full/v26/i13/760.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v26.i13.760
在正常组织的生长周期中, 细胞的凋亡和增殖是维持动态平衡的. 当这个平衡发生破坏时, 就会引起诸多疾病. 如当肝细胞凋亡过多时, 组织将出现坏死, 肝功能出现异常; 当肝细胞过度增殖时, 癌前病变及癌症将可能随之发生. 乙型肝炎病毒(hepatitis B virus, HBV)感染是我国诱发急慢性肝病和原发性肝癌(hepatocellular carcinoma, HCC)的主要病因[1,2]. 它属于嗜肝DNA 病毒科, 直接感染肝细胞. HBV基因DNA组包含四个部分重叠的开放读码框(open reading frame, ORF), 分别命名为S, C, P和X. 在这4个DNA基因组中, X-ORF编码154个氨基酸(amio acid, aa)多肽则称之为HBx蛋白[3,4]. HBx作为反式调控蛋白, 通过协调和激活具有不同作用的功能性蛋白及其靶基因, 从而在病毒感染/复制以及诱发肝癌的发生发展中发挥重要的作用[5,6].
近年来, 人们在HBV相关肝癌的研究中, 发现HBx的突变体在诱发肝细胞癌变的过程中发挥了重要的作用. 人们发现3'羧基末端被截短的HBx蛋白被频繁地检测在HBV相关的HCC肿瘤组织中[7]. 2003年Iavarone等[8]和2004年Wang等[9]的研究表明HBV在整合到肝细胞的时候, 易发生HBx突变, 即野生型HBx(wild-type HBx, wt-HBx)基因的3'末端被截断(遗失), 从而形成突变型的HBx (truncated HBx, tHBx). 2007 年Xu等[10] 进一步发现: 在自然情况下, 在肝癌组织中HBx3'羧基末端易于丢失35aa, 即形成自然突变体tHBxΔ35. 但是自然突变体tHBxΔ35如何诱导其癌变的作用机制目前仍不完全清楚. 在本研究中旨在通过转染tHBxΔ35, wt-HBx到正常肝细胞中探讨对肝细胞生长及增殖的影响及作用机制.
人永生化非肿瘤性肝细胞MIHA, LO2, 包装细胞293T细胞购自美国标准培养收集公司(ATCC, Manassas, VA, United States). 所有的细胞都用含10%胎牛血清(HyClone公司, United States)的高糖DMEM培养液(Gbico公司)培养. 限制性内切酶EcoRⅠ购自美国Promega Biotech Co. Ltd公司; BamHⅠ, HpaⅠ, XhoⅠ, SalI内切酶, T4 DNA 连接酶购自美国New England BioLabs Inc.公司; RNA提取试剂盒, 无内毒素质粒提取试剂盒, DNA纯化试剂盒及PCR扩增试剂购自北京康为世纪生物科技有限公司. 引物序列均由Invitrogen公司合成. TOPO TA载体试剂盒购自Invitrogen公司. 流式细胞仪为BD FACS AriaTM公司.
1.2.1 重组慢病毒转移载体的构建: 野生型wt-HBx为全长HBx, 它是以HBV 血清型adw的HBx为模板; tHBxΔ35 为wt-HBx含3'末端被截断35氨基酸; 它的模板来自香港中文大学附属威尔斯亲王医院患HCC病人的血清; 引物设计: 分子克隆引物: HBx adw(wt-HBx)上游引物5'-GCCACCATGGATTACAAGGATGACGATGACAAGGCTGCTAGGGTGTGCTG-3', 下游引物: 5'-TAGGGCGTCGACTTAGGCAGAGGTGAAAAAGTTG-3'(内含酶切位点); tHBxΔ35:下游引物Reverse 5'-TAGGGCGTCGACTTAGTCTTTAAACACACAGTCTTTGA-3'; 在设计的寡核苷酸序列中, Kozak一致序列(GCCACC)位于起始密码子(ATG)之前, 它可以增强转染进入真核细胞的效率. Flag-tag序列(GATTACAAGGATGACGATGACAAG)连接在HBx序列的N端; 下游引物在HBx的CooH端截断35氨基酸处含有人工合成的终止密码子(TAA). 序列均由Invitrogen公司合成. wt-HBx, tHBxΔ35的DNA片段通过PCR扩增和克隆到TOPO TA载体, 从而产生TOPO3.1-wt-HBx和TOPO3.1- tHBxΔ35. 然后它们被亚克隆到含有EcoRI和SalI限制性内切酶切位点的慢病毒载体pRRL-cPPT-CMV-X-IRES- EGFP- PRE-SIN(由香港中文大学YC. Chen教授馈赠)中.
1.2.2 慢病毒的产生: 通过用磷酸钙方法将病毒转移载体和3个包装载体pMDL/pRRE, pRSV-REV和pCMV-VSVG瞬时转染到人293T细胞进行包装病毒. 在转染前1 d, 将生长状态良好的293T细胞接种至10 cm培养皿中, 待细胞密度达70%时, 更换无血清无抗生素DMEM培养基, 取质粒混悬液(10 μg病毒转移载体, 6.6 μg pMDL/pRRE, 3.5 μg pCMV-VSVG 和2.5 μg pRSV-REV通过用磷酸钙方法转移到293T细胞, 放入5% CO2, 37 ℃的温箱中孵育48 h, 收集含病毒的上清培养液, 并进行纯化和浓缩, 分装-80 ℃冰箱保存.
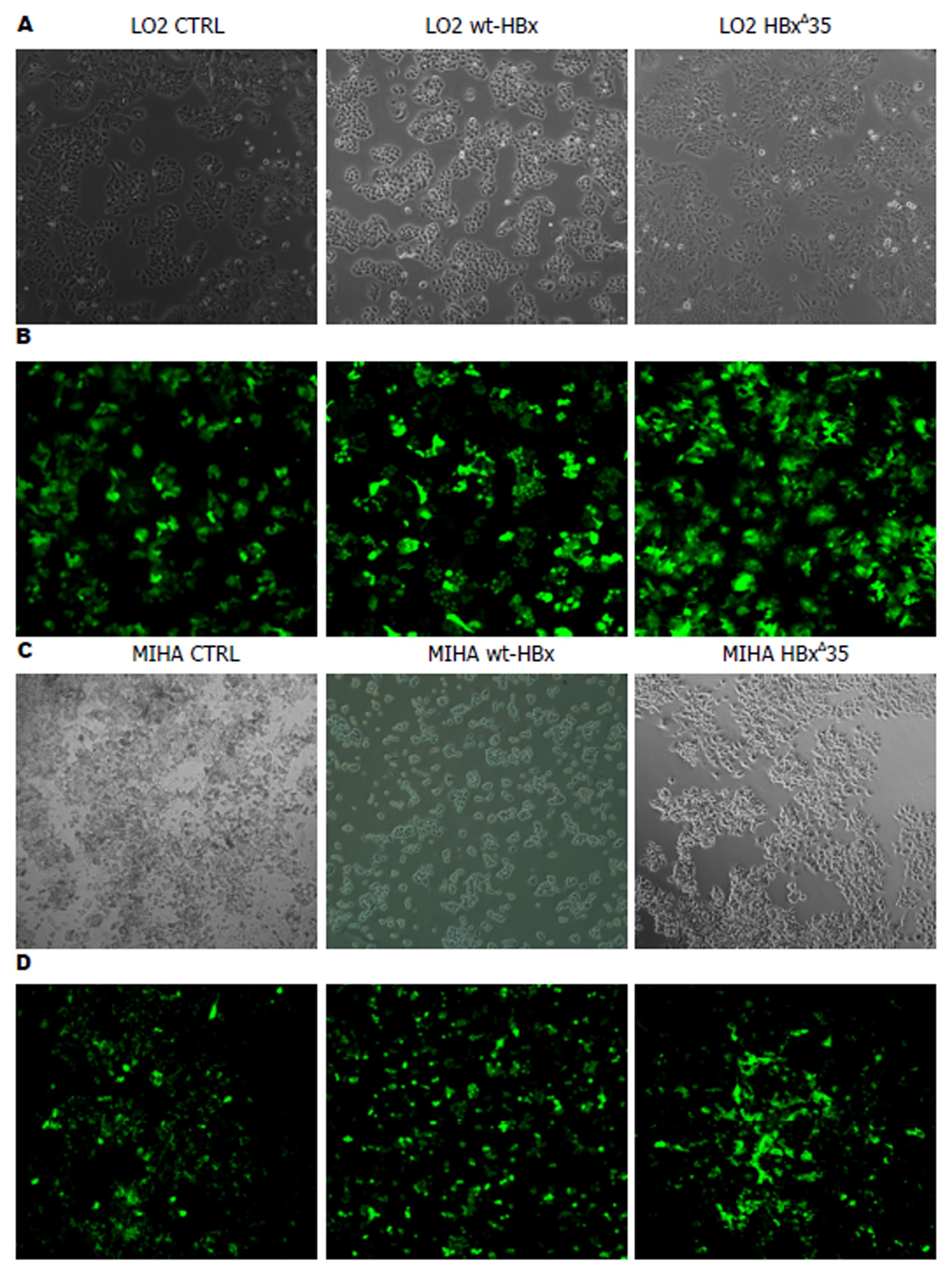
1.2.3 慢病毒的感染: 感染前1 d, 取对数生长期状态良好的MIHA, LO2细胞, 按每孔 2×104个细胞接种于24-孔培养板中. 待细胞密度达70%时, 弃去培养液, 加入包装的慢病毒混悬液(4 μL 聚凝胺polybrene+15 μL慢病毒+381 μL新鲜DMEM培养基)放入5%CO2, 37 ℃的温箱中孵育. 经过48 h后, 换液, 放入荧光显微镜下观察细胞荧光发光(被感染上EGFP阳性的细胞则放射出绿色的荧光). 已感染的细胞所释放绿色荧光的密度和范围被测定为转染效率的标准.
1.2.4 Western-blot鉴定: 分别收集感染重组慢病毒和对照未感染的细胞, 裂解提取细胞总蛋白, 经BCA法蛋白定量, SDS-PAGE凝胶电泳样品, 蛋白上样量为50 μg, 半干转15 V稳压转膜17 min, 经凝胶蛋白转移至聚偏氟乙烯(PVDF)膜. 5%脱脂奶粉37 ℃封闭1.5 h, 后加入鼠抗人HBx一抗(1:2000 稀释)或β-actin一抗(1:5000 稀释), 4 ℃过夜, TBST洗膜后加入抗鼠二抗(1:5000稀释), 室温孵育1h, TBST洗膜后与化学发光底物孵育5 min, 暗室中用X线片曝光, 显影, 定影. 用β-actin作内参验证蛋白含量.
1.2.5 生长曲线绘制: 重组慢病毒tHBxΔ35组, wt-HBx组和空载体(CTRL)阴性对照组按照1×104个/孔接种在3块6孔板培养. 每24 h取3孔计数, 每孔计数2次, 取平均值作为日平均细胞数, 连续计数5 d, 绘制细胞生长曲线.
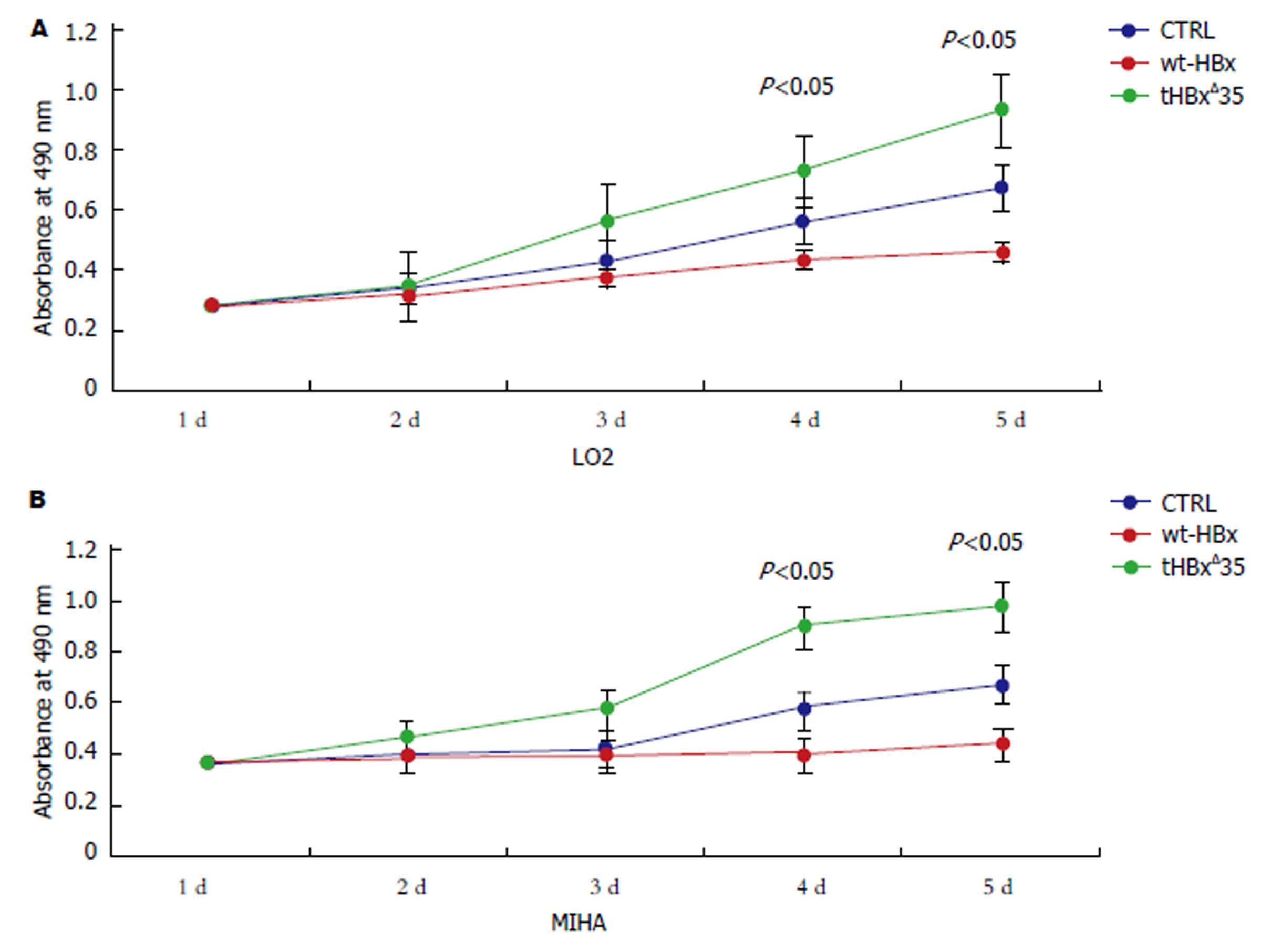
1.2.6 MTS法检测细胞增殖: 实验设重组慢病毒空载体阴性对照组CTRL, 重组慢病毒tHBxΔ35组, wt-HBx组, 每组各设6个重复孔, 按照每孔5000个细胞密度接种于96孔板中, 在37 ℃, 5% CO2孵育0 h, 24 h, 48 h, 72 h, 96 h后分别每孔加20 μL MTS溶液, 继续培养2 h. 酶标仪上选490 nm波长测定各孔吸光度(A490)值. 计算6孔平均值.
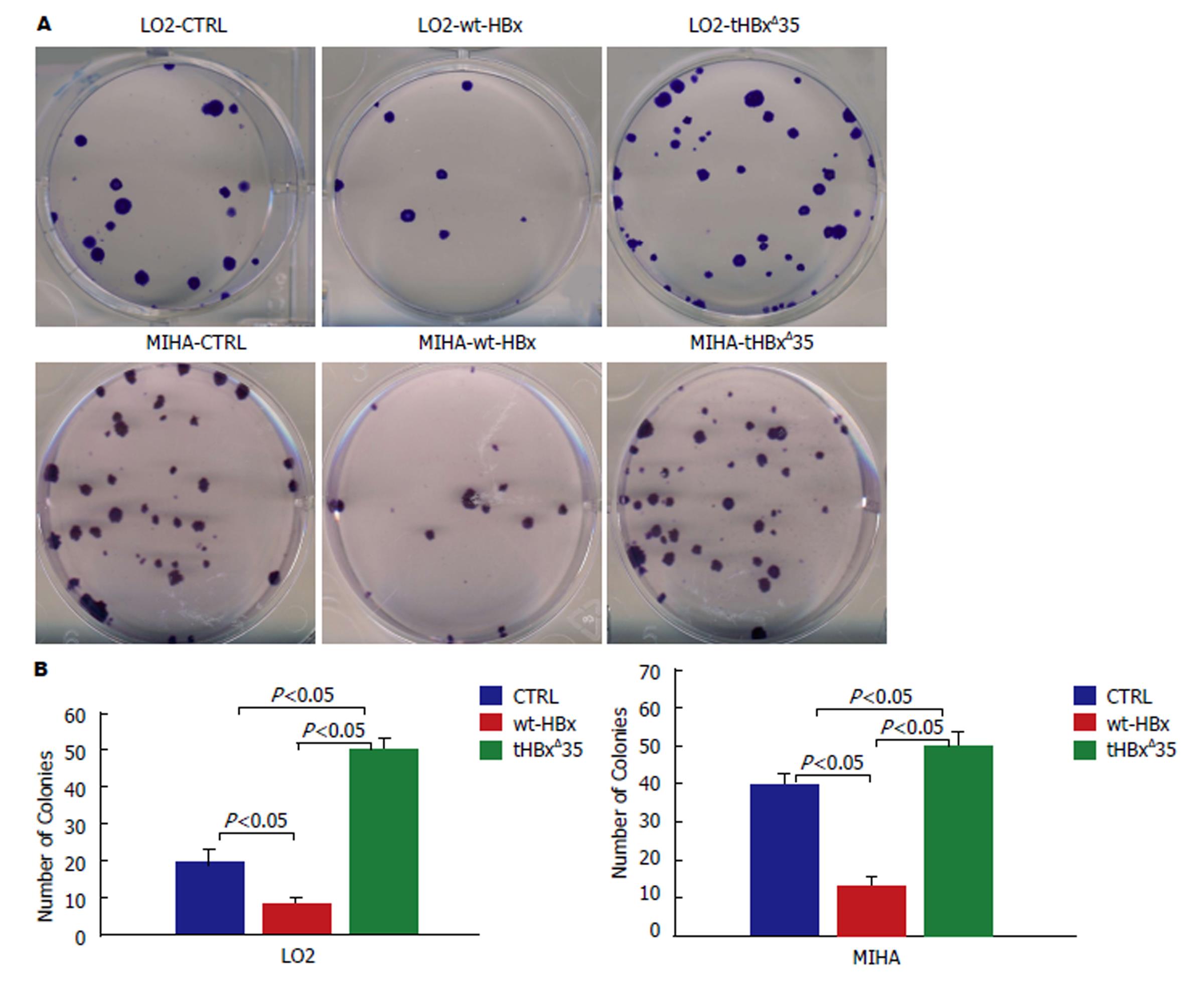
1.2.7 集落形成实验: 将重组慢病毒空载体阴性对照组CTRL, 重组慢病毒wt-HBx组, tHBxΔ35组细胞分别按每含50个细胞的密度接种于6孔板, 每组细胞接种3个孔. 将培养板移入CO2培养箱培养2 wk. 弃去培养液, 用PBS液小心漂洗2次, 加入甲醇固定15 min, 弃去固定液, 加适量的0.25%结晶紫染料在室温下染10 min, 细胞集落在显微镜下计数, 重复3次以上实验取其平均值.
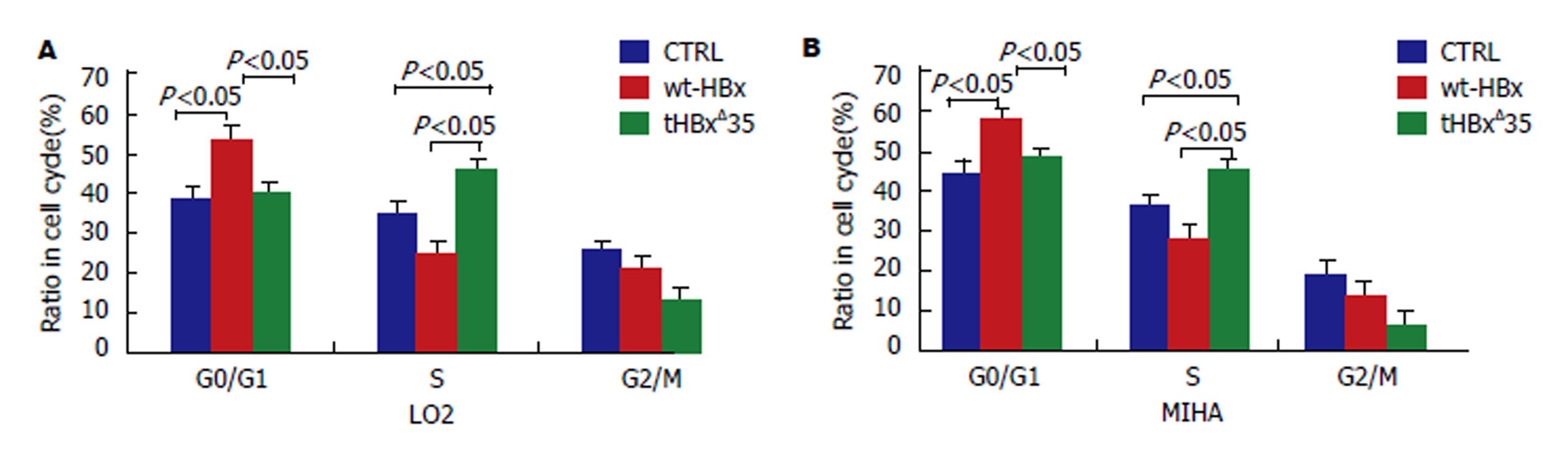
1.2.8 细胞周期的检测:收集重组慢病毒空载体阴性对照组CTRL, 重组慢病毒wt-HBx组, tHBxΔ35组细胞, 调整细胞密度至1×108/L, 预冷的70%乙醇固定2 h后加入0.5 mL碘化丙啶染色液, 37℃避光温浴30 min, 随即进行流式细胞仪检测, 观察细胞周期分布情况.
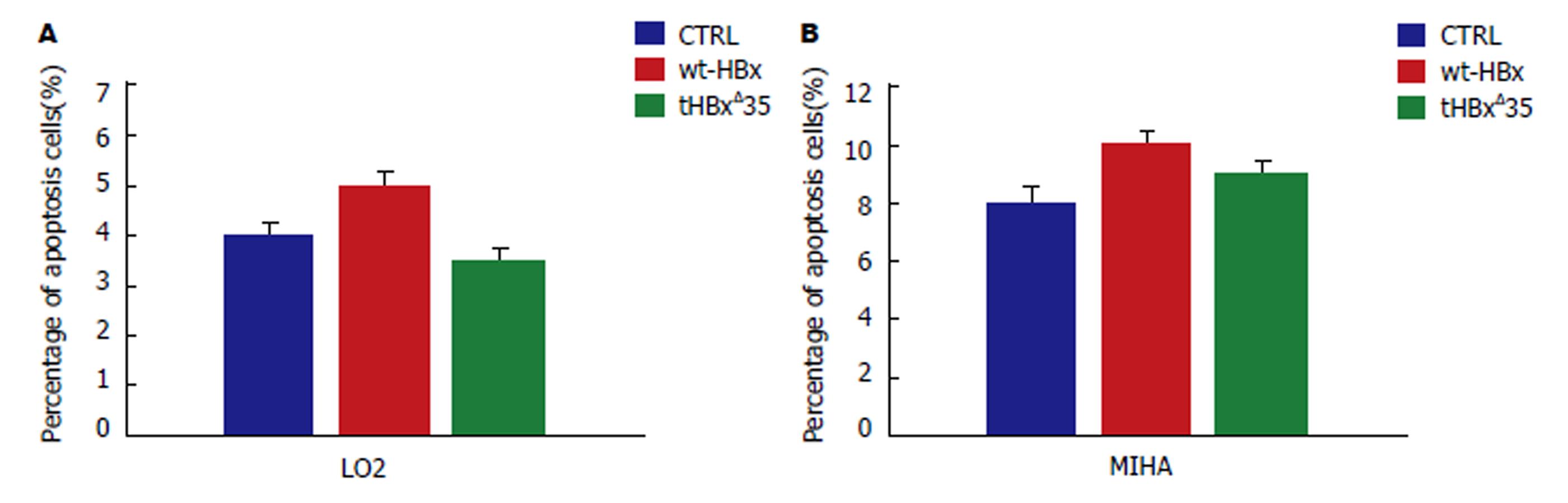
1.2.9 细胞凋亡的检测: 收集重组慢病毒空载体阴性对照组CTRL, 重组慢病毒wt-HBx组, tHBxΔ35组细胞, 调整细胞密度至1×108/L, 加入5 μL膜联蛋白V-异硫氰酸荧光素(annexin V-FITC), 室温避光孵育10 min, 加入5 μL碘化丙啶(PI)染色, 随即进行流式细胞仪检测, 观察凋亡细胞百分比.
统计学处理 应用SPSS13.0统计软件分析, 组间比较采用t检验, P<0.05为统计学差异意义. 数据以mean±SD表示.
感染重组慢病毒48 h后在荧光显微镜下观察细胞, 其生长状态良好. 与对照组比较, 感染后的细胞可见广泛绿色荧光存在(感染效率≥80%), 说明慢病毒的感染效率较高(图1).
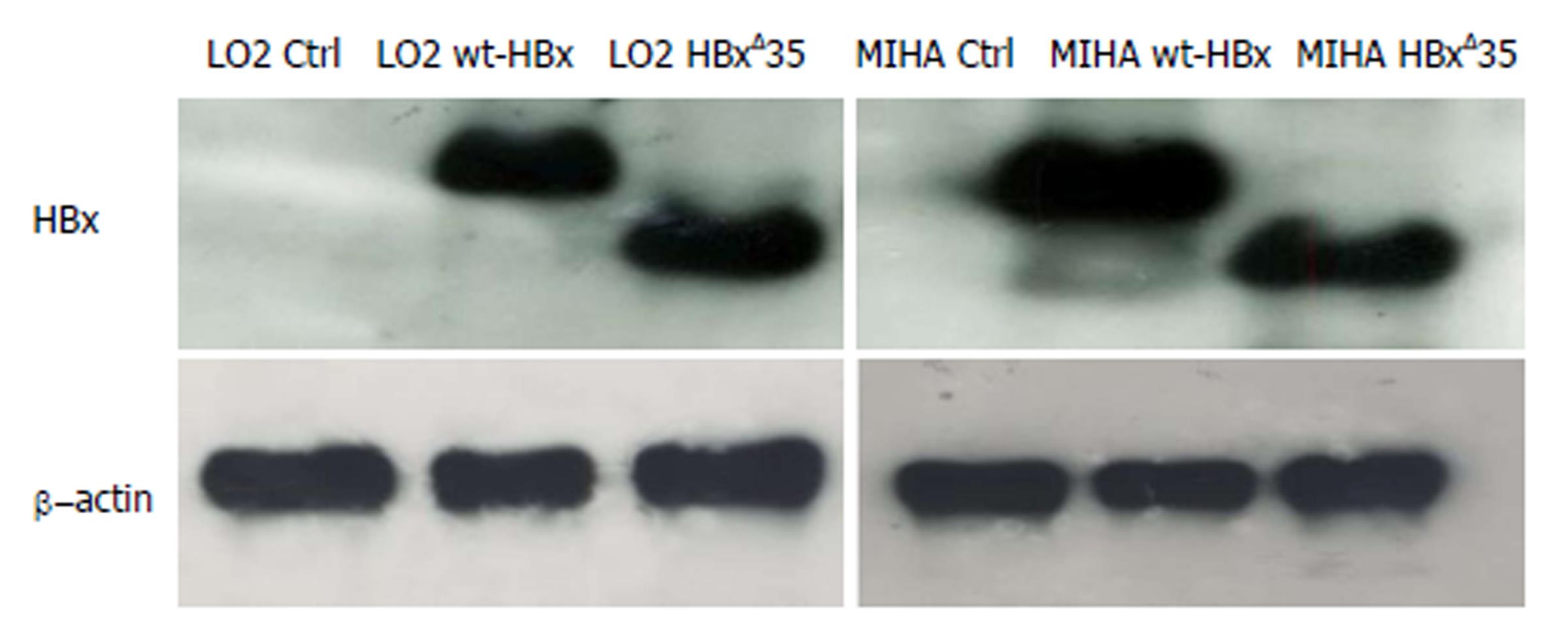
Western blot 结果显示通过慢病毒的介导感染, 野生型wt-HBx和突变型tHBxΔ35基因均在LO2和MIHA细胞中的蛋白水平上稳定地表达出来(图2).
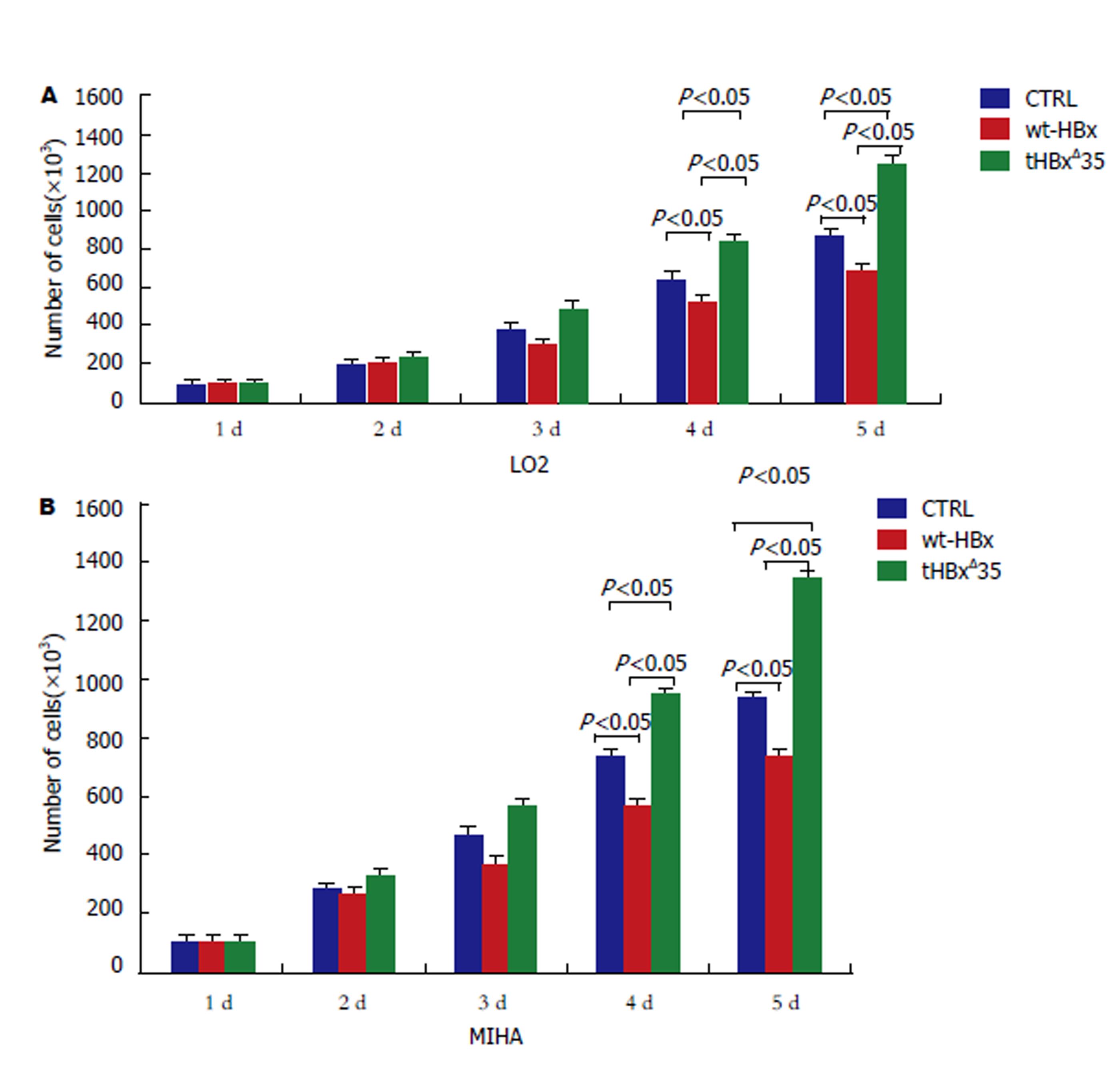
感染肝细胞5 d后, 感染tHBxΔ35组的LO2肝细胞增殖速度比空载体(CTRL)对照组肝细胞增殖效应明显加快(P<0.05), 而感染wt-HBx组的MIHA肝细胞增殖速度比空载体(CTRL)对照组肝细胞增殖要慢(P<0.05). 类似的结果也显示在感染MIHA肝细胞中(见图3).
经培养5 d后, 可见感染tHBxΔ35组明显对肝细胞有促进增殖作用. 感染tHBxΔ35组的LO2肝细胞增殖速度比wt-HBx组, 空载体(CTRL)对照组增殖效应要快(P<0.05). 而感染wt-HBx组的LO2肝细胞增殖速度却比空载体(CTRL)对照组, tHBxΔ35组要慢(P<0.05), 其类似的结果也显示在感染MIHA肝细胞中(见图4). 显然, 我们的结果揭示感染tHBxΔ35肝细胞比感染wt-HBx肝细胞更能促进肝细胞增殖.
培养14 d后, 重组慢病毒tHBxΔ35组形成细胞集落明显较空载体(CTRL)对照组, wt-HBx组为多(P<0.05), 而wt-HBx组形成的细胞集落比tHBxΔ35组, 空载体(CTRL)对照组要少(P<0.05), tHBxΔ35组所形成细胞集落为三者中最多, wt-HBx组所形成的细胞集落则相较之为最少(如图5).
与细胞增殖试验结果一致, 重组慢病毒tHBxΔ35组的细胞在S期(DNA合成期)的比例明显高于wt-HBx细胞和对照组(CTRL), 45.37%±3.15% vs 28%±2.83% vs 38.18%±2.69%, P<0.05). 另一方面, wt-HBx组的细胞在G0/G1期(DNA合成前期)的比例明显高于对照组(CTRL)和tHBxΔ35组细胞(58.01%±3.14% vs 44.73%±5.69% vs 48.32%±4.35%, P<0.05), 而S期的比例明显低于tHBxΔ35组和对照组(图6). 因而, 重组慢病毒tHBxΔ35组的细胞可能通过促进细胞S期的合成而刺激细胞增殖, 而wt-HBx可能通过捕获(阻滞)细胞的G0/G1期而抑制细胞增殖. 然而, 在我们的研究中, 不同形式的HBx在MIHA细胞的凋亡率上却是很微弱的, 且显示不出明显的差异性(图7).
HBV与HCC的发生发展有着密切的关系. 近年来, 研究显示HBx在HBV相关的HCC疾病发展中发挥了重要作用. HBx 是一个含154氨基酸的多功能蛋白. 但是HBx在HCC致癌过程中的作用机制还不是太清楚(存在广泛争议). 一些学者报道, 野生型HBx能诱导肝细胞的凋亡或是使细胞敏感于促凋亡刺激所诱发的凋亡[11,12], 并且通过和原癌基因ras, myc的相互作用而抑制集落的形成[13]. 他们认为HBx可以通过结合DNA修复基因以干扰宿主细胞DNA修复机制以及干预细胞周期的进展, 其中包括S期的进展和染色体的稳定性从而诱导肝细胞凋亡[14]. 同时野生型HBx也可通过涉及肿瘤坏死因子所诱导凋亡的体制, 包括激活一系列含半胱氨酸的天冬氨酸蛋白水解酶级联反应从而促使细胞敏感于凋亡. 而另一方面, 一些学者则阐述了HBx促进肝细胞无限增殖, 进而导致HCC的产生. HBx和它的某些特定靶基因的相互作用则在启动肝癌形成的信号传导通路上发挥了主要的作用.
如何解释HBx 在肝癌形成中截然相反的作用呢?研究显示, 当HBx5'氨基端的前50个aa被明确为转化功能区域时, 其3'羧基末端的后14个aa具有反式激活转化功能区的活性, 从而达到抑制细胞过度增殖的效应. 当羧基末端超过14aa的截断则会失去其对野生型wt-HBx的生长抑制效应[15,16]. 2003年Iavarone 等[8]和2004年Wang等[9] 分别发现HBV在整合到肝细胞的时候, 易发生HBx 3'羧基末端的丢失, 即野生型wt-HBx转变为突变型的tHBx. 因而人们推测, 在肝癌组织细胞中HBx可能存在两种不同的形式: 野生型wt-HBx和突变型tHBx. 2007年Xu等[10]在Hepatology进一步提出: 在自然情况下, 在肝癌组织中的HBx3'羧基末端, 359和360的碱基位置易于发生高频地G到A的突变, 即TGG变成TAA, 也就是在120个aa的位置形成了未成熟的终止密码子, 从而导致了羧基末端的35aa的自然丢失. 因而, tHBxΔ35被认为是野生型HBx自然形成的突变体[10]. 然而自然突变体tHBxΔ35如何诱导其癌变的作用机制目前仍不完全清楚. 在本研究旨在通过转染tHBxΔ35, wt-HBx到正常肝细胞中探讨对肝细胞生长及增殖的影响及作用机制.
本实验成功地扩增出wt-HBx和tHBxΔ35, 并分别将其成功地克隆入慢病毒载体质粒中Tpo3.1中, 经酶切鉴定及测序证实载体构建成功. 并与3个质粒系统将载体质粒包装成病毒颗粒, 感染肝细胞株. MIHA和LO2作为人永生化非肿瘤性肝细胞, 因此, 成为我们所选择研究慢病毒稳定转染的肝细胞株. 当慢病毒感染肝细胞株MIHA和LO2 48 h后, 可见广泛绿色荧光存在, Western blot结果显示明显的过表达效果, 提示稳定转染细胞株构建成功. 慢病毒wt-HBx和tHBxΔ35的稳定转染细胞株的构建成功为下一步的研究奠定了坚实的基础, 有利于tHBxΔ35, wt-HBx基因在肝细胞中功能的研究以及进一步发病机制的探索.
为了明确tHBxΔ35, wt-HBx是否对正常肝细胞的生长及增殖的影响, 我们首先用其生长曲线, MTS增殖试验, 集落形成实验鉴定, 发现感染tHBxΔ35基因的MIHA和LO2肝细胞能生长地更快, 形成细胞克隆率更多; 而wt-HBx使得肝细胞生长变慢, 形成细胞克隆率较少. 这可能是因为tHBxΔ35基因在羧基末端丢失了35aa, 失去了其对野生型wt-HBx的生长抑制效应. 接着, 我们用流式细胞仪进一步分析tHBxΔ35, wt-HBx基因对肝细胞增殖影响的原因, 检测它们对细胞周期和凋亡的影响. 结果显示tHBxΔ35基因可促使细胞S期的合成增加进而刺激细胞增殖, 而wt-HBx 可通过捕获(阻滞)细胞的G0/G1期而抑制细胞增殖. 但tHBxΔ35, wt-HBx 对细胞的凋亡是很微弱的. 而本实验也存在一定的局限性, 并未对tHBxΔ35基因如何促进细胞增殖的机制做更深入地具体分析.
总之, HBx在HBV相关的HCC疾病发生发展中发挥了重要的作用, 其羧基端缺失35aa的突变体能促进肝细胞的异常增殖. tHBxΔ35基因可能通过促使细胞S期的合成增加进而刺激细胞增殖, 而HBx可通过捕获(阻滞)细胞的G0/G1期而抑制细胞增殖. HBx蛋白是作为反式调控蛋白, 在细胞核内, 虽然不能直接结合靶基因DNA, 但可通过蛋白-蛋白相互作用即与转录因子结合, 如HBx和核转录因子, 炎症因子, 促癌因子等与其靶基因相互作用从而在病毒感染/复制以及诱发肝癌的发生发展中发挥重要的作用[5,6], 这将是我们下一步研究的方向, 为HBx蛋白羧基端缺失35aa的突变体对HCC的发生发展的具体分子生物学机制以及为将来临床诊治提供坚实的理论依据.
原发性肝细胞癌(hepatocellular carcinoma, HCC)是我国最为常见的恶性肿瘤, 乙型肝炎病毒(hepatitis B virus, HBV)感染则是我国诱发HCC的主要病因. 研究发现HBV编码的X蛋白HBx 在HCC发展中发挥重要的作用.
近年来, 人们对HBx在HCC致癌过程中的作用机制还不是太清楚(存在广泛争议). 一些学者报道, HBx能诱导肝细胞的凋亡或坏死, 而另一些学者则发现HBx促进肝细胞无限增殖, 进而导致HCC的产生. 如何解释HBx 在肝癌形成中截然相反的作用呢?近来, 人们发现在肝癌组织中检测到HBx3'羧基末端易于丢失35个氨基酸, 即形成自然突变体(truncated HBx, tHBxΔ35). 也许HBx感染肝脏组织后存在不同的形式, 即野生型HBx和突变体tHBxΔ35, 从而产生出不同的作用. 然而人们对他们如何诱导正常肝细胞癌变的作用机制目前仍不完全清楚.
本研究旨在通过转染tHBxΔ35, wt-HBx到正常肝细胞中探讨对肝细胞生长及增殖的影响.
构建wt-HBx和tHBxΔ35重组慢病毒表达载体, 用磷酸钙方法包装成慢病毒颗粒稳定转染肝细胞株, 用细胞计数, 细胞活力测定, 集落形成实验, 流式细胞仪等方法检测对肝细胞增殖和凋亡效应的影响.
重组慢病毒载体及稳定转染细胞株构建成功; 重组慢病毒tHBxΔ35相对于重组慢病毒wt-HBx组和CTRL对照组促进肝细胞增殖, 而重组慢病毒wt-HBx组则相比较重组慢病毒tHBxΔ35, CTRL对照组在肝细胞增殖速度中最慢(P<0.05); tHBxΔ35可能通过促进细胞S期的合成而刺激细胞增殖, 而wt-HBx可能通过捕获细胞的G0/G1期而抑制细胞增殖.
tHBxΔ35对肝细胞具有促进增殖的作用, 而wt-HBx对肝细胞具有抑制增殖的作用.
以tHBxΔ35促进肝细胞增殖为理论基础, 接下来将进一步探寻tHBxΔ35对其靶基因的作用机制, 进而对临床中乙型肝炎患者的诊断和治疗提供有价值的理论基础.
非常感谢香港中文大学陈力元教授, 郑诗乐教授在本实验中给予极大的帮助.
学科分类: 胃肠病学和肝病学
手稿来源地: 广东省
同行评议报告分类
A级 (优秀): A
B级 (非常好): B, B
C级 (良好): C, C
D级 (一般): 0
E级 (差): 0
编辑: 崔丽君 电编:张砚梁
| 1. | Zhu RX, Seto WK, Lai CL, Yuen MF. Epidemiology of Hepatocellular Carcinoma in the Asia-Pacific Region. Gut Liver. 2016;10:332-339. [PubMed] [DOI] |
| 2. | Lu T, Seto WK, Zhu RX, Lai CL, Yuen MF. Prevention of hepatocellular carcinoma in chronic viral hepatitis B and C infection. World J Gastroenterol. 2013;19:8887-8894. [PubMed] [DOI] |
| 3. | Levrero M, Zucman-Rossi J. Mechanisms of HBV-induced hepatocellular carcinoma. J Hepatol. 2016;64:S84-S101. [PubMed] [DOI] |
| 4. | Ding SL, Yang ZW, Wang J, Zhang XL, Chen XM, Lu FM. Integrative analysis of aberrant Wnt signaling in hepatitis B virus-related hepatocellular carcinoma. World J Gastroenterol. 2015;21:6317-6328. [PubMed] [DOI] |
| 5. | Al-Qahtani AA, Al-Anazi MR, Nazir N, Ghai R, Abdo AA, Sanai FM, Al-Hamoudi WK, Alswat KA, Al-Ashgar HI, Khan MQ. Hepatitis B virus (HBV) X gene mutations and their association with liver disease progression in HBV-infected patients. Oncotarget. 2017;8:105115-105125. [PubMed] [DOI] |
| 6. | Shih C, Yang CC, Choijilsuren G, Chang CH, Liou AT. Hepatitis B Virus. Trends Microbiol. 2018;26:386-387. [PubMed] [DOI] |
| 7. | Chen Z, Tang J, Cai X, Huang Y, Gao Q, Liang L, Tian L, Yang Y, Zheng Y, Hu Y. HBx mutations promote hepatoma cell migration through the Wnt/β-catenin signaling pathway. Cancer Sci. 2016;107:1380-1389. [PubMed] [DOI] |
| 8. | Iavarone M, Trabut JB, Delpuech O, Carnot F, Colombo M, Kremsdorf D, Bréchot C, Thiers V. Characterisation of hepatitis B virus X protein mutants in tumour and non-tumour liver cells using laser capture microdissection. J Hepatol. 2003;39:253-261. [PubMed] |
| 9. | Wang Y, Lau SH, Sham JS, Wu MC, Wang T, Guan XY. Characterization of HBV integrants in 14 hepatocellular carcinomas: association of truncated X gene and hepatocellular carcinogenesis. Oncogene. 2004;23:142-148. [PubMed] |
| 10. | Xu R, Zhang X, Zhang W, Fang Y, Zheng S, Yu XF. Association of human APOBEC3 cytidine deaminases with the generation of hepatitis virus B x antigen mutants and hepatocellular carcinoma. Hepatology. 2007;46:1810-1820. [PubMed] |
| 11. | Jiang Z, Liu H. Metformin inhibits tumorigenesis in HBV-induced hepatocellular carcinoma by suppressing HULC overexpression caused by HBX. J Cell Biochem. 2017; Epub ahead of print. [PubMed] [DOI] |
| 12. | Yang Y, Wang X, Zhang Y, Yuan W. Hepatitis B virus X protein and proinflammatory cytokines synergize to enhance TRAIL-induced apoptosis of renal tubular cells by upregulation of DR4. Int J Biochem Cell Biol. 2018;97:62-72. [PubMed] [DOI] |
| 13. | Lee S, Kim W, Ko C, Ryu WS. Hepatitis B virus X protein enhances Myc stability by inhibiting SCF(Skp2) ubiquitin E3 ligase-mediated Myc ubiquitination and contributes to oncogenesis. Oncogene. 2016;35:1857-1867. [PubMed] [DOI] |
| 14. | Park SH, Lee SM, Kim YJ, Kim S. ChARM: Discovery of combinatorial chromatin modification patterns in hepatitis B virus X-transformed mouse liver cancer using association rule mining. BMC Bioinformatics. 2016;17:452. [PubMed] [DOI] |
| 15. | Tu H, Bonura C, Giannini C, Mouly H, Soussan P, Kew M, Paterlini-Bréchot P, Bréchot C, Kremsdorf D. Biological impact of natural COOH-terminal deletions of hepatitis B virus X protein in hepatocellular carcinoma tissues. Cancer Res. 2001;61:7803-7810. [PubMed] |
| 16. | Zhang AY, Lai CL, Poon RT, Huang FY, Seto WK, Fung J, Wong DK, Yuen MF. Hepatitis B virus full-length genomic mutations and quasispecies in hepatocellular carcinoma. J Gastroenterol Hepatol. 2016;31:1638-1645. [PubMed] [DOI] |