修回日期: 2016-12-28
接受日期: 2017-01-09
在线出版日期: 2017-02-28
探讨小肠血管畸形患者再出血率及相关危险因素, 指导临床对此类患者的管理, 同时探讨沙利度胺对小肠血管畸形患者再出血率的影响.
选取郑州大学第一附属医院2012-01/2014-12行胶囊内镜(capsule endoscopy, CE)及小肠镜检查的消化道出血患者, 排除其中非小肠血管畸形患者, 通过查阅病历、门诊随访及打电话随访的方式观察小肠血管畸形患者(156例)的再出血率, 分析再出血相关危险因素及应用沙利度胺患者(70例)和未应用沙利度胺患者(86例)再出血率有无差异.
共纳入小肠血管畸形患者156例并全部完成随访, 平均随访时间10.78 mo±7.64 mo, 再出血率为46.15%(72/156), 其中高血压病史(HR = 1.994, 95%CI: 1.236-3.125, P = 0.005)、畸形血管数(≥3)(HR = 1.644, 95%CI: 1.002-2.703, P = 0.049)、肝硬化病史(HR = 2.116, 95%CI: 1.063-4.212, P = 0.033)是小肠血管畸形患者再出血的独立危险因素, 而应用沙利度胺治疗是小肠血管畸形患者再出血保护性因素(HR = 0.497, 95%CI: 0.303-0.816, P = 0.006). CE及小肠镜检查后治疗患者再出血率比较, 应用沙利度胺患者再出血率比未应用沙利度胺患者再出血率低(35.71% vs 54.65%), 差异具有统计学意义(P<0.05).
小肠血管畸形患者再出血率较高, 应该在内镜检查后密切随访, 尤其是合并高血压、肝硬化、血管畸形数目(≥3)的患者, 建议在2年内复查CE或电子小肠镜. 无相关禁忌证的患者在药物治疗方面可给予沙利度胺应用, 可以降低其再出血率.
核心提要: 在对156例小肠血管畸形患者的随访研究中, 发现其再出血率较高(46.15%), 其中高血压病史、畸形血管数(≥3)、肝硬化病史是小肠血管畸形患者再出血的独立危险因素, 而应用沙利度胺治疗可以降低再出血率, 并且差异具有统计学意义(P<0.05). 对于合并高危因素患者应积极采取措施控制危险因素, 并在胶囊内镜(capsule endoscopy, CE)及小肠镜检查后密切随访, 必要时复查CE或小肠镜检查, 以改善预后并尽可能预防严重再出血事件发生.
引文著录: 王亚, 张金平, 牛颖, 李建生. 小肠血管畸形患者再出血危险因素及沙利度胺干预治疗. 世界华人消化杂志 2017; 25(6): 552-559
Revised: December 28, 2016
Accepted: January 9, 2017
Published online: February 28, 2017
To investigate the risk factors for re-bleeding events in patients with small intestinal vascular malformation and assess the influence of thalidomide on the re-bleeding rate.
This study involved patients with gastrointestinal bleeding referred to the First Affiliated Hospital of Zhengzhou University for capsule endoscopy (CE) and enteroscopy between January 2012 and December 2014. Only patients with small intestinal vascular malformation were included in the study. Follow-up data were obtained through medical records review, telephone interviews or follow-up clinic visits to identify the risk factors associated with re-bleeding. Based on the follow-up data, the re-bleeding rate was compared between patients who had been treated with thalidomide and those who had not.
A total of 156 patients were included in the study, and all of them completed the follow-up, with a mean follow-up duration of 10.78 ± 7.64 mo. Multiple regression analysis identified that presence of hypertension (HR = 1.994, 95%CI: 1.236-3.125, P = 0.005), multiple lesions (≥3) (HR = 1.644, 95%CI: 1.002-2.703, P = 0.049) and liver cirrhosis (HR = 2.116, 95%CI: 1.063-4.212, P = 0.033) were significant independent predictors of re-bleeding, while treatment with thalidomide was a protecting factor (HR = 0.497, 95%CI: 0.303-0.816, P = 0.006). The cumulative re-bleeding rates in patients who were treated with thalidomide and those who were not were 35.71% and 54.65%, respectively, and the difference reached statistical significance (P < 0.05).
The re-bleeding rate in patients with small bowel vascular malformation is relatively high, especially those with hypertension, multiple lesions (≥3) and liver cirrhosis. Repeated CE or enteroscopy is recommended for those patients with risk factors for re-bleeding within 2 years. Treatment with thalidomide for patients without contraindication can reduce the re-bleeding rate.
- Citation: Wang Y, Zhang JP, Niu Y, Li JS. Re-bleeding events in patients with small intestinal vascular malformation: Risk factors and effect of treatment with thalidomide. Shijie Huaren Xiaohua Zazhi 2017; 25(6): 552-559
- URL: https://www.wjgnet.com/1009-3079/full/v25/i6/552.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v25.i6.552
小肠血管畸形包括血管扩张症、血管发育不良、动静脉畸形等病变, 病变累及小动脉、小静脉及毛细血管. 现在发病原因不明确, 可能为先天性血管发育不良, 也可能为后天性血管退行性变和黏膜慢性缺血有关, 也有人认为其发生与内脏脂肪堆积有关[1]. 目前关于小肠血管畸形的诊断主要靠胶囊内镜(capsule endoscopy, CE)及小肠镜来诊断, CE及小肠镜可以直视小肠黏膜及黏膜血管, 故而具有较高的诊断率. 不明原因消化道出血(obscure gastrointestinal bleeding, OGIB)中的5%-10%来自小肠出血, 而小肠血管畸形是小肠出血的主要原因, 由于CE及小肠镜被越来越多的应用于临床, 越来越多的小肠血管畸形被检出, 病变多隐匿, 多发, 且易于再生, 传统的治疗方法包括内镜下氩气等离子体电凝、外科手术、介入栓塞术可以有效地治疗局限的血管病变, 但对于多发弥漫性病变仍无确切疗效, 故小肠血管畸形患者有较高的再出血率, 并具有反复出血的特点. 药物治疗方面, 激素类药物包括雌激素及孕激素之前被认为有前景的, 但最近的一项随机临床试验证实是无效的[2]. 生长抑素及其衍生物奥曲肽等也被用来治疗血管畸形出血患者, 并认为可以减少出血, 但仍需要同其他标准方案连用, 并且与之前的研究相比不良反应多了30%[3]. 沙利度胺因其抗血管生成作用被用来治疗小肠血管畸形, 并被一些研究证实是有效的, 但对于再出血率的影响研究尚缺乏. 本研究旨在探讨小肠血管畸形患者再出血的危险因素, 同时探讨沙利度胺治疗对患者再出血率的影响.
回顾性分析郑州大学第一附属医院消化科2012-01/2014-12收治的OGIB并完成CE及小肠镜检查患者资料. 经过郑州大学第一附属医院胃镜及结肠镜检查均无阳性发现, 顺利完成CE及小肠镜检查并确诊为小肠血管畸形患者, 最终入组156例, 根据不同的治疗方法将其分为应用沙利度胺治疗组(70例), 未应用沙利度胺治疗组(86例), 未应用沙利度胺治疗患者同时也未应用其他治疗措施. 纳入标准: (1) CE或小肠镜检查前于郑州大学第一附属医院行胃镜及结肠镜检查, 并且无阳性发现者; (2)首次行CE或小肠镜检查者, 而非明确病因后复查者; (3)顺利完成CE检查而无滞留者; (4)小肠镜检查患者完成经口及肛门检查的对接, 无遗漏部分、经内镜检查后确诊为小肠血管畸形并且没有合并感染、肿瘤及其他病变. 应用沙利度胺治疗的年轻育龄期女性需避孕. 应用沙利度胺治疗的禁忌证: (1)肝硬化所致静脉曲张及门脉高压性胃病、恶性肿瘤或严重的器官功能障碍; (2)有周围神经病变、癫痫发作史或血栓性疾病史; (3)1年内曾使用过非甾体抗炎药、银杏类中草药、紫锥花属类中草药或曾接受过抗血管生成药物及免疫调节剂治疗者; (4)近期接受系统的肿瘤化疗及放疗者[4]. 服用沙利度胺的剂量为(50 mg BID, 疗程4 mo). 收集156例患者的临床资料, 包括: (1)一般特征: 性别、年龄、出血类型(显性出血或隐性出血)吸烟史、饮酒史、抗血小板药物应用史、合并症(高血压病、糖尿病、心血管疾病、脑血管疾病、肝硬化)等; (2)接受CE及小肠镜前的检查: 最低血红蛋白浓度, 输血史, 铁剂替代治疗史; (3)确诊后有无再出血、治疗方法及每月复查血红蛋白浓度. 本研究经郑州大学第一附属医院伦理委员会审核批准, 所有研究对象均签署知情同意书.
1.2.1 检查方法: 选用以色列GIVEN影像有限公司生产的无线二代CE. 所有患者于检查前6-8 h禁食并口服复方聚乙二醇电解质散剂(舒泰清)清肠, 然后吞服CE, 允许自由活动. CE图像由RAPID® 6.5 ACCESS软件处理, 结果由2个有经验的内镜医师分开出报告, 若报告有差异, 则共同商讨, 达成一致意见. 小肠镜是奥林巴斯公司生产的单气囊小肠镜, 所有患者经口检查前禁食12 h, 经肛检查前6-8 h禁食并口服复方聚乙二醇电解质散剂(舒泰清)清肠. 以先经口侧, 于到达的肠段用鈦夹做标记, 后经肛侧到达金属钛夹所在位置的方式, 完成全消化道的检查. 所有患者经胶囊胃镜检查拟诊后均经过小肠镜重复检查确诊为小肠血管畸形.
1.2.2 内镜下血管畸形诊断标准: 内镜下血管畸形诊断标准为局部或弥漫性分布静脉/毛细血管病变, 可表现为红色扩张血管、搏动性隆起伴周围静脉扩张、片状红斑伴或不伴有渗血等[4].
1.2.3 相关概念: 显性出血指肉眼可见的出血如便血或黑便, 隐性出血指的是反复慢性缺铁性贫血和/或大便潜血阳性而无明显可见出血; 再出血指的是CE检查后反复出现肉眼可见的出血(便血或黑便)或血红蛋白浓度较正常基线值下降>20 g/L或再次需要输血治疗, 并且近期常规内镜(胃镜及结肠镜)检查阴性[5].
1.2.4 随访: 于CE及小肠镜检查确诊后嘱患者每月复查血常规, 每月采用电话或门诊随访2年(24 mo), 随访时间定义为CE检查后至再出血事件发生时间, 若无再出血事件发生则为随访截止日期.
统计学处理 所有数据采用SPSS19.0软件进行统计学分析. 采用COX比例风险模型单因素及多因素分析方法评估各因素与再出血危险性的关系, 是否应用沙利度胺组再出血事件发生率的比较采用Kaplan-Meier模型分析和Log-Rank检验, 连续性计量资料用mean±SD表示, 分类变量采用数字和百分比表示, 采用χ2检验或校正χ2检验. P<0.05为差异有统计学意义.
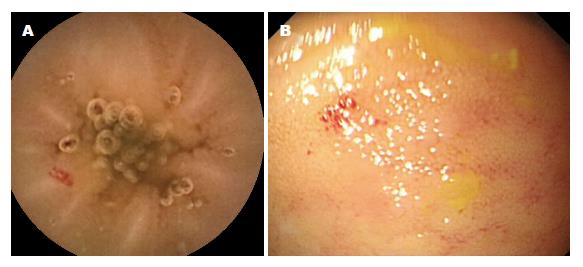
156例完成CE及小肠镜检查并诊断为小肠血管畸形患者, 平均年龄为52.13岁±19.23岁, 病变于CE及小肠镜下所见(图1), 所有患者均完成随访(100%), 所有患者临床特点如表1. 总体平均随访时间10.78 mo±7.64 mo, 随访期间共有72例发生再出血事件, 再出血率为46.15%(72/156). 其中应用沙利度胺治疗组患者70例(44.87%), 再出血率为35.71%(25/70), 未应用沙利度胺治疗组患者86例, 再出血率为54.65%(47/86), 应用沙利度胺组患者再出血率较低(P = 0.024), 随访时间较长(P = 0.024), 差异均具有统计学意义, 而2组在一般情况(性别、年龄、吸烟、饮酒史、输血史、最低血红蛋白浓度)、出血类型、合并症、药物应用等方面无差异.
| 总体(n = 156) | 未应用沙利度胺n(%) | 应用沙利度胺n(%) | P值 | |
| 性别 | 0.071 | |||
| 男 | 95 | 58(61.05) | 37(38.95) | |
| 女 | 61 | 28(45.90) | 33(54.10) | |
| 出血类型 | 0.543 | |||
| 显性出血 | 145 | 81(55.86) | 64(44.14) | |
| 隐性出血 | 11 | 5(45.45) | 6(54.55) | |
| 抗血小板药物 | 0.179 | |||
| 否 | 119 | 63(52.94) | 56(47.06) | |
| 是 | 37 | 23(62.16) | 14(37.84) | |
| 吸烟史 | 0.092 | |||
| 否 | 102 | 51(50.00) | 51(50.00) | |
| 是 | 57 | 35(63.93) | 22(36.07) | |
| 饮酒史 | 0.609 | |||
| 否 | 106 | 60(56.60) | 46(43.40) | |
| 是 | 50 | 26(52.00) | 24(48.00) | |
| 脑血管疾病 | 0.658 | |||
| 否 | 132 | 74(56.06) | 58(43.94) | |
| 是 | 24 | 12(50.00) | 12(50.00) | |
| 心血管疾病 | 0.836 | |||
| 否 | 127 | 69(54.33) | 58(45.67) | |
| 是 | 29 | 17(58.62) | 12(41.38) | |
| 高血压病 | 0.957 | |||
| 否 | 91 | 50(54.33) | 41(45.05) | |
| 是 | 65 | 36(55.38) | 29(44.62) | |
| 高脂血症 | 0.866 | |||
| 否 | 102 | 57(55.88) | 45(44.12) | |
| 是 | 54 | 29(53.70) | 25(46.30) | |
| 糖尿病 | 0.789 | |||
| 否 | 141 | 77(54.61) | 64(45.39) | |
| 是 | 15 | 9(60.00) | 6(40.00) | |
| 畸形血管数(≥3) | 0.498 | |||
| 否 | 80 | 42(52.50) | 38(47.50) | |
| 是 | 76 | 44(57.89) | 32(42.11) | |
| 肝硬化 | 0.420 | |||
| 否 | 141 | 76(53.90) | 65(46.10) | |
| 是 | 15 | 10(66.67) | 5(33.33) | |
| 输血史 | 0.214 | |||
| 否 | 45 | 21(46.67) | 24(53.33) | |
| 是 | 111 | 65(58.56) | 46(41.44) | |
| 铁剂替代治疗 | 0.496 | |||
| 否 | 105 | 60(57.14) | 45(42.86) | |
| 是 | 51 | 26(50.98) | 25(49.02) | |
| 是否再出血 | 0.024 | |||
| 否 | 86 | 39(46.43) | 45(53.57) | |
| 是 | 70 | 47(65.28) | 25(34.72) | |
| 年龄 | 52.13±19.23 | 51.00±20.58 | 53.51±17.49 | 0.418 |
| 最低血红蛋白浓度 | 75.57±15.00 | 76.84±15.04 | 74.01±14.92 | 0.244 |
| 时间 | 10.78±7.64 | 9.55±7.67 | 12.29±7.37 | 0.025 |
随访小肠血管畸形患者, COX比例风险模型单因素分析显示: 脑血管疾病史(P = 0.081)、高血压病史(P = 0.001)、畸形血管数(≥3)(P = 0.042)、肝硬化病史(P = 0.036)、最低血红蛋白浓度(P = 0.055)是再出血的危险因素, 而排除混杂因素后多因素分析显示: 高血压病史(HR = 1.994, 95%CI: 1.236-3.125, P = 0.005)、畸形血管数(≥3)(HR = 1.644, 95%CI: 1.002-2.703, P = 0.049)、肝硬化病史(HR = 2.116, 95%CI: 1.063-4.212, P = 0.033)是小肠血管畸形患者再出血的独立危险因素, 而应用沙利度胺治疗是小肠血管畸形患者再出血保护性因素(HR = 0.497, 95%CI: 0.303-0.816, P = 0.006, 表2).
| 因素 | 未再出血(n = 84) | 再出血(n = 72) | 单因素 | 多因素 | |||
| P值 | Exp(B) | 95%CI用于Exp(B) | P值 | ||||
| 下部 | 上部 | ||||||
| 性别(女) | 30 | 31 | 0.247 | N/A | N/A | N/A | N/A |
| 年龄(岁) | 51.08 | 53.35 | 0.529 | N/A | N/A | N/A | N/A |
| 出血类型(隐性) | 6 | 5 | 0.793 | N/A | N/A | N/A | N/A |
| 抗血小板药物 | 19 | 18 | 0.505 | N/A | N/A | N/A | N/A |
| 吸烟史 | 38 | 23 | 0.190 | N/A | N/A | N/A | N/A |
| 饮酒史 | 28 | 22 | 0.795 | N/A | N/A | N/A | N/A |
| 脑血管疾病 | 10 | 14 | 0.081 | 1.570 | 0.859 | 2.869 | 0.143 |
| 心血管疾病 | 14 | 15 | 0.572 | N/A | N/A | N/A | N/A |
| 高血压病 | 26 | 39 | 0.001 | 1.994 | 1.236 | 3.125 | 0.005 |
| 高脂血症 | 26 | 28 | 0.147 | N/A | N/A | N/A | N/A |
| 糖尿病 | 7 | 8 | 0.470 | N/A | N/A | N/A | N/A |
| 畸形血管数(≥3) | 34 | 42 | 0.042 | 1.644 | 1.002 | 2.703 | 0.049 |
| 肝硬化 | 4 | 11 | 0.036 | 2.116 | 1.063 | 4.212 | 0.033 |
| 输血史 | 56 | 55 | 0171 | N/A | N/A | N/A | N/A |
| 最低血红蛋白浓度(g/L) | 73.40 | 77.78 | 0.055 | 1.015 | 0.999 | 1.031 | 0.063 |
| 铁剂替代治疗 | 30 | 21 | 0.455 | N/A | N/A | N/A | N/A |
| 应用沙利度胺 | 45 | 25 | 0.009 | 0.497 | 0.303 | 0.816 | 0.006 |
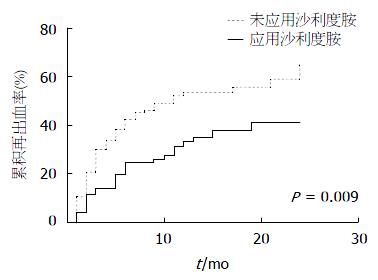
使用Kaplan-Meier法生存曲线模型绘制出应用和未应用沙利度胺组患者累积再出血率曲线(图2), 从曲线上看应用沙利度胺组患者累积再出血率较低, 并且差异有统计学意义(P = 0.009, Log-rank检验).
小肠血管畸形包括血管扩张症、血管发育不良、动静脉畸形等病变. 小肠血管扩张是由一系列没有正常弹性内膜结构的薄壁扭曲毛细血管组成的不正常血管[6], Yano等[7]将小肠血管扩张根据内镜下形态分为4种类型, 同时又进一步将1型分为1a及1b型, 1a型指的是内镜下可见点状红斑, 直径<1 mm伴或不伴有血液渗出, 1b型指的是内镜下可见片状红斑, 直径约2-3 mm伴或不伴有血液渗出; 2型分为2a型及2b型, 2a型指的是点状损伤伴搏动性出血, 2b型指的是搏动性红色出血灶不伴有周围静脉扩张; 3型指的是搏动性红色出血灶伴有周围静脉扩张; 4型指的是其他未分类型. 血管发育不良是一种位于肠道黏膜层或黏膜下层的薄壁, 扩张的点状红色血管结构, 是下OGIB及小肠出血的主要原因, 他通常位于盲肠、升结肠、空肠、回肠, 病变多发, 而小肠血管发育不良占小肠出血的30%-40%, 并且是年龄>50岁患者小肠出血的主要原因[8], 多与血管退行性变有关. 动静脉畸形是由厚而肥大的血管壁的畸形动静脉互相连络组成, 这些病变通常是先天性的, 多在年轻患者中被发现.
CE是小肠疾病, 尤其是小肠血管病变的首选检查方式, 因为其具有无创、操作简便、无交叉感染等的特点, 特别适合并有心、脑、肺、肾等器官疾病及不能耐受小肠镜检查的老年患者, 现正在临床上广泛应用, 而小肠镜是小肠出血的二线检查手段, 可以对CE的结果进一步补充及确认, 同时对于伴有活动性出血的患者条件允许时可以同时行内镜下氩气电凝治疗[9]. 目前关于小肠血管畸形诊断无明确标准, 多参考Yano-Yamamoto's的内镜下分型. 小肠血管畸形患者病灶大多隐匿, 多发, 内镜下氩气电凝治疗及手术难以根治, 又缺乏有效的药物治疗方法, 故其再出血率较高, 且部分患者易反复出现显性或隐性再出血, 甚至有患者会发生危及生命的消化道大出血, 随访中2例患者因反复发生出血导致失血性休克于外科行小肠部分切除术. 本研究中小肠血管畸形患者再出血率为46.15%, 而Igawa等[6]报道了小肠血管扩张患者再出血率为33.80%.
关于小肠血管畸形患者再出血危险因素探讨, 本研究中血管畸形数目(≥3)是再出血独立危险因素, 与Sakai等[10]研究结果相符合. 门脉高压性胃肠病是OGIB的一个重要原因, CE下常常把门脉高压性胃肠病描述为红斑、血管扩张等病变, Akyuz等[11]开展了一项基于CE的研究, 发现67%的门脉高压性胃肠病患者合并肝硬化, 同时肝硬化是小肠血管扩张发生的一个独立危险因素[6], 肝硬化患者再出血风险增加可能与肝脏储备功能下降导致凝血功能异常和/或门脉高压导致的外周血管阻力增加所致. 小肠血管畸形合并高血压患者再出血风险增加, 与文献报道相似, 可能由于高血压本身可慢性动态改变动脉血管壁的弹性和厚度, 导致小动脉瘤的发生, 并可能在血压骤升时破裂; 或已有血管发育不良患者的病变血管壁厚薄不均, 血压升高时可导致管壁较薄部位发生破裂而出血[12].
沙利度胺(反应停), 化学名为酚胺哌啶酮, 曾被广泛用于早孕反应止吐的治疗, 后因严重致畸作用而被禁用. 由于他具有强大的抗炎、免疫调节、抗血管生成作用, 现在正在被重新应用于麻风病、多发性骨髓瘤和各种肿瘤性疾病的治疗. 沙利度胺的抗血管生成作用在治疗小肠血管畸形中起重要作用, 这种作用机制目前尚不明确, 可能包括以下2种途径: (1)血管内皮生长因子(vascular endothelial growth factor, VEGF)在小肠血管畸形患者血清中是增加的, VEGF是一种重要的促血管生成物质, 在癌细胞的形成及正常细胞在低氧循环时明显增加, VEGF在小肠血管畸形形成的病理过程中起重要作用, 尤其是老年患者及肠黏膜细胞慢性缺氧时通过产生VEGF促进血管畸形的发生, 而沙利度胺可以抑制VEGF的产生实现抗血管生成作用; (2)沙利度胺可以抑制转录因子核因子-κB(nuclear factor-kappa B, NF-κB), 而NK-κB在细胞凋亡过程中起作用, 现在认为沙利度胺在体内的代谢物可以使NK-κB失活, 继而减慢细胞生长并且诱导新生的血管内皮细胞凋亡[13]. Peng等[14]报道沙利度胺可降低遗传性出血性毛细血管扩张患者转化生长因子-β3和信使RNA表达, 同时降低血浆中VEGF的表达, 并且导致血管重塑, 明显改善患者出血状况; Perze Botero等[15]报道一例先天性凝血因子V缺乏合并小肠动静脉畸形患者反复发作OGIB, 经沙利度胺治疗后出血症状消失, 通过CE比较治疗前后病灶前后范围、大小、颜色、程度均有明显改善; 国内学者Ge等[4]开展一项高质量随机对照研究, 对应用沙利度胺的胃肠道血管畸形患者进行了长达一年的随访, 观察到患者出血次数、输血要求及住院治疗次数均有所降低, 随访中并未出现危及生命的严重不良反应, 多数不适可以通过对症治疗缓解, 从而证实了沙利度胺在胃肠道血管畸形的治疗中的有效性及短期应用(疗程4 mo)的安全性. 本研究中未应用沙利度胺组患者同时也未应用其他治疗措施, 以便观察该病的自然进程, 应用沙利度胺组患者再出血率较低(P = 0.024), 随访时间较长(P = 0.024), 可见沙利度胺可降低患者再出血率, 并且延长再出血时间, 从而延缓再出血事件的发生, 2组患者在其他方面无差异, 可排除其对结果的干扰.
越来越多的研究表明沙利度胺在小肠血管畸形出血中短期用药的有效性及安全性, 但他所具有严重的不良反应不可忽视, 包括周围神经病变、便秘、嗜睡、镇静、皮疹、深静脉血栓及海豹肢畸形等, 所以在临床应用中存在诸多限制. 本研究在随访中1例患者因为并发严重的周围神经病变并同时有反复OGIB不得不中止使用沙利度胺. 目前国外关于其在小肠血管畸形中的应用也只多为个案报道, 同时仅为短期(疗程多为4 mo)应用. 本研究中应用沙利度胺组患者再出血率为35.71%, 仍相对较高, 威胁着部分患者的生命安全, 而发生再出血后患者能否继续应用沙利度胺及最长耐受时间仍然是亟待解决的问题. 总体来说沙利度胺是一类不良反应较大的药物, 因而限制了其在临床上长时间重复应用. Pereira等[16]正在研究一种沙利度胺负荷的可进行生物降解的皮下植入物, 他可以在距离病变部位最近的位置缓慢释放, 在维持有效的治疗浓度同时可以减轻全身系统不良反应, 有望成为小肠血管畸形患者长期维持治疗的方案. 同时随着新药来那度胺在临床上的应用, 他具有与沙利度胺相似的药理作用但具有较小的不良反应, 也许在不久的将来可以解决沙利度胺带来的问题, 成为长期控制小肠血管畸形出血的新型药物[13].
本研究存在一些限制, 首先本研究是回顾性研究, 难以避免的存在一些选择偏倚, 其次小肠血管畸形的诊断标准尚不明确, 可能存在CE及小肠镜漏诊或误诊的情况, 本研究样本量不够大, 可能会限制我们的结论, 为了完善对小肠血管畸形患者再出血风险的评估及管理, 仍需要大量大样本随机对照试验进行研究.
本研究可以看出小肠血管畸形患者再出血率较高, 对于合并高危因素患者应积极采取措施控制危险因素, 并在CE及小肠镜检查后2年内密切随访, 必要时复查CE或小肠镜检查, 以改善预后并尽可能预防严重再出血事件发生. 关于沙利度胺, 在长期控制出血的长期用药方案及药物释放系统仍需要进一步的研究, 以期降低再出血率的同时减少药物的不良反应.
不明原因消化道出血(obscure gastrointestinal bleeding, OGIB)是威胁患者生命安全的一个常见原因, 而OGIB中的5%-10%来自小肠出血, 而小肠血管畸形是小肠出血的主要原因, 由于胶囊内镜(capsule endoscopy, CE)及小肠镜被越来越多的应用于临床, 越来越多的小肠血管畸形被检出. 但目前在临床上尚无明确的诊断标准及统一的治疗方法, 故对该病的研究不可或缺.
小肠血管畸形患者常具有反复出血的特点, 尤其是有多种合并症的患者, 制定一个严格的随访指南对降低再出血率及改善预后意义重大; 在药物治疗方面, 沙利度胺的抗血管生成作用已被大部分的研究证实, 但是在控制出血的长期用药方案及药物释放系统仍需要进一步的研究, 以期降低再出血率的同时减少药物的不良反应; 同时统一的诊断及治疗标准是亟待研究的问题.
以前的研究集中在对OGIB的研究, 而单独研究小肠血管畸形的少见. 内镜下治疗对小肠血管畸形的疗效显著, 尤其是对伴有活动性出血的患者, 对患者的临床症状和生活有良好的改善作用, 但是对影响其再出血的危险因素研究较少. 本文研究发现高血压病史、畸形血管数(≥3)、肝硬化病史是小肠血管畸形患者再出血的独立危险因素, 而应用沙利度胺治疗可以降低再出血率, 延缓再出血事件的发生时间.
本文着重研究小肠血管畸形患者再出血的危险因素, 其再出血率较高(46.15%), 其中高血压病史、畸形血管数(≥3)、肝硬化病史是小肠血管畸形患者再出血的独立危险因素, 对于指导对患者的管理和随访意义重大; 未应用沙利度胺组患者同时也未给予其他治疗措施, 以便于观察该病的自然进程, 文中提出了一种沙利度胺负荷的可进行生物降解的皮下植入物, 他可以在距离病变部位最近的位置缓慢释放, 在维持有效的治疗浓度同时可以减轻全身系统不良反应, 有望成为小肠血管畸形患者长期维持治疗的方案, 引导其他学者在这方面进行深入的研究.
小肠血管畸形患者常具有反复出血的特点, 部分患者甚至发生失血性休克, 尤其是有多种合并症的患者, 制定一个严格的随访指南对降低再出血率及改善预后意义重大; 在药物治疗方面, 沙利度胺的抗血管生成作用已被大部分的研究证实, 但是不良反应较大, 随着新药来那度胺在临床上的应用, 未来能否取代沙利度胺成为临床上的治疗小肠血管畸形的主要药物仍需要更进一步的研究.
显性出血: 指肉眼可见的出血如便血或黑便;
隐性出血: 指的是反复慢性缺铁性贫血和/或大便潜血阳性而无明显可见出血;
再出血: 指的是CE检查后反复出现肉眼可见的出血(便血或黑便)或血红蛋白浓度较正常基线值下降>20 g/L或再次需要输血治疗, 并且近期常规内镜(胃镜及结肠镜)检查阴性.
郭晓钟, 教授, 辽宁省沈阳市, 沈阳军区总医院消化内科; 蒋波涛, 副主任医师, 广州中医药大学附属重庆北碚中医院消化内科; 刘爱群, 副主任医师, 广西医科大学附属肿瘤医院内科
本文将多种影响小肠血管畸形患者再出血的危险因素及药物治疗结合在一起, 有一定的创新性.
手稿来源: 自由投稿
学科分类: 胃肠病学和肝病学
手稿来源地: 河南省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C, C
D级 (一般): D
E级 (差): 0
编辑: 马亚娟 电编:胡珊
| 1. | Yamada A, Niikura R, Kobayashi Y, Suzuki H, Yoshida S, Watabe H, Yamaji Y, Hirata Y, Koike K. Risk factors for small bowel angioectasia: The impact of visceral fat accumulation. World J Gastroenterol. 2015;21:7242-7247. [PubMed] [DOI] |
| 2. | Junquera F, Feu F, Papo M, Videla S, Armengol JR, Bordas JM, Saperas E, Piqué JM, Malagelada JR. A multicenter, randomized, clinical trial of hormonal therapy in the prevention of rebleeding from gastrointestinal angiodysplasia. Gastroenterology. 2001;121:1073-1079. [PubMed] [DOI] |
| 3. | Holleran G, Hall B, Breslin N, McNamara D. Long-acting somatostatin analogues provide significant beneficial effect in patients with refractory small bowel angiodysplasia: Results from a proof of concept open label mono-centre trial. United European Gastroenterol J. 2016;4:70-76. [PubMed] [DOI] |
| 4. | Ge ZZ, Chen HM, Gao YJ, Liu WZ, Xu CH, Tan HH, Chen HY, Wei W, Fang JY, Xiao SD. Efficacy of thalidomide for refractory gastrointestinal bleeding from vascular malformation. Gastroenterology. 2011;141:1629-1637.e1-e4. [PubMed] [DOI] |
| 5. | Kim JB, Ye BD, Song Y, Yang DH, Jung KW, Kim KJ, Byeon JS, Myung SJ, Yang SK, Kim JH. Frequency of rebleeding events in obscure gastrointestinal bleeding with negative capsule endoscopy. J Gastroenterol Hepatol. 2013;28:834-840. [PubMed] [DOI] |
| 6. | Igawa A, Oka S, Tanaka S, Kunihara S, Nakano M, Aoyama T, Chayama K. Major predictors and management of small-bowel angioectasia. BMC Gastroenterol. 2015;15:108. [PubMed] [DOI] |
| 7. | Yano T, Yamamoto H, Sunada K, Miyata T, Iwamoto M, Hayashi Y, Arashiro M, Sugano K. Endoscopic classification of vascular lesions of the small intestine (with videos). Gastrointest Endosc. 2008;67:169-172. [PubMed] [DOI] |
| 8. | Tan HH, Ge ZZ, Chen HM, Gao YJ. Successful treatment with thalidomide for a patient with recurrent gastrointestinal bleeding due to angiodysplasia diagnosed by capsule endoscopy. J Dig Dis. 2013;14:153-155. [PubMed] [DOI] |
| 9. | Gerson LB, Fidler JL, Cave DR, Leighton JA. ACG Clinical Guideline: Diagnosis and Management of Small Bowel Bleeding. Am J Gastroenterol. 2015;110:1265-1287; quiz 1288. [PubMed] [DOI] |
| 10. | Sakai E, Endo H, Taguri M, Kawamura H, Taniguchi L, Hata Y, Ezuka A, Nagase H, Kessoku T, Ishii K. Frequency and risk factors for rebleeding events in patients with small bowel angioectasia. BMC Gastroenterol. 2014;14:200. [PubMed] [DOI] |
| 11. | Akyuz F, Pinarbasi B, Ermis F, Uyanikoglu A, Demir K, Ozdil S, Besisik F, Kaymakoglu S, Boztas G, Mungan Z. Is portal hypertensive enteropathy an important additional cause of blood loss in portal hypertensive patients? Scand J Gastroenterol. 2010;45:1497-1502. [PubMed] [DOI] |
| 13. | Heidt J, Langers AM, van der Meer FJ, Brouwer RE. Thalidomide as treatment for digestive tract angiodysplasias. Neth J Med. 2006;64:425-428. [PubMed] |
| 14. | Peng HL, Yi YF, Zhou SK, Xie SS, Zhang GS. Thalidomide Effects in Patients with Hereditary Hemorrhagic Telangiectasia During Therapeutic Treatment and in Fli-EGFP Transgenic Zebrafish Model. Chin Med J (Engl). 2015;128:3050-3054. [PubMed] [DOI] |
| 15. | Perez Botero J, Burns D, Thompson CA, Pruthi RK. Successful treatment with thalidomide of a patient with congenital factor V deficiency and factor V inhibitor with recurrent gastrointestinal bleeding from small bowel arteriovenous malformations. Haemophilia. 2013;19:e59-e61. [PubMed] [DOI] |
| 16. | Pereira BG, Batista LF, de Souza PA, da Silva GR, Andrade SP, Serakides R, da Nova Mussel W, Silva-Cunha A, Fialho SL. Development of thalidomide-loaded biodegradable devices and evaluation of the effect on inhibition of inflammation and angiogenesis after subcutaneous application. Biomed Pharmacother. 2015;71:21-28. [PubMed] [DOI] |