修回日期: 2016-11-29
接受日期: 2016-12-05
在线出版日期: 2017-02-08
研究他克莫司(tacrolimus, FK506)预处理对自体原位肝移植(autologous orthotopic liver transplantation, AOLT)大鼠肝脏缺血再灌注(ischemia reperfusion, IR)损伤的作用.
将32只成熟的♂SD大鼠随机分为4组: 假手术组(S组)、AOLT组、AOLT+FK506低剂量处理组(L组)、AOLT+FK506高剂量处理组(H组). 术后6 h取材, 检测4组大鼠血清丙氨酸氨基转移酶(alanine aminotransferase, ALT)、天冬氨酸氨基转移酶(aspartate aminotrans-ferase, AST)、肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)、白介素-6(interleukin-6, IL-6)水平; 观察肝组织病理学改变; 测定高迁移率族蛋白B1(high mobility group box 1, HMGB1)的mRNA及蛋白表达情况.
肝移植术后, L组和H组血清中的ALT、AST及炎症因子TNF-α、IL-6水平均显著低于AOLT组, 但明显高于S组(P<0.05). 肝组织病理表明, AOLT组肝血窦淤血、肝细胞坏死及炎症细胞浸润程度较显著, 而L组和H组较AOLT组明显减轻. L组和H组中HMGB1 mRNA及蛋白表达水平显著低于AOLT组, 但高于S组(P<0.05). 上述检测指标在L组和H组之间比较无显著差异.
FK506预处理可以显著降低AOLT大鼠肝脏HMGB1的表达, 抑制炎症因子释放, 减少细胞坏死, 从而减轻肝脏IR损伤, 保护移植肝脏.
核心提要: 本文通过动物实验的研究, 探索他克莫司(tacrolimus, FK506)预处理对自体原位肝移植大鼠肝脏缺血再灌注(ischemia reperfusion, IR)损伤的作用机制. 研究发现, FK506预处理可以降低大鼠移植肝脏高迁移率族蛋白B1的表达, 抑制炎症因子释放, 减少细胞坏死, 进而减轻肝脏IR损伤, 保护移植肝脏.
引文著录: 陈峰, 王建, 张雅敏. FK506抑制HMGB1的释放减轻肝移植大鼠肝脏缺血再灌注损伤. 世界华人消化杂志 2017; 25(4): 326-333
Revised: November 29, 2016
Accepted: December 5, 2016
Published online: February 8, 2017
To evaluate the effect of tacrolimus (FK506) pretreatment on liver ischemia-reperfusion injury in a rat model of autologous orthotopic liver transplantation (AOLT).
Thirty-two adult SD rats were randomly divided into four groups: sham-operated group (S), AOLT group, low dose FK506-treated group (L), and high dose FK506-treated group (H). After 6 h of reperfusion, serum alanine aminotransferase (ALT), aspartate aminotransferase (AST), tumor necrosis factor-α (TNF-α) and interleukin-6 (IL-6) levels were detected using commercial assay kits. The histopathological changes in the rat liver were assessed by H&E staining. The high mobility group box 1 (HMGB1) expression was tested by immunohistochemistry, RT-qPCR and Western blot assays.
Compared with the S group, serum ALT, AST, TNF-α and IL-6 levels were markedly increased in the AOLT group, but decreased in the FK506-treated groups (P < 0.05). The histopathological changes in the liver of rats in the AOLT group included hepatic sinusoidal congestion, neutrophil infiltration, and hepatocyte necrosis, which were alleviated in the L group and H group. Compared with the S, L and H groups, there was a marked increase in HMGBl translocation and release in the AOLT group, but FK506 pretreatment (L and H groups) reduced the HMGB1 expression in hepatocytes. Compared with the S group, the expression of HMGB1 mRNA and protein also demonstrated a marked increase in the AOLT group, but decreased in the FK506 pretreatment groups. However, there was no significant difference in the above indicators between the L and H groups.
FK506 pretreatment has a protective effect against liver ischemia-reperfusion injury by inhibiting HMGB1 translocation and release, suppressing the release of inflammatory factors, and reducing hepatocyte necrosis in the AOLT rat model.
- Citation: Chen F, Wang J, Zhang YM. FK506 reduces liver ischemia-reperfusion injury in a rat model of autologous orthotopic liver transplantation by decreasing HMGB1 release. Shijie Huaren Xiaohua Zazhi 2017; 25(4): 326-333
- URL: https://www.wjgnet.com/1009-3079/full/v25/i4/326.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v25.i4.326
缺血再灌注(ischemia reperfusion, IR)损伤是肝脏外科常见的组织器官损伤, 是影响肝移植、肝切除术后肝功能恢复的一个重要指标[1-3]. 肝脏IR损伤可使肝脏解毒功能降低, 微循环助力增高, 严重者可导致肝功能衰竭, 直接影响疾病预后、手术成功率和患者存活率[4,5]. 如何保护缺血的肝脏, 减少再灌注带来的损伤是目前亟需解决的临床课题. 由于肝脏IR损伤是多种细胞和炎症因子共同参与的复杂病理生理现象, 而高迁移率族蛋白B1(high mobility group box 1, HMGB1)是一种高度保守并普遍存在于细胞内的非组蛋白[6], 并作为一种重要的炎症介质参与了肝脏IR的损伤过程[7,8]. 他克莫司(tacrolimus, FK506)是目前用作器官移植术后抗排斥反应的新型免疫抑制剂[9], 已被证实对肝脏IR损伤具有保护作用[10-12], 但关于FK506预处理对肝脏移植过程中IR损伤的保护作用与HMGB1的关系目前尚无报道. 因此, 本实验通过建立经门静脉灌注的自体原位肝移植(autologous orthotopic liver transplantation, AOLT)模型来模拟肝脏移植过程中的IR现象, 探讨FK506预处理对肝脏IR损伤的影响及其与HMGB1之间的关系.
健康成年♂SD大鼠, 体质量220-250 g, 由北京军事科学院动物实验中心提供. 主要试剂包括FK506(Astellas公司); ELISA试剂盒(Bio value公司); HMGB1抗体(Abcam公司); 辣根酶标记的IgG二抗(北京中杉金桥生物技术有限公司); TRIzol试剂(Invitrogen公司); PCR试剂盒(TaKaRa公司).
1.2.1 AOLT模型的建立: 大鼠称重后给予麻醉, 固定四肢并皮肤消毒, 沿腹中线开腹, 暴露胸骨柄, 显露剑突, 用拉钩拉开腹壁. 进腹后分离肝周围韧带, 分别游离肝上下腔静脉、肝下下腔静脉、肝动脉和门静脉. 在游离至右肾上腺静脉时给予结扎并切断. 然后, 用无创的小血管夹在门静脉肝门侧分叉处夹闭血管. 用4号针头刺入门静脉, 推注肝素化生理盐水3 mL, 固定针头. 分别夹闭肝上下腔静脉、肝下下腔静脉, 并在肝下下腔静脉血管夹稍上方静脉壁剪约1 mm的灌注液流出道, 使用输液泵以2 mL/min速度经门静脉穿刺处缓慢持续灌注4 ℃肝素化的乳酸林格液(12.5 U/mL)20 mL, 同时给予冰生理盐水浇注肝脏表面降温, 当肝脏完全变为土黄色即完成. 灌注完成后拔针, 分别用9-0 prolene和8-0 prolene缝线修补门静脉穿刺点和肝下下腔静脉流出道, 预松血管夹查看修补是否成功, 松开各个血管夹, 结束无肝期30 min±2 min, 并给予温生理盐水浇注肝脏表面以快速复温. 关腹前, 腹腔注射40万单位的青霉素钠1 mL[13-16].
1.2.2 实验分组: 将SD大鼠随机分为4组, 每组8只. 假手术组(S组), AOLT组: 术前1 h经阴茎背静脉注射等量生理盐水. AOLT+FK506低剂量处理组(L组): 术前1 h经阴茎背静脉注射FK506 0.3 mg/kg. AOLT+FK506高剂量处理组(H组): 术前1 h经阴茎背静脉注射FK506 1 mg/kg. L组和H组给药剂量参照文献配制[17,18].
1.2.3 标本采集: 肝移植术后6 h, 分别自每只大鼠下腔静脉取血4-5 mL, 注入离心管, 静置后, 3000 r/min 4 ℃离心15 min, 吸上清液装于EP管, -80 ℃冰箱保存. 同时, 切取肝左外叶, 并将其切成两部分, 一部分用固定液固定, 另一部分放于冻存管中, 液氮保存待检.
1.2.4 标本检测: (1)血清丙氨酸氨基转移酶(alanine aminotransferase, ALT)、天冬氨酸氨基转移酶(aspartate aminotransferase, AST)检测: 采用全自动生化分析仪对收集的大鼠血清进行ALT、AST水平检测; (2)血清肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)、白介素-6(interleukin-6, IL-6)的检测: 按照双抗夹心和竞争ELISA法的试剂盒操作说明书分别对炎症因子TNF-α、IL-6进行检测; (3)肝脏病理检测: 对再灌注后的肝脏进行HE染色, 判定肝组织的损伤程度; (4)免疫组织化学染色法检测HMGB1的表达: 肝组织HMGB1在免疫组织化学染色中阳性结果为细胞核或细胞质中出现棕黄色颗粒样沉淀; (5)肝组织HMGB1 mRNA水平检测: 将待检肝组织用TRIzol试剂提取总RNA, 以此作为模板逆转录得总cDNA. 采用RT-qPCR法检测HMGB1及内参β-actin mRNA表达. 引物应用Primer Premier5.0设计. 结果经仪器配制软件分析; (6)Western blot法检测HMGB1蛋白表达: 将适量肝组织置于预冷研钵中, 加入蛋白裂解液, 提取蛋白. 取上清液进行蛋白定量(BCA定量), 在590 nm的波长下测定吸光值, 绘制标准曲线, 计算蛋白浓度. 经电泳、转膜、封闭、一抗二抗孵育、曝光得到条带. 以GAPDH为内参进行分析.
统计学处理 采用SPSS19.0统计学软件进行统计分析, 计量资料用mean±SD表示, 对数据进行正态性检验和方差齐性检验. 若呈正态分布, 则两两间比较采用t检验; 若呈偏态分布, 则采用秩和检验. P<0.05为差异有统计学意义.
比较不同处理组大鼠血清ALT、AST水平的变化, 结果表明S组大鼠血清ALT和AST水平分别在52.23 IU/L±5.72 IU/L和200.53 IU/L±20.25 IU/L之间. 与S组相比, AOLT组、L组和H组的ALT和AST水平均显著升高, 其中, AOLT组(ALT: 1380.87 IU/L±72.79 IU/L, AST: 2274.90 IU/L±114.63 IU/L)最高; L组和H组大鼠血清ALT和AST水平均显著低于AOLT组, 差异有统计学意义; 而L组和H组之间, 差异并无统计学意义(表1).
对4组不同处理的大鼠血清中炎症因子TNF-α、IL-6进行分析, 结果表明, TNF-α、IL-6含量在S组最低, 其他各个实验组均显示出明显增高的TNF-α、IL-6水平, 而AOLT组含量最高; L组和H组大鼠在FK506预处理后血清中TNF-α、IL-6 2种炎症因子的水平较AOLT组均显著降低, 而L组和H组之间相比, 差异无统计学意义(表1).
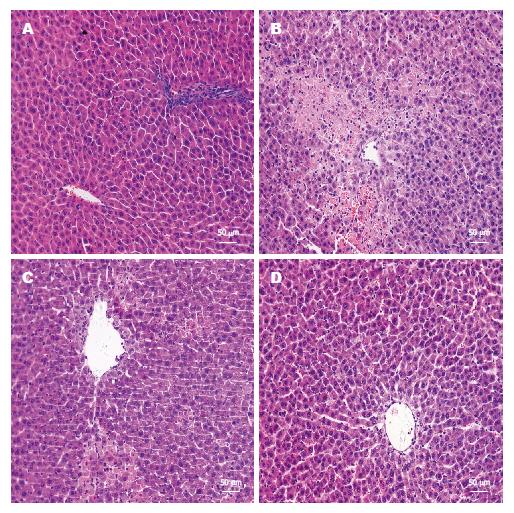
光镜下, S组肝组织结构清晰, 细胞形态基本正常, 无明显淤血(图1A). AOLT组表现为肝血窦淤血、肝细胞片状坏死且炎症细胞明显浸润(图1B); 而L组和H组与AOLT组相比, 肝血窦淤血、肝细胞坏死及炎症细胞浸润程度明显减轻(图1C, D).
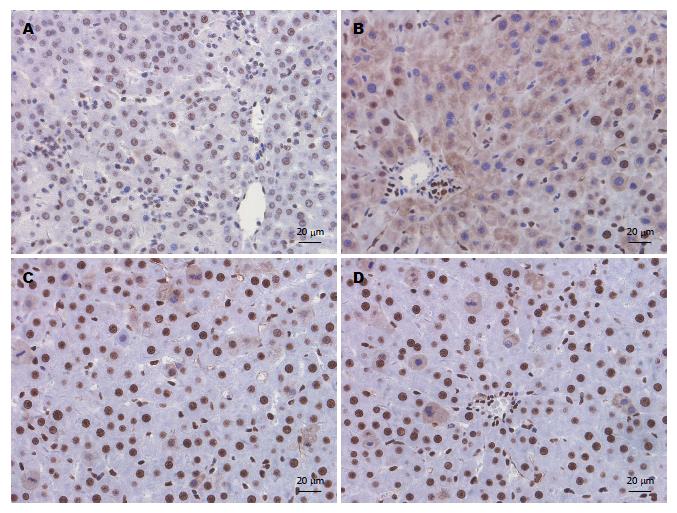
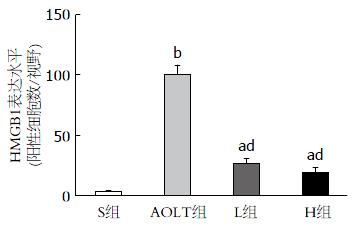
免疫组织化学染色结果表明, 在S组中, HMGB1蛋白主要定位于细胞核内, 细胞质中几乎没有(图2A); 在AOLT组中, HMGB1蛋白在细胞核内的表达降低, 而在细胞质内的表达明显增强(图2B), 这表明经IR处理, 部分肝细胞核内的HMGB1蛋白可能释放到细胞质中; 在L组和H组中, HMGB1蛋白在细胞质中部分表达, 但较AOLT组显著减弱(图2C, D). 对不同处理的SD大鼠肝细胞质内HMGB1表达的阳性细胞进行定量分析, 结果以mean±SD表示, AOLT组、L组和H组与S组相比, 有显著差异; L组和H组与AOLT组比较, 有显著差异(图3).
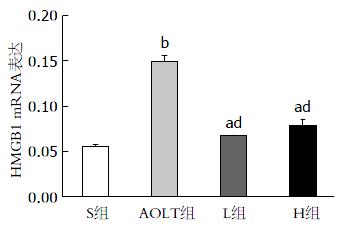
mRNA表达变化 肝脏移植术后6 h, 对4组不同处理的肝组织中HMGB1的mRNA水平进行定量分析, 结果显示: 与S组相比, AOLT组、L组和H组的HMGB1 mRNA表达明显升高, 尤其AOLT组(P<0.01, 图4); FK506预处理组(L组和H组)的HMGB1 mRNA水平较AOLT组均显著降低(P<0.01, 图4); L组与H组之间并无明显差异.
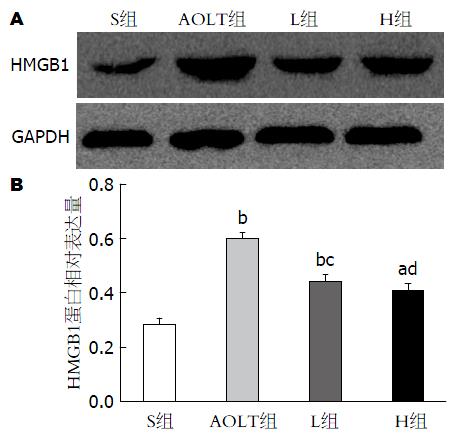
Western blot检测不同处理组大鼠肝脏中HMGB1蛋白表达水平. 结果表明, S组肝组织中显示最低的HMGB1表达水平, AOLT组中HMGB1蛋白表达最高(P<0.01, 图5B). L组与H组HMGB1蛋白水平均显著低于AOLT组, 而L组与H组之间, 没有明显差异(图5).
肝移植是当前解决肝脏晚期病变、肝外伤、肝衰竭等急重症肝脏疾病的唯一有效方法. 临床上, 移植肝需要经历热缺血、冷灌注、低温保存、复温、再灌注等多个环节, 而每一环节都可能对移植肝造成不同程度的损伤[19]. 其中, 肝脏的IR损伤是导致移植肝损害的重要环节, 但目前其具体机制仍未完全阐明. 另外, 由于器官短缺, 使得边缘器官移植被不断接受. 然而, 研究指出边缘供体会增加肝移植术后急性IR损伤的风险[20], 降低移植物存活率[21]. 因此, 深入研究如何防治供体IR带来的损伤, 降低移植风险, 将对临床实践产生深远意义.
肝脏IR损伤涉及乏氧代谢、氧自由基的产生以及炎症反应等多种病理生理变化, 机制十分复杂. 但目前学者认为, 肝脏IR损伤的核心仍然是炎症反应[22]. 多种细胞因子被证实参与了肝脏IR损伤, 其中HMGB1在肝脏IR损伤中的作用引起广泛关注. HMGB1是一种存在于真核生物细胞核内的具有高迁移能力的非组DNA结合蛋白, 包括A、B、C 3个结构域. 生理情况下, HMGB1存在于细胞质和细胞核内, 处于动态平衡中. 由于HMGB1的入核是主动机制, 因此其主要位于细胞核内[23], 并维持在较低的基础水平[24]. 细胞核内的HMGB1跟DNA结合, 通过与多种因子相互作用, 参与靶基因的转录、翻译等生命活动[25,26]. 最近, 研究发现HMGB1在IR时表达增加并被动释放至胞外, 介导炎症反应引起相应组织、器官损伤, 即当细胞受损或坏死时, HMGB1便从核内转移至胞外, 引起炎症细胞分泌促炎细胞因子, 后者进而促进HMGB1的分泌, 由此形成正反馈[7,27], 进而介导肝细胞损害的发生. HMGB1的相关受体-Toll样受体4(Toll-like receptor 4, TLR4)在多种细胞内表达[28]. 研究发现, TLR4在大鼠肝移植后的枯否细胞内表达上调; 在敲除TLR4基因的小鼠模型中, 肝脏IR损伤程度明显减弱[29]. 并且, 在敲除HMGB1第106位氨基酸基因的模型中, 发现其与TLR4的结合受到抑制, 导致下游细胞因子的释放减少[30]. 这些研究表明HMGB1/TLR4信号通路可能参与了肝脏IR损伤. 然而, 有报道[31]指出, FK506能够降低移植物IR损伤后TLR4的含量, 减轻缺血器官的损伤. FK506是一种新型免疫抑制剂, 通过多种机制减轻或防止肝脏IR损伤. 但是关于FK506预处理对肝脏IR损伤的具体作用, 及其与HMGB1蛋白的关系目前尚无报道. 因此本研究构建了FK506预处理的大鼠模型, 以探讨FK506预处理对肝脏IR损伤的影响, 及其与炎症介质HMGB1的关系, 以期为临床治疗提供新的思路.
本研究首先检测了4组不同处理的大鼠血清ALT、AST水平. 结果显示, FK506预处理组(L组和H组)大鼠血清中ALT、AST含量明显低于AOLT组, 表明FK506预处理对移植肝脏具有保护作用. 炎症因子TNF-α、IL-6在肝脏受到损伤时表达增加, 而FK506预处理后TNF-α、IL-6含量明显降低, 并且肝细胞坏死和炎症细胞浸润程度较FK506未处理组(AOLT组)明显减轻, 说明FK506通过抑制炎症因子的释放减轻了肝脏IR引起的肝细胞损伤.
接下来, 利用免疫组织化学技术对不同处理的肝组织切片中HMGB1蛋白表达进行分析比较, 结果显示, AOLT组中IR诱导肝细胞核内HMGB1转位到细胞质, 加重肝细胞损伤; 经FK506预处理(L组和H组)后, HMGB1释放到胞质中的细胞数明显减少, 肝细胞损伤明显减轻. 随后, 采用RT-qPCR和Western blot技术检测4组不同处理的大鼠肝组织中HMGB1 mRNA和蛋白表达水平. 结果表明, FK506预处理组(L组和H组), HMGB1 mRNA和蛋白表达较AOLT组均显著降低, 说明FK506预处理对HMGB1的表达有明显的抑制作用. 上述结果表明, FK506预处理可通过降低移植肝脏再灌注后HMGB1的表达减轻肝细胞损伤, 从而对肝脏IR损伤发挥保护作用. 这一保护作用可能与FK506降低TLR4水平, 阻碍HMGB1与TLR4结合, 继而抑制HMGB1的表达有关, 但具体机制仍需进一步探讨. 另外, 分别对FK506低剂量处理组(L组)和FK506高剂量处理组(H组)的上述实验结果进行分析显示, L组和H组之间的差异并无统计学意义, 这说明FK506对移植肝脏的保护作用不存在剂量依赖性.
总之, 本研究通过建立AOLT模型来模拟肝移植过程中的IR损伤, 探讨FK506预处理对肝脏的保护作用. 结果表明FK506预处理对肝脏IR损伤具有保护作用, 该作用与减轻HMGB1介导的炎症反应有关. 但是, FK506通过抑制HMGB1的表达、减轻缺血及再灌注带来的肝损伤的具体机制仍需进一步的研究.
目前, 肝移植是解决肝脏晚期病变、肝外伤、肝衰竭等急性重症肝脏疾病的唯一有效方法, 而移植过程中对肝脏造成的缺血再灌注(ischemia reperfusion, IR)损伤是无法避免的. 但到目前为止, 仍没有减轻IR损伤的专用药物, 寻找和发现用于降低IR损伤的药物显得十分迫切.
本文显示他克莫司(tacrolimus, FK506)作为降低IR损伤的治疗药物, 其机制与抑制炎症介质高迁移率族蛋白B1(high mobility group box 1, HMGB1)的释放有关. 进一步的开展FK506抑制HMGB1相关通路的实验, 确定该药物的作用机制, 是目前亟待解决的问题.
FK506作为一种免疫抑制剂, 被证实对肝脏IR损伤具有保护作用, 但目前尚无报道FK506对肝脏移植过程中IR损伤的保护作用是否与HMGB1有关. 本实验从分子水平进一步明确FK506减轻IR损伤的机制, 为进一步了解FK506的治疗作用打下基础.
本文通过建立经门静脉灌注的自体原位肝移植(autologous orthotopic liver transplantation, AOLT)模型模拟肝移植过程中的IR, 发现FK506预处理对肝脏IR损伤的保护作用与HMGB1的释放减少有关.
FK506是临床常用的免疫抑制剂, 本实验表明了FK506预处理减轻肝脏IR损伤的作用与HMGB1的表达有关, 对临床诊断IR损伤程度具有一定的参考价值, 并有助于临床对FK506治疗剂量的调整.
高迁移率族蛋白B1(HMGB1): 一种存在于真核生物细胞核内的具有高迁移能力的非组DNA结合蛋白, 在IR时表达增加并被释放至胞外, 介导炎症反应引起相应组织、器官损伤.
杜国盛, 主任医师, 解放军第309医院肝胆外科; 秦建民, 主任医师, 上海中医药大学附属普陀医院普外科; 张卓, 副教授, 沈阳医学院公共卫生学院营养与食品卫生学教研室
本文通过建立大鼠AOLT模型, 观察FK506不同剂量对模型建立过程中肝脏IR损伤的防治作用及其对HMGB1表达的影响, 具有一定的临床应用指导意义, 并有助于进一步研究HMGB1在肝移植术后的免疫调节作用.
手稿来源: 自由投稿
学科分类: 胃肠病学和肝病学
手稿来源地: 天津市
同行评议报告分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): C
D级 (一般): D
E级 (差): 0
编辑: 闫晋利 电编:胡珊
| 1. | Papadopoulos D, Siempis T, Theodorakou E, Tsoulfas G. Hepatic ischemia and reperfusion injury and trauma: current concepts. Arch Trauma Res. 2013;2:63-70. [PubMed] [DOI] |
| 2. | Tashiro H, Kuroda S, Mikuriya Y, Ohdan H. Ischemia-reperfusion injury in patients with fatty liver and the clinical impact of steatotic liver on hepatic surgery. Surg Today. 2014;44:1611-1625. [PubMed] [DOI] |
| 3. | Gehrau RC, Mas VR, Dumur CI, Ladie DE, Suh JL, Luebbert S, Maluf DG. Regulation of molecular pathways in ischemia-reperfusion injury after liver transplantation. Transplantation. 2013;96:926-934. [PubMed] [DOI] |
| 4. | Elias-Miró M, Jiménez-Castro MB, Rodés J, Peralta C. Current knowledge on oxidative stress in hepatic ischemia/reperfusion. Free Radic Res. 2013;47:555-568. [PubMed] [DOI] |
| 5. | Zhai Y, Petrowsky H, Hong JC, Busuttil RW, Kupiec-Weglinski JW. Ischaemia-reperfusion injury in liver transplantation--from bench to bedside. Nat Rev Gastroenterol Hepatol. 2013;10:79-89. [PubMed] [DOI] |
| 6. | Ogiku M, Kono H, Hara M, Tsuchiya M, Fujii H. Glycyrrhizin prevents liver injury by inhibition of high-mobility group box 1 production by Kupffer cells after ischemia-reperfusion in rats. J Pharmacol Exp Ther. 2011;339:93-98. [PubMed] [DOI] |
| 7. | Tsung A, Sahai R, Tanaka H, Nakao A, Fink MP, Lotze MT, Yang H, Li J, Tracey KJ, Geller DA. The nuclear factor HMGB1 mediates hepatic injury after murine liver ischemia-reperfusion. J Exp Med. 2005;201:1135-1143. [PubMed] [DOI] |
| 8. | Klune JR, Dhupar R, Cardinal J, Billiar TR, Tsung A. HMGB1: endogenous danger signaling. Mol Med. 2008;14:476-484. [PubMed] [DOI] |
| 9. | Clipstone NA, Crabtree GR. Identification of calcineurin as a key signalling enzyme in T-lymphocyte activation. Nature. 1992;357:695-697. [PubMed] [DOI] |
| 10. | Suzuki S, Toledo-Pereyra LH, Rodriguez FJ, Cejalvo D. Neutrophil infiltration as an important factor in liver ischemia and reperfusion injury. Modulating effects of FK506 and cyclosporine. Transplantation. 1993;55:1265-1272. [PubMed] [DOI] |
| 11. | St Peter SD, Moss AA, Mulligan DC. Effects of tacrolimus on ischemia-reperfusion injury. Liver Transpl. 2003;9:105-116. [PubMed] [DOI] |
| 12. | Pratschke S, Bilzer M, Grützner U, Angele M, Tufman A, Jauch KW, Schauer RJ. Tacrolimus preconditioning of rat liver allografts impacts glutathione homeostasis and early reperfusion injury. J Surg Res. 2012;176:309-316. [PubMed] [DOI] |
| 13. | Jin C, Zhang PJ, Wu XM, Zhou B, Li Y, Liu XY, Feng M, Tao LD. Impact of hypoxic preconditioning on apoptosis and its possible mechanism in orthotopic liver autotransplantation in rats. Hepatobiliary Pancreat Dis Int. 2009;8:40-45. [PubMed] |
| 15. | 金 成, 张 培建, 冯 敏, 刘 新颜, 周 斌, 李 勇. 经门静脉灌注法大鼠自体原位肝移植模型的建立. 中国普外基础与临床杂志. 2009;16:184-186. |
| 17. | Tamura A, Li XK, Funeshima N, Enosawa S, Amemiya H, Kitajima M, Suzuki S. Immunosuppressive therapy using FTY720 combined with tacrolimus in rat liver transplantation. Surgery. 2000;127:47-54. [PubMed] [DOI] |
| 18. | Crenesse D, Laurens M, Heurteaux C, Cursio R, Saint-Paul MC, Schmid-Alliana A, Gugenheim J. Rat liver ischemia-reperfusion-induced apoptosis and necrosis are decreased by FK506 pretreatment. Eur J Pharmacol. 2003;473:177-184. [PubMed] [DOI] |
| 19. | Clavien PA, Harvey PR, Strasberg SM. Preservation and reperfusion injuries in liver allografts. An overview and synthesis of current studies. Transplantation. 1992;53:957-978. [PubMed] [DOI] |
| 20. | Angele MK, Rentsch M, Hartl WH, Wittmann B, Graeb C, Jauch KW, Loehe F. Effect of graft steatosis on liver function and organ survival after liver transplantation. Am J Surg. 2008;195:214-220. [PubMed] [DOI] |
| 21. | McCormack L, Dutkowski P, El-Badry AM, Clavien PA. Liver transplantation using fatty livers: always feasible? J Hepatol. 2011;54:1055-1062. [PubMed] [DOI] |
| 22. | Tomiyama K, Ikeda A, Ueki S, Nakao A, Stolz DB, Koike Y, Afrazi A, Gandhi C, Tokita D, Geller DA. Inhibition of Kupffer cell-mediated early proinflammatory response with carbon monoxide in transplant-induced hepatic ischemia/reperfusion injury in rats. Hepatology. 2008;48:1608-1620. [PubMed] [DOI] |
| 24. | Li J, Kokkola R, Tabibzadeh S, Yang R, Ochani M, Qiang X, Harris HE, Czura CJ, Wang H, Ulloa L. Structural basis for the proinflammatory cytokine activity of high mobility group box 1. Mol Med. 2003;9:37-45. [PubMed] |
| 25. | 尹 朝奇, 罗 成群, 周 建大, 贺 全勇, 朱 颉, 李 萍, 陈 铁夫, 彭 浩, 徐 阳成. HSF-1抑制HMGB1所致炎症反应的作用及机制. 中国普通外科杂志. 2014;23:1207-1212. |
| 27. | Liu A, Jin H, Dirsch O, Deng M, Huang H, Bröcker-Preuss M, Dahmen U. Release of danger signals during ischemic storage of the liver: a potential marker of organ damage? Mediators Inflamm. 2010;2010:436145. [PubMed] [DOI] |
| 28. | Tsung A, Hoffman RA, Izuishi K, Critchlow ND, Nakao A, Chan MH, Lotze MT, Geller DA, Billiar TR. Hepatic ischemia/reperfusion injury involves functional TLR4 signaling in nonparenchymal cells. J Immunol. 2005;175:7661-7668. [PubMed] [DOI] |
| 29. | Vardanian AJ, Busuttil RW, Kupiec-Weglinski JW. Molecular mediators of liver ischemia and reperfusion injury: a brief review. Mol Med. 2008;14:337-345. [PubMed] [DOI] |
| 30. | Yang H, Hreggvidsdottir HS, Palmblad K, Wang H, Ochani M, Li J, Lu B, Chavan S, Rosas-Ballina M, Al-Abed Y. A critical cysteine is required for HMGB1 binding to Toll-like receptor 4 and activation of macrophage cytokine release. Proc Natl Acad Sci USA. 2010;107:11942-11947. [PubMed] [DOI] |
| 31. | Kilinc S, Tan S, Kolatan EH, Ruscuklu D, Satici E, Kemiksiz M, Dalkilic L, Erdogdu UE, Karaca C. The effects of preoperative immunosuppressive therapy on ischemia and reperfusion (I/R) injury in healthy rats. Int Urol Nephrol. 2014;46:389-393. [PubMed] [DOI] |