修回日期: 2017-11-29
接受日期: 2017-12-03
在线出版日期: 2017-12-28
通过MTT细胞活性实验、Western蛋白印记实验, 证明E804能够对MGC803等胃癌细胞系产生抑制细胞活性的作用, 提高自噬标记物的表达, 促进MGC803细胞进行自噬过程, 并且探究E804的药理机制.
正常培养的MGC-803与MKN-45细胞作为阴性对照组, 实验组将E804按照相应梯度浓度处理24 h, 部分实验加入白介素-6浓度100 ng/mL处理2 h作为阳性对照组. 采用MTT实验、蛋白印记实验和裸鼠成瘤模型建立实验来分析两组细胞的细胞活性、细胞的自噬标记物表达升高情况及检测检测移植瘤直径变化.
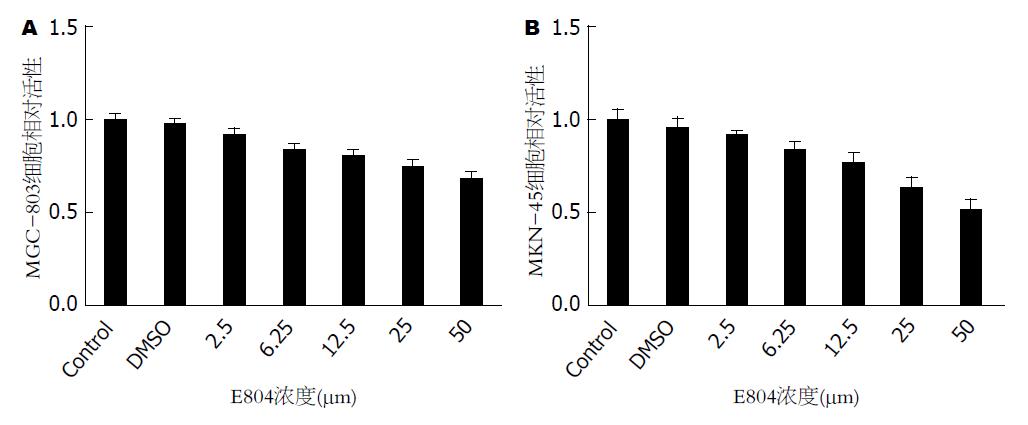
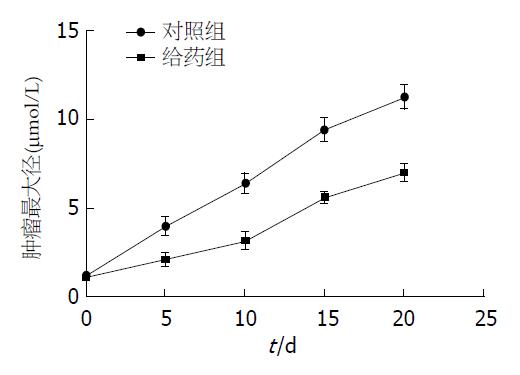
随着E804浓度的上升, MGC-803与MKN-45两组细胞的细胞活性均降低, 差异有统计学意义(P<0.05), E804处理后到自噬标记物LC3-B及Beclin-1的表达量显著上升, 并且呈现明显的剂量依赖效应; 比较对照组载瘤鼠与给药组载瘤鼠肿瘤最大径随时间的变化曲线, 给药组的肿瘤生长速度显著慢于对照组, 有统计学差异(P<0.05).
E804通过抑制Stat3活化促进胃癌细胞自噬活动来抑制胃癌细胞生长, 为胃癌的联合治疗提供了新的思路.
核心提要: 信号转导和转录活化因子3(signal transducerand activator of transcription 3, Stat3)的表达量与胃癌的恶性程度成正相关. E804能够通过抑制Stat3通路的激活, 促进凋亡等方式降低降低多种肿瘤细胞的增殖能力, 对Stat3低表达的正常细胞抑制作用较小, E804能否对胃癌细胞产生同样的抑制作用尚不明确. 通过实验证明E804能够对MGC803胃癌细胞系产生抑制细胞活性的作用, 提高自噬标记物的表达, 促进MGC803细胞进行自噬过程, 进一步的实验证明该作用机制至少是部分的通过抑制Stat3通路的激活来实现的, 包括减少Stat3和Jak1的激活.
引文著录: 聂国青, 王新强, 杨明英. 中药靛玉红衍生物通过信号转导子和转录激活子3途径促进胃癌细胞自噬. 世界华人消化杂志 2017; 25(36): 3184-3190
Revised: November 29, 2017
Accepted: December 3, 2017
Published online: December 28, 2017
To explore the pharmacological mechanism of E804, a derivative of indirubin, by investigating whether it can inhibit the viability of gastric cancer cells, alter the expression of markers of autophagy, and promote the autophagy activity.
MGC-803 and MKN-45 cells were treated with different concentrations of E804. Non-treated MGC-803 and MKN-45 cells were used as negative controls, and those treated with interleukin-6 (100 ng/mL) for 2 h were used as a positive control. After treatment, cell viability was detected by MTT assay. The expression of autophagy markers was detected by Western blot. The diameter of transplantable tumor in a subcutaneous xenotransplanted tumor model was also measured.
The viability of both MGC-803 and MKN-45 cells declined significantly after treatment (P < 0.05). E804 increased the expression of LC3-B and Beclin-1, two markers of autophagy, in a dose-dependent manner. When comparing the maximal diameters of tumor in the control group (non-treated) and experimental group (treated with E804), the speed of tumor growth in the experimental group was significantly lower than that of the control group (P < 0.05).
E804 can promote autophagy of gastric cancer cells to suppress their growth, at least partly by inhibiting the activation of Stat3.
- Citation: Nie GQ, Wang XQ, Yang MY. E804, a derivative of indirubin, promotes autophagy of gastric cancer cells through Stat3 signaling pathway. Shijie Huaren Xiaohua Zazhi 2017; 25(36): 3184-3190
- URL: https://www.wjgnet.com/1009-3079/full/v25/i36/3184.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v25.i36.3184
胃癌是发生在胃黏膜上皮组织的恶性肿瘤, 是消化系统最常见的恶性肿瘤之一. 近几年来, 随着分子生物学和分子遗传学的发展与基因工程技术的不断进步, 靶向治疗成为了胃癌治疗的重要手段之一. 信号转导和转录活化因子3(signal transducerand activator of transcription 3, Stat3)在胃癌细胞中的过度激活, 可促进胃癌细胞的增殖、侵袭和转移能力, 从而进一步增强了肿瘤的恶性生物学行为[1-3]. 靛玉红衍生物(E804)作为一种中药靛玉红的有效成分, 已经证明对Stat3通路有抑制作用, 然而E804是否对胃癌细胞有相似作用尚不明确, 本课题通过对胃癌细胞系MGC803施加E804处理, 通过分子生物学的方法验证细胞水平上癌细胞产生的变化, 并探究产生变化的分子机制, 证明了E804能够促进胃癌细胞的凋亡从而抑制其增殖, 并且提供了潜在的临床治疗选择.
MGC803与MKN-45购自美国标准细胞株收藏中心(ATCC). 磷酸化Jak1抗体、E804、Jak1抗体、Beclin-1抗体、LC-3抗体、β-actin抗体购自Abcam公司; DMEM培养基、胎牛血清、0.25% EDTA-胰酶、青霉素-链霉素双抗溶液、美国Gibco公司; MTT购自Sigma公司; BCA蛋白浓度测定试剂盒购自Thermo Scientific公司; 裸鼠购自北大医学部; 自动高压灭菌器购自Sanyo公司; 细胞培养箱Heraeus公司; 普通倒置显微镜购自Olympus公司; 酶标测定仪购自Bio-Rad公司; 低温高速离心机购自Eppendorf公司; Western blot电泳仪、转膜仪购自Bio-Rad公司.
1.2.1 细胞培养: MGC803与MKN-45细胞系均为低分化胃癌细胞系, 细胞培养培养方式相同, 均为加入含10%胎牛血清的RPMI 1640培养基, 每2 d换液或传代. 在37 ℃、50 mL/L CO2培养箱中培养, 传代时先吸去培养液, 加入适量的胰酶消化1-2 min, 随后吸去胰酶, 加入适量培养液吹下贴壁细胞, 离心, 弃去上清, 加入新培养基重悬, 然后接种到新的培养皿上. E804的溶解: E804不溶于水, 因此溶解于DMSO溶液中-20 ℃保存, 储存终浓度为1 mmoL/mL, 实验浓度根据具体实验需要调整.
1.2.2 实验分组: 正常培养的MGC-803与MKN-45细胞作为阴性对照组, 实验组将E804按照相应梯度浓度处理24 h, 部分实验加入白介素(interleukin, IL)-6浓度100 ng/mL处理2 h作为阳性对照组. 根据以往文献, E804浓度在1-50 μm/mL时能够发挥药理作用且不造成细胞大量死亡. DMSO组添加实验组中最大剂量的DMSO以出去溶剂的影响.
1.2.3 细胞活性实验: 采用MTT实验来验证细胞活性, 收集处于对数生长期的细胞, 按照每孔5×103细胞的密度100 μL培养基接种于96孔板中, 不同浓度E804处理24 h后, 接着测量每孔450 nm波长的吸光度, 计算细胞的相对活性.
1.2.4 蛋白印记实验: 贴壁培养的细胞在不同的实验条件下培养, 中止培养时, 用蛋白裂解液和蛋白酶抑制剂收集细胞, 并提取蛋白. 取样品上清并根据蛋白浓度加入上样缓冲液. 按照SDS-PAGE凝胶电泳的凝胶配制方法配制上下层胶, 上样后进行电泳, 目的条带进入凝胶最佳分离区时, 停止电泳. 进行转膜, 小于25 V电压转膜1 h. 转膜结束后将PVDF膜取出, 脱脂奶粉封闭1 h, 一抗孵育过夜, TBST冲洗3次, 二抗孵育1 h, 同样TBST冲洗3次. 向PVDF膜上滴加ECL避光孵育5 min, 暗室进行曝光, 分析条带.
1.2.5 裸鼠成瘤模型建立: 12只裸鼠(Balb/c裸小鼠, ♀, 4周龄, 购自北大医学部). 随机分为2组, 即MGC803组和MGC803给药组, 每6只. 取对数生长期, MGC803细胞, 将密度调2×106/mL, 每只裸鼠取0.2 mL细胞悬液接种于左大腿背侧皮下. (1)接种后观察裸鼠的一般情况和成瘤, 出现肉眼可见移植瘤后, 用游标卡尺测量移植瘤; (2)移植瘤体积达50 mm3左右时实验组开始给药, 按照20-30 μg/kg, 每3 d给药1次; (3)检测移植瘤体积、重量, 待达100 mm3左右(约接种后20 d)时, 采用颈椎脱臼方法处死裸鼠并完整剥离肿瘤, 采用颈椎脱臼方法处死裸鼠并完整剥离肿瘤, 电子天平称量移植瘤重.
统计学处理 采用GraphPad Prism5软件绘图, 采用SPSS16.0软件对组间差异行成组t检验或单因素方差分析. P<0.05为差异具有统计学意义.
使用MTT实验测定随着E804浓度的上升, MGC-803与MKN-45两组细胞的细胞活性均降低, 差异有统计学意义(P<0.05, 图1).
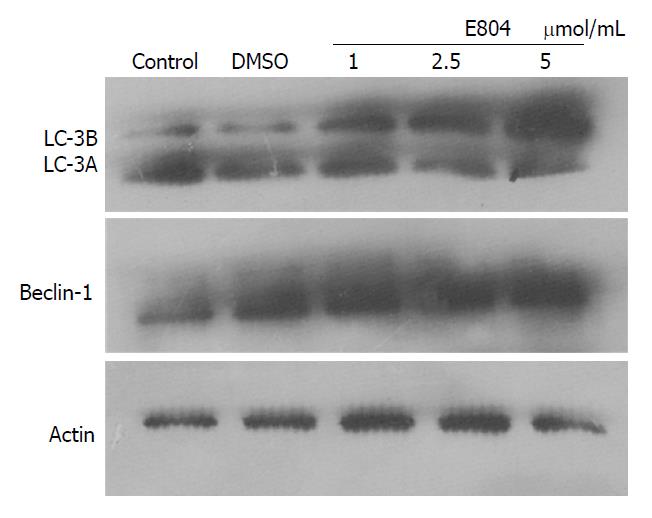
Western blot实验显示E804能够促进MGC803细胞的自噬标记物表达升高, E804处理后到自噬标记物LC3-B及Beclin-1的表达量显著上升, 并且呈现明显的剂量依赖效应, 表明E804促进了MGC803细胞的自噬活动(图2).
E804通过Stat3途径影响自噬E804很可能是通过影响Stat3的状态来影响肿瘤的自噬. 通过为了更加深入的探究E804的具体药物作用及机制. 探究E804对胃癌细胞的Jak1-Stat3通路的影响. 分别测定了对照组及处理组Stat3、磷酸化Stat3、Jak1、磷酸化Jak1的表达水平. 证明E804的处理抑制了Jak1-Stat3通路的激活, E804抑制肿瘤细胞活性, 促进自噬的机制很可能是通过该途径实现的(图3).
选择对数生长期的MGC-803细胞接种于裸鼠皮下. 实验过程中无小鼠逃逸, 裸鼠饮水、进食正常, 无腹泻、活动迟缓等不良反应, 无一裸鼠自然死亡. 所有裸鼠均在接种后5 d形成肉眼可见的移植瘤, 接种后20 d肿瘤长至100 mm3左右. 给药组移植瘤生长明显较对照组慢, 对照组肿瘤由于生长迅速, 后期出现明显出血、坏死. 实验过程中检测移植瘤直径变化并绘制移植瘤生长曲线(图4).
胃癌作为最常见恶性肿瘤和死亡率最高的恶性肿瘤之一, 寻求其预防与根治手段一直是研究的焦点. 传统的外科手术治疗往往复发率较高, 需要佐以高效的药物治疗. 近些年研究发现, 干扰Stat3通路可使胃癌细胞侵袭转移能力下降, 而胃癌的转移能力主要与侵袭、迁移及黏附相关[4-6]. Stat3蛋白激活可能是胃癌发生及发展中的一个关键事件[1,7-10]. 针对胃癌细胞中组成性高表达的Stat3通路, E804的药物效果具有良好的选择性, 对胃癌根治术后治疗有较好的辅助作用. E804作为一种中药靛玉红的有效成分, 已经证明对Stat3通路有抑制作用, 然而E804是否对胃癌细胞有相似作用尚不明确.
自噬是调节生物体生长、代谢和死亡的重要生理机制, 是涉及到细胞自身结构通过溶酶体机制而被分解的过程, 他帮助细胞产物在合成, 降解等循环中保持一种平衡的状态[11,12]. 细胞自噬由多个步骤组成, 包括吞噬泡的形成、自噬体的形成、自噬体与溶酶体融合形成自噬溶酶体和自噬溶酶体的降解. 自噬的进行是一个连续的过程, 正常的自噬活动可以清除受损的蛋白与细胞器, 而过度的自噬则会引起细胞的死亡. 自噬过程增强说明细胞的正常代谢已经受到了扰乱, 正常的代谢可能已经无法进行. 并且一般认为自噬过程增强时细胞的更新能力降低, 分裂增殖受到抑制, 因此自噬的增强可能有潜在的抑癌效果. 目前应用最广泛的自噬检测方法是测定自噬标记物LC-3B的变化. 自噬形成时, 胞浆型LC3(即LC3-Ⅰ)会酶解掉一小段多肽, 转变为(自噬体)膜型(即LC3-Ⅱ), LC3-Ⅱ/Ⅰ比值的大小可估计自噬水平的高低. 同时自噬体的形成受到自噬相关蛋白Beclin1的调控. Beclin1与一个多蛋白复合体(包括hVps34、PI3KC3、p150和Atg14L或UVRAG)相结合[13,14]. 当Beclin1-PI3KC3复合物形成和激活时, 会产生自噬效应器募集物的第二信使PI3P[15-17]. 当细胞受到刺激启动自噬后, 胞浆中的蛋白质和脂质在Beclin1-PI3KⅢ复合物的作用下被不断募集用于形成自噬体膜. Phospho-mTOR和Beclin1为自噬启动的重要标志物, 这是自噬泡双层膜形成的第一步. 因此Bcelin-1的表达量体现了自噬活动的强度[18]. Western blot实验证明, E804处理后到自噬标记物LC3-B及Beclin-1的表达量显著上升, 并且呈现明显的剂量依赖效应. 我们的研究发现E804能够促进MGC803细胞的自噬, 并且呈现剂量依赖效应, 随着E804终浓度的升高, 自噬过程的重要标记物LC3-B及Beclin-1的表达量显著增高. 自噬是涉及到细胞自身结构通过溶酶体机制而被分解的过程, 他帮助细胞产物在合成, 降解等循环中保持一种平衡的状态. 自噬过程增强说明细胞的正常代谢已经受到了扰乱, 正常的代谢可能已经无法进行. 并且一般认为自噬过程增强时细胞的更新能力降低, 分裂增殖受到抑制, 因此自噬的增强可能有潜在的抑癌效果. MTT实验表明, 随着处理E804浓度的上升, 细胞的活性下降. 因此, 自噬过程的激活可能也是细胞活性下降的一个重要原因, 但两者具体的联系和机制还不明确. 这部分的实验初步证明了E804的潜在抑癌效果, 并且这种药物作用至少是部分的通过自噬过程的增强实现的. 我们推测MGC803细胞活性的下降也与转录因子Stat3的受抑制有关, 因此还需要更多的后续实验来验证.
JAKs蛋白酪氨酸激酶家族是仅次于Src和Tec的第三大非跨膜型蛋白酪氨酸激酶, 共包括4个成员: Jak1、Jak2、Jak3和Tyk2. 他可在细胞因子受体与相应配体结合后活化, 并进而激活Stat, 诱导目的基因的表达[19-22]. Stat3蛋白的发现源于对干扰素信号传导机制的研究, Stat3蛋白分子可以在外界信号刺激下激活并直接转入细胞核内引发相应靶基因的转录, 因此被称为"信号传导及转录活化因子"(Stat). IL-6参与活化的是Stat3蛋白, Stat3不仅参与正常的生理过程, 而且还存在于有异常酪氨酸激酶活化的肿瘤组织中. 吕庆福等[23]研究发现, 利用RNAi-Stat3瞬时转染胃癌细胞, 通过四甲基偶氮唑盐实验检测细胞抑制率, RNAi-Stat3组细胞增殖明显受到抑制, 72 h后抑制达到最大程度, 并且实验组与对照组相比, 细胞出现了较明显的凋亡. Lin等[24]研究发现可以用5,7-二羟黄酮通过抑制JAK/STAT3/IL-6/gp130通路抑制新生血管的形成, 达到抑制肿瘤细胞增殖的目的. Li等[25]研究发现, 百里香醌是JAK/Stat信号通路的抑制剂, 他可以抑制IL-6诱导的Stat3磷酸化, 同时抑制JAK与非受体酪氨酸激酶的激活, 达到抑制肿瘤细胞增殖的目的. Stat3是一个涉及到许多生物过程的转录因子, 影响自噬、凋亡、增殖、分化等许多过程. 他能够被许多生长因子介导的通路激活, 例如表皮生长因子、JAK激酶、Src家族激酶等等. Stat3的激活需要705位酪氨酸的磷酸化, 激活后, Stat3形成二聚体入核, 调节基因的转录. 在正常细胞中, Stat3的激活被严格的调控着并且持续时间很短, 然而, 临床标本和胃癌细胞系的检测都证明Stat3在胃癌中保持了高度激活的状态并且促进了肿瘤的增殖与抗药性. 更重要的是, 许多通路的异常激活都会汇集与Stat3转录因子并且通过其转录因子作用促进胃癌细胞的增殖[26,27]. 而在正常的成熟细胞中, 并不需要Stat3因子来参与生命过程. 已知Stat3的下游靶基因是Bcl-XL、Mcl-1、cyclins D1/D2和c-Myc等. 由于多种细胞因子、生长因子、激素等的信号传导途径中JAK激酶和Stat蛋白的参与, 因此JAK/Stat信号途径在这些因子介导的免疫反应和免疫调控中具有重要的作用[28,29]. 该途径的缺陷和异常活化与多种疾病的发生发展及预后有密切的关系. 已经证明在胃癌细胞中存在着Stat3的持续性过度活化, 因此E804很可能是通过影响Stat3的状态来影响肿瘤的自噬[30]. 通过为了更加深入的探究E804的具体药物作用及机制, 我们进行了一系列实验, 探究E804对胃癌细胞的Jak1-Stat3通路的影响. 分别测定了对照组及处理组Stat3、磷酸化Stat3、Jak1、磷酸化Jak1的表达水平. 证明E804的处理抑制了Jak1-Stat3通路的激活, E804抑制肿瘤细胞活性, 促进自噬的机制很可能是通过该途径实现的.
本课题通过对胃癌细胞系MGC803施加E804处理, 通过分子生物学的方法验证细胞水平上癌细胞产生的变化, 并探究产生变化的分子机制, 首次证明了E804对胃癌细胞有促进凋亡的作用, 并且由于Stat3在正常细胞中仅短暂表达, 而在胃癌细胞中组成性高表达, 因此该潜在治疗手段具有良好的选择性, 为临床联合治疗提供了新的思路.
信号转导和转录活化因子3(signal transducerand activator of transcription 3, Stat3)蛋白激活可能是胃癌发生及发展中的一个关键事件. 针对胃癌细胞中组成性高表达的Stat3通路, E804的药物效果具有良好的选择性, 对胃癌根治术后治疗有较好的辅助作用. E804作为一种中药靛玉红的有效成分, 已经证明对Stat3通路有抑制作用, 然而E804是否对胃癌细胞有相似作用尚不明确. 通过对胃癌细胞系MGC803施加E804处理, 验证细胞水平上癌细胞产生的变化, 探究产生变化的分子机制, 证明E804对胃癌细胞有促进凋亡的作用, Stat3在正常细胞中仅短暂表达, 在胃癌细胞中组成性高表达, 该潜在治疗手段具有良好的选择性, 为临床联合治疗提供了新的思路.
通过对胃癌细胞系MGC803施加E804处理, 验证细胞水平上癌细胞产生的变化, 探究产生变化的分子机制, 证明E804对胃癌细胞有促进凋亡的作用, Stat3在正常细胞中仅短暂表达, 在胃癌细胞中组成性高表达, 该潜在治疗手段具有良好的选择性, 为临床联合治疗提供了新的思路. 部分的实验初步证明E804的潜在抑癌效果, 推测MGC803细胞活性的下降也与转录因子Stat3的受抑制有关, 还需要更多的后续实验来验证.
实验结果表明, Stat3及其上游Jak1的总表达量没有变化, 而磷酸化的分子明显降低并且呈现剂量依赖效应, 因此证明E804对胃癌MGC803细胞促进自噬的作用是通过抑制Stat3通路来实现的. 另外部分实验证明E804的潜在抑癌效果, 并且这种药物作用至少是部分的通过自噬过程的增强实现的.
E804已经证明对Stat3通路有抑制作用, E804是否对胃癌细胞有相似作用尚不明确, 本课题首次证明了E804对胃癌细胞有促进凋亡的作用, 并且由于Stat3在正常细胞中仅短暂表达, 而在胃癌细胞中组成性高表达, MGC-803细胞在E804浓度的影响下自噬活动强度的变化情况等, 因此该潜在治疗手段具有良好的选择性, 为临床联合治疗提供了新的思路.
本文通过对胃癌细胞系MGC803施加E804处理, 通过分子生物学的方法验证细胞水平上癌细胞产生的变化, 并探究产生变化的分子机制, 首次证明了E804对胃癌细胞有促进凋亡的作用, 并且由于Stat3在正常细胞中仅短暂表达, 而在胃癌细胞中组成性高表达, 因此该潜在治疗手段具有良好的选择性, 为临床联合治疗提供了新的思路.
自噬: 调节生物体生长、代谢和死亡的重要生理机制, 是涉及到细胞自身结构通过溶酶体机制而被分解的过程, 他帮助细胞产物在合成, 降解等循环中保持一种平衡的状态. 自噬的进行是一个连续的过程, 正常的自噬活动可以清除受损的蛋白与细胞器, 而过度的自噬则会引起细胞的死亡. 自噬过程增强说明细胞的正常代谢已经受到了扰乱, 正常的代谢可能已经无法进行.
本文论述了E804对胃癌细胞增值和凋亡的影响, 有一定的价值.
冯学泉, 主任医师, 天津市第一中心医院神经外科; 梁国刚, 教授, 大连医科大学附属第一医院; 王刚, 副研究员, 哈尔滨医科大学附属第一医院胰胆外科(普外二科)
手稿来源: 自由投稿
学科分类: 胃肠病学和肝病学
手稿来源地: 山东省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C
D级 (一般): D, D
E级 (差): 0
编辑: 闫晋利 电编:杜冉冉
| 1. | Giraud AS, Menheniott TR, Judd LM. Targeting STAT3 in gastric cancer. Expert Opin Ther Targets. 2012;16:889-901. [PubMed] [DOI] |
| 2. | Gryko M, Pryczynicz A, Guzińska-Ustymowicz K, Kamocki Z, Zaręba K, Kemona A, Kędra B. Immunohistochemical assessment of apoptosis-associated proteins: p53, Bcl-xL, Bax and Bak in gastric cancer cells in correlation with clinical and pathomorphological factors. Adv Med Sci. 2012;57:77-83. [PubMed] [DOI] |
| 3. | Huang S, Chen M, Shen Y, Shen W, Guo H, Gao Q, Zou X. Inhibition of activated Stat3 reverses drug resistance to chemotherapeutic agents in gastric cancer cells. Cancer Lett. 2012;315:198-205. [PubMed] [DOI] |
| 4. | Judd LM, Bredin K, Kalantzis A, Jenkins BJ, Ernst M, Giraud AS. STAT3 activation regulates growth, inflammation, and vascularization in a mouse model of gastric tumorigenesis. Gastroenterology. 2006;131:1073-1085. [PubMed] [DOI] |
| 5. | Jackson CB, Judd LM, Menheniott TR, Kronborg I, Dow C, Yeomans ND, Boussioutas A, Robb L, Giraud AS. Augmented gp130-mediated cytokine signalling accompanies human gastric cancer progression. J Pathol. 2007;213:140-151. [PubMed] [DOI] |
| 6. | Bronte-Tinkew DM, Terebiznik M, Franco A, Ang M, Ahn D, Mimuro H, Sasakawa C, Ropeleski MJ, Peek RM Jr, Jones NL. Helicobacter pylori cytotoxin-associated gene A activates the signal transducer and activator of transcription 3 pathway in vitro and in vivo. Cancer Res. 2009;69:632-639. [PubMed] [DOI] |
| 7. | 张 竹青, 卢 书明, 陈 美如, 李 春艳, 刘 丽娜, 吕 申. 胃癌中STAT3、p-STAT3和Bcl-xL的表达及临床意义. 肿瘤防治研究. 2014;41:430-433. [DOI] |
| 8. | Yakata Y, Nakayama T, Yoshizaki A, Kusaba T, Inoue K, Sekine I. Expression of p-STAT3 in human gastric carcinoma: significant correlation in tumour invasion and prognosis. Int J Oncol. 2007;30:437-442. [PubMed] |
| 9. | Deng JY, Sun D, Liu XY, Pan Y, Liang H. STAT-3 correlates with lymph node metastasis and cell survival in gastric cancer. World J Gastroenterol. 2010;16:5380-5387. [PubMed] [DOI] |
| 10. | Kanai M, Konda Y, Nakajima T, Izumi Y, Kanda N, Nanakin A, Kubohara Y, Chiba T. Differentiation-inducing factor-1 (DIF-1) inhibits STAT3 activity involved in gastric cancer cell proliferation via MEK-ERK-dependent pathway. Oncogene. 2003;22:548-554. [PubMed] [DOI] |
| 11. | Pietrocola F, Izzo V, Niso-Santano M, Vacchelli E, Galluzzi L, Maiuri MC, Kroemer G. Regulation of autophagy by stress-responsive transcription factors. Semin Cancer Biol. 2013;23:310-322. [PubMed] [DOI] |
| 13. | Yue Z, Jin S, Yang C, Levine AJ, Heintz N. Beclin 1, an autophagy gene essential for early embryonic development, is a haploinsufficient tumor suppressor. Proc Natl Acad Sci USA. 2003;100:15077-15082. [PubMed] [DOI] |
| 14. | Liang XH, Jackson S, Seaman M, Brown K, Kempkes B, Hibshoosh H, Levine B. Induction of autophagy and inhibition of tumorigenesis by beclin 1. Nature. 1999;402:672-676. [PubMed] [DOI] |
| 15. | Wirawan E, Lippens S, Vanden Berghe T, Romagnoli A, Fimia GM, Piacentini M, Vandenabeele P. Beclin1: a role in membrane dynamics and beyond. Autophagy. 2012;8:6-17. [PubMed] [DOI] |
| 16. | Choi KS. Autophagy and cancer. Exp Mol Med. 2012;44:109-120. [PubMed] [DOI] |
| 18. | Turkson J, Jove R. STAT proteins: novel molecular targets for cancer drug discovery. Oncogene. 2000;19:6613-6626. [PubMed] [DOI] |
| 20. | Bromberg JF, Horvath CM, Wen Z, Schreiber RD, Darnell JE Jr. Transcriptionally active Stat1 is required for the antiproliferative effects of both interferon alpha and interferon gamma. Proc Natl Acad Sci USA. 1996;93:7673-7678. [PubMed] [DOI] |
| 21. | Cooney RN. Suppressors of cytokine signaling (SOCS): inhibitors of the JAK/STAT pathway. Shock. 2002;17:83-90. [PubMed] [DOI] |
| 22. | Krebs DL, Hilton DJ. SOCS proteins: negative regulators of cytokine signaling. Stem Cells. 2001;19:378-387. [PubMed] [DOI] |
| 24. | Lin CM, Shyu KG, Wang BW, Chang H, Chen YH, Chiu JH. Chrysin suppresses IL-6-induced angiogenesis via down-regulation of JAK1/STAT3 and VEGF: an in vitro and in ovo approach. J Agric Food Chem. 2010;58:7082-7087. [PubMed] [DOI] |
| 25. | Li F, Rajendran P, Sethi G. Thymoquinone inhibits proliferation, induces apoptosis and chemosensitizes human multiple myeloma cells through suppression of signal transducer and activator of transcription 3 activation pathway. Br J Pharmacol. 2010;161:541-554. [PubMed] [DOI] |
| 28. | Chung CD, Liao J, Liu B, Rao X, Jay P, Berta P, Shuai K. Specific inhibition of Stat3 signal transduction by PIAS3. Science. 1997;278:1803-1805. [PubMed] [DOI] |
| 29. | Liu B, Liao J, Rao X, Kushner SA, Chung CD, Chang DD, Shuai K. Inhibition of Stat1-mediated gene activation by PIAS1. Proc Natl Acad Sci USA. 1998;95:10626-10631. [PubMed] [DOI] |
| 30. | Wormald S, Hilton DJ. Inhibitors of cytokine signal transduction. J Biol Chem. 2004;279:821-824. [PubMed] [DOI] |