修回日期: 2017-11-14
接受日期: 2017-11-18
在线出版日期: 2017-12-18
研究金荞麦(fagopyrumcymosum, FAG)主要提取物中活性成分在硫酸葡聚糖(dextran sulfate sodium, DSS)诱导的溃疡性结肠炎(ulcerative colitis, UC)小鼠模型体内组织分布特征.
建立同时测定小鼠组织样品中FAG提取物中的4种活性成分, 即儿茶素、表儿茶素、原花青素B1及原花青素B2的LC-MS/MS分析方法, 考察该方法的专属性、线性、最低定量限、准确度和精密度、基质效应、回收率和稳定性. 采用饮用3% DSS水7 d的方法建立UC小鼠模型, 应用2.28 g/kg的FAG提取物给于正常及UC小鼠, 于不同时间点取正常及UC小鼠的血浆、结肠、空肠、肝脏, 用于后续的分析检测.
方法学考察结果表明, 该方法符合生物样品分析的要求, 可用于测定生物样品中儿茶素、表儿茶素、原花青素B1和原花青素B2的浓度. FAG活性成份儿茶素、原花青素B1和原花青素B2在UC小鼠中的血浆暴露程度均有所增加, 但不具显著性差异(P>0.05). 组织分布结果表明其主要活性成分在UC小鼠的空肠、结肠组织及肝脏组织中的浓度比正常组要高. 如表儿茶素在UC小鼠给药4 h后的结肠组织中(5.77 μg/g±0.59 μg/g)浓度显著大于正常小鼠(4.44 μg/g±0.32 μg/g)的结肠组织分布(P = 0.0014).
在UC病理状态下, FAG活性成分在肠道的高浓度分布, 可以有效地保证其效应的发挥.
核心提要: 金荞麦具有抗炎、调节免疫的功效, 药代动力学研究表明其活性成份在溃疡性结肠炎(ulcerative colitis, UC)小鼠的系统暴露度增加, 在血液及结肠、肝脏等组织中呈高浓度分布, 进而发挥其抗炎功效, 该研究为传统中药治疗UC提供药理基础.
引文著录: 葛飞, 祁明明, 刘丽娜, 严晶, 康安, 朱时林, 季瑜, 田祖成, 代海峰, 葛乃建. 金荞麦提取物主要活性成份在溃疡性结肠炎模型小鼠体内的组织分布. 世界华人消化杂志 2017; 25(35): 3123-3132
Revised: November 14, 2017
Accepted: November 18, 2017
Published online: December 18, 2017
To investigate the tissue distribution of the main active components of Fagopyrum cymosum (FAG) extracts in dextran sulfate sodium (DSS) induced colitis mice.
LC-MS/MS analytical method was developed to simultaneously determine catechin, epicatechin, procyanidin B1, and procyanidin B2, four main components of FAG extracts, in different mouse biological samples. The method was then validated by specificity, linearity, lower limit of quantification (LLOQ), precision, accuracy, matrix effect, recovery, and stability tests. Ulcerative colitis was then induced in mice by administering 3% DSS in drinking water for 7 d. The plasma, liver, jejunum, and colon samples from normal mice or ulcerative colitis mice were collected to analyze the distribution of the main active components of FAG extracts in mice after oral administration of FAG extracts (2.24 g/kg).
The initial method validation indicated that the LC-MS/MS method could be used for determining the concentrations of catechin, epicatechin, procyanidins B1, and procyanidins B2 in mouse biological samples. The plasma exposures of catechin, epicatechin, procyanidins B1, and procyanidins B2 were increased in the DSS induced colitis mice compared with normal mice, but there was no significant difference (P > 0.05). However, in the tissue distribution study, we found that the concentrations of the main components of FAG in different tissue samples were significantly increased when compared with the normal mice. Taking epicatechin as an example, the concentration of epicatechin in the colitis tissue was significantly increased from 4.44 μg/g ± 0.32 μg/g to 5.77 μg/g ± 0.59 μg/g (P = 0.0014).
Increased systemic exposures of main active components of FAG in ulcerative colitis may be beneficial for the therapeutic effects of FAG on ulcerative colitis.
- Citation: Ge F, Qi MM, Liu LN, Yan J, Kang A, Zhu SL, Ji Y, Tian ZC, Dai HF, Ge NJ. Tissue distribution of main active components of Fagopyrum cymosum extracts in mice with ulcerative colitis. Shijie Huaren Xiaohua Zazhi 2017; 25(35): 3123-3132
- URL: https://www.wjgnet.com/1009-3079/full/v25/i35/3123.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v25.i35.3123
金荞麦(fagopyrumcymosum, FAG)为江苏南通地道药材, 系蓼科植物, 传统药用其根茎, 研究[1-3]表明其具有清热解毒、排脓化痰、健脾止泻、祛风活血、抗肿瘤等功效. 临床上FAG主要适用于肺科疾病[4-6], 亦可用于肠道疾病[7,8]及肿毒疮痈等感染性疾病, 以及肿瘤性疾病[9]等. 现代研究表明, FAG在临床上具有较好的抗炎、抗过敏[10]、抗风湿、抗肿瘤等功效[11]. FAG提取物中除了黄酮类成分[12], 还有含原矢车菊素、表儿茶素等即多酚类成份[13]. 实验研究[14-16]表明, FAG中的多种成份活性与其抗炎抗氧化活性密切相关. 课题组前期研究发现FAG可明显改善肠易激综合征及溃疡性结肠炎(ulcerative colitis, UC)引起的肠道黏膜损伤[8,17]. 但FAG中活性成分在胃肠道疾病模型动物中的组织分布情况未见研究. 本研究拟采用LC-MS/MS技术对其主要活性成分在硫酸葡聚糖(dextran sulfate sodium, DSS)诱导的UC小鼠主要脏器中的分布情况开展研究.
1.1.1 仪器: 微量高速冷冻离心机(Thermo Scientific, 美国); Sartorious Bp211D电子天平(Satrorius, 德国); 高效液相色谱仪(安捷伦, 美国); 旋转蒸发器(金正教学仪器有限公司, 南京); Vortex-Genie 2涡旋振荡器(Scientific Industries公司, 美国); HH-S数显恒温水浴锅(金坛市医疗仪器厂); Thermo快速液相色谱系统(Thermo公司, 美国); TSQ三重四极杆质谱仪(赛默飞世尔科技, 上海); FA1104电子天平; 微量高速冷冻离心机(Thermo Scientific公司, 美国); MilH-Q超纯水机(Millipore司, 美国); SpeedVac离心浓缩仪(Thermo Scientific公司, 美国).
1.1.2 药材及试剂: FAG购自南京市交通医院(批号: 20140502-1), 南京中医药大学博士刘圣金鉴定其为正品; 儿茶素、原儿茶酸、表儿茶素标准品(中国生物药品检定研究院); 原花青素B1和原花青素B2标准品(上海诗丹德生物技术有限公司); 95%乙醇(南京化学试剂有限公司); 甲醇(色谱纯, Merk公司).
1.1.3 实验动物: 购买SPF级C57BL/6♂小鼠(南通大学实验动物中心), 8 wk.
1.1.4 FAG的制备及混合标准溶液的配制: 取100 g FAG饮片加入约8倍体积的50%乙醇, 萃取2次, 每次回流持续1 h. 在60 ℃下将收集的滤液浓缩减压, 经过干燥后提取物重约9.48 g.
1.2.1 LC-MS/MS条件: (1)色谱条件: 色谱柱: BDS Hypersil C18(50 mm×2.1 mm, 2.4 μm); 流动相: 乙腈: 1 mmol/L的甲酸铵水溶液(A:B)流动相, 流速为0.30 mL/min; 梯度洗脱, 洗脱程序为: 0-0.5 min, 5%(A)、0.6-3.5 min, 5%-30%(A)、3.5-4.5 min, 30%(A)、4.5-4.8 min, 30%-4%(A)、4.8-6.0 min, 5%(A); 柱温: 40 ℃, 进样量2 μL; (2)质谱条件: 离子源: ESI源; 检测方式: 负离子检测; 电子能量: 70 eV; ESI源温度: 250 ℃; 色谱质谱接口温度: 320 ℃; 碰撞气氢气压力: 1.5 mTorr. 内标检测参数及各待测成分如表1.
| 待测化合物 | 分子量 | 子离子/母离子 | 碰撞能量(V) | S-Lens |
| 儿茶素 | 290.0 | 289.0→245.0 | 14 | 137.1 |
| 表儿茶素 | 290.1 | 289.1→245.1 | 12 | 106.5 |
| 原花青素B1 | 578.1 | 577.1→289.1 | 24 | 108.6 |
| 原花青素B2 | 578.1 | 577.1→425.1 | 16 | 145.7 |
| 莨菪亭(内标) | 192.2 | 191.2→176.0 | 22 | 127.5 |
1.2.2 对照品溶液与质控样品的制备: 对照品储备液的制备: 精确称取对照品及儿茶素、原花青素B1、原花青素B2、表儿茶素适量, 经50%甲醇溶解后在容量瓶中定容, 配制成浓度分别为730.6、792.8、775.8、1580.4 μg/mL的储备液, 置于4 ℃避光保存. 制备内标储备液: 用甲醇溶解一定量的东莨菪素标准品配制成内标母液, 浓度为1.0 mg/mL, 避光保存于4 ℃环境下. 使用前需稀释成内标溶液1000 ng/mL.
1.2.3 血浆及组织样品的处理: 在1.5 mL的EP管中置入50 μL血浆样品, 加入内标溶液10 μL(1.0 μg/mL), 经过30 s涡旋, 将甲醇(蛋白沉淀试剂)200 μL加入后予以涡旋5 min, 离心10 min(以12000 r/min), 上清取出后, 予以离心浓缩并挥干(45 ℃下), 加入100 μL流动相复溶后进样, 再予以14000 r/min速率离心10 min, 同时取上清2 μL进样. 实验取组织0.2 g加入0.8 mL NS, 予以匀浆并加入1.0 μg/mL的内标溶液50 μL, 予以30 s涡旋, 然后加入3 mL沉淀蛋白物-甲醇, 进行5 min涡旋后再离心5 min(以6000 r/min速率), 将上清液取出, 予以离心浓缩并挥干(45 ℃下), 然后加入200 μL流动相复溶, 进样, 再以14000 r/min速率离心10 min, 取上清2 μL进样.
1.2.4 方法学考察: (1)专属性: 分别取小鼠空白血浆、加入混合对照品后的血浆样品以及灌胃给予2.28 g/kg FAG提取物2 h后的小鼠血浆样品, 按1.2.3项下血浆样品处理方法对上述3种血浆样品进行样品处理后, LC-MS/MS进样分析, 考察本方法的专属性; (2)标准曲线与定量限: 小鼠空白血浆加入不同浓度的混合标准溶液, 按血浆样品处理方法对上述样品进行处理, LC-MS/MS分析. 以各成分浓度为横坐标, 血浆中检测的各活性成份与内标的峰面积之比为纵坐标, 进行线性回归分析, 回归方程采用1/X加权. 以信噪比(S/N)>10的最低浓度作为各待测化合物的定量限; (3)准确度与精密度: 取空白血浆样品, 加入不同浓度的混合标准溶液, 配置成高、中、低三个浓度的质控样品(n = 6, 各成分浓度如表2所示), 按血浆样品处理方法对上述样品进行处理, LC-MS/MS分析. 经标准曲线计算质控样品的浓度, 分别用相对误差和相对标准偏差考察批内、批间准确度和精密度; (4)提取回收率和基质效应: 取含不同浓度的质控样品, 经血浆样品处理后, LC-MS/MS检测. 计算得样品中待测药物峰面积与对应质量浓度对照品溶液中待测药物峰面积的比值考察提取溶剂对低、中、高三种质控浓度的提取回收率, 平行6份. 另取50 μL小鼠空白血浆按样品处理项下方法处理样品, 样品挥干后用流动相分别配制的不同浓度的对照品复溶, 应用LC-MS/MS进行检测峰面积A1. 取流动相配制的高、中、低浓度的对照品, 予以进样分析后得峰面积A2. 基质效应为两次峰面积之比(A2/A1×100%); (5)稳定性试验: 取质控样品, 考察以下3种条件: 即-20 ℃下放置15 d, 进行3次反复冻融, 在4 ℃的自动进样器内放置24 h, 同一浓度采用6个重复, 进行稳定性考察.
| 成分 | 标示浓度(ng/mL) | 批间(n = 18) | 批内(n = 6) | ||||
| 测得浓度(ng/mL) | 准确度(%) | 精密度(%) | 测得浓度(ng/mL) | 准确度(%) | 精密度(%) | ||
| 儿茶素 | 49.50 | 101.16±2.82 | 102.18 | 2.78 | 98.52±4.18 | 99.52 | 4.23 |
| 892.00 | 378.78±21.38 | 95.60 | 2.82 | 775.28±29.74 | 97.81 | 3.84 | |
| 4.56 | 4.46±0.38 | 97.81 | 8.38 | 4.64±0.38 | 101.75 | 7.98 | |
| 表儿茶素 | 45.70 | 47.24±2.78 | 103.37 | 2.94 | 46.99±1.05 | 102.88 | 2.24 |
| 729.60 | 741.32±15.40 | 101.61 | 2.08 | 730.40±29.05 | 100.15 | 3.99 | |
| 4.85 | 4.70±0.10 | 97.11 | 2.18 | 4.78±0.20 | 98.76 | 4.07 | |
| 原花青素B1 | 48.50 | 49.35±1.13 | 101.75 | 2.29 | 48.82±1.08 | 100.66 | 2.22 |
| 776.0 | 750.15±23.05 | 96.67 | 3.08 | 761.24±22.32 | 98.10 | 2.93 | |
| 9.86 | 10.31±0.21 | 104.56 | 2.01 | 10.17±0.28 | 103.14 | 2.73 | |
| 原花青素B2 | 197.50 | 200.89±11.63 | 101.72 | 5.79 | 201.98±8.48 | 102.27 | 4.20 |
| 1580.00 | 1589.91±54.67 | 100.63 | 3.44 | 1575.59±44.44 | 99.72 | 2.82 | |
| 5.00 | 4.92±0.38 | 98.40 | 7.69 | 5.08±034 | 101.60 | 6.65 | |
1.2.5 FAG中主要活性成分在DSS诱导的UC小鼠中的组织分布研究: 24只♂C57BL/6小鼠, 每只体质量18-22 g, 随机将其分为模型组和正常组. DSS诱导的UC模型建立: 给予正常饮用水前, 小鼠先自由饮用3%的DSS溶液7 d, 于9 d后进行实验. 将FAG提取物用0.5% CMC-Na配成混悬液(2.28 g/kg), 将模型组、正常组小鼠分别灌胃给予FAG提取物, 从小鼠眼底静脉丛取血, 时间为给药后0.5、1、2、4 h, 用肝素化EP管存放所取血液, 以3000 r/min转速离心10 min, 然后吸取血浆80 μL到EP中, 在-20 ℃下密封保存, 待测. 同时分别取结肠、空肠、肝脏组织, 用PBS漂洗后吸干水分, 在-20 ℃下保存以备分析.
统计学处理 计量数据采用mean±SD表示. 所有数据均采用GraphPad Prism5软件进行分析. 组间比较采用student's t检验. 以P<0.05为差异有统计学意义.
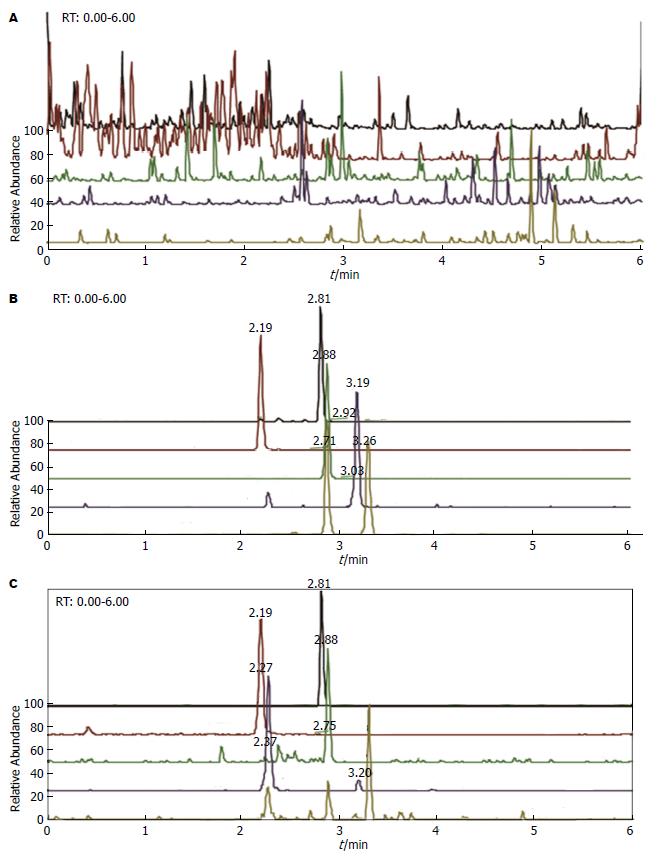
2.1.1 专属性实验: 在上述色谱条件下, 绘制形成各成分的色谱图(图1), 血浆中内源性物质以及杂峰之间不受各待测成分和内标的干扰, 均能实现较好分离. 以上待测成分及其内标的保留时间为: 原花青素B1tR = 2.19 min, 原花青素B2tR = 3.19 min, 表儿茶素tR = 3.26 min, 儿茶素tR = 2.88 min, 内标tR = 2.81 min. 实验结果表明各成分保留时间与各对照品出峰时间基本一致, 提示本方法具有较好的专属性.
2.1.2 标准曲线与定量限: 原花青素B1的线性范围为2.42-970.00 ng/mL, 回归方程: y = 0.0013x+0.0018, 定量下限为2.42 ng/mL, R2 = 0.996; 原花青素B2的线性范围为4.93-1975.00 ng/mL, 回归方程: y = 0.0138x+0.0034, 定量下限为4.93 ng/mL, R2 = 0.998; 表儿茶素的线性范围为2.28-912.00 ng/mL, 回归方程: y = 0.0018x+0.0029, 定量下限为2.28 ng/mL, R2 = 0.997; 儿茶素的线性范围为2.50-990.00 ng/mL, 回归方程: y = 0.0016x+0.0015, 定量下限为2.50 ng/mL, R2 = 0.998. 结合预实验结果可知, 本方法的线性范围符合生物样品测定的要求.
2.1.3 准确度与精密度: 如表2所示, 质控样品中不同浓度儿茶素的批内和批间准确度分别为97.81%-101.60%、95.60%-102.18%; 批内和批间精密度为2.82%-7.69%、3.84%-6.65%. 与此类似, 表儿茶素、原花青素等成份批间和批内精密度、准确度亦符合生物分析方法要求.
2.1.4 提取回收率和基质效应实验: 如表3所示, 原花青素B1的提取回收率为57.38%-61.16%; 原花青素B2的提取回收率为67.24%-70.67%; 表儿茶素的提取回收率为78.86%-81.69%; 儿茶素的提取回收率为61.25%-65.87%. 各浓度间提取回收率较为稳定, 符合相关实验分析要求. 此外基质效应结果亦符合生物样品分析的相关要求: 原花青素B1为92.48%-99.14%; 原花青素B2为98.68%-103.48%; 表儿茶素为95.68%-103.63%; 儿茶素为94.48%-107.14%. 提示本研究所采用的生物样品处理方法较为合理.
| 成分 | 质控浓度(ng/mL) | -20 ℃ 15 d | 反复冻融3次 | 4 ℃自动进样器24 h | |||
| 测定浓度(ng/mL) | 准确度(%) | 测定浓度(ng/mL) | 准确度(%) | 测定浓度(ng/mL) | 准确度(%) | ||
| 儿茶素 | 49.50 | 50.47±1.19 | 101.96 | 48.15±0.30 | 104.88 | 51.62±2.45 | 104.28 |
| 792.00 | 78434±38.60 | 99.16 | 817.59±15.94 | 103.23 | 775.12±7.84 | 97.87 | |
| 4.56 | 4.62±0.37 | 101.32 | 4.63±0.22 | 104.68 | 4.11±0.28 | 90.18 | |
| 表儿茶素 | 45.70 | 48.56±1.15 | 106.26 | 47.45±0.44 | 105.36 | 48.67±1.01 | 106.50 |
| 729.60 | 713.64±5.58 | 97.81 | 820.30±21.78 | 95.17 | 708.74±5.24 | 97.13 | |
| 4.85 | 4.60±0.18 | 95.04 | 4.63±0.40 | 95.57 | 4.82±0.39 | 99.70 | |
| 原花青素B1 | 48.50 | 47.59±0.95 | 98.12 | 47.45±3.96 | 97.84 | 46.38±0.50 | 95.63 |
| 776.0 | 797.50±7.51 | 102.77 | 820.30±41.38 | 105.71 | 812.70±17.65 | 104.73 | |
| 9.86 | 9.58±0.28 | 97.12 | 10.22±0.91 | 103.67 | 10.13±0.30 | 102.73 | |
| 原花青素B2 | 197.50 | 186.36±2.88 | 94.36 | 212.08±12.38 | 107.36 | 214.47±3.44 | 108.59 |
| 1580.0 | 1572.6±33.4 | 99.53 | 1646.0±52.4 | 104.18 | 1604.1±64.0 | 101.52 | |
| 5.00 | 5.08±0.30 | 101.60 | 4.78±0.06 | 105.61 | 2.56±0.15 | 102.42 | |
2.1.5 稳定性考察: 本实验的目的是通过质控样品的稳定性考察, 得出合适的生物样品储存时限、血浆样品处理至分析结束间的时限等. 在本实验中, 我们发现经不同稳定性考察后的质控样品, 经血浆样品处理, LC-MS/MS分析, 各成分在冻存15 d后的准确度仍为94.36%-106.26%, 反复冻融3次后的准确度为95.57%-107.36%, 4 ℃自动进样器24 h的准确度为90.18%-108.59%. 上述结果均在85%-115%允许波动范围内, 提示上述样品的稳定性良好.
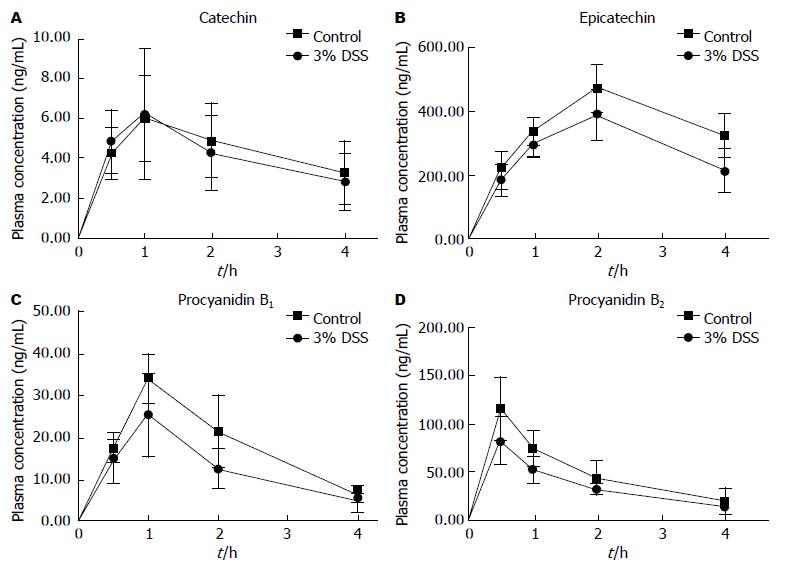
2.2.1 血药浓度时间曲线: 灌胃给正常小鼠与DSS诱导的UC小鼠FAG提取物(以2.28 g/kg浓度单剂量), 检测到FAG各有效成份经计算得到的血药浓度-时间曲线分别见图2A-D所示. 儿茶素为在正常小鼠及模型小鼠血浆中的暴露水平较低(最高浓度仅6.19 ng/mL±3.25 ng/mL), 且各时间点下正常组及模型组小鼠体内暴露水平未见明显差异(P>0.05). 从表儿茶素的血药浓度-时间曲线上看, 正常组及模型组小鼠体内最高浓度点出现在2 h, 体内浓度分别为387.69 ng/mL±78.62 ng/mL和472.49.69 ng/mL±75.64 ng/mL, 但2 h及4 h的血浆暴露水平在两组间均未见显著性差异. 原花青素B1和原花青素B2的情况类似, 尽管UC小鼠体内暴露水平有所增加, 但未见显著性差异. 由于血浆中的暴露水平的改变可能来源于胃肠道吸收及药物在肝脏中代谢情况的变化, 后续应关注药物在上述部位的分布情况.
2.2.2 组织分布: 单剂量灌胃将FAG提取物(剂量为2.28 g/kg)给予正常小鼠与DSS诱导的UC小鼠, 儿茶素等活性成份在空、结肠和肝脏组织中的浓度如表4所示. 通过比较儿茶素在正常小鼠及UC小鼠肝脏、空肠中的分布情况可知, 儿茶素的分布未见明显差异, 而在结肠组织中, 4 h时, 模型组的结肠分布较正常组更高(1.51±0.34 vs 0.87±0.28), 且有显著性差异(P = 0.0045). 表儿茶素在肝、空肠、结肠中的浓度均较高, 在结肠组织中, 模型组小鼠在1、2 h时较正常组显著增加(P = 0.0245、0.0413), 模型组小鼠在4 h时极显著的高于正常组(P = 0.0014)与此类似的是, 模型组小鼠肝、空肠、结肠组织中原花青素B1和原花青素B2中的浓度较正常组显著提高. 提示在UC病理状态下, FAG主要活性成分在肝、肠组织的高浓度分布, 可能更有利与其药效的发挥.
| 化合物 | 时间(h) | 肝(ng/g) | 空肠(µg/g) | 结肠(µg/g) | |||
| 正常 | 模型 | 正常 | 模型 | 正常 | 模型 | ||
| 儿茶素 | 1 | 24.57±8.24 | 28.54±5.28 | 1.23±0.43 | 1.39±0.13 | 0.49±0.25 | 0.55±0.17 |
| 2 | 15.32±3.24 | 21.46±3.97 | 1.21±0.58 | 1.45±0.46 | 0.98±0.32 | 1.25±0.42 | |
| 4 | 8.87±2.14 | 11.59±2.42 | 0.42±0.24 | 0.47±0.13 | 0.87±0.28 | 1.51±0.34b | |
| 0.5 | 458.62±48.35 | 435.29±41.45 | 3.85±1.04 | 4.28±0.58 | 2.05±1.04 | 2.28±0.26 | |
| 表儿茶素 | 1 | 563.52±68.43 | 621.67±48.28 | 6.47±0.99 | 9.09±1.48a | 3.47±0.99 | 4.69±1.48a |
| 2 | 1043.8±258.5 | 1723.54±325.17a | 3.56±1.08 | 5.95±0.88b | 4.75±0.62 | 5.53±0.68a | |
| 4 | 885.47±652.47 | 1040.35±421.17 | 1.47±0.32 | 2.07±0.64 | 4.44±0.32 | 5.77±0.59b | |
| 0.5 | 78.42±18.26 | 83.48±9.32 | 0.78±0.18 | 0.67±0.11 | 0.55±0.21 | 0.74±0.21 | |
| 原花青素B1 | 1 | 154.57±42.75 | 221.58±43.24a | 0.99±0.41 | 1.04±0.43 | 1.17±0.26 | 1.24±0.35 |
| 2 | 167.39±38.47 | 261.34±54.29 | 1.82±0.27 | 2.67±0.56a | 1.98±0.51 | 2.17±0.44 | |
| 4 | 102.63±35.78 | 121.54±28.57 | 0.78±0.18 | 1.41±0.21a | 2.47±0.78 | 3.25±0.49a | |
| 0.5 | 304.58±32.86 | 398.21±48.79 | 4.62±1.28 | 5.27±0.87 | 2.54±0.58 | 2.87±0.77 | |
| 原花青素B2 | 1 | 334.87±77.64 | 562.47±67.85b | 6.23±1.14 | 7.29±0.68 | 3.67±0.58 | 4.82±0.74 |
| 2 | 287.49±87.53 | 321.52±58.94 | 4.22±0.87 | 5.67±0.97a | 5.21±1.07 | 7.28±0.99a | |
| 4 | 101.48±28.47 | 151.42±38.91 | 2.66±0.59 | 3.21±0.73 | 3.24±0.69 | 5.29±0.61b | |
| 0.5 | 21.52±8.92 | 24.32±6.58 | 0.57±0.14 | 0.71±0.16 | 0.22±0.04 | 0.31±0.11 | |
FAG传统用于肺部感染性疾病的治疗, 其活性成份具有抗炎、抗风湿、抗肿瘤的功效, 文献研究及课题组实验表明其对肠道炎症性疾病亦有效[18-22], 但其机制尚不十分明确, 目前研究较多的是其活性成份对炎症免疫的抑制作用. 闫继平等研究[23-25]表明, FAG中含有儿茶素、表儿茶素、槲皮素等有效成份, 而这些成份具有较好的抗炎抗应激功效[24,26], 牛晓玲等[27]研究表明, FAG片可抑制脾虚湿热证腹泻型肠易激综合征大鼠免疫炎症反应, 冯丕敏等[28]研究表明FAG粉灌肠对UC有显著疗效, 其机制与其抑制炎症因子水平以及肠道敏感性相关.
研究[29]表明, 在UC小鼠中, 可见明显的肠黏膜损伤、肠道通透性增加, 此外UC小鼠出现可出现肠道菌群紊乱[30]. 研究[31,32]证实UC炎症状态可增加葡萄糖醛酸转移酶活性, 同时肠道葡萄糖醛酸苷酶等水解酶活性显著增加. 这些对于相关底物药的生物利用度可能有一定影响. 研究[33]报导, FAG中的儿茶素、表儿茶素等成份有效抑制LPS诱导的UC小鼠体内炎症反应. 其中原花色素缩合性单宁类物质的水溶性较好, 大部分单宁类物质可以在葡萄糖醛酸转移酶作用下进行二相代谢, 仅少量多酚类成分可以通过胞旁转运途径吸收入血[34], 同时单宁类物质可被肠道菌群水解, 提高其生物利用度.
本实验采用DSS诱导UC模型, 建立了同时测定FAG中各活性成份的LC-MS/MS分析方法, 其准确度与精密度经过方法学考察, 符合生物样品分析的要求, 可用于测定生物样品中儿茶素、表儿茶素、原花青素B1和原花青素B2的浓度. FAG活性成份儿茶素、原花青素B1和原花青素B2在UC小鼠中的血浆暴露程度均有所增加, 但不具显著性差异(P>0.05). 组织分布结果表明其主要活性成分在UC小鼠的空肠、结肠组织及肝脏组织中的浓度比正常组要显著升高. 在一定浓度范围内生物样品中活性成份的线性关系表现良好, 此外该法的基质效应和稳定性均符合要求, 可用于FAG中各活性成份在小鼠体内的组织分布及药代动力学的研究.
总之, 本研究中FAG提取物中的各活性成份在UC小鼠血浆暴露增加, 这与UC炎症损伤肠黏膜屏障有关, 也可能与FAG提取物中单宁类物质被肠道细菌分解增加有关. 而在空肠、结肠等肠道组织中, FAG活性成份的分布显著增加, 这可能是由于在UC小鼠的肠道中, 加速水解代谢FAG中其他单宁类物质并转化成活性成份, 导致肠道分布增加, 从而发挥FAG的抗炎作用, 具体机制仍在进一步研究中. 后续研究可借助分子生物学、酶动力学等技术手段, 研究参与FAG活性成分吸收、代谢等相关的酶在mRNA, 蛋白表达等水平上的变化, 进一步阐释UC这一病理状态对FAG活性成分药代动力学影响的可能机制.
金荞麦(fagopyrumcymosum, FAG)传统用于肺脓疡的治疗, 其活性成份具有抗炎、抗风湿、抗肿瘤的功效, 文献研究及课题组实验表明其对肠道炎症性疾病亦有效, 但其机制尚不十分明确, 目前研究较多的是其活性成份对炎症免疫系统的抑制作用.
溃疡性结肠炎(ulcerative colitis, UC)目前尚无特效治疗药物, 中西医结合治疗成为研究的热点, 实验研究发现中药FAG对炎症性肠道疾病有效, 而中药体内药效与其活性成份分布及组织吸收密切相关, 进一步探索传统中药的现代抗炎机制是亟待研究的重点.
闫继平等研究表明, FAG中含有儿茶素、表儿茶素、槲皮素等有效抗炎成份, 牛晓玲等研究表明, FAG片可抑制脾虚湿热证腹泻型肠道疾病大鼠模型免疫炎症反应, 其机制与其抑制炎症因子水平以及肠道敏感性相关.
FAG具有抗炎、调节免疫的作用而应用于肺部感染性疾病已得到专家共识, 而FAG对于肠道炎症免疫相关疾病疗效机制的报导较少, 本研究从FAG在UC小鼠组织学分布角度研究其抗炎机理, 为阐明其药理机制提供了新的思路.
UC的西药治疗主要是氨基水杨酸类和激素类, 其副作用多、易复发, 而新型生物制剂价格昂贵, 传统中药FAG具有调节炎症免疫、副作用少的优点, 提取其有效活性成份并研究其体内作用机制有望为新药开发提供基础.
溃疡性结肠炎(UC): 结肠的一种非特异性炎症性疾病, 祖国传统医学中属于"久痢"、"泄泻"等范筹. 临床表现为腹痛、腹泻、里急后重以及黏液脓血便等, 长期慢性发作者有演变为肿瘤的风险, 其发病机制与炎症免疫、饮食、环境等密切相关.
本文采用LC-MS/MS技术对FAG提取物活性成分在硫酸葡聚糖诱导的UC小鼠血浆、结肠、空肠等的分布情况, 试验设计合理, 研究方法准确, 文章条理清晰, 论述详实准确, 论据充足, 科学结论可信.
郝微微, 主任医师, 硕士生导师, 上海中医药大学附属岳阳中西医结合医院消化内科; 袁红霞, 研究员, 天津中医药大学
手稿来源: 自由投稿
学科分类: 胃肠病学和肝病学
手稿来源地: 江苏省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): C
D级 (一般): 0
E级 (差): 0
编辑: 闫晋利 电编:杜冉冉
| 3. | Chan PK. Inhibition of tumor growth in vitro by the extract of fagopyrum cymosum (fago-c). Life Sci. 2003;72:1851-1858. [PubMed] [DOI] |
| 4. | 董 六一, 汪 春彦, 吴 常青, 江 勤, 张 志芬. 金荞麦对克雷伯杆菌肺炎大鼠肺组织中TLR2/4,MyD88 mRNA和IκB-α表达的影响. 中国中药杂志. 2011;36:200-204. |
| 6. | 陶 志强, 高 想, 唐 艳芬, 孙 建, 章 匀, 尤 菊松, 倪 卫兵, 喻 海忠. 金荞麦水剂对慢性阻塞性肺病患者血清细胞因子和肺功能的影响. 辽宁中医杂志. 2008;35:332-333. |
| 8. | Liu L, Cai X, Yan J, Luo Y, Shao M, Lu Y, Sun Z, Cao P. In Vivo and In Vitro Antinociceptive Effect of Fagopyrum cymosum (Trev.) Meisn Extracts: A Possible Action by Recovering Intestinal Barrier Dysfunction. Evid Based Complement Alternat Med. 2012;2012:983801. [PubMed] [DOI] |
| 10. | Kim CD, Lee WK, No KO, Park SK, Lee MH, Lim SR, Roh SS. Anti-allergic action of buckwheat (Fagopyrum esculentum Moench) grain extract. Int Immunopharmacol. 2003;3:129-136. [PubMed] [DOI] |
| 14. | Shen L, Wang P, Guo J, Du G. Anti-arthritic activity of ethanol extract of Fagopyrum cymosum with adjuvant-induced arthritis in rats. Pharm Biol. 2013;51:783-789. [PubMed] [DOI] |
| 15. | Shahid A, Ali R, Ali N, Hasan SK, Bernwal P, Afzal SM, Vafa A, Sultana S. Modulatory effects of catechin hydrate against genotoxicity, oxidative stress, inflammation and apoptosis induced by benzo(a)pyrene in mice. Food Chem Toxicol. 2016;92:64-74. [PubMed] [DOI] |
| 16. | Lee YJ, Kim KJ, Park KJ, Yoon BR, Lim JH, Lee OH. Buckwheat (Fagopyrum esculentum M.) sprout treated with methyl jasmonate (MeJA) improved anti-adipogenic activity associated with the oxidative stress system in 3T3-L1 adipocytes. Int J Mol Sci. 2013;14:1428-1442. [PubMed] [DOI] |
| 17. | Liu LN, Yan J, Sun ZG. Effect of Fagopyrum cymosum (Trev.) Meisn alcohol extract on defecation and isolated colon of diarrhea-IBS rats and its mechanism. Zhongguo Zhongxiyi Jiehe Zazhi. 2014;34:1469-1475. [PubMed] |
| 19. | 刘 丽娜, 孙 志广, 张 雪梅, 周 梁, 田 超, 陈 利, 邵 铭, 史 会连, 郭 海燕. 金荞麦提取物对IBS大鼠脊髓镇痛的干预机制. 世界华人消化杂志. 2012;20:1290-1295. [DOI] |
| 23. | 闫 继平. 金荞麦化学成分及HPLC指纹图谱研究. 沈阳: 沈阳药科大学 2006; . |
| 24. | Olschläger C, Regos I, Zeller FJ, Treutter D. Identification of galloylated propelargonidins and procyanidins in buckwheat grain and quantification of rutin and flavanols from homostylous hybrids originating from F. esculentumxF. homotropicum. Phytochemistry. 2008;69:1389-1397. [PubMed] [DOI] |
| 25. | Danila AM, Kotani A, Hakamata H, Kusu F. Determination of rutin, catechin, epicatechin, and epicatechin gallate in buckwheat Fagopyrum esculentum Moench by micro-high-performance liquid chromatography with electrochemical detection. J Agric Food Chem. 2007;55:1139-1143. [PubMed] [DOI] |
| 26. | Youn SH, Kwon JH, Yin J, Tam LT, Ahn HS, Myung SC, Lee MW. Anti-Inflammatory and Anti-Urolithiasis Effects of Polyphenolic Compounds from Quercus gilva Blume. Molecules. 2017;22. [PubMed] [DOI] |
| 29. | Tang C, Kamiya T, Liu Y, Kadoki M, Kakuta S, Oshima K, Hattori M, Takeshita K, Kanai T, Saijo S. Inhibition of Dectin-1 Signaling Ameliorates Colitis by Inducing Lactobacillus-Mediated Regulatory T Cell Expansion in the Intestine. Cell Host Microbe. 2015;18:183-197. [PubMed] [DOI] |
| 30. | Zhou X, Cao L, Jiang C, Xie Y, Cheng X, Krausz KW, Qi Y, Sun L, Shah YM, Gonzalez FJ. PPARα-UGT axis activation represses intestinal FXR-FGF15 feedback signalling and exacerbates experimental colitis. Nat Commun. 2014;5:4573. [PubMed] [DOI] |
| 31. | Huang Y, Hu N, Gao X, Yan Z, Li S, Jing W, Yan R. Alterations of testosterone metabolism in microsomes from rats with experimental colitis induced by dextran sulfate sodium. Chem Biol Interact. 2015;232:38-48. [PubMed] [DOI] |
| 32. | Li S, Sui Y, Xiao J, Wu Q, Hu B, Xie B, Sun Z. Absorption and urinary excretion of A-type procyanidin oligomers from Litchi chinensis pericarp in rats by selected ion monitoring liquid chromatography-mass spectrometry. Food Chem. 2013;138:1536-1542. [PubMed] [DOI] |
| 33. | Prince PD, Fischerman L, Toblli JE, Fraga CG, Galleano M. LPS-induced renal inflammation is prevented by (-)-epicatechin in rats. Redox Biol. 2017;11:342-349. [PubMed] [DOI] |