修回日期: 2017-10-17
接受日期: 2017-10-28
在线出版日期: 2017-12-08
观察轻度慢性乙型肝炎(chronic hepatitis B, CHB)合并肺结核(pulmonary tuberculosis, PTB)患者的应用恩替卡韦抗乙型肝炎病毒(hepatitis B virus, HBV)的临床治疗效果.
选取2010-01/2016-12收治的临床诊断为轻度CHB[谷丙转氨酶(alanine transaminase, ALT)≤80 IU/L, HBV DNA升高超过检测下限]同时合并PTB的患者82例, 做肝活检后随机分为"抗病毒+抗痨组"和单独"抗痨组"各41例. 前者应用恩替卡韦抗HBV, 2 wk后联合2HREZ/4HR抗痨方案; 后者直接单独应用2HREZ/4HR, 疗程均为6 mo. 两组疗程中常规预防性口服水飞蓟宾、复方甘草酸苷等护肝药物.
82例肝活检显示, 炎症程度G1级22例, 占26.8%, G2-3级73.2%, 纤维化程度≥S2 49例, 占59.8%; 抗病毒组患者治疗前及治疗后4、12、24 wk ALT、总胆红素水平稳定, 其参数变化无统计学意义, 但治疗后HBV DNA下降明显, 与治疗前相比, 治疗后4、12、24 wk均有统计学差异(P<0.05), 与未抗病毒组HBV DNA水平比较, 治疗后4、12、24 wk亦有明显差异(P<0.05); 两组患者于抗痨治疗6 mo疗程结束时比较, 在HBV DNA阴转率(95.1% vs 0.0%)、肝损害发生率(14.6% vs 46.3%)、因不良反应未按时完成抗痨疗程, 中途被迫中断抗痨比例(9.8% vs 34.2%)等方面, 均有显著差别(P<0.05), 抗病毒组优于单纯抗痨组.
临床诊断的轻度CHB合并PTB患者, ALT等血清生化学指标难以如实体现合并感染后的肝脏炎症情况; 即使ALT水平和肝活检结果未达到《慢性乙型肝炎防治指南》要求, 预先应用恩替卡韦等强效抗HBV药物干预, 对降低患者应用抗痨药物的肝脏不良反应发生几率、抑制HBV DNA的复制、减少抗痨中断、提高患者的抗痨依从性和治疗效果亦有良好作用.
核心提要: 将82例临床诊断为初治轻度(chronic hepatitis B, CHB)合并肺结核(pulmonary tuberculosis, PTB)患者, 经肝穿活检后随机分为抗病毒治疗组和单独抗结核治疗组各41例, 前者应用抗乙型肝炎病毒(hepatitis B virus, HBV)联合抗结核治疗; 后者直接单独进行抗结核治疗, 两组疗程中常规预防性口服水飞蓟宾、复方甘草酸苷等护肝药物. 结果显示轻度CHB合并PTB病患者, 抗结核治疗前予抗HBV治疗能有效降低患者应用抗痨药物的肝脏不良反应发生几率、抑制HBV DNA的复制、减少抗痨中断、提高患者的抗痨依从性和治疗效果.
引文著录: 蒋福明, 程书权, 黄成军, 刘平香, 曹亚昭, 林君, 杨景毅. 轻度慢性乙型肝炎合并肺结核患者抗病毒治疗82病例对照研究. 世界华人消化杂志 2017; 25(34): 3072-3079
Revised: October 17, 2017
Accepted: October 28, 2017
Published online: December 8, 2017
To observe the clinical efficacy of entecavir against hepatitis B virus (HBV) in patients with mild chronic hepatitis B (CHB) and pulmonary tuberculosis (PTB).
Eight-two cases mild chronic hepatitis B patients with tuberculosis were chosen between January 2010 and December 2016. After liver biopsy, they were randomly divided into an antiviral treatment group (41 cases) and an antituberculosis therapy group (41 cases). The antiviral treatment group was treated with entecavir, and after 2 wk, it was combined with 2HREZ/4HR for antituberculosis treatment. The antituberculosis therapy group was treated with 2HREZ/4HR only. The course of treatment in both groups was 6 mo. Oral silybin and compound glycyrrhizin were given in both groups. After treatment, therapeutic efficacy and safety were compared between the two groups.
All the 82 cases underwent liver biopsy, which showed that 22 (26.8%) cases had G1 grade inflammation and 49 (59.8%) cases had a fibrosis level ≥ S2. The levels of ALT and Tbil were comparable between after and before treatment in the two groups. However, the HBV DNA significantly declined at 4, 12, and 24 wk after antiviral treatment (P < 0.05), and HBV DNA in the antiviral treatment group was significantly lower than that in the antituberculosis therapy group. After treatment, HBV DNA negative conversion rate (95.1% vs 0%), liver damage (14.6% vs 46.3%), and the rate of discontinuing antituberculosis treatment due to adverse reactions (9.8% vs 34.2%) were significantly better in the antiviral treatment group than in the antituberculosis therapy group (P < 0.05).
For mild chronic hepatitis B patients with tuberculosis, entecavir treatment can reduce the incidence of liver adverse reactions to antituberculosis treatment, decrease HBV DNA level, reduce the discontinuation of antituberculosis therapy, and improve the clinical compliance to antituberculosis treatment.
- Citation: Jiang FM, Cheng SQ, Huang CJ, Liu PX, Cao YZ, Lin J, Yang JY. Antiviral treatment of mild chronic hepatitis B patients with tuberculosis: A controlled study. Shijie Huaren Xiaohua Zazhi 2017; 25(34): 3072-3079
- URL: https://www.wjgnet.com/1009-3079/full/v25/i34/3072.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v25.i34.3072
慢性乙型肝炎(chronic hepatitis B, CHB)和肺结核病(pulmonary tuberculosis, PTB)作为我国病毒性传染病和细菌性传染病的两大主要疾患, 其高发病与高流行形势迄今依然严峻[1,2], 乙型肝炎病毒(hepatitis B virus, HBV)与结核杆菌(mycobacterium tuberculosis, MTB) 的合并感染已成为传染病防控和临床治疗的一个新的棘手问题[3-6]. 对于此类患者, 若初始出现明显的肝功能异常如谷丙转氨酶(alanine transaminase, ALT) >80 IU/L[>2 正常值上限(upper limits of normal, ULN)], 达到我国《慢性乙型肝炎防治指南》的CHB抗病毒治疗指征[7], 应于抗痨前进行抗HBV治疗, 这已成为多数医师的临床共识[6]. 但对于抗痨治疗前肝功能正常或ALT轻微升高(ALT≤2 ULN)的轻度CHB患者, 在未做肝活检确定肝脏炎症和纤维化程度时, 是否应予先行抗HBV治疗, 至今仍有争论[8]. 本文总结我们收治的82例临床诊断为轻度CHB的合并PTB患者, 分组进行抗HBV联合抗痨和单独抗痨的比对研究, 现总结如下.
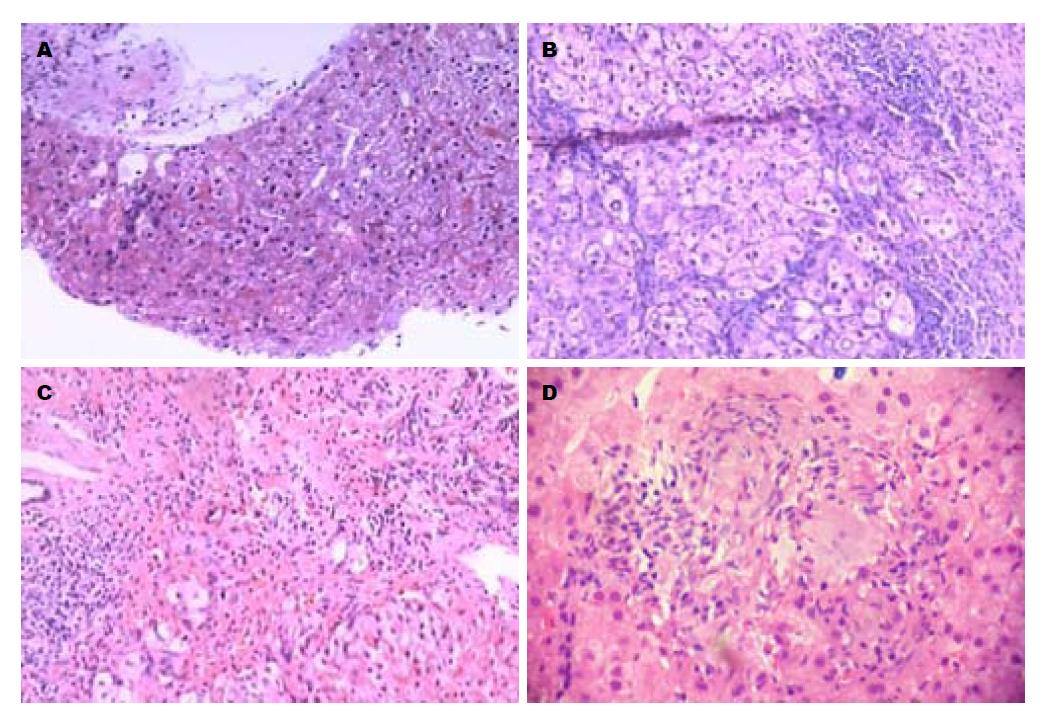
2010-01/2016-12桂林市第三人民医院肝病科共收治CHB合并PTB患者共165例, 选取其中的82例作为研究对象, 所有入选对象均符合以下条件: (1)两种感染均为初治, 入院前未应用过任何抗痨和抗HBV药物; (2)ALT≤80 IU/L, HBV DNA升高超过检测下限(>100 IU/mL); (3)未合并慢性支气管炎、肺气肿、支气管扩张、肺癌、肝硬化、肝癌、糖尿病、高血压及其他心脑血管疾病和基础疾病, 无长期应用免疫抑制剂和精神药物, 无人类免疫缺陷病毒、丙型肝炎及其他嗜肝病毒感染或肝吸虫混合或重叠感染者; (4)无潜存自身免疫性肝病、药物性肝炎、胆汁淤积性肝病、遗传代谢性肝病、酒精性肝病等可能影响肝功能指标的疾病. 82例入院后均行1 s快速肝穿刺活检术, 尔后随机分为"抗病毒+抗痨"组(抗HBV+抗痨联合治疗)和"抗痨"组(单独抗痨), 2组各41例. 前者中男性26例, 女性15例, 平均年龄为39.80岁±14.20岁, 乙型肝炎表面抗原(hepatitis B surface antigen, HBsAg)阳性32例, 抗-HBe阳性9例; 后者中男性25例, 女性16例, 平均年龄为42.11岁±15.02岁, HBsAg阳性31例, 抗-HBe阳性10例. 两组患者性别、年龄、HBV和MTB感染时间等基本因素的基线资料无统计学差异(P>0.05, 表1), 具可比性. 囿于CHB和PTB治疗的迫切性、时效性和伦理学约束, 本研究未设立应用安慰剂的对照组. 入院时统一检测血常规、血糖、血凝四项、肝肾功能、HBV血清标记物(HBV serum markers, HBV-M)、HBV DNA、腹部B超和计算机断层扫描(computed tomography, CT)等影像学检查并常规做痰涂片及MTB培养、胸部X线与CT扫描等筛选适合病例. 82例中病灶位于单侧肺部44例, 双肺38例, 合并空洞23例, 合并胸腔积液15例, 通过肝活检发现肝脏不同程度炎症和纤维化(图1A, B), 其中4例存在肝结核(图1C, D). 痰菌阳性10例, 阴性72例, 两组患者在胸部表现方面亦无统计学差异. 所有患者在肝穿活检前1 mo内均未进行过相关的血液治疗, 包括血液透析、输血或血制品、腹膜透析、服用影响凝血机制的药物, 如华法林、肝素、维生素K等.
| 分组 | 性别 | 平均年龄(岁) | 疾病类型 | ||||
| 男性 | 女性 | 单肺 | 双肺 | 痰菌阳性 | 合并胸膜炎 | ||
| "抗病毒+抗痨"组 | 26 (63.4) | 15 (36.6) | 40.15±14.21 | 24 (58.5) | 17 (41.5) | 6 (14.6) | 8 (19.5) |
| 抗痨组 | 25 (61.0) | 16 (39.0) | 42.17±14.97 | 20 (48.8) | 21 (51.2) | 4 (9.8) | 7 (17.1) |
1.2.1 实验室检查: 肝功能由全自动生化分析仪检测; 凝血酶原时间检测采用法国STA-Compact全自动血凝仪, 试剂及质控液均由DIAGNOSTICA STAGO公司原装配套提供; HBV DNA和HBV基因型诊断仪器为中山大学达安DA-7600型荧光定量PCR仪及其配套设备, HBV-DNA试剂盒由广州达安基因公司提供, 以上检测均严格按照说明书要求规范操作.
1.2.2 病理检查: 肝活检在患者签署知情同意书后, 通过B超定位进行. 用美国产Bard MAGNUM型穿刺枪、16 G穿刺针, 实施1 s负吸法于呼气末快速肝组织穿刺活检. 获取肝组织10-20 mm, 包含4个以上可供评价的汇管区, 即刻固定于4%甲醛溶液中, 进行石蜡包埋, 连续切片, HE染色、Masson染色、Vimentin染色. 由高年资病理医师在未知患者疾病状态的情况下进行炎症活动、纤维化程度进行分级和分期诊断, 严格参照2000年《病毒性肝炎防治方案》中的慢性肝炎分级、分期标准执行[9]. 每份病理标本均经2位医师复核, 以减少诊断误差(典型病变如图1A).
1.2.3 治疗: 2组患者抗痨方案均统一为2HREZ/4HR, 即开始2 mo应用异烟肼(isoniazid, INH)0.3 g/d+利福平(rifampicin, RFP)0.45 g/d+乙胺丁醇0.75 g/d每天1次顿服, 吡嗪酰胺(pyrazinamide, PZA)1.5 g/d, 分3次口服, 2 mo后改为INH、RFP继续口服4 mo; 疗程中常规预防性口服水飞蓟宾、复方甘草酸苷等护肝药物. 其中"抗病毒+抗痨"组于抗痨前2 wk先予恩替卡韦(entecavir, ETV)分散片0.5 mg/d(正大天晴公司生产)空腹口服, 直至抗痨疗程结束, G2(或S2)以上患者建议继续服用恩替卡韦, 达到最新指南停药标准后停药; G1(或S1)以上患者建议经充分沟通后, 同意服药者继续服药, 达停药标准后停药, 不同意者继续服恩替卡韦直至抗痨药后3 mo停抗病毒药. 抗HBV治疗2 wk后联合上述抗痨药物; 未抗病毒组直接应用上述抗痨药物组合.
1.2.4 观察指标: 开始病原治疗前复查2组患者的血常规、肝肾功能等生化指标、HBV DNA变化情况, 治疗开始后2-4 wk复查1次, 持续稳定者酌情延长复查时间至8-12 wk 1次, 直至疗程结束, 着重观察抗痨治疗后4、12、24 wk时的肝功能和HBV DNA结果. 对2组患者的疗程、症状演变、肝功能改变及其他不良反应出现情况及处理等列表记录. 抗痨疗程结束后随访24 wk.
1.2.5 肝损害的诊断标准与判断处理: 疗程中若患者ALT或总胆红素(total bilirubin, TBil)在2×ULN以上, 或谷草转氨酶(aspartate transaminase, AST)、ALT及TBil同时升高, 且≥1项在2 ULN以上, 则评定为肝损害[2]. 肝损害的诊断按照世界卫生组织肝损害分级(表2)进行[10].
| 世界卫生组织损害分级 | 肝功能指标 |
| 轻度(1级) | <2.5×ULN(ALT 51-125 U/L) |
| 轻度(2级) | 2.5-5.0×ULN(ALT 126-250 U/L) |
| 中度(3级) | 5.0-10.0×ULN(ALT 251-500 U/L) |
| 重度(4级) | >10.0×ULN(ALT>500 U/L) |
出现肝功能异常者运用以下分层与处理[11]: (1)仅ALT在2 ULN范围内波动, TBil正常者为肝功能轻微异常, 可仅用上述口服护肝药物, 消化道症状明显者酌情使用针剂护肝治疗, 原则上稳定肝细胞膜药物≤1种, 降酶药物≤2种, 肝病辅助用药≤2种. 若肝功能好转, 原抗痨方案不变, 若肝功能反复异常, 酌情停用肝损伤发生频率较高的药物如PZA; (2)2 ULN≤ALT(或AST)≤5 ULN, TBil正常者, 口服上述护肝药物无好转或消化道症状持续, 可静脉使用2种护肝药物, 更改抗痨方案中的PZA、RFP为链霉素, INH亦可改为左氧氟沙星或暂停抗痨药物加强护肝处理(更改抗痨方案者需酌情延长疗程); (3)ALT(或AST)>5 ULN, 无论消化道症状轻重、TBil是否正常, 均应立即停用所有抗痨药物, 积极保肝治疗, 待肝功能恢复后再酌情调整为二、三线抗痨药物治疗.
统计学处理 用SPSS19.0统计软件, 计量数据以mean±SD表示, 方差齐时两组均数比较采用t检验, 方差不齐时采用Mann-Whitney U检验, 两样本率的比较采用χ2检验, P<0.05为差异有统计学意义.
两组患者各基线资料比较, 无显著性差异(P>0.05, 表1).
由表3可见, 本组患者肝脏病理损害较为明显, 虽然ALT水平均为轻度改变, 但肝细胞病理学改变均在G0S0以上. 其中G1S1、G1S2各11例, G2S2 22例, G2S2 24例, G3S2 6例, G3S3 5例. 炎症程度≥G2 60例, 占73.2%. 纤维化程度≥S2 49例, 占59.8%.
| 纤维化程度 | 炎症活动度 | 合计 | ||||
| G0 | G1 | G2 | G3 | G4 | ||
| S0 | 0 | 0 | 0 | 0 | 0 | 0 |
| S1 | 0 | 11 | 22 | 0 | 0 | 33 |
| S2 | 0 | 11 | 24 | 6 | 0 | 41 |
| S3 | 0 | 0 | 3 | 5 | 0 | 8 |
| S4 | 0 | 0 | 0 | 0 | 0 | 0 |
| 合计 | 0 | 22 | 49 | 11 | 0 | 82 |
表4结果显示, "抗病毒+抗痨"组患者治疗前及治疗后4、12、24 wk ALT、TBil水平稳定, 其参数变化无统计学意义. 但治疗后HBV DNA水平下降明显, 与治疗前相比, 治疗后4、12、24 wk下降幅度均有统计学差异(P<0.05). 与抗痨组HBV DNA水平比较, 治疗后4、12、24 wk亦有明显差异(P<0.05). 抗痨组治疗前及治疗后4 wk ALT、TBil变化无统计学意义, 治疗后12、24 wk与治疗前相比, ALT、TBil似有升高趋势, 但无统计学意义. HBV DNA治疗前与治疗后4、12、24 wk两两比较有统计学差异, 治疗后12、24 wk较治疗前升高(P<0.05).
| 分组 | ALT(U/L) | TBil(µmol/L) | HBV DNA水平(log值) |
| "抗病毒+抗痨"组 | |||
| 治疗前 | 38.32±17.15 | 10.86±3.38 | 6.77±0.91 |
| 治疗4 wk | 38.56±35.32 | 10.16±3.80c | 3.84±1.89 |
| 治疗12 wk | 32.95±24.42 | 10.23±4.03 | 1.09±1.74 |
| 治疗24 wk | 23.73±7.03 | 9.28 ±4.32 | 0.18±0.79a |
| 抗痨组 | |||
| 治疗前 | 35.66±16.90 | 10.42±3.23 | 6.25±1.03 |
| 治疗4 wk | 39.95±40.33 | 9.36±5.89 | 6.56±0.79c |
| 治疗12 wk | 51.07±58.67 | 19.15±58.03 | 6.75±0.84c |
| 治疗24 wk | 44.68±89.78 | 17.29±46.34 | 6.84±0.81c |
由表5结果显示, 两组患者于抗痨治疗6 mo疗程结束时比较, 在HBV DNA阴转率(95.1% vs 0.0%)、肝损害发生率(14.6% vs 46.3%)、因不良反应未按时完成抗痨疗程, 中途被迫中断抗痨比例(9.8% vs 34.2%)等方面, 均有显著差别(P<0.05), "抗病毒+抗痨"组优于抗痨组.
| 分组 | DNA阴转 | 肝损害 | 中断抗痨 | 死亡 |
| "抗病毒+抗痨"组 | 39 (95.1) | 6 (14.6) | 4 (9.8) | 0 (0) |
| 抗痨组 | 0 (0) | 19 (46.3) | 14 (34.2) | 2 (4.9) |
| χ2值 | 74.372 | 9.725 | 7.118 | 2.05 |
| P值 | 0.00 | 0.002 | 0.008 | 0.152 |
轻度CHB是HBV感染后一种最为常见的临床状态, 由于肝细胞炎症程度较轻, 多数患者缺乏典型症状, 肝功能仅1-2项轻度异常, 常常仅于体检时做HBV-M而被发现. 我们曾对其中的94例患者进一步做肝活检, 结果发现44.7%患者肝脏炎症程度≥2级[8]. 由于此类患者潜存一定程度的免疫功能异常, 易于合并MTB感染[12]. MTB感染的缓慢、持续、复发率高等特征和抗痨治疗疗程长、需多药联合、易于出现明显的肝脏毒性等因素, 使得二者合并出现后临床经过复杂, 治疗难度倍增. 在抗痨过程中更容易出现肝损害致使抗痨方案的中断、结核病不易治愈、MTB耐药率增加或提早出现, 甚至因严重肝损害诱发重型肝炎、肝衰竭而致命, 故已成为当今临床的棘手难题之一[4,13]. CHB合并PTB抗痨后易于出现肝损害的主要因素有: (1)CHB患者存在T淋巴细胞亚群介导的细胞免疫功能紊乱, 机体防御功能下降, 导致药物对肝脏损伤的易感性增加[14]; (2)CHB预存一定程度的肝脏炎症, 使得肝脏生物转化功能减弱, 药物在肝脏的代谢变慢, 容易发生蓄积导致中毒性损伤[15]; (3)CHB的纤维化可使肝小叶结构紊乱, 肝组织血流供应减少、分布异常, 药物清除能力下降, 进而加剧药物的肝毒性[15]; (4)HBV感染使网状内皮细胞功能下降、数量减少, 肝脏清除炎症因子及抗痨药物体内代谢的中间产物等毒素的能力下降; (5)MTB本身具有的肝脏侵袭风险和毒性作用[16], 如本组82例肝活检发现肝结核4例, 占4.9%; (6)抗痨药物大多以明显或潜在肝毒性为主要不良反应, 三种或三种以上的药物长程、足量使用, 与HBV形成对肝细胞"里应外合"的叠加作用[17]. 因此, 对CHB合并PTB提前进行评估和恰当干预, 已渐为临床医师所关注[6,12,17,18].
依据我国《慢性乙型肝炎防治指南》的推荐意见, 患者抗痨前有明显肝损害, ALT≥2 ULN便达到抗HBV的治疗指征, 可先予抗病毒治疗的干预. 但轻度CHB因多处于免疫耐受期, 肝功能正常或ALT未达≥2 ULN, 不主张应用抗HBV药物[7]. 对合并感染者单纯抗痨易出现较高的肝毒性, 使治疗失败, 是否能够控制CHB的病毒活动, 于抗痨前先行抗HBV治疗, 至今尚无一致意见[15,17]. 支持者认为抗HBV可减少肝脏损伤及抗痨风险, 增加肝脏对抗痨药物的毒性抵御能力和患者的治疗依从性和治愈率[6,12]; 反对者认为未达抗HBV生化指征时予抗HBV可能影响疗效甚或诱发抗HBV药物的耐药株提早出现的风险, 有过度治疗之虞[15]. 本组82例肝活检结果提示, 73.2%肝脏炎症程度≥G2, 与我们之前报道的单纯CHB患者肝活检结果(≥G2者44.7%)明显为高[8], 提示合并感染患者肝脏病理损害程度重于单纯CHB, 且多数呈潜隐性经过, ALT水平并无相应升高. 由此可见, 合并感染者的血清ALT水平与肝脏炎症程度及纤维化程度并非线性关系, 若抗痨前单凭ALT指标决定是否抗病毒治疗, 将ALT作为抗HBV的主要依据, 会导致较大比例的患者失去最佳的抗病毒治疗时机, 亦对后续的抗痨治疗产生不利影响. 对此, 肝活检的重要价值不可取代[18]. 本组另22例肝活检在G1水平者予ETV治疗期间, HBV DNA水平亦得到显著下降, 抗痨疗程中未出现1例HBV耐药, 是否与ETV对HBV抑制作用较强且耐药屏障较高或抗痨用药疗程较短等因素有关, 值得进一步观察.
由表5可见, 抗痨前预先进行抗HBV治疗干预者出现肝损害的比例远低于未抗HBV治疗者(14.6% vs 46.3%), 中断抗痨治疗的比例"抗病毒+抗痨"组亦较抗痨组明显为少(9.8% vs 34.2%). 这从临床角度提示, 对合并感染者若HBV DNA阳性, 即使ALT升高不明显, 亦建议抗痨前先行抗HBV治疗, 以减少肝细胞HBV DNA载量及其在肝细胞表面的表达, 减轻肝细胞的免疫损伤, 改善肝组织炎症状态, 提高肝脏的解毒功能, 增加肝脏对抗痨药物的耐受性, 从而减少药物性肝炎出现几率, 提高PTB的治愈率. 值得注意的是, 抗痨组2例发生重型肝炎, 分别出现于抗痨12 wk和23 wk抗痨疗程即将结束时, 虽经人工肝等措施积极救治亦未能挽救患者生命, 而"抗病毒+抗痨"组中无类似病例出现. 亦提示抗痨前的HBV抑制或许是减少罹发药物性肝损害的有效手段之一, 值得临床进一步关注.
迄今, 可用于CHB临床的核苷类似物(nucleoside analogues, NAs)包括拉米夫定(lamivudine, LAM)、阿德福韦酯、替比夫定、ETV及替诺福韦酯(tenofovir disoproxil fumarate, TDF)5种. NAs具有抑制病毒作用快而强、使用方便、不良反应少而轻微、可用于肝功能失代偿期等优点. 我国早期的研究应用LAM治疗合并感染者发现, 干预后可使患者肝损害的发生风险降低9.3倍[19]. 但由于LAM的高耐药率, 目前主张ETV及TDF作为治疗的首选. 据白艳红[20]对比研究使用ETV和LAM对80例合并感染患者的经验, ETV组的肝功能改善率及HBV DNA下降水平均优于LAM组. 但目前国内的研究报道均未提及合并感染者的抗病毒适应证相关情况, 由本研究"抗病毒+抗痨"组预先使用ETV干预的结果显示, 治疗后4 wk HBV DNA水平即开始明显下降, 呈现出有意义的统计学差别, 治疗至24 wk使HBV DNA转阴达95.1%, 已获得满意的抗HBV治疗效果. 而抗痨组抗痨12 wk后的HBV DNA较治疗前反见升高(P<0.05), 提示抗痨药的使用可能会导致HBV DNA的活跃程度增加, 由此可能加大CHB重症化的风险, 对PTB的后续治疗和肝脏本身都形成隐患."抗病毒+抗痨"组治疗前及治疗过程中肝功能持续稳定, 未出现有统计学意义的变化, 抗痨组虽然出现肝损害的比例较"抗病毒+抗痨"组明显增多, 但抗痨治疗前后ALT及TBil对比无统计学意义, 则与本组研究者对肝损害的出现高度关注, 发生轻微改变即予及时处理有关.
由本研究数据可见, 对初治的CHB合并PTB无明显肝、肾功能损害者, 在先期强效抗病毒药物应用的前提下, 2HREZ/4HR亦可作为主要的抗痨方案使用. 尤其PZA, 对处于酸性环境中缓慢生长的吞噬细胞内的MTB具有最佳的杀灭作用, 抑制细胞内MTB的浓度比细胞外低10倍, 通过渗透入吞噬细胞后进入MTB菌体内, 转化为吡嗪酸而发挥抗菌作用. 尤对于痰菌阳性的患者, 作用更为重要, 成为短程化疗的坚实保障. 囿于H、R、Z均有一定的肝毒性, 联合尤然, 对轻度CHB合并PTB患者, 我们认为, 在常规应用口服护肝药物的前提下, 为降低抗痨后肝损害的出现几率, 先期抗HBV治疗不失为最好的选择方法之一.
慢性乙型肝炎(chronic hepatitis B, CHB)和肺结核(pulmonary tuberculosis, PTB)均为我国发病率居高不下的传染性疾病, 乙型肝炎病毒(hepatitis B virus, HBV)及结核分枝杆菌合并感染已经不容忽视; 目前对此类患者于抗结核治疗前的基线肝功能正常或ALT轻微升高(≤2 正常值上限)的轻度CHB, 是否应予先行抗HBV治疗, 以及抗结核治疗前行抗HBV治疗是否可减轻抗结核药物的肝损害, 至今未得到一致意见, 亟待进一步研究探索.
近年来, 尽管国内外对于CHB合并肺结核的治疗方案渐渐成为研究热点, 但迄今仍未完全阐明CHB和PTB的相互作用及其机制, 国内未形成完整的相关治疗指南. 因此, 如何高效地抗HBV并减少合并感染患者对核苷类似物和抗结核化疗方案的耐药、如何遴选适合合并感染患者的高效低肝毒性抗痨组合、如何把控抗HBV药物的切入及停药时机、如何最大限度降低抗结核药物的肝毒性等等问题, 是目前及今后一个相当长时段需要临床正视的重要问题. 需要结防、疾控、呼吸、传染、药学等不同专业人员整合相应资源, 打破条块约束, 改变传统理念, 积极创新, 联合攻关. 以谋求最适合的抗病毒、抗结核顺序及治疗方案, 提高治疗效果, 改善患者预后.
文章在展望国内外研究前沿的基础上, 针对临床诊断为轻度CHB合并肺结核这一特定人群, 分组对临床病例进行不同治疗方案的比较, 通过缜密的临床实验设计及可靠的统计学方法, 得出了具有临床指导价值的结论, 本文条理清晰, 实验数据可靠, 临床效果较好, 值得临床进一步探讨验证.
在目前相对成熟的抗HBV及抗结核治疗的基础上, 从合并感染这一特殊切入点着手, 在临床治疗中, 前期先行予以抗HBV治疗, 辅以口服护肝药物, 再行经典抗结核治疗, 有效地减少了传统抗结核疗程中容易出现的严重肝损害风险, 具有较好的临床应用价值.
本文对轻度CHB合并肺结核的患者应用恩替卡韦抗HBV治疗的临床效果进行了观察分析, 发现: 轻度CHB合并PTB患者, 肝组织炎症程度明显重于单纯CHB; ALT等血清生化学指标难以区别患者的肝脏炎症程度; 预先应用恩替卡韦抗HBV干预, 对降低患者应用抗痨药物的肝脏不良反应发生几率、抑制HBV DNA的复制、减少抗痨中断、提高患者的抗痨依从性和治疗效果亦有良好作用. 对临床工作具有重要的价值.
党双锁, 教授, 研究员, 主任医师, 西安交通大学医学院第二附属医院感染科; 丁向春, 副教授, 主任医师, 宁夏医科大学总医院感染性疾病科; 杨江华, 副教授, 主任医师, 安徽省芜湖市皖南医学院弋矶山医院感染科
手稿来源: 自由投稿
学科分类: 胃肠病学和肝病学
手稿来源地: 广西壮族自治区
同行评议报告分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): C
D级 (一般): D
E级 (差): 0
编辑: 马亚娟 电编:李瑞芳
| 1. | Goyal A, Murray JM. The impact of vaccination and antiviral therapy on hepatitis B and hepatitis D epidemiology. PLoS One. 2014;9:e110143. [PubMed] [DOI] |
| 2. | Mijiti P, Yuehua L, Feng X, Milligan PJ, Merle C, Gang W, Nianqiang L, Upur H. Prevalence of pulmonary tuberculosis in western China in 2010-11: a population-based, cross-sectional survey. Lancet Glob Health. 2016;4:e485-e494. [PubMed] [DOI] |
| 3. | Bushnell G, Stennis NL, Drobnik AM, Proops DC, Ahuja SD, Bornschlegel K, Fuld J. Characteristics and TB treatment outcomes in TB patients with viral hepatitis, New York City, 2000-2010. Epidemiol Infect. 2015;143:1972-1981. [PubMed] [DOI] |
| 4. | Liu YM, Cheng YJ, Li YL, Liu CE, Hsu WH. Antituberculosis treatment and hepatotoxicity in patients with chronic viral hepatitis. Lung. 2014;192:205-210. [PubMed] [DOI] |
| 5. | Nooredinvand HA, Connell DW, Asgheddi M, Abdullah M, O'Donoghue M, Campbell L, Wickremasinghe MI, Lalvani A, Kon OM, Khan SA. Viral hepatitis prevalence in patients with active and latent tuberculosis. World J Gastroenterol. 2015;21:8920-8926. [PubMed] [DOI] |
| 6. | 蒋 福明, 李 秀芬, 程 书权, 刘 平香, 黄 成军, 冼 永超. 83例轻度慢性乙型肝炎合并肺结核患者肝组织病理学与血清生化学及T细胞亚群相关性分析. 重庆医科大学学报. 2018;43:180-186. |
| 8. | 胡 金华, 程 书权, 唐 振祥, 冼 永超, 黄 成军, 蔡 毅峰, 张 磊. 不同基因型HBV感染的慢性乙型肝炎患者临床与病理改变研究. 重庆医科大学学报. 2012;37:355-359. |
| 13. | Saitou Y, Hatazi O, Aonuma H, Ogura S, Yamamoto N, Kobayashi T. Pulmonary tuberculoma in a patient with chronic hepatitis C: a clinical pitfall in the treatment strategy. Intern Med. 2014;53:1669-1674. [PubMed] [DOI] |
| 16. | Kharrasse G, Soufi M, Berekhli H, Intissar H, Bouziane M, Ismaili Z. Primary tuberculoma of the liver: a case report and literature review. Pan Afr Med J. 2014;19:321. [PubMed] [DOI] |
| 19. | 惠 石生, 陈 立章, 李 战战. 拉米夫定对肺结核合并慢性乙型肝炎患者抗结核治疗肝损害干预作用的Meta分析. 中南大学学报(医学版). 2015;40:912-920. |