修回日期: 2017-11-02
接受日期: 2017-11-04
在线出版日期: 2017-12-08
探讨肝移植术后肝组织T淋巴细胞Th17/Treg表达变化和肝移植免疫耐受之间的关系.
以采用改良Kamada二袖套法建立LEWIS→BN原位肝移植大鼠急性排斥反应模型: LEWIS大鼠为供体, BN大鼠为受体, 行原位肝移植(orthotopic liver transplantation, OLT). 对照组为: BN→BN原位肝移植大鼠耐受模型: BN大鼠为供体, BN大鼠为受体, 行OLT. 术后观察大鼠一般情况, 并于第1、3、5及7天分别处死大鼠取肝组织, HE染色观察肝组织结构. 检测血清谷丙转氨酶(alanine transaminase, ALT)、谷草转氨酶(aspartate transaminase, AST)、白介素(interleukin, IL)-17、IL-23、IL-10和转化生长因子-β1(transforming growth factor beta 1, TGF-β1)的表达水平.
与对照组比较, LEWIS→BN组各时间点肝功能指标ALT、AST明显上调(P<0.05); 对照组第7天ALT: 819.29 IU/L±79.33 IU/L; OLT组第7天ALT: 1305.62 IU/L±94.82 IU/L; 对照组第7天AST: 337.82 IU/L±32.17 IU/L, OLT组第7天AST: 867.75 IU/L±73.97 IU/L. 大鼠第7天外周血Th17相关因子IL-17(对照组: 28.67 pg/mL±2.55 pg/mL, OLT组: 92.36 pg/mL±9.00 pg/mL), IL-23(对照组: 26.82 pg/mL±8.17 pg/mL, OLT组: 62.98 pg/mL±12.96 pg/mL)明显上升, 而Treg相关因子IL-10(对照组: 76.92 pg/mL±12.87 pg/mL, OLT组: 47.92 pg/mL±7.00 pg/mL)、TGF-β1(对照组: 129.47 pg/mL±18.37 pg/mL, OLT组: 82.48 pg/mL±11.83 pg/mL)明显下降, Th17/Treg表达失去平衡. 同时, TGF-β下游Smad2/3蛋白具有跟TGF-β1相同变化趋势, LEWIS→BN急性排斥组与BN→BN免疫耐受组相比, 差异具有统计意义(P<0.05).
IL-17、IL-23、IL-10、TGF-β1、Smad2/3参与了同种异体大鼠肝移植急性排斥反应, 引起Treg向Th17的免疫偏移, 可作为治疗大鼠肝移植免疫耐受的靶向指标.
核心提要: 本研究利用近交系大鼠急性肝移植排斥模型(LEWIS→BN), 观察淋巴细胞中Th17/Treg的平衡改变的机理, 研究发现: 与BN→BN组比较, LEWIS→BN组大鼠外周血Th17相关因子[白介素(interleukin, IL)-17, IL-23]明显上升, 而Treg相关因子[IL-10、转化生长因子-β(transforming growth factor beta, TGF-β)1]明显下降, 与TGF-β相关的Smad2和Smad3蛋白也表现下调的趋势, Th17/Treg的平衡向Th17迁移.
引文著录: 李瑞东, 陶一峰, 沈从欢, 马震宇, 张晓飞, 张全保, 王正昕. Th17、Treg及其平衡与大鼠肝移植术后免疫耐受的研究. 世界华人消化杂志 2017; 25(34): 3046-3052
Revised: November 2, 2017
Accepted: November 4, 2017
Published online: December 8, 2017
To investigate the relationship between Th17/Treg expression in liver tissue and immune tolerance after liver transplantation.
A rat model of orthotopic liver transplantation from Lewis rats to Brown Norway (BN) rats (LEWIS→BN) was developed using Kamada's two-cuff technique. Control rats underwent orthotopic BN→BN liver transplantation. After operation, the general condition of rats was observed. Rats were sacrificed on days 1, 3, 5, and 7 after modeling to collect liver tissues for HE staining. The levels of serum alanine transaminase (ALT), aspartate transaminase (AST), interleukin (IL)-17, IL-23, IL-10, and transforming growth factor (TGF)-β1 were measured by ELISA.
Compared with the control group, serum levels of ALT and AST were increased obviously in the LEWIS→BN group at all the three time points (P < 0.05, on the 7th day, ALT in the control group: 819.29 IU/L ± 79.33 IU/L; in the LEWIS→BN group: 1305.62 IU/L ± 94.82 IU/L, AST in the control group: 337.82 IU/L ± 32.17 IU/L; AST in the LEWIS→BN group: 867.75 IU/L ± 73.97 IU/L); the levels of Th17 related factors IL-17 (the control group: 28.67 pg/mL ± 2.55 pg/mL, the LEWIS→BN group: 92.36 pg/mL ± 9.00 pg/mL) and IL-23 (the control group: 26.82 pg/mL ± 8.17 pg/mL, the LEWIS→BN group: 62.98 pg/mL ± 12.96 pg/mL) in the peripheral blood were increased dramatically, while the levels of Treg related factor IL-10 (the control group: 76.92 pg/mL ± 12.87 pg/mL, the LEWIS→BN group: 47.92 pg/mL ± 7.00 pg/mL) and TGF-β1 (the control group: 129.47 pg/mL ± 18.37 pg/mL, the LEWIS→BN group: 82.48 pg/mL ± 11.83 pg/mL) were decreased dramatically in the LEWIS→BN group, suggesting the presence of Th17/Treg imbalance in acute rejection. The downregulation of Smad2/3 protein levels had the same trend as TGF-β1, and the difference between the Lewis→BN acute rejection group and the BN→ BN immune tolerance group was statistically significant (P < 0.05).
IL-17, IL-23, IL-10, and TGF-β1 take part in acute rejection after orthotopic liver transplantation, causing Treg to Th17 immune deviation, which may be used as a target index in immune tolerance of liver transplantation.
- Citation: Li RD, Tao YF, Shen CH, Ma ZY, Zhang XF, Zhang QB, Wang ZX. Role of Th17 and Treg cells and Th17/Treg imbalance in immune tolerance in rats after liver transplantation. Shijie Huaren Xiaohua Zazhi 2017; 25(34): 3046-3052
- URL: https://www.wjgnet.com/1009-3079/full/v25/i34/3046.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v25.i34.3046
自美国科学家Starzl在20世纪中期实施了第1例人体原位肝移植以来, 历经几十年的研究和发展, 肝移植技术已经成为治疗各种终末期肝病最有效的方法[1,2]. 尽管肝脏是一个免疫特惠器官, 与其他实质器官相比, 肝移植术后排斥反应的发生率及程度较低. 但是肝移植术后的急、慢性排斥反应仍是移植肝脏长期存活的主要障碍[3,4]. 因此, 缓解肝移植术后排斥反应的最好方法是诱导一种供者特异性的免疫抑制状态, 使移植物为宿主所接受, 且不影响宿主的其他免疫功能, 即移植免疫耐受[5]. 目前, 随着"外来"免疫抑制剂应用的失败, 人们意识到对排斥反应的最佳治疗方式是诱导性的自发免疫耐受[6].
在肝移植术后, 淋巴细胞活化, CD4+T细胞进一步分化为1型辅助性T细胞(T helper cells 1, Th1)、2型辅助性T细胞(T helper cells 2, Th2)、Th17和调节性T细胞(regulatery T cell, Treg细胞)等亚型, 各亚型的T淋巴细胞具有分泌不同细胞因子、调节机体免疫应答和维持机体稳态等多种功能, 在移植免疫中发挥重要作用[7]. 已有研究[8]证实, Th1向Th2细胞发生免疫偏离是移植耐受的机制之一. 而Th17和Treg的关系, 正如Th1和Th2一样, 既可相互对抗, 还可相互转化, 在复杂的细胞因子网络中, 表现出极大的可塑性. 此外, 转化生长因子-β(transforming growth factor beta, TGF-β)/Smad信号通路调节的Th17/Treg平衡已经成为防治慢性移植性肝病的新途径. 近年来Thl7/Treg轴在移植免疫调控中的作用倍受关注[9,10], 但是具体的调控机制尚不明确. 本研究利用近交系大鼠急性肝移植排斥模型(Lewis-BN), 观察Th17/Treg的平衡的改变, 研究失衡机制的内在原因, 为肝移植术后的免疫治疗提供新的策略和思路.
1.1.1 实验动物: 健康♂10-12 wk龄LEWIS大鼠24只, 体质量220-260 g, 健康♂ 10-12 wk Brown Norway(BN)大鼠72只, 体质量200-260 g, 均购自于上海斯莱克实验动物有限责任公司. 实验动物合格证号: SCXK(沪)2012-0002大鼠饲养于恒温、非特殊病原菌(SPF)级实验室. 给予标准鼠料喂养, 给予12 h昼夜节律, 正常饮水. 术前8-12 h禁食. 所有操作遵守复旦大学伦理委员会发布的伦理及管理指南.
1.1.2 主要试剂: 5804台式微量高速离心机(德国Ependorf公司, 编号: 00958); COBAS INTEGRA 400 Plus AU5800系统全自动生化分析仪(瑞士Roche公司); ELISA试剂盒购自美国Active motif公司; 乳酸钠林格液, 肝素钠注射液, 3.5%水合氯醛等试剂均由复旦大学附属华山医院外科提供; 单克隆抗体Smad2、Smad3和内参β-actin均购自美国CST公司.
1.2.1 大鼠原位肝移植模型建立及分组: 采用改良的Kamada"二袖套管"法[11]建立LEWIS→BN大鼠大鼠配对组合的原位肝移植(orthotopic liver transplantation, ROLT)急性排斥反应模型, 以及BN→BN大鼠大鼠配对组合的原位肝移植, 每组6只. 手术主要方式分为: (1)从供鼠(ROLT组是LEWIS大鼠; 耐受组是BN大鼠)获取肝脏; (2)采用套袖管调整取出的肝脏, 作为供肝; (3)对受体大鼠进行开腔手术, 并将供体肝脏植入受体大鼠腹腔内. 术后记录受体大鼠的精神情况、活动情况、对外界刺激源反应情况. 并于术后第1、3、5、7天, 各取6只处死, 切取脾脏、肝左外叶组织一部分保存于-80 ℃冰箱, 另一部分以40 g/L甲醛固定, 石蜡包埋, 4 μm厚连续切片. 抽取下腔静脉血10 mL分两份, 5 mL以Na2EDTA抗凝后备外周血单核细胞分离, 另5 mL采用不抗凝血静置离心后置于-80 ℃冻存, 用于后续细胞因子的检测.
1.2.2 大鼠肝组织病理切片: 将40 g/L甲醛固定肝左外叶组织切片. 用苏木精-伊红(HE)染色. 常规封片、镜检. 结果判定以是否具有浸润的T淋巴细胞以及浸润程度和面积计算.
1.2.3 Western blot检测2组大鼠肝脏Smad2、Smad3蛋白表达情况: 组织采用研磨的方法, 加入预冷的含抑制剂的蛋白质抽提试剂, 将获得蛋白在冰上冰浴30 min进行裂解. 裂解液于预冷的离心机中14 000 g离心15 min, 弃上清; BCA分析试剂测定蛋白质浓度. 50 μg总蛋白质在SDS聚丙烯酰胺凝胶电泳分离后, 电转移至PVDF膜, 膜在5% BSA溶液中室温孵育1 h以封闭膜上的非特异结合. 封闭过的膜加入一级抗体4 ℃过夜, 抗原抗体结合. 三羟甲基氨基甲烷缓冲盐水(tris buffered saline, TBS)/T洗膜3次, 5 min/次, 再加入辣根过氧化物酶(horseradish peroxidase, HRP)标记的二级抗体以结合一级抗体及HRP标记的抗生物素抗体以结合分子量标准, 室温孵育膜1 h, TBS/T洗膜3次, 5 min/次; 同样方法标记鼠单克隆抗β-actin作对照. 洗完膜稍干后, 按1:1加入AB显影液(与二抗HRP结合), 在Bio-Rad的化学发光成像仪上显影. 然后分析灰度值, 再进行计算灰度系数比.
1.2.4 血清肝功能检测: 使用全自动生化分析仪分析各时段大鼠血清中谷丙转氨酶(alanine transaminase, ALT)和谷草转氨酶(aspartate transaminase, AST)活性水平.
1.2.5 细胞因子测定: 术后第1、3、5、7天获取肝组织及外周血, 根据ELISA试剂盒说明, 检测各时段外周血中白介素(interleukin, IL)-17、IL-23、IL-10和TGF-β1的表达水平. 每组实验重复3次.
统计学处理 采用SPSS13.0统计软件包处理数据. 各组数据采用mean±SD表示, 两独立样本均数比较, 采用Independent-Samples t test, 不同时点比较采用重复测量方差分析. P<0.05为差异有统计学意义, P<0.01为差异有显著统计学意义.
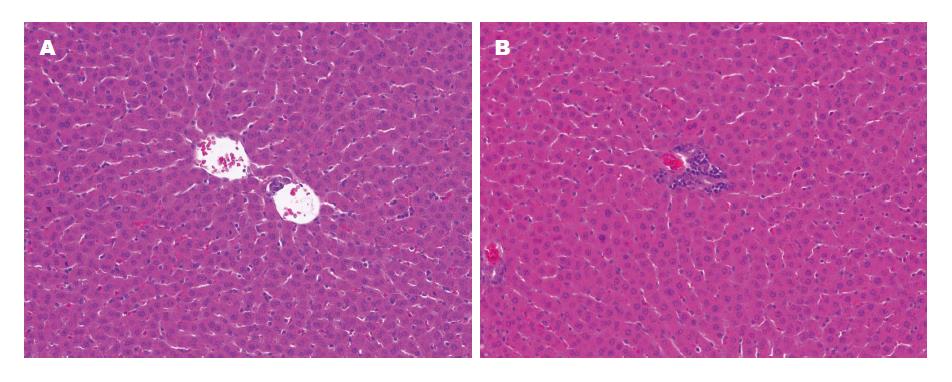
BN→BN组大鼠精神尚可, 进食正常, 体重无明显变化, 尿色清澈; LEWIS→BN组大鼠精神不振, 体重下降, 尿量减少, 色浑浊. 经HE染色, BN→BN组大鼠肝细胞间仅见少量散在T淋巴细胞浸润, 汇管区有少量T淋巴细胞浸润; LEWIS→BN组大鼠肝组织可见中到重度T淋巴细胞浸润, 病理结果提示为肝实质见明显坏死, 可见中、重度免疫排斥反应(图1).
术后检测各组大鼠肝功能情况结果显示: BN→BN组大鼠术后各时间点血清ALT、AST水平明显低于LEW→BN组大鼠, 术后第1天, 两组的肝功能无明显差异(P>0.05); 术后第3天起, LEW→BN组的肝功能出现明显改变, 血清ALT、AST随时间延长而增高, 于第7天达峰值; 而BN→BN组肝功能变化不明显, 两组相比较, 具其显著的统计学差异(P<0.05, 表1).
| 分组 | ALT | AST | ||||||
| D1 | D3 | D5 | D7 | D1 | D3 | D5 | D7 | |
| BN→BN | 662.45±52.83 | 700.72±64.48 | 752.89±70.22 | 819.29±79.33 | 334.21±18.23 | 400.27±35.19 | 320.86±28.15 | 337.82±32.17 |
| LEW→BN | 810.33±27.82 | 940.28±80.21 | 1086.52± 96.55 | 1305.62± 94.82 | 372.33±21.38 | 511.92±50.00 | 755.64± 60.22 | 867.75±73.97 |
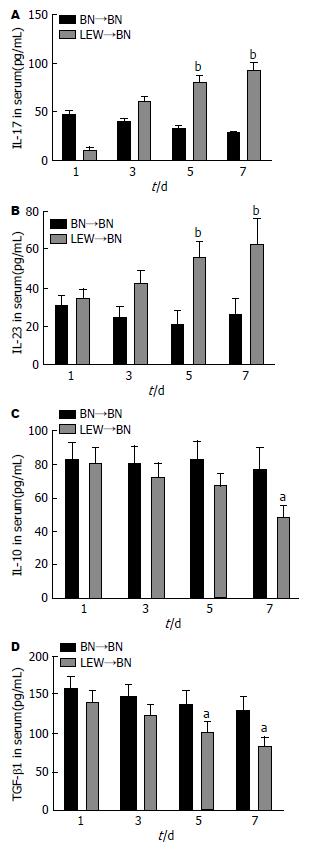
将术后第1、3、5和7天收集的外周血标本以ELISA检测两组血清中Th17相关因子(IL-17、IL-23)及Treg相关因子(IL-10、TGF-β1)浓度的变化. 结果显示术后第1天两组Th17相关因子及Treg相关因子浓度无显著差异(P>0.05); 但在术后3、5和7 d, LEW→BN组血清中IL-17和IL-23浓度显著高于耐受(BN→BN)组(P<0.05), 而IL-10、TGF-β1却相反(图2).
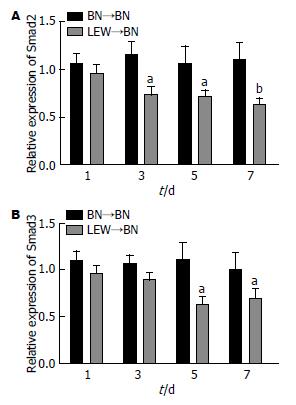
Western blot结果发现: 与BN→BN组比较, LEWIS→BN组大鼠肝组织Smad2、Smad3蛋白术明显下降. 以内参β-actin条带的灰密度值为1, Image J图象处理系统分析, 结果显示(图3): 第3、5、7天, Smad2在LEWIS→BN组急性排斥大鼠肝组织的相对灰密度值(0.74±0.07)、(0.72±0.06)、(0.63±0.07)均明显低于BN→BN免疫耐受组(1.15±0.14)、(1.06±0.18)、(1.11±0.17)(P<0.05, P<0.01). 而在第5、7天时, Smad2在LEWIS→BN组急性排斥大鼠肝组织的相对灰密度值(0.63±0.08)、(0.70±0.09)均明显低于BN→BN免疫耐受组(1.10±0.18)、(1.00±0.18)(P<0.05). 提示Smad2/3蛋白与TGF-β1保持同向调节作用.
尽管与其他器官移植相比, 移植肝具有一定的免疫特惠性[12]. 但是肝脏为人体内最大的实质性器官, 含有的免疫细胞和抗原量亦是最多. 其中T淋巴细胞是一种重要的免疫细胞亚群, 能分泌多种细胞因子, 调节机体的免疫应答, 在移植免疫中发挥重要作用[13,14]. T淋巴细胞按其功能可分为CD4+辅助性T细胞(Th), 抑制性T细胞以及CD8+杀伤性T细胞(细胞毒性T细胞). 每一亚群的T淋巴细胞能够分泌许多种细胞因子, 这些分泌的细胞因子在信号传递的调控作用下, 导致细胞的活化、增殖和分化[15]. Th17作为近年发现一种新的CD4+T淋巴细胞亚群, 以特异性分泌IL-17A-IL-17F等促炎因子为主要特点[16]. 通常, IL-17、IL-23的表达水平可作为Th17的风向标; 而Treg细胞发挥免疫调节作用的方式之一就是通过分泌IL-10和TGF-β来实现的. 在特定条件下, IL-10可诱导CD4+CD25+Treg细胞的分化, 增强Treg的抑制作用. 而TGF-β对免疫功能的抑制作用主要通过以下途径: 抑制免疫效应细胞的增殖、分化和活性以及抑制细胞因子的产生和调节作用[17]. 有研究证实, 通过采用体外诱导、扩增并分选出CD4+CD25+Treg回输入受体大鼠, 建立大鼠肝移植免疫耐受的模型的试验中, 耐受组血浆中细胞因子IL-10和TGF-β的表达明显高于排斥组, 提示CD4+CD25+Treg细胞的免疫抑制作用离不开细胞因子IL-10和TGF-β的参与[18].
此外, 与TGF-β关系最为密切的信号通路, 其中最重要就是TGF-β/Smad信号途径. Smad家族包括Smad1-8共8种蛋白, 其中Smad1、2、3、5、8为受体激活型, Smad4是共同伴侣型. Smad6和7为抑制型, 具有抑制受体激活型信号转导的作用. 通常, TGF-β与细胞膜表面的Ⅱ型受体结合, 形成二元复合物, 再与Ⅰ型受体结合, 形成三元复合物. 随后Ⅱ型受体胞浆区的丝氨酸/苏氨酸蛋白激酶磷酸化的Ⅰ型受体, 进一步磷酸化下游分子Smad2和Smad3[19], 激活TGF-β/Smad信号通路. 本研究中发现, 与免疫耐受组比较, 急性排斥组大鼠肝组织Smad2、Smad3蛋白术明显下降, 与Th17细胞的分化方向一致. 提示Smad2和Smad3在肝移植免疫耐受的过程中与Th17细胞起正调控作用.
与Th1/Th2平衡偏移相似, Th1/Th2/Th17/Treg之间动态平衡偏移也是决定急性排斥反应(acute rejection, AcR)发生与否的重要环节. Th1与Th17细胞主要促进AcR的发生发展, 而Th2/Treg则有利于抑制局部免疫反应[20]. Th17细胞与Treg细胞都是由CD4+T细胞分化而来, 在生理状态下, 两者的分化发育相互制约, 处于动态平衡. 初始T细胞在TGF-β诱导下向Treg细胞分化, 而在TGF-β与IL-6联合作用下, CD4+T细胞分化为Th17细胞[21,22], 说明Th17细胞与Treg细胞相互联系, 且IL-6是CD4+T细胞向两者分化方向的关键细胞因子.
有学者[23]发现肝癌患者较健康者外周血中Treg显著升高, Th17明显减少, 提示Th17细胞与Treg细胞参与了肝癌的发生和发展. 进一步研究发现, Th17/Treg比例在肝癌浸润淋巴细胞中高于非肿瘤浸润淋巴细胞, 且Th17和Treg百分比与肝癌的TNM分期呈直线关系, 说明Th17/Treg与肝癌的发展密切相关, 比例越高, 肝癌分期越晚. 然而Th17/Treg在自体免疫性疾病、炎性疾病及肿瘤发生发展等方面的报道较多[24-26], 而在肝移植方面较少且缺乏对其机制的深入研究. 因此, 阐明肝移植急性排斥中Th17/Treg何时失衡、如何失衡等均具有重要意义.
本研究证实, 与BN→BN免疫耐受模型相比, LEWIS→BN肝移植急性排斥反应模型在肝移植后1、3、5、7 d肝功能变化明显, 肝组织出现明显T细胞浸润现象. 与BN→BN组比较, LEWIS→BN组大鼠外周血Th17相关因子(IL-17、IL-23)明显上升, 而Treg相关因子(IL-10、TGF-β1)明显下降, 与TGF-β相关的Smad2和Smad3蛋白也表现下调的趋势. 提示TGF-β/Smad信号通路参与了促进Th17/Treg平衡向Th17偏移的过程. 且肝功能指标AST、ALT随着时间变化明显, 提示肝移植术后急性排斥反应与Th17/Treg平衡密切相关.
总之, 调节IL-17、IL-23、IL-10、TGF-β1和Smad2/3的表达, 诱导Th17/Treg免疫平衡, 延长受体存活率, 抑制AcR对移植肝的破坏、保护肝功能, 为器官移植诱导免疫耐受的临床治疗, 提供新的思路和途径.
目前, 肝移植已经成为治疗终末期肝病的惟一有效方法. 但是移植后的排斥反应是影响移植术后生存率的最主要因素. 因此, 诱导一种持久稳定且无需药物的免疫耐受是迫切需要解决的问题.
肝移植术后, CD4+T细胞进一步分化调节性T细胞(regulatery T cell, Treg)和辅助性T细胞(T helper cells, Th)17淋巴细胞亚群, 而Th17/Treg轴在移植免疫调控中的作用倍受关注. 研究Th17/Treg平衡转变可以为防治慢性移植性肝病提供新思路和新途径.
张增光等报道, 肝癌患者外周血中Th17/Treg比例在肝癌浸润淋巴细胞中高于非肿瘤浸润淋巴细胞, 提示Th17/Treg平衡的偏移与肝癌的发展密切相关. 但是Th17/Treg平衡的改变在肝移植后急性排斥反应中的报道较少, 而且与转化生长因子-β(transforming growth factor beta, TGF-β)/Smad信号通路的相关性及作用机制尚未见报道. 本研究从大鼠肝移植急性排斥反应的模型中研究Th17/Treg与TGF-β和Smad蛋白的表达情况, 为有进一步明确Th17/Treg平衡偏移的调节机制打下基础.
本研究首次证实TGF-β/Smad信号通路在影响器官移植免疫耐受的过程中对Th17/Treg平衡的影响.
现用的免疫抑制药物为非特异免疫抑制, 往往具有毒性和不良反应. 因此, 诱导一种持久稳定且无需药物的免疫耐受是迫切需要解决的问题. 本研究通过Th17/Treg轴偏移机制, 明确"免疫偏离"平衡调节肝移植后各种反应有着重要的科学意义, 并为寻找免疫治疗的靶点提供科学依据.
免疫耐受: 机体免疫系统接受某种抗原后产生的特异性免疫无反应状态, 可天然形成, 亦可后天获得;
移植免疫耐受: 免疫系统成熟的受者在没有免疫抑制剂作用下(停用免疫抑制剂1年以上)接受MHC不匹配供者器官移植物的状态, 或称为操作性免疫耐受.
本文采用改良Kamada二袖套法建立LEWIS→BN原位肝移植大鼠急性排斥反应模型, 从体内水平探讨肝移植术后肝组织T淋巴细胞Th17/Treg表达变化和肝移植免疫耐受之间的关系. 具有一定的新颖性与参考价值.
朱世凯, 副教授, 副主任医师, 电子科技大学附属医院四川省人民医院肝胆胰外科•器官移植中心
手稿来源: 自由投稿
学科分类: 胃肠病学和肝病学
手稿来源地: 上海市
同行评议报告分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C
D级 (一般): 0
E级 (差): 0
编辑: 马亚娟 电编:杜冉冉
| 1. | Nastos C, Kalimeris K, Papoutsidakis N, Tasoulis MK, Lykoudis PM, Theodoraki K, Nastou D, Smyrniotis V, Arkadopoulos N. Global consequences of liver ischemia/reperfusion injury. Oxid Med Cell Longev. 2014;2014:906965. [PubMed] [DOI] |
| 3. | Chen XB, Xu MQ. Primary graft dysfunction after liver transplantation. Hepatobiliary Pancreat Dis Int. 2014;13:125-137. [PubMed] [DOI] |
| 4. | Zhai Y, Petrowsky H, Hong JC, Busuttil RW, Kupiec-Weglinski JW. Ischaemia-reperfusion injury in liver transplantation--from bench to bedside. Nat Rev Gastroenterol Hepatol. 2013;10:79-89. [PubMed] [DOI] |
| 6. | Oo YH, Sakaguchi S. Regulatory T-cell directed therapies in liver diseases. J Hepatol. 2013;59:1127-1134. [PubMed] [DOI] |
| 8. | Hu A, Li Q, Shi H, Tai Q, Wu L, Xiong J, Fu B, He X. Donor-derived bone marrow transfusion produces mixed chimerism and promotes a Th2 shift in Th1/Th2 balance in rat heterotopic small bowel transplantation. Dig Liver Dis. 2012;44:988-994. [PubMed] [DOI] |
| 10. | Tian Y, Wang J, Wang W, Ding Y, Sun Z, Zhang Q, Wang Y, Xie H, Yan S, Zheng S. Mesenchymal stem cells improve mouse non-heart-beating liver graft survival by inhibiting Kupffer cell apoptosis via TLR4-ERK1/2-Fas/FasL-caspase3 pathway regulation. Stem Cell Res Ther. 2016;7:157. [PubMed] [DOI] |
| 13. | 王 琳, 窦 科峰. T淋巴细胞与肝移植免疫. 国外医学: 外科学分册. 2005;32:339-342. |
| 14. | Qi H, Chen G, Huang Y, Si Z, Li J. Foxp3-modified bone marrow mesenchymal stem cells promotes liver allograft tolerance through the generation of regulatory T cells in rats. J Transl Med. 2015;13:274. [PubMed] [DOI] |
| 15. | Dong JY, Yin H, Li RD, Ding GS, Fu ZR, Wu YM, Wang ZX. The relationship between adenosine triphosphate within CD4(+) T lymphocytes and acute rejection after liver transplantation. Clin Transplant. 2011;25:E292-E296. [PubMed] [DOI] |
| 17. | Chen L, Zheng L, He W, Qiu M, Gao L, Liu J, Huang A. Cotransfection with IL-10 and TGF-β1 into immature dendritic cells enhances immune tolerance in a rat liver transplantation model. Am J Physiol Gastrointest Liver Physiol. 2014;306:G575-G581. [PubMed] [DOI] |
| 18. | 肖 江卫, 刘 紫麟, 叶 鹏程, 罗 雅军, 符 致明, 魏 寿江. 低剂量西罗莫司协同CD4+CD25+T-reg诱导大鼠肝移植免疫耐受的实验研究. 中华临床医师杂志(电子版). 2015;9:2708-2712. |
| 20. | Böttcher JP, Knolle PA, Stabenow D. Mechanisms balancing tolerance and immunity in the liver. Dig Dis. 2011;29:384-390. [PubMed] [DOI] |
| 21. | Li P, Spolski R, Liao W, Leonard WJ. Complex interactions of transcription factors in mediating cytokine biology in T cells. Immunol Rev. 2014;261:141-156. [PubMed] [DOI] |
| 22. | Martin F, Apetoh L, Ghiringhelli F. Controversies on the role of Th17 in cancer: a TGF-β-dependent immunosuppressive activity. Trends Mol Med. 2012;18:742-749. [PubMed] [DOI] |
| 24. | Fasching P, Stradner M, Graninger W, Dejaco C, Fessler J. Therapeutic Potential of Targeting the Th17/Treg Axis in Autoimmune Disorders. Molecules. 2017;22:pii E134. [PubMed] [DOI] |
| 25. | Noack M, Miossec P. Th17 and regulatory T cell balance in autoimmune and inflammatory diseases. Autoimmun Rev. 2014;13:668-677. [PubMed] [DOI] |
| 26. | Wang X, Wang L, Mo Q, Dong Y, Wang G, Ji A. Changes of Th17/Treg cell and related cytokines in pancreatic cancer patients. Int J Clin Exp Pathol. 2015;8:5702-5708. [PubMed] |