修回日期: 2017-10-19
接受日期: 2017-11-04
在线出版日期: 2017-11-28
研究脐带间充质干细胞(umbilical cord-mesenchyma stem cell, UC-MSC)对环磷酰胺(cyclophosphamide, CTX)导致的大鼠药物性肝损伤的治疗作用.
首先分离培养UC-MSC. SD大鼠腹腔注射CTX建立肝损伤模型, 分别给予尾静脉注射UC-MSC或生理盐水, 将其分为Control组、CTX组和CTX+UC-MSC组. 在不同时间点检测血清谷丙转氨酶(alanine transaminase, ALT)、谷草转氨酶(aspartate transaminase, AST)、碱性磷酸酶(alkaline phosphatase, ALP)和总胆红素(total bilirubin, TBIL)的浓度. 肝组织均浆中检测丙二醛(malondialdehyde, MDA)、脂质过氧化物(lipid peroxide, LPO)、一氧化氮(NO)、总超氧化物歧化酶(total superoxide dismutase, T-SOD)、谷胱甘肽(glutathione, GSH)、谷胱甘肽过氧化物(glutathione peroxidase, GSH-PX)的水平. qPCR检测肝组织中Bax、Bcl-2、血管内皮细胞生长因子(vascular endothelial growth factor, VEGF)A基因mRNA表达情况. 肝组织切片行HE染色和α-平滑肌肌动蛋白(α-smooth muscle actin, α-SMA)、Ki-67染色.
与Control组相比, CTX组ALT、AST、ALP和TBIL含量明显增高, SOD、GSH和GSH-PX表达下降, MDA、LPO和NO表达增加, 凋亡增加, VEGFA表达减少, 肝细胞水肿明显. CTX+UC-MSC组ALT、AST、ALP和TBIL值均低于CTX组(P<0.05). CTX+UC-MSC组的SOD、GSH和GSH-PX均高于CTX组, MDA、LPO和NO均低于CTX组(P<0.05). CTX+UC-MSC组的Bax的表达低于CTX组, BCL-2和VEGFA的mRNA水平高于CTX组(P<0.05). HE染色示CTX+UC-MSC组的肝细胞水肿、出血等损伤低于CTX组. CTX+UC-MSC组的α-SMA+细胞少于CTX组, Ki-67+细胞多于CTX组(P<0.05).
UC-MSC治疗可缓解CTX导致的大鼠药物性肝损伤.
核心提要: 本文探讨了人脐带间充质干细胞在环磷酰胺(cyclophosphamide, CTX)导致的大鼠药物性肝损伤的作用, 其短期作用包括减少肝细胞损伤, 降低肝酶, 减少CTX导致的肝细胞氧化应激损伤, 长期作用包括减少肝脏纤维化, 促进肝细胞再生.
引文著录: 王晓媛, 李栋, 周盼盼, 金敏, 鞠秀丽. 人脐带间充质干细胞治疗环磷酰胺导致的大鼠药物性肝损伤. 世界华人消化杂志 2017; 25(33): 2956-2966
Revised: October 19, 2017
Accepted: November 4, 2017
Published online: November 28, 2017
To assess the effect of human umbilical cord mesenchymal stem cells (UC-MSCs) on cyclophosphamide (CTX)-induced liver injury.
UC-MSCs were isolated from the human umbilical cord. Male SD rats were randomly divided into three groups: control group, CTX group, and CTX + UC-MSC group. The CTX group and CTX + UC-MSC group were intraperitoneally injected with CTX. After that, the control group and CTX group were injected with water via the tail vein, and the CTX + UC-MSC group was injected with MSCs via the tail vein. Six rats of each group were selected randomly and sacrificed at different time points. Blood samples were taken to measure serum alanine transaminase (ALT), aspartate transaminase (AST), alkaline phosphatase (ALP), and total bilirubin (TBIL). Liver tissues were collected for biochemical assays of malondialdehyde (MDA), lipid peroxide (LPO), NO, glutathione (GSH), glutathione peroxidase (GSH-PX), and total superoxide dismutase (T-SOD). qPCR was used to test the expression of Bcl-2, Bax, and vascular endothelial growth factor (VEGF) A. Histological examination (HE straining) and immunohistochemical staining for α-smooth muscle actin (α-SMA) and Ki-67 were also performed.
Compared with the control group, the levels of ALT, AST, ALP, and TBIL were significantly higher, the SOD, GSH, and GSH-PX contents were significantly lower, MDA, LPO, and NO were significantly higher, cell apoptosis significantly increased, and the expression of VEGFA significantly decreased in the CTX group. Compared with the CTX group, the ALT, AST, ALP, and TBIL were significantly lower, the SOD, GSH, and GSH-PX contents were significantly higher, and MDA, LPO, and NO were significantly lower in the CTX + UC-MSC group (P < 0.05). The expression of Bax was lower and Bcl-2 and VEGFA expression was higher in the CTX + UC-MSC group than in the CTX group (P < 0.05). Pathological analysis showed that liver status was better in the CTX + UC-MSC group than in the CTX group. The α-SMA+ cells in the CTX + UC-MSC group were less than and Ki-67+ cells were more than those in the CTX group (P < 0.05).
UC-MSCs injected via the tail vein could alleviate CTX-induced hepatotoxicity in rats.
- Citation: Wang XY, Li D, Zhou PP, Jin M, Ju XL. Human umbilical cord mesenchymal stem cells alleviate cyclophosphamide-induced liver injury in rats. Shijie Huaren Xiaohua Zazhi 2017; 25(33): 2956-2966
- URL: https://www.wjgnet.com/1009-3079/full/v25/i33/2956.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v25.i33.2956
环磷酰胺(cyclophosphamide, CTX)广泛应用于各种肿瘤的治疗, 包括淋巴瘤、乳腺癌和白血病等[1]. 然而, 由于其严重的不良反应, 尤其是肝毒性, 极大程度地限制了CTX的临床应用[2]. CTX的代谢始于肝脏, 在肝脏微粒体混合功能氧化酶系(主要是2B6和CYP2C)的作用下分解成4-羟基环磷酰胺, 后者的同分异构体是醛磷酰胺, 两者在3',5'-核酸内切酶的作用下降解成磷酰胺芥氮和丙烯醛[3], 前者是抗肿瘤的主要成分, 后者是产生不良反应的主要成分[4]. 丙烯醛是一种高活性α,β-不饱和醛, 可诱导脂质过氧化反应, 导致严重的细胞损伤[5]. 目前临床上对于CTX导致的药物性肝损伤的治疗主要是保肝药物的应用, 不能预防和改善其预后. 现已有文献报道人脐带间充质干细胞(umbilical cord-mesenchyma stem cell, UC-MSC)在临床上应用于酒精性肝损伤[6]、终末期肝硬化和失代偿期肝硬化患者[7], 取得较好的疗效. 而UC-MSC对于CTX导致的药物性肝损伤以及纤维化是否有疗效, 尚无文献报道. 间充质干细胞(mesenchyma stem cell, MSC)是来源于成人组织的多功能干细胞, 具有自我更新和多向分化能力, 可分化为软骨细胞、骨细胞、脂肪细胞和肝脏细胞[8]. 本实验中, 我们研究了UC-MSC在CTX诱导的肝毒性的生化、氧化应激损伤、凋亡和组织病理等方面的作用.
主要试剂: 健康成年♂SPF级SD大鼠72只(8周龄), 购自北京维通利华实验动物技术有限公司, 体质量240-250 g. SD大鼠的饲养及实验流程符合《山东大学齐鲁医院实验动物伦理审查办法》的规定. CTX购自江苏恒瑞医药股份有限公司; 戊巴比妥钠购自美国Sigma公司; 丙二醛(malondialdehyde, MDA)、脂质过氧化物(lipid peroxide, LPO)、一氧化氮(nitric oxide, NO)、总超氧化物歧化酶(total superoxide, T-SOD)、谷胱甘肽(glutathione, GSH)和谷胱甘肽过氧化物(glutathione peroxidase, GSH-PX)检测试剂盒购自南京建成生物工程研究所; TRIzol购自Ambion公司; 反转录试剂盒和SYBR qPCR Mix购自日本东洋纺公司; 引物由济南博尚生物科技有限公司合成; 柠檬酸缓冲液和SP Rabbit and Mouse HRP Kit(DAB)购自北京康为世纪生物科技有限公司; 抗大鼠α-SMA(货号ab5694)和Ki-67(货号ab15580)抗体购自Abcam公司; 苏木素染液购自北京索莱宝科技有限公司.
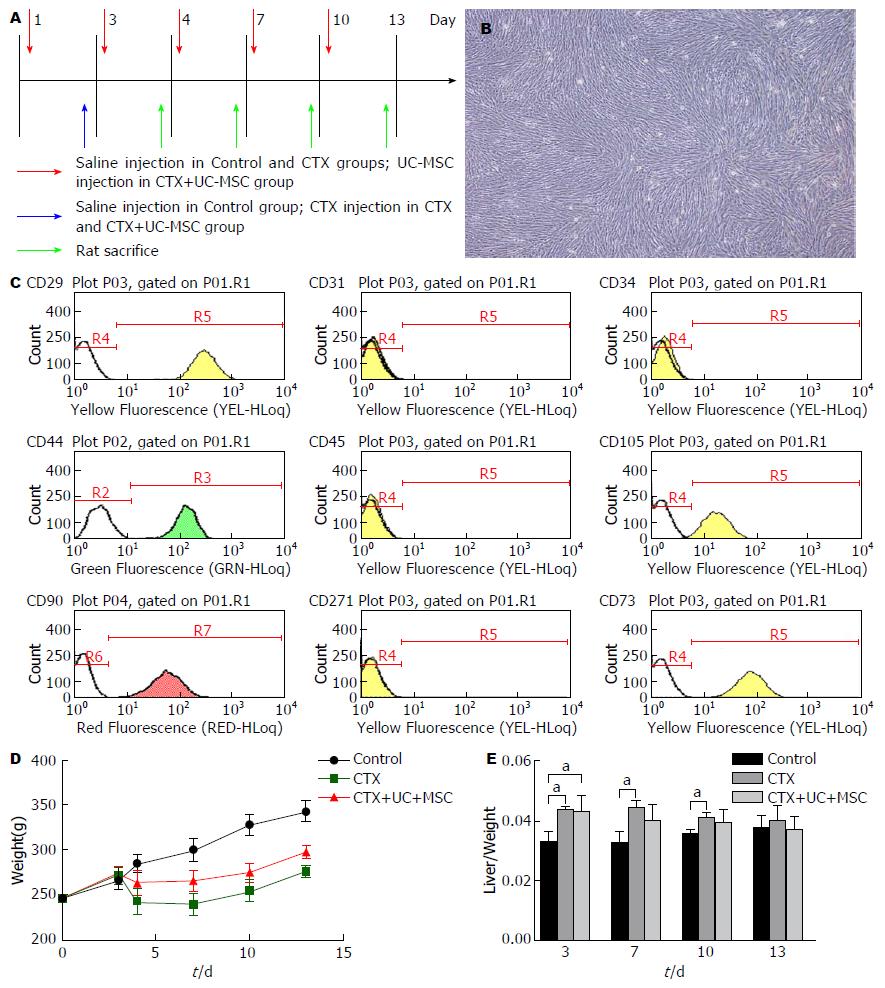
1.2.1 UC-MSC的分离、培养和鉴定: 实验所用脐带由山东大学齐鲁医院产科提供, 均由产妇签署知情同意书. UC-MSC的分离培养和鉴定遵循本实验室先前发表的操作程序[9]. 取第4代增殖稳定的贴壁细胞消化后计数, 将106个细胞重悬于PBS中, 加入下列鼠抗人单克隆抗体: CD29、CD31、CD34、CD44、CD45、CD73、CD90、CD105和CD271, 孵育后, 应用流式细胞仪进行分析鉴定.
1.2.2 实验动物分组处理: SD大鼠饲养于SPF级环境下, 温度和湿度适宜, 12 h明暗交替, 给予充足的水和食物. 待大鼠适应环境1 wk后进行实验. 所有实验过程均重复3次. 将72只大鼠随机分为3组: Control组(n = 24), CTX组(n = 24)和CTX+UC-MSC组(n = 24). 实验流程如图1A, 简述如下, 以CTX+UC-MSC组大鼠第1次注射UC-MSC记为实验第1天, CTX+UC-MSC组在第1、4、7、10天尾静脉注射第4代UC-MSC(UC-MSC溶于生理盐水, 浓度为5×106/mL, 每只大鼠注射0.4 mL), CTX组和CTX+UC-MSC组第3天腹腔注射CTX 200 mg/kg, Control组在相同时间相同方式注射生理盐水. 称其质量, 并观察大鼠饮食、毛色等改变. 分别在第4、7、10、13天从3组中随机选取6只大鼠, 腹腔注射戊巴比妥钠40 mg/kg, 心脏取血, 快速取出肝脏, 称其湿重, 计算器官/体质量比率. 部分肝脏组织浸入4%多聚甲醛固定, 剩余组织液氮速冻后置-80 ℃, 备用.
1.3.1 外周血肝脏生化指标检测: 将心脏取出的血液离心3500 g, 20 min, 取上清, 应用全自动生化分析仪(Cobas, c701)检测血清谷丙转氨酶(alanine transaminase, ALT)、谷草转氨酶(aspartate transaminase, AST)、碱性磷酸酶(alkaline phosphatase, ALP)和总胆红素(total bilirubin, TBIL).
1.3.2 氧化应激损伤指标检测: 在本实验中将肝脏组织在预冷的生Wes理盐水中漂洗, 滤纸拭干, 称取0.1 g于Ep管, 加生理盐水0.9 mL, 采用超声波碎细胞法制成10%组织匀浆, 频率为10 s/次, 间隔10 s, 重复5次. 离心取上清. 按照各自试剂盒说明书, 分别检测组织均浆中MDA(TAB法)、LPO、NO(硝酸还原酶法)、T-SOD(WST-1法)、GSH(分光光度法)和GSH-PX(比色法)的含量.
1.3.3 定量PCR检测凋亡相关蛋白以及大鼠VEGFA mRNA表达: 取50 mg组织液氮速冻研磨后, 加1 mL TRIzol, 提取RNA后反转录成cDNA. Bcl-2、Bax、VEGFA和GAPDH基因检测引物序列如表1. 在PCR仪上进行实时定量扩增. 根据SYBR说明书反应体系为10 μL, 反应条件95 ℃ 1 min, 95 ℃ 15 s, 65 ℃ 45 s, 40个循环. 以2-ΔΔCt[ΔΔCt = (Ct目的基因-Ct内参基因)实验组-(Ct目的基因-Ct内参)对照组]表示目的基因相对表达, 将Control组基因相对表达量设置为1.
| 基因 | 引物 |
| Bax | 上游引物 5'-TGGCGATGAACTGGACAACA-3' |
| 下游引物 5'-CACGGAAGAAGACCTCTCGG-3' | |
| Bcl-2 | 上游引物 5'-GACTGAGTACCTGAACCGGC-3' |
| 下游引物 5'-AGTTCCACAAAGGCATCCCAG-3' | |
| VEGFA | 上游引物 5'-ACCATGCCAAGTGGTGAAGT-3' |
| 下游引物 5'-GGAAGATGTCCACCAGGGTC-3' | |
| GAPDH | 上游引物 5'-AGTGCCAGCCTCGTCTCATA-3' |
| 下游引物 5'-TGAACTTGCCGTGGGTAGAG-3' |
1.3.4 组织学检测: 为检测肝脏组织损伤及修复情况, 多聚甲醛固定后脱水, 石蜡包埋, 切成5 μm的薄片. 脱蜡、复水后根据染色步骤, 进行HE染色, 封片镜检.
1.3.5 免疫组织化学染色: 石蜡切片做α-SMA和Ki-67免疫组织化学染色, 常规脱蜡、乙醇梯度复水, 采用微波法柠檬酸缓冲液进行抗原修复, 根据SP Rabbit and Mouse HRP Kit(DAB)说明书进行封闭, 一抗(稀释比例均为1:100)4 ℃孵育过夜, 二抗室温孵育30 min, DAB显色, 苏木素复染, 中性树脂封片, 镜检. 每张切片随机选取5个视野, 应用Image Pro plus 6.0进行统计分析.
统计学处理 数据采用IBM SPSS statistics 24.0软件进行分析, 描述为mean±SD, 3组样本均数间比较采用单因素方差分析, 用LSD程序进行两两比较, P<0.05为差异具有显著统计学意义. 数据制图应用Graphpad Prism6软件.
镜下观察第5代人UC-MSC, 形态学上示呈漩涡样贴壁生长, 状态良好, 如图1B. 应用流式细胞技术对其免疫表型进行鉴定, 结果示培养的细胞高表达CD29、CD44、CD73、CD90和CD105, 不表达CD31、CD34、CD45和CD271(图1C), 符合间充质干细胞的一般标准.
2.2.1 大鼠体征改变: Control组大鼠皮毛光滑, 反应灵活, 饮食正常, 大便固体成形, 体质量平稳增长. CTX组大鼠毛色晦暗无光泽, 饮食较差, 口鼻处有出血, 大便带血, 体质量下降, CTX+UC-MSC组大鼠整体状况优于CTX组, 结果如图1D所示. 与Control组相比, CTX组和CTX+UC-MSC组在第4天大鼠肝脏/体质量显著增加(P<0.05), 且CTX组重于CTX+UC-MSC组(P<0.05), 第7天CTX+UC-MSC组大鼠肝脏/体质量与对照组相比, 无明显差异(P>0.05), 结果如图1D.
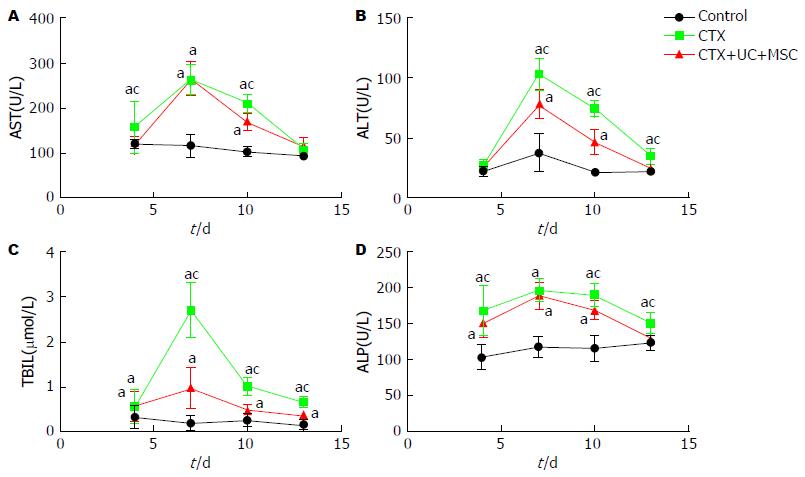
2.2.2 UC-MSC可缓解CTX诱导的大鼠血清肝功能生化指标: 与Control组相比, CTX注射后, 大鼠AST均开始上升, 第7天达高峰, 第10天开始下降. 在各个时间点, CTX+UC-MSC组的血清AST水平均低于CTX组, 第13天与Control组相比无显著差异(P>0.05, 图2A). CTX注射后, 大鼠ALT值在第7天开始显著上升并达峰值(P<0.05), 第10天开始下降, CTX+UC-MSC组ALT升高幅度低于CTX组, 第13天与Control组相比无显著差异(P>0.05, 图2B). 如图2C和2D示, CTX注射后, TBIL和ALP在第4天均开始上升(P<0.05), 第7天达高峰, 第10天开始下降, CTX+UC-MSC组TBIL和ALP升高幅度低于CTX组, 第13天时与Control组相比无显著差异(P>0.05).
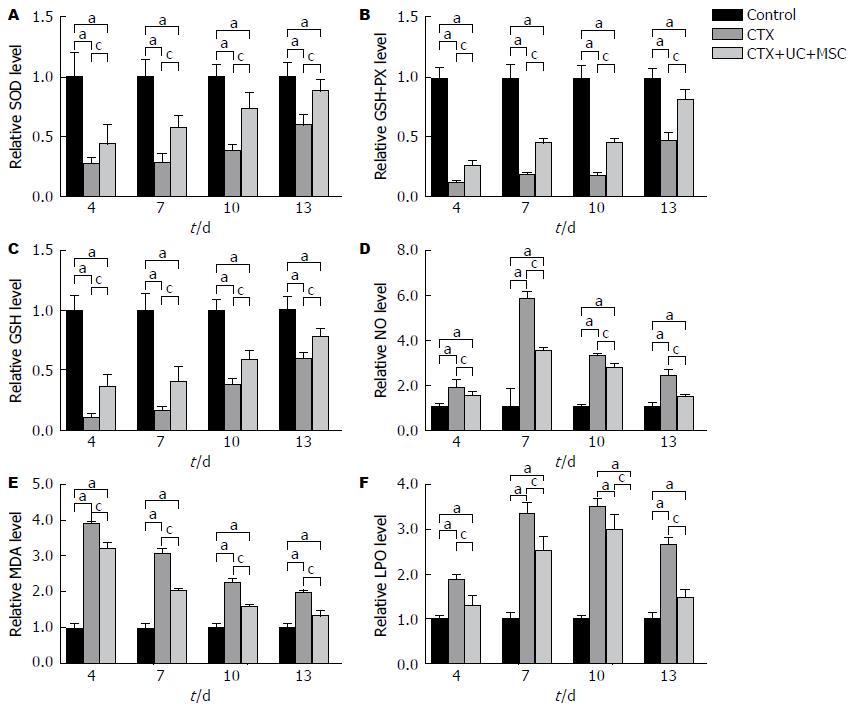
2.2.3 UC-MSC可缓解CTX诱导的大鼠氧化应激损伤: 与Control组相比, CTX注射后, 大鼠肝组织SOD、GSH-PX和GSH水平在第4天均下降, 第7天开始上升, CTX+UC-MSC组肝组织SOD、GSH-PX和GSH在任意时间点均高于CTX组, 结果如图3A-C. 与Control组相比, CTX注射后, 大鼠肝组织NO水平在第4天上升, 第7天达高峰, 而后开始下降, UC-MSC处理后的大鼠, NO的含量均低于CTX组(P<0.05, 图3D). 如图3E所示, CTX注射后, 大鼠肝组织MDA在第4天升高, 而后开始下降, UC-MSC处理后的大鼠, MDA的含量均低于CTX组. 与Control组相比, CTX注射后, 大鼠LPO在第4天均上升, 第10天达高峰, 而后开始下降, UC-MSC处理后的大鼠肝脏中LPO水平均低于CTX组(P<0.05, 图3F).
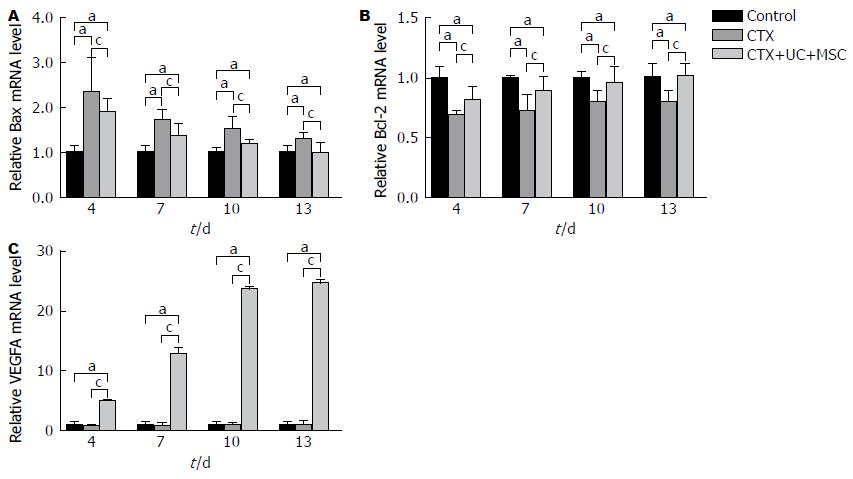
2.2.4 UC-MSC改变凋亡相关蛋白基因表达及促进VEGFA基因表达: 如图4A所示, CTX注射后, 大鼠肝组织内Bax mRNA表达量第7天明显上升, 而后逐渐下降. CTX+UC-MSC组上升幅度低于CTX组, 第13天与Control组相比无明显差异(P>0.05). 与对照组相比, CTX注射后, 大鼠肝组织内Bcl-2基因表达量均在第4天上升, CTX+UC-MSC组上升幅度高于CTX组(P>0.05, 图4B). 本实验中, 与Control组和CTX组相比, CTX+UC-MSC组大鼠肝脏组织中大鼠VEGFA表达量明显上升, 随着UC-MSC注射次数的增加, VEGFA表达量随之增加(P<0.05, 图4C).
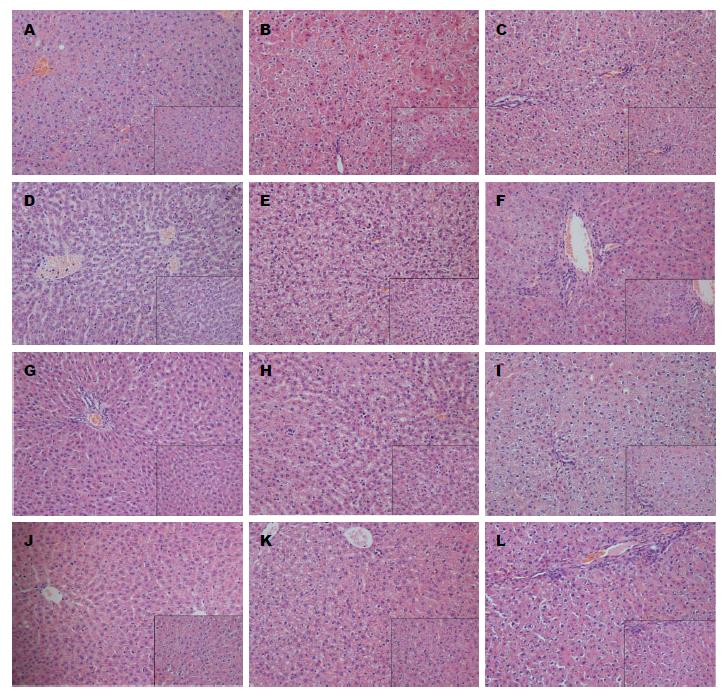
2.2.5 UC-MSC缓解CTX诱导的组织损伤: HE染色示, CTX诱导的肝脏组织肝索紊乱, 肝细胞基质疏松淡染, 呈气球样变. 部分细胞内可见脂肪空泡, 有的空泡较大将肝细胞核挤压靠近肝细胞膜呈月牙状. 局部可见炎细胞浸润. UC-MSC预处理的大鼠肝脏病变程度轻于CTX组(图5A-C). 腹腔注射CTX后, CTX+UC-MSC组大鼠肝脏恢复速度快于CTX组(图5D-L).
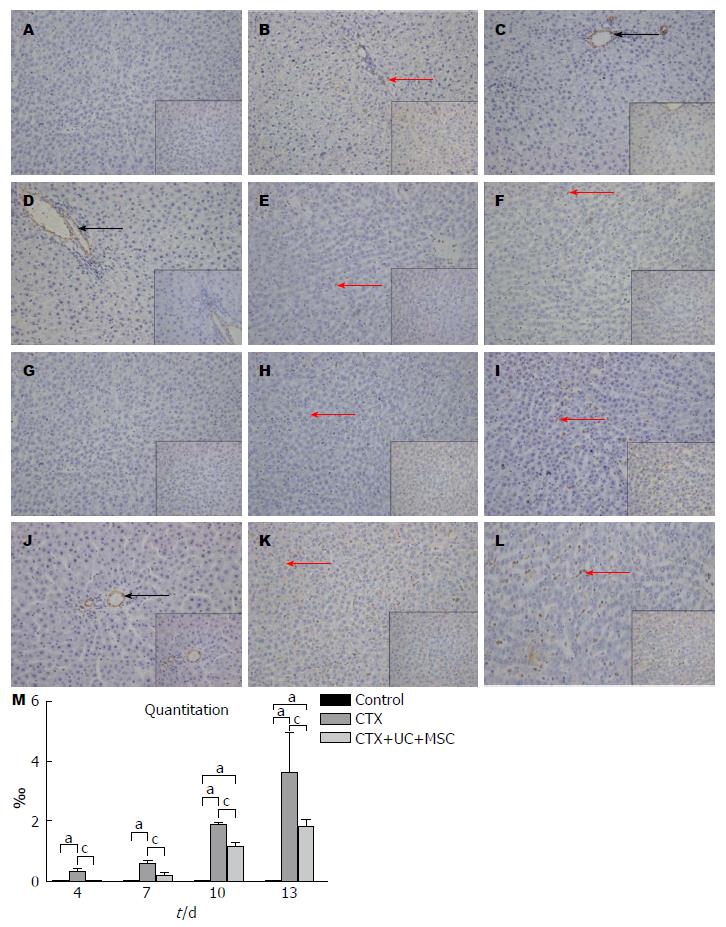
2.2.6 UC-MSC减少肝脏组织中α-SMA+细胞的表达: Control组未见α-SMA+细胞, CTX注射后, 肝脏组织在第4天可见散杂α-SMA+细胞, 随时间推移而增加. CTX+UC-MSC组α-SMA+细胞数量在各个时间点均低于CTX组(图6, P<0.05).
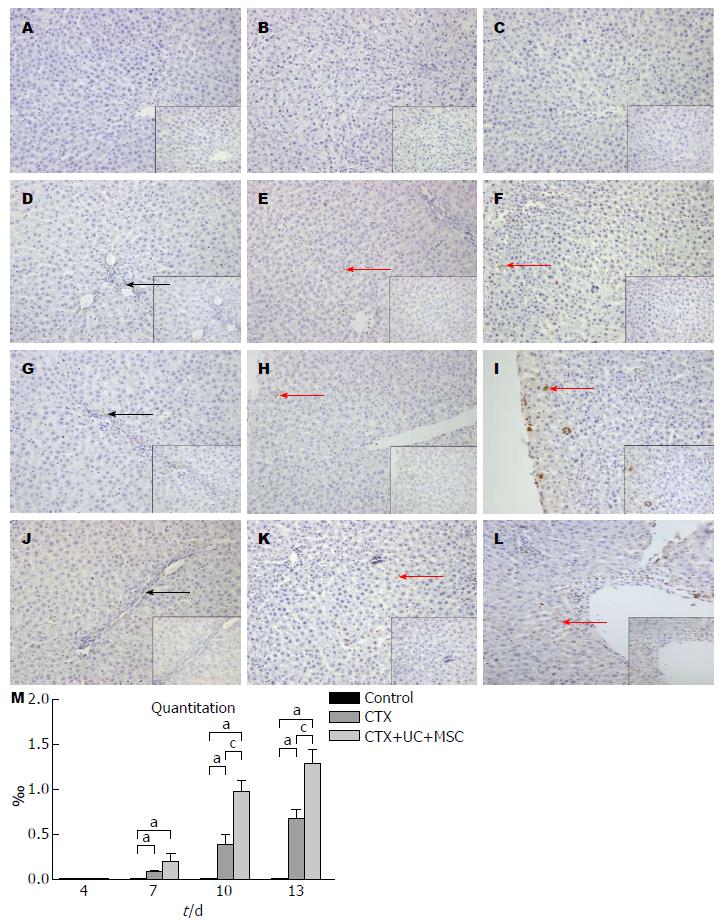
2.2.7 UC-MSC增加肝脏组织中Ki-67+细胞表达: 镜下观察不同时间点Control组切片发现Ki-67+细胞散在分布于血管内壁, 肝脏组织内未发现Ki-67+细胞. CTX组切片在第4天血管内壁和肝脏组织内均未发现Ki-67+细胞, 第7、10和13天的切片在血管附近和肝脏组织内可见散在少量Ki-67+细胞. CTX+UC-MSC组在第7天开始在肝脏组织内发现Ki-67+细胞, 其后逐渐增多, 第13天切片可见Ki-67+细胞分布于肝脏组织和大血管周围(P>0.05, 图7).
本实验中我们首先使用腹腔注射CTX造成大鼠肝损伤, 血清生化指标、氧化应激水平和病理检测等结果说明造模成功. UC-MSC预处理的大鼠肝损伤的程度低于CTX组. 肝损伤后, 尾静脉多次注射UC-MSC可加速肝损伤的修复. 腹腔注射大剂量的CTX激活肝星状细胞(hepatic stellate cells, HSC), 表达α-SMA, 引起肝脏纤维化, UC-MSC缓解了这一改变. 另外, UC-MSC可刺激肝细胞再生, 增殖期细胞增多.
已知在体内和体外环境中, MSC具有分泌广泛的营养因子的能力, 包括VEGF、碱性成纤维细胞生长因子、肝细胞生长因子(hepatocyte growth factor, HGF)、血小板衍生生长因子和表皮生长因子等[10]. 另外, 当外源性UC-MSC注入动物体内, 可引起损伤部位VEGF表达的增加, 其机制可能是MSC改变肝脏微环境来诱导局部肝脏前体细胞增殖和分化, 改善损伤组织微循环和灌注, 预防实质细胞凋亡, 为损伤组织提供营养支持[11], 而改善的血供促进周围内皮细胞增殖, 导致更多的营养因子分泌, 加速损伤组织修复[12-14]. 在体内外研究中均发现, MSC可以下调促炎因子(如IL-1β、TNF和IL-6等)的表达, 分泌抑炎因子(IL-10和IL-12等), 建立免疫耐受环境, 加速淋巴细胞的凋亡[15]. 因此, MSC一旦进入损伤组织, 分泌营养因子改善微环境, 促进组织再生, 抑制炎症反应, 防止实质细胞凋亡, 促进血管形成, 避免组织纤维化[16]. 大量研究[10,11,15]证实MSC可以缓解多种诱因导致的肝损伤, 但也存在与之相反的结论, 认为MSC可能存在潜在的致病性并增加骨质疏松或者没有任何效果[17-19]. 我们的实验结果证实UC-MSC通过分泌某些营养因子刺激肝细胞增殖, 抑制其凋亡, 促凋亡因子Bax表达下降, 抑凋亡因子Bcl-2表达增加, 同时, 增殖的肝脏内皮细胞分泌VEGFA增加, 进一步改善损伤部位的血供, 保护肝脏功能, 减少氧化损伤. 这与部分报道存在差异[18,19], 分析其存在的原因可能是MSC的来源和制备不同, 动物品系差异, 以及动物模型不同. Ki-67是增殖性细胞核抗原, 被认为是细胞增殖活性的标志物, 存在于细胞周期S、G、M和G1晚期的细胞核中, 其数量反映了细胞的增生活性[20]. 在急性肝衰竭模型中, Ki-67可作为评价肝细胞修复的指标[21,22]. 在本实验中, CTX+UC-MSC组大鼠肝脏组织中Ki-67+细胞明显高于CTX组, 同样说明UC-MSC诱导局部肝脏前体细胞增殖和分化, 加速肝损伤的修复.
肝脏纤维化的关键步骤是HSC的激活, 其激活的主要标志是α-SMA的表达[23]. 当刺激因素损伤肝脏时, 静息状态的HSC转化成具有收缩性、增生性和纤维源性的肌成纤维细胞, 表达α-SMA, 其表达量的大小可衡量HSC的激活程度[24]. 有研究[25]表明UC-MSC可用于预防化疗药物引起的器官纤维化, 如博来霉素诱导的肺纤维化. MSC可通过分泌营养因子来保护HSC, 分泌的因子包括VEGFA、HGF和炎症调节因子, 在动物肝脏纤维化模型中, MSC的输注可改善肝功能, 缓解肝脏纤维化[26]. 在本实验中, 尾静脉注射UC-MSC的大鼠肝脏组织内VEGFA的表达量增加, UC-MSC预处理的大鼠肝脏中α-SMA+细胞低于CTX组, CTX激活肝星状细胞后, 尾静脉注射UC-MSC, 受损肝组织中α-SMA+细胞表达量低于未注射组, 提示UC-MSC可抑制CTX刺激的肝星状细胞的激活, MSC对HSC有保护作用. 将各个时间点的肝脏切片进行Masson染色, 未见蓝色束状纤维(结果未列出), 分析原因可能是实验周期短, CTX虽激活HSC, 但尚未形成纤维.
综合现有文献报道, 我们可以得出MSC移植对损伤肝脏的干预措施主要包括以下几个方面: (1)诱导内源性增殖和分化, 即刺激肝细胞增殖, 抑制肝细胞凋亡, 改善内源性再生障碍[27]; (2)减少肝脏纤维化, 即抑制HSC增殖, 刺激HSC凋亡和诱导细胞外基质降解[28]; (3)炎性调节作用, 即抑制抗原提呈细胞成熟, 增殖, 活化和/或T细胞引发活性, 减少淋巴细胞增殖和刺激T调节细胞增殖[29]; (4)转化为实质细胞, 在体内外实验中均证实MSC可以转化成肝实质细胞, 并且具备肝细胞所具备的代谢、合成和储备功能[30], 这可能与MSC的高塑性相关. 以上过程是相互交叉, 相互促进的.
总之, 本实验结果表明静脉注射UC-MSC可减弱CTX导致的药物性肝损伤, 加快CTX诱导的肝损伤的修复. 初步证实了UC-MSC对CTX导致的肝损伤的治疗作用, 为临床上UC-MSC应用于CTX等引起的药物性肝损伤提供了一定的实验基础及理论依据.
环磷酰胺(cyclophosphamide, CTX)是临床常用的化疗药物, 药物性肝损伤是其主要不良反应, 而临床治疗主要是保肝药物的应用, 不能预防和改善其预后. 已有文献证实脐带间充质干细胞(umbilical cord-mesenchyma stem cell, UC-MSC)在酒精性肝硬化、终末期肝硬化等肝损伤中有明显治疗作用, 间充质干细胞在其中发挥重要作用.
药物性肝损伤是目前临床较为常见的药物不良反应, 治疗多为对症治疗. 近年来间充质干细胞广泛应用于多种疾病, 包括肝硬化、急性肺损伤等, 其对药物性肝损伤是否有效果, 鲜有文献报道.
近年来关于间充质干细胞与肝脏的重要研究为本文的研究结果提供了理论支撑, 更为药物性肝损伤的防治提供重要思路.
本文检测了尾静脉注射UC-MSC在CTX导致的药物性肝损伤中的作用, 为药物性肝损伤的防治提供依据.
UC-MSC缓解了CTX导致的大鼠肝损伤及纤维化, 其作用机制可能是诱导内源性增殖和分化, 抑制炎症反应, 转化成肝实质细胞, 减少纤维化. UC-MSC将是防治药物性肝损伤的新措施.
本课题研究了UC-MSC在CTX诱导的肝毒性的生化、氧化应激损伤、凋亡及组织病理等方面的作用, 实验设计合理, 有一定的创新性, 对临床实践有一定的指导意义.
孟忠吉, 教授, 湖北医药学院附属太和医院感染科; 王劲, 主任医师, 中山大学附属第三医院放射科; 张卓, 副教授, 沈阳医学院公共卫生学院营养与食品卫生学教研室
手稿来源: 自由投稿
学科分类: 胃肠病学和肝病学
手稿来源地: 山东省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): B, B
C级 (良好): 0
D级 (一般): D
E级 (差): 0
编辑: 闫晋利 电编:李瑞芳
| 1. | Moignet A, Hasanali Z, Zambello R, Pavan L, Bareau B, Tournilhac O, Roussel M, Fest T, Awwad A, Baab K. Cyclophosphamide as a first-line therapy in LGL leukemia. Leukemia. 2014;28:1134-1136. [PubMed] [DOI] |
| 2. | Tsai-Turton M, Luong BT, Tan Y, Luderer U. Cyclophosphamide-induced apoptosis in COV434 human granulosa cells involves oxidative stress and glutathione depletion. Toxicol Sci. 2007;98:216-230. [PubMed] [DOI] |
| 3. | Wagner T. Ifosfamide clinical pharmacokinetics. Clin Pharmacokinet. 1994;26:439-456. [PubMed] [DOI] |
| 4. | Emadi A, Jones RJ, Brodsky RA. Cyclophosphamide and cancer: golden anniversary. Nat Rev Clin Oncol. 2009;6:638-647. [PubMed] [DOI] |
| 5. | Sheweita SA, El-Hosseiny LS, Nashashibi MA. Protective Effects of Essential Oils as Natural Antioxidants against Hepatotoxicity Induced by Cyclophosphamide in Mice. PLoS One. 2016;11:e0165667. [PubMed] [DOI] |
| 6. | Fong CY, Gauthaman K, Cheyyatraivendran S, Lin HD, Biswas A, Bongso A. Human umbilical cord Wharton's jelly stem cells and its conditioned medium support hematopoietic stem cell expansion ex vivo. J Cell Biochem. 2012;113:658-668. [PubMed] [DOI] |
| 7. | Zhang Z, Lin H, Shi M, Xu R, Fu J, Lv J, Chen L, Lv S, Li Y, Yu S. Human umbilical cord mesenchymal stem cells improve liver function and ascites in decompensated liver cirrhosis patients. J Gastroenterol Hepatol. 2012;27 Suppl 2:112-120. [PubMed] [DOI] |
| 8. | Hayes M, Curley G, Laffey JG. Mesenchymal stem cells - a promising therapy for Acute Respiratory Distress Syndrome. F1000 Med Rep. 2012;4:2. [PubMed] [DOI] |
| 9. | Fu J, Zhang H, Zhuang Y, Liu H, Shi Q, Li D, Ju X. The role of N-acetyltransferase 8 in mesenchymal stem cell-based therapy for liver ischemia/reperfusion injury in rats. PLoS One. 2014;9:e103355. [PubMed] [DOI] |
| 10. | Ghaedi M, Tuleuova N, Zern MA, Wu J, Revzin A. Bottom-up signaling from HGF-containing surfaces promotes hepatic differentiation of mesenchymal stem cells. Biochem Biophys Res Commun. 2011;407:295-300. [PubMed] [DOI] |
| 11. | Prockop DJ, Kota DJ, Bazhanov N, Reger RL. Evolving paradigms for repair of tissues by adult stem/progenitor cells (MSCs). J Cell Mol Med. 2010;14:2190-2199. [PubMed] [DOI] |
| 12. | Ziebart T, Yoon CH, Trepels T, Wietelmann A, Braun T, Kiessling F, Stein S, Grez M, Ihling C, Muhly-Reinholz M. Sustained persistence of transplanted proangiogenic cells contributes to neovascularization and cardiac function after ischemia. Circ Res. 2008;103:1327-1334. [PubMed] [DOI] |
| 13. | 赵俊暕 陈乃耀 石峻, 王 沂, 孟 爱国, 韩 晓燕, 赵 辉. 人脐带间充质干细胞移植对创伤性脑损伤大鼠VEGF分泌及血管新生的影响. 中国神经免疫学和神经病学杂志. 2013;20:267-273. |
| 15. | Aggarwal S, Pittenger MF. Human mesenchymal stem cells modulate allogeneic immune cell responses. Blood. 2005;105:1815-1822. [PubMed] [DOI] |
| 16. | Lee T. Stem cell therapy independent of stemness. World J Stem Cells. 2012;4:120-124. [PubMed] [DOI] |
| 17. | di Bonzo LV, Ferrero I, Cravanzola C, Mareschi K, Rustichell D, Novo E, Sanavio F, Cannito S, Zamara E, Bertero M. Human mesenchymal stem cells as a two-edged sword in hepatic regenerative medicine: engraftment and hepatocyte differentiation versus profibrogenic potential. Gut. 2008;57:223-231. [PubMed] [DOI] |
| 18. | Baertschiger RM, Serre-Beinier V, Morel P, Bosco D, Peyrou M, Clément S, Sgroi A, Kaelin A, Buhler LH, Gonelle-Gispert C. Fibrogenic potential of human multipotent mesenchymal stromal cells in injured liver. PLoS One. 2009;4:e6657. [PubMed] [DOI] |
| 19. | Carvalho AB, Quintanilha LF, Dias JV, Paredes BD, Mannheimer EG, Carvalho FG, Asensi KD, Gutfilen B, Fonseca LM, Resende CM. Bone marrow multipotent mesenchymal stromal cells do not reduce fibrosis or improve function in a rat model of severe chronic liver injury. Stem Cells. 2008;26:1307-1314. [PubMed] [DOI] |
| 20. | Buchynska LG, Nesina IP, Yurchenko NP, Bilyk OO, Grinkevych VN, Svintitsky VS. Expression of p53, p21WAF1/CIP1, p16INK4A and Ki-67 proteins in serous ovarian tumors. Exp Oncol. 2007;29:49-53. [PubMed] |
| 23. | Reeves HL, Friedman SL. Activation of hepatic stellate cells--a key issue in liver fibrosis. Front Biosci. 2002;7:d808-d826. [PubMed] [DOI] |
| 24. | Fujita T, Soontrapa K, Ito Y, Iwaisako K, Moniaga CS, Asagiri M, Majima M, Narumiya S. Hepatic stellate cells relay inflammation signaling from sinusoids to parenchyma in mouse models of immune-mediated hepatitis. Hepatology. 2016;63:1325-1339. [PubMed] [DOI] |
| 25. | Ortiz LA, Gambelli F, McBride C, Gaupp D, Baddoo M, Kaminski N, Phinney DG. Mesenchymal stem cell engraftment in lung is enhanced in response to bleomycin exposure and ameliorates its fibrotic effects. Proc Natl Acad Sci USA. 2003;100:8407-8411. [PubMed] [DOI] |
| 26. | Raicevic G, Najar M, Najimi M, El Taghdouini A, van Grunsven LA, Sokal E, Toungouz M. Influence of inflammation on the immunological profile of adult-derived human liver mesenchymal stromal cells and stellate cells. Cytotherapy. 2015;17:174-185. [PubMed] [DOI] |
| 27. | Sato Y, Araki H, Kato J, Nakamura K, Kawano Y, Kobune M, Sato T, Miyanishi K, Takayama T, Takahashi M. Human mesenchymal stem cells xenografted directly to rat liver are differentiated into human hepatocytes without fusion. Blood. 2005;106:756-763. [PubMed] [DOI] |
| 28. | Li T, Yan Y, Wang B, Qian H, Zhang X, Shen L, Wang M, Zhou Y, Zhu W, Li W. Exosomes derived from human umbilical cord mesenchymal stem cells alleviate liver fibrosis. Stem Cells Dev. 2013;22:845-854. [PubMed] [DOI] |
| 29. | Bala S, Petrasek J, Mundkur S, Catalano D, Levin I, Ward J, Alao H, Kodys K, Szabo G. Circulating microRNAs in exosomes indicate hepatocyte injury and inflammation in alcoholic, drug-induced, and inflammatory liver diseases. Hepatology. 2012;56:1946-1957. [PubMed] [DOI] |
| 30. | Hengstler JG, Brulport M, Schormann W, Bauer A, Hermes M, Nussler AK, Fandrich F, Ruhnke M, Ungefroren H, Griffin L. Generation of human hepatocytes by stem cell technology: definition of the hepatocyte. Expert Opin Drug Metab Toxicol. 2005;1:61-74. [PubMed] [DOI] |