修回日期: 2017-10-17
接受日期: 2017-10-28
在线出版日期: 2017-11-18
探讨慢性乙型肝炎(chronic hepatitis B, CHB)患者肝组织Toll样受体3、4(toll-like receptor 3、4, TLR3、TLR4)的表达变化与肝脏炎症活动度、肝脏纤维化程度的相关性及其临床意义.
CHB患者156例通过一秒钟快速穿刺肝活检, 所得肝组织分别进行免疫组织化学TLR3、TLR4染色, 10例趋于正常的肝组织作为对照组, 之后对TLRs免疫组化组结果做出判断, 得出TLR3、TLR4与各自的肝脏炎症活动度、肝纤维化程度的相关性. 应用SPSS18.0版统计软件处理数据.
TLR3在CHB患者肝组织中有较强的表达, 在细胞水平主要表达于肝细胞胞浆, 少部分表达于细胞核, 为单纯胞浆表达或单纯细胞核内表达, 细胞膜无染色, 其表达强度与肝组织炎症活动程度分级(G)有显著的正相关(rs = 0.528, P<0.01)和线性关系(χ2 = 16.679, P<0.01); TLR3表达强度与肝组织纤维化程度分级(S)有显著的正相关(rs = 0.510, P<0.01)和线性关系(χ2 = 16.654, P<0.01). TLR4在肝细胞内表达明显, 主要定位于肝细胞胞浆, 少部分为肝细胞膜表达, 细胞核内未见表达. TLR4表达强度与G分级有显著的正相关(rs = 0.414, P<0.01)和线性关系(χ2 = 11.593, P<0.01), TLR4表达强度与S分级有显著的正相关(rs = 0.354, P<0.01)和线性关系(χ2 = 10.124, P<0.05). 对照组肝细胞均未见TLR3, TLR4的阳性表达.
肝细胞中TLR3、TLR4的高表达可能参与了CHB的某些发病机制, 与慢性乙型肝炎患者的肝组织炎症活动、纤维化程度正相关.
核心提要: Toll样受体3(toll-like receptor 3, TLR3)在慢性乙型肝炎(chronic hepatitis B, CHB)患者肝组织中有较强的表达, 在细胞水平主要表达于肝细胞胞浆, 少部分表达于细胞核, 为单纯胞浆表达或单纯细胞核内表达, 其表达强度与肝组织炎症活动程度分级(G)和肝组织纤维化程度分级(S)有显著的相关性; TLR4在肝细胞内表达明显, 主要定位于肝细胞胞浆, 少部分为肝细胞膜表达, 其表达强度与G分级和S分级有显著的相关性. 肝细胞中TLR3、TLR4的高表达可能参与了CHB的某些发病机制, 与CHB患者的肝组织炎症活动、纤维化程度相关.
引文著录: 蒋福明, 李秀芬, 程书权, 曹亚昭, 黄成军, 杨景毅, 林君. 慢性乙型肝炎患者肝组织Toll样受体3、4表达及其临床意义. 世界华人消化杂志 2017; 25(32): 2879-2887
Revised: October 17, 2017
Accepted: October 28, 2017
Published online: November 18, 2017
To investigate the correlation of the expression of Toll-like receptors 3 and 4 (TLR3, TLR4) with liver inflammation and liver fibrosis degree in the liver tissue of patients with chronic hepatitis B (CHB).
One hundred and fifty-six CHB liver tissues obtained by liver biopsy were subjected to immunohistochemical staining for TLR3 and TLR4. Ten normal liver tissues served as controls. Then, immunohistochemical staining was quantified, and its correlation liver inflammatory activity and liver fibrosis degree was analyzed statistically.
TLR3 was strongly expressed in liver tissue of patients with CHB, mainly in the cytoplasm of liver cells and occasionally in the nucleus. The expression of TLR3 in liver tissue had a significant positive correlation with inflammation grade (rs = 0.528, P < 0.01), and there was a significant linear relationship between them (χ2 = 16.679, P < 0.01). The expression of TLR3 was also correlated with liver fibrosis degree (rs = 0.510, P < 0.01), and there was a significant linear relationship between them (χ2 = 16.654, P < 0.01). TLR4 was obviously expressed in liver cells, mainly in the cytoplasm and occasionally on cell membrane The expression of TLR4 had a significant positive correlation of liver fibrosis degree (rs = 0.354, P < 0.01), and there was a significant linear relationship between them (χ2 = 10.124, P < 0.05).
High expression of TLR3 and TRL4 is positively correlated with liver inflammation and liver fibrosis degree in CHB patients, suggesting that they might participate in the pathogenesis of CHB.
- Citation: Jiang FM, Li XF, Cheng SQ, Cao YZ, Huang CJ, Yang JY, Lin J. Clinical significance of expression of TLR3 and TLR4 in liver tissue of patients with chronic hepatitis B. Shijie Huaren Xiaohua Zazhi 2017; 25(32): 2879-2887
- URL: https://www.wjgnet.com/1009-3079/full/v25/i32/2879.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v25.i32.2879
我国属于乙型肝炎病毒(hepatitis B virus, HBV)感染高流行区, 一般人群的乙型肝炎表面抗原阳性率迄今仍达7%以上. HBV感染不仅可导致慢性乙型肝炎(chronic hepatitis B, CHB), 且可进展为肝硬化与肝细胞癌, 严重影响到人类健康、生活与生存质量. 迄今问世的所有药物均不能清除肝细胞核中的共价闭合环状DNA(covalently closed circular DNA, cccDNA), 这是HBV病毒持续感染和CHB停药复发的主要原因之一[1]. 就目前的诊疗现状, 亦无满意的治疗方法能够自体内彻底清除HBV或避免HBV变异出现耐药, 亦不能完全消除乙型肝炎慢性化及乙型肝炎相关肝癌发生的风险. 而从CHB患者紊乱的免疫调控入手, 采用免疫调节的手段制定新的抗病毒治疗策略正成为CHB治疗研究的热点领域. 目前已知, HBV的清除应答包括强效的先天免疫和后天获得性的细胞应答, HBV与先、后天免疫之间的内在关系往往决定着感染的结局[2,3]. Toll样受体(Toll-like receptors, TLRs)是参与非特异性免疫的重要蛋白分子, 在连接特异性免疫与非特异性免疫中有桥梁作用[4]. 迄今, 已在哺乳动物中发现了11种TLRs, 称为TLRs家族, 分别被命名为TLR1-11. 其中TLR2, 3, 4, 7, 8, 9具有病毒识别作用, 它们如同天然免疫的"眼睛"监视与识别病原体相关分子模式(pathogen-associated molecular patterns, PAMPs), 发挥着重要的抗病毒作用[5], 甚至与HBV相关性的肝细胞癌的发生与控制有密切关系[6]. 目前已知, 在CHB患者体内, TLRs与其相应的配体结合, 诱导特异性靶细胞基因的表达以及调节Th1/Th2反应平衡而参与抑制HBV复制介导肝损伤与损伤后的修复[7], 其中TLR3, 4发挥着及其重要的作用[8]. 但TLR3, 4与CHB的肝脏炎症活动度及纤维化程度的关系尚未十分明了, 本文拟就此问题加以探讨.
本组共收集广西壮族自治区桂林市第三人民医院肝病科自2013-01/2017-06行肝脏活组织检查的未应用过抗HBV药物的CHB患者共156例, 所有患者诊断均符合2010年中华医学会感染病学分会、肝病学分会联合制订的《慢性乙型肝炎防治指南》的标准. 对照组为10例取自无嗜肝病毒感染的肝血管瘤周边(大致正常)肝组织. 排除标准: (1)近期使用过干扰素、胸腺肽、糖皮质激素等影响免疫功能药物的患者; (2)重叠或混合感染甲型肝炎病毒、丙型肝炎病毒、HDV、HEV者; (3)合并脂肪肝、酒精性肝病、药物性肝损害及肝硬化, 原发性肝癌者; (4)合并糖尿病、心脑血管及免疫等系统疾病者. 156例CHB患者年龄26岁-63岁, 平均年龄37岁, 其中男性92例, 女性64例; 10例对照组年龄24岁-64岁, 平均年龄32岁, 其中男性6例, 女性4例.
1.2.1 肝组织切片的制备: 所有CHB患者均采用一秒钟快速肝穿刺活检术获取肝脏病理标本, 所得标本通过梯度酒精脱水、二甲苯脱水、浸蜡、包埋、切片机连续切片(切片厚5 μm)、常规脱蜡等步骤予处理后进行保存. 10例作为对照的非CHB患者标本制备方法同上.
1.2.2 肝病病理结果评定: 由高年资病理医师在未知患者疾病状态的情况下对炎症活动、纤维化程度等进行分级和分期诊断. 每一份病理标本均经2位医师复核, 其标准严格参照2000年《病毒性肝炎防治方案》实施. 其中炎症程度分为G 0-4, 纤维化程度分为S 0-4各5级.
1.2.3 肝脏组织免疫组化实验及结果判断: 所有肝组织标本分别进行免疫组织化学TLR3、TLR4染色, 一抗为兔源性的TLR3、TLR4(购自Bioss公司), 二抗为快捷型酶标羊抗兔免疫球蛋白G聚合物, 具体操作步骤参照试剂盒的要求进行. 以缓冲液代替一抗设立阴性对照.
TLRs免疫组化结果判断: 由研究者及1名病理科医师釆用人工双盲法分别阅片评分. 阳性着色呈棕色细颗粒状. 凡细胞质或细胞核不着色为0分、浅棕色为1分、棕色为2分、深棕色为3分; 在高倍镜下随机计数5个视野, 计算阳性细胞所占百分比, 阳性细胞占所有细胞的比例: 1%-10%为0分, 11%-25%为1分, 26%-50%为2分, 51%-75%为3分, 76%-100%为4分. 根据上述2项指标的两积分相乘分为4级: 0分为阴性(-)、1-4分为弱阳性(+)、5-8分为中等阳性(++)、9-12分为强阳性(+++). 阴性对照以缓冲液PBS替代一抗.
统计学处理 应用SPSS18.0版统计软件处理数据. 计量资料以mean±SD表示, 两组计量资料间比较采用t检验, 多组计量资料组间比较釆用单因素方差分析进行差异的显著性检验; 两组等级资料之间的比较采用秩和检验, 多组等级资料组间比较采用Kruskal-Wallis检验; 相关分析采用Spearman、Pearson或Kendall's tau-b相关分析P<0.05为差异有统计学意义, P<0.01为差异有显著性意义.
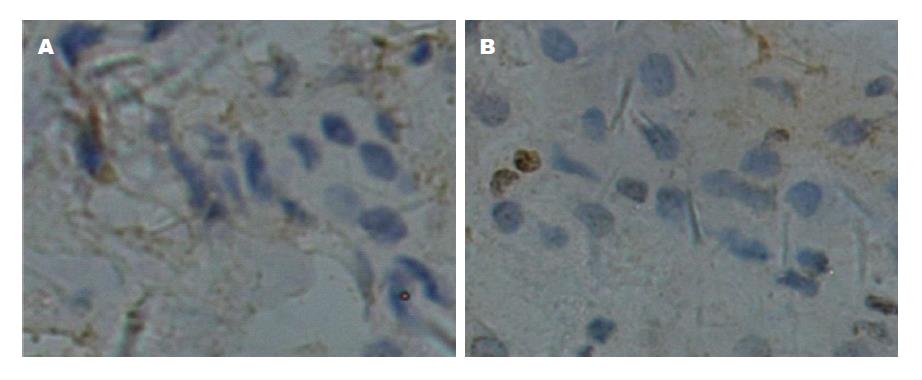
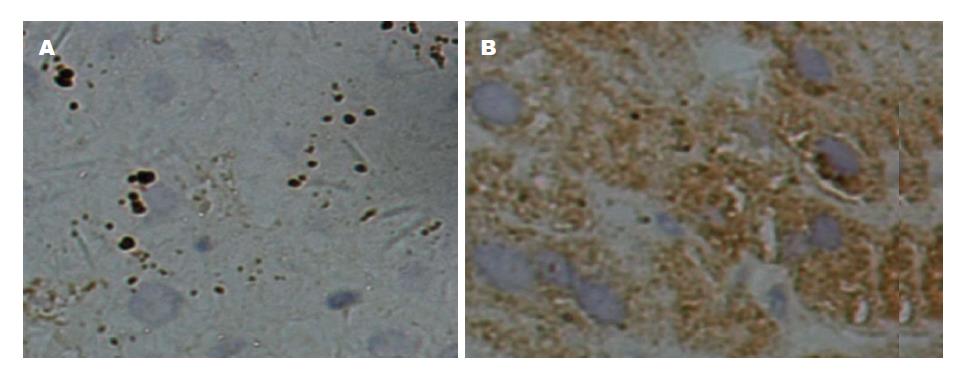
由下图1可见, 健康肝细胞组织免疫组化染色TLR3、4均为(-)表达.
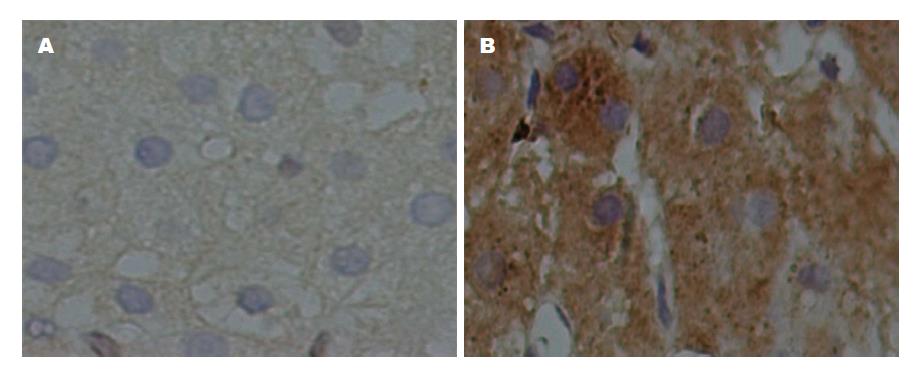
不同炎症程度与TLR3表达情况如下表1和2所示. 由表1可见, 经Kruskal Wallis检验显示, G0-G3四组之间TLR3表达强度差异有显著的统计学意义(H = 22.833, P<0.01); 经扩展的t检验两两比较显示(见表2), G0与Gl比较、G0与G2比较、G1与G2比较、G1与G3比较、G2与G3比较, 差异有显著的统计学意义(P<0.01); G0与G3比较差异无统计学意义(P>0.05), Spearman秩相关性分析显示TLR3表达强度与肝组织炎症活动度分级(G)有显著的正相关性(rs = 0.528, P<0.01); 线性趋势检验显示TLR3表达强度与肝组织炎症活动度分级(G)有显著的线性关系(χ2 = 16.679, P<0.01), TLR3表达强度与肝组织炎症活动度分级(G)之间不仅存在相关关系且为线性关系. 图2A显示, G0期肝组织免疫组化染色, TLR3表达分级(-); 图2B显示, G3期肝组织免疫组化染色, TLR3在肝细胞中表达分级(+++).
| 组别 | n | TLR3表达评级 | 秩均值 | |||
| - | + | ++ | +++ | |||
| G0 | 24 | 6 (0.25) | 6 (0.25) | 12 (0.5) | 0 (0) | 2.04 |
| G1 | 72 | 6 (0.08) | 42 (0.58) | 12 (0.17) | 12 (0.17) | 3.54 |
| G2 | 42 | 0 (0) | 12 (0.28) | 18 (0.44) | 12 (0.28) | 3.04 |
| G3 | 18 | 0 (0) | 0 (0) | 6 (0.33) | 12 (0.67) | 1.38 |
| G4 | 0 | 0 (0) | 0 (0) | 0 (0) | 0 (0) | 0 |
| 组别 | G1 vs G2 | G1 vs G3 | G2 vs G3 | G0 vs G1 | G0 vs G2 | G0 vs G3 |
| t值 | 3.602 | 4.532 | 5.745 | -4.815 | -4.690 | 1.483 |
| P值 | 0.004 | 0.001 | 0.000 | 0.001 | 0.001 | 0.166 |
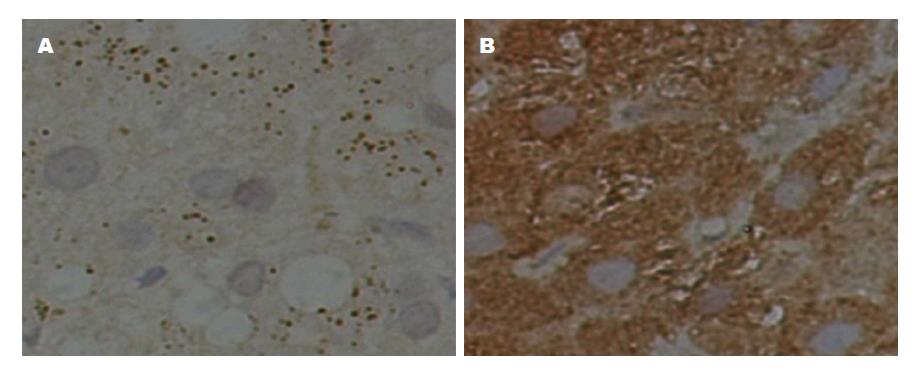
不同肝纤维化程度与TLR3表达情况如下表3, 图3所示. 由表3可见, 经Kruskal Wallis检验显示, S0~S4四组之间TLR3表达强度差异无统计学意义(H = 6.000, P>0.05); Spearman秩相关性分析显示TLR3表达强度与肝组织纤维化程度分级(S)有显著的正相关性(rs = 0.510, P<0.01); 线性趋势检验显示TLR3表达强度与肝组织纤维化程度分级(S)有显著的线性关系(χ2 = 16.654, P<0.01), TLR3表达强度与肝组织纤维化程度分级(S)之间不仅存在相关关系且为线性关系. 图3A显示, S0期肝组织免疫组化染色, TLR3表达分级(-); 图3B显示, S4期肝组织免疫组化染色, TLR3在肝细胞中表达分级(+++).
| 组别 | n | TLR3表达评级 | 秩均值 | |||
| - | + | ++ | +++ | |||
| S0 | 12 | 0 (0) | 12 (1) | 0 (0) | 0 (0) | 1.00 |
| S1 | 60 | 6 (0.1) | 30 (0.5) | 18 (0.3) | 6 (0.2) | 3.75 |
| S2 | 54 | 6 (0.11) | 18 (0.33) | 12 (0.23) | 18 (0.33) | 4.50 |
| S3 | 18 | 0 (0) | 0 (0) | 6 (0.33) | 12 (0.67) | 3.25 |
| S4 | 12 | 0 (0) | 0 (0) | 6 (0.5) | 6 (0.5) | 2.50 |
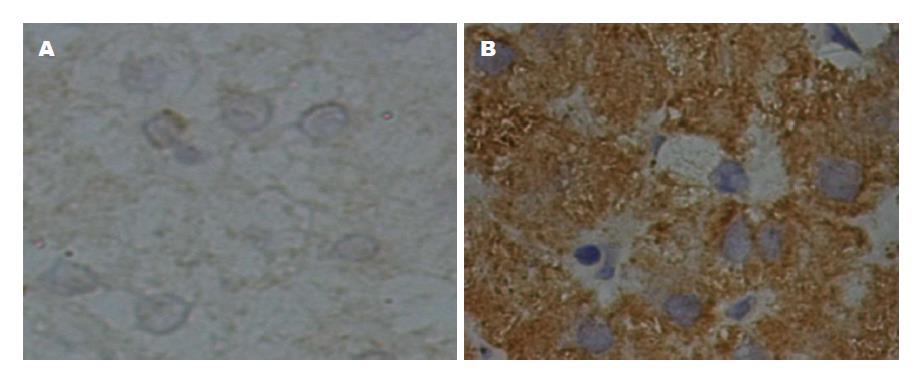
不同炎症程度与TLR4表达情况如表4、5, 图4所示. 由表4可见, 经Kruskal Wallis检验显示, G0~G3四组之间TLR4表达强度差异有统计学意义(H = 8.351, P<0.05); 经扩展的t检验两两比较显示(见表5), G1与G2比较、G1与G3比较, 差异有统计学意义(P<0.05); G0与Gl比较、G2与G3比较、G0与G2比较、G0与G3比较, 差异无统计学意义(P>0.05), Spearman秩相关性分析显示TLR4表达强度与肝组织炎症活动度分级(G)有显著的正相关性(rs = 0.414, P<0.01); 线性趋势检验显示TLR4表达强度与肝组织炎症活动度分级(G)有显著的线性关系(χ2 = 11.593, P<0.01), TLR4表达强度与肝组织炎症活动度分级(G)之间不仅存在相关关系且为线性关系. 图4A显示, G0期肝组织免疫组化染色, TLR4表达分级(-); 图4B显示, G3期肝组织免疫组化染色, TLR4在肝细胞中表达分级(+++).
| 组别 | n | TLR4表达评级 | 秩均值 | |||
| - | + | ++ | +++ | |||
| G0 | 24 | 6 (0.25) | 6 (0.25) | 12 (0.5) | 0 (0) | 2.25 |
| G1 | 72 | 6 (0.09) | 18 (0.25) | 24 (0.33) | 24 (0.33) | 2.50 |
| G2 | 42 | 0 (0) | 6 (0.14) | 18 (0.43) | 18 (0.43) | 1.38 |
| G3 | 18 | 0 (0) | 0 (0) | 6 (0.33) | 12 (0.67) | 3.88 |
| G4 | 0 | 0 (0) | 0 (0) | 0 (0) | 0 (0) | 0 |
| 组别 | G1 vs G2 | G1 vs G3 | G2 vs G3 | G0 vs G1 | G0 vs G2 | G0 vs G3 |
| t值 | 5.000 | 4.700 | 2.449 | -2.449 | -0.878 | 0.333 |
| P值 | 0.015 | 0.018 | 0.092 | 0.092 | 0.444 | 0.761 |
不同肝纤维化程度与TLR4表达情况如表6, 图5所示. 由表6可见, 经Kruskal Wallis检验显示, S0~S4四组之间TLR4表达强度差异无统计学意义(H = 7.429, P>0.05); Spearman秩相关性分析显示TLR4表达强度与肝组织纤维化程度分级(S)有显著的正相关性(rs = 0.354, P<0.01);线性趋势检验显示TLR4表达强度与肝组织纤维化程度分级(S)有显著的线性关系(χ2 = 10.124, P<0.05), TLR4表达强度与肝组织纤维化程度分级(S)之间不仅存在相关关系且为线性关系. 图5A显示, S0期肝组织免疫组化染色, TLR4表达分级(+); 图5B显示, S4期肝组织免疫组化染色, TLR4在肝细胞中表达分级(++).
| 组别 | n | TLR4表达评级 | 秩均值 | |||
| - | + | ++ | +++ | |||
| S0 | 12 | 6 (0.5) | 0 (0) | 6 (0.5) | 0 (0) | 1.50 |
| S1 | 60 | 6 (0.1) | 18 (0.3) | 18 (0.3) | 18 (0.3) | 4.25 |
| S2 | 54 | 0 (0) | 12 (0.22) | 18 (0.33) | 24 (0.45) | 4.75 |
| S3 | 30 | 0 (0) | 0 (0) | 6 (0.3) | 12 (0.7) | 2.50 |
| S4 | 22 | 0 (0) | 0 (0) | 6 (0.5) | 6 (0.5) | 2.00 |
目前认为, HBV本身并不直接损伤肝细胞, 而是通过在被感染的肝细胞上表达HBV的抗原表位, 经抗原递呈细胞的识别、加工后, HBV抗原肽与主要组织相容性复合物Ⅰ类分子结合, 进而激活CD8+ T细胞, 产生细胞免疫反应攻击肝细胞导致疾病, 而CD8+ T细胞的激活首先依赖天然免疫的识别[5]. TLRs是参与天然免疫的一类重要蛋白质分子, 在连接天然免疫和特异性免疫起重要的桥梁作用, 通过识别不同病原体的PAMPs, 激活多种信号通路, 表达免疫相关蛋白. TLRs不仅能调节先天性免疫, 而且直接参与启动获得性免疫反应[8]. TLRs与相应配体结合后, 通过构象变化和二聚作用等复杂网络机制[6], 启动激活细胞内信号转导途径Ð调炎性反应, 促进某些蛋白激酶和转录因子κB (nuclear transcription factor-κB, NF-κB)的激活, 诱导Ⅰ型干扰素的产生, 并参与抗HBV反应[7]. 尤其是TLR3、TLR4所介导的信号通路, 可能在CHB的发病机制及免疫介导的肝细胞损伤中起主要作用, 从而促进机体对HBV的清除[9]甚至对肝细胞癌变的治疗带来新的启迪[10].
本研究通过免疫组化方法观察CHB患者肝脏组织TLR3, 4两种TLRs的表达情况, 图1结果显示, 作为对照组的10例来自肝血管瘤旁未感染HBV的肝细胞中未见明显的TLRs阳性表达; 由表1、2, 图2B可见, TLR3在CHB患者肝组织上表达较强, 在细胞水平上主要表达于肝细胞胞浆, 有少部分表达于细胞核, 一般为单纯胞浆表达或单纯细胞核内表达, 细胞膜无染色. 显示TLR3表达强度与G之间不仅存在正相关关系且为线性关系, 其表达强度随着G的增高而增高. 研究[11]表明肝脏炎症及其所致的肝纤维化或肝硬化是肝病进展的主要病理学基础, 多种激素、体液因子(炎症介质、促炎或抗炎因子)以及细胞黏附分子等参与炎症调控, 它们之间有相互促进或拮抗的关系, 共同构成了复杂的调控网络, 其中包括炎症诱导物、炎症感受细胞、炎症介质. 炎症感受细胞主要是免疫及炎症细胞, 如库普弗细胞、中性粒细胞、内皮细胞等, TLR3作为炎症感受细胞表面上的受体之一, 它可启动获得性免疫和固有免疫, 激活巨噬细胞, 在炎症反应的过程中起到承上启下的作用, 而炎症因子的产生可促使更多炎症细胞募集, 活性增强, 从而启动瀑布式炎症级联反应[12]. 在某种程度上可见, CHB炎症程度越重, TLR3表达程度越高, 本实验结果亦印证这观点. 因此, CHB的抗炎治疗在临床治疗中起重要作用, 研究开发TLR3及其配体有望成为CHB免疫治疗及疾病预测的新方法.
由表3、4, 图3A可见, TLR4的表达主要定位于肝细胞胞浆, 一些为肝细胞膜表达, 细胞核内未见表达. 其表达强度与肝组织炎症活动程度之间具有正相的线性关系, 且其表达强度随肝组织炎症分级(G)的增加而增高. 就目前所知[13], TLR4可通过调节辅助性T淋巴细胞(Th1)和(Th2)间的平衡及诱导型一氧化氮合酶发挥抑制HBV复制, 还可促进CD8+ T淋巴细胞在肝细胞黏附而增强抑制HBV复制作用, 即HBV复制越活跃, 炎症程度越重, TLR4表达越明显[14], 而本实验结果也验证了这一观点. 由于TLR4表达于调节性T淋巴细胞(regulatory T cells, Treg)表面, 可通过识别和结合HBV来参与Treg的活化, 活化后的Treg却抑制了HBV抗原特异性的CD4+ T淋巴细胞的增殖, 所以TLR4具有双向作用, 当其升高到一定程度, 反而不利于HBV抑制与自身的清除, 从而可能导致HBV感染的慢性化[15].
本实验结果还显示, TLR3、TLR4与肝脏纤维化程度密切相关, 其强度随肝组织纤维化程度分级(S)的增加而增高. 已知先天免疫系统通过多种模式识别受体识别病原体产物的成分, 受体与PAMPs识别并结合后, 调节肝纤维化的发生[16,17]. 而肝纤维化受到多种先天免疫系统成分的控制, 包括体液因子(如补体和干扰素)、吞噬细胞(如中性粒细胞和巨噬细胞)、淋巴细胞(如NK细胞和NKT细胞)和TLRs[17], 由此推测TLR3、TLR4可能参与到肝纤维化病理过程之中. 因TLR3可通过诱导DNA损伤, 引起组织损伤修复反应, 改变氧化应激和线粒体应激状态, 增加了肝组织纤维化标志物之一的Ⅰ型胶原[18], 最终导致肝纤维化的病态增生. 而星状细胞(hepatic stellate cell, HSC)表面富含TLR4, 当脂多糖与HSC表面的TLR4结合后, 通过MyD88途径下的NF-κB通路使位于肝窦间隙内的HSC被激活, 激活的HSC分泌巨噬细胞产生转化生长因子β等重要促纤维化因子, 同时转化纤维母细胞, 大量增殖后形成过量的细胞外基质并沉积于肝脏[19]. TLR3、TLR4表达强度随着肝组织纤维化程度分级的增加而增高, 提示了TLR3、TLR4可能在一定程度上判断患者肝组织纤维化程度, 对疾病的发展、预后起预测功能. 肝脏炎症活动或HBV活跃复制导致TLR3、TLR4表达升高, 从而促进肝纤维化的形成, 因此可认为肝脏炎症程度与肝组织TLR3、TLR4表达水平和肝纤维化程度之间存在一定相关性. 鉴于人体免疫系统具有强大的自我清除与修复能力, 本实验未行肝组织的马松染色, 未能在组织病理学层面深入论证TLR3与肝纤维化的相关性, 是为一憾.
既往的相关性研究[20-25]取材对象为动物肝脏或人体外周血液, 罕有大样本关于CHB肝细胞由TLRs染色及其与病理状况的对比分析. 本组结果显示TLR3、TLR4与CHB的炎症程度、纤维化程度具有一定相关性, 并可能参与到CHB的免疫调控病理生理过程. 由此推测阻断TLR3、TLR4信号传导系统有可能对控制CHB疾病的进展有利. 但TLR3、TLR4是否为CHB免疫机制中关键的信号分子, 调节或干扰TLR3、TLR4信号转导途径, 是否有望成为较为有效的病毒性肝炎的免疫治疗方法? 目前研究者不能圆满回答这些问题. TLRs将来是否能成为新的免疫调节治疗途径或疾病发展的检测、预后指标, 需不断的深入研究.
志谢: 感谢桂林医学院统计学教研室谭胜奎教授对撰写此稿件的帮助.
乙型肝炎病毒(hepatitis B virus, HBV)的免疫清除机制包括固有的先天免疫和获得性的后天免疫, HBV与先、后天免疫之间的内在关系往往决定着感染的结局. Toll样受体作为参与非特异性免疫的重要蛋白质分子, 在连接特异性免疫与非特异性免疫中的桥梁作用日趋受到人们的关注. 从慢性乙型肝炎(chronic hepatitis B, CHB)患者体内的TLRs改变情况入手, 探讨在HBV感染后的不同阶段不同类型的TLRs水平, 对深化CHB的发病机理、探寻新的免疫检测与调控手段、制定新的抗病毒治疗策略均具有重要意义.
TLRs作为炎症感受细胞表面上的受体之一, 可启动获得性免疫和固有免疫, 激活巨噬细胞, 在炎症反应的过程中起到承上启下的作用, 而炎症因子的产生可促使更多炎症细胞募集, 活性增强, 从而启动瀑布式炎症级联反应. 在某种程度上CHB炎症程度越重, TLRs表达程度越高. 因此, CHB的抗炎治疗在临床治疗中起重要作用. 但调节或干扰TLR3、TLR4的信号转导途径, 是否有望成为较为有效的病毒性肝炎的免疫治疗方法? TLRs将来是否能成为新的免疫调节治疗途径或疾病发展的检测及预后指标? 尚需进一步深入研究.
目前TLRs的激动剂与拮抗剂研究均为研究热点, 如文献报道较多的TLR3激动剂双链病毒RNA(dsRNA)和dsRNA的合成衍生物. 前者为一种强效激活天然免疫的优势活化剂, 后者为人工合成的病毒dsRNA类似物, 能够模拟病毒感染后所形成的dsRNA分子. 目前临床使用的TLR3靶点激动剂多为后者或后者的修饰后的改良药物, 如聚肌胞(polyI:C)、PolyI: C12U、Hiltonol等. 当TLR3被这些激动剂激活后, 通过胞内信号转导通路级联激活NF-κB, 启动核内炎症相关基因的表达, 产生白介素、干扰素、肿瘤坏死因子等一系列细胞因子, 诱发炎症和抗病毒反应, 发挥早期天然免疫效应.
既往有关TLRs在HBV感染方面的研究多囿于动物肝脏标本或人体外周血单个核白细胞, 研究报告亦限于TLRs各参数之间的简单变化与增减情况, 罕有通过CHB患者肝活检取样做大样本肝细胞TLRs免疫组化染色及其与病理状况的对比分析. 本组通过观察肝脏组织不同部位TLR3、TLR4染色情况, 对比TLR3、TLR4与肝脏炎症程度、纤维化程度的相关性, 进尔推测TLR3、TLR4是否参与到CHB的免疫调控病理生理过程, 阻断TLR3、TLR4信号传导系统对控制CHB疾病的进展是否有利等.
TLR3, TLR4表达强度随着肝组织炎症和纤维化程度分级的增加而增高, 提示观察二者的变化水平有助于判断CHB患者肝组织炎症与纤维化程度, 对疾病的发展、预后可能起到预测作用.
Toll样受体: 有机体参与非特异性免疫的一类重要蛋白分子, 在连接特异性免疫与非特异性免疫中起桥梁作用. 迄今, 已在哺乳动物中发现了11种TLRs, 称为TLRs家族, 分别被命名为TLR1-11.
丁岗强, 副主任医师, 河南省人民医院感染性疾病科; 刘正稳, 教授, 主任医师, 西安交通大学附属第一医院传染科; 阴赪宏, 研究员, 首都医科大学附属北京友谊医院内科
作者研究CHB患者肝组织TLR3、4的表达变化与肝脏炎症活动度、肝脏纤维化程度的相关性及其临床意义, 标本为人体标本, 说服力较强. 文章设计合理, 语言组织严谨. 具有一定的临床意义及创新性.
手稿来源: 自由投稿
学科分类: 胃肠病学和肝病学
手稿来源地: 广西壮族自治区
同行评议报告分类
A级 (优秀): 0
B级 (非常好): B, B
C级 (良好): C
D级 (一般): 0
E级 (差): 0
编辑: 马亚娟 电编:杜冉冉
| 1. | 张 磊, 程 书权. 核苷(酸)类似物治疗慢性乙型肝炎研究进展. 中华临床医师杂志(电子版). 2013;7:766-768. |
| 2. | TrehanPati N, Kotillil S, Hissar SS, Shrivastava S, Khanam A, Sukriti S, Mishra SK, Sarin SK. Circulating Tregs correlate with viral load reduction in chronic HBV-treated patients with tenofovir disoproxil fumarate. J Clin Immunol. 2011;31:509-520. [PubMed] [DOI] |
| 3. | Broering R, Lu M, Schlaak JF. Role of Toll-like receptors in liver health and disease. Clin Sci (Lond). 2011;121:415-426. [PubMed] [DOI] |
| 5. | Ait-Goughoulte M, Lucifora J, Zoulim F, Durantel D. Innate antiviral immune responses to hepatitis B virus. Viruses. 2010;2:1394-1410. [PubMed] [DOI] |
| 6. | Lopes JA, Borges-Canha M, Pimentel-Nunes P. Innate immunity and hepatocarcinoma: Can toll-like receptors open the door to oncogenesis? World J Hepatol. 2016;8:162-182. [PubMed] [DOI] |
| 8. | Li HJ, Zhai NC, Song HX, Yang Y, Cui A, Li TY, Tu ZK. The Role of Immune Cells in Chronic HBV Infection. J Clin Transl Hepatol. 2015;3:277-283. [PubMed] [DOI] |
| 9. | Pei RJ, Chen XW, Lu MJ. Control of hepatitis B virus replication by interferons and Toll-like receptor signaling pathways. World J Gastroenterol. 2014;20:11618-11629. [PubMed] [DOI] |
| 10. | Mai CW, Kang YB, Pichika MR. Should a Toll-like receptor 4 (TLR-4) agonist or antagonist be designed to treat cancer? TLR-4: its expression and effects in the ten most common cancers. Onco Targets Ther. 2013;6:1573-1587. [PubMed] [DOI] |
| 11. | Tang D, Kang R, Coyne CB, Zeh HJ, Lotze MT. PAMPs and DAMPs: signal 0s that spur autophagy and immunity. Immunol Rev. 2012;249:158-175. [PubMed] [DOI] |
| 14. | Xu CL, Hao YH, Lu YP, Tang ZS, Yang XC, Wu J, Zheng X, Wang BJ, Liu J, Yang DL. Upregulation of toll-like receptor 4 on T cells in PBMCs is associated with disease aggravation of HBV-related acute-on-chronic liver failure. J Huazhong Univ Sci Technolog Med Sci. 2015;35:910-915. [PubMed] [DOI] |
| 15. | Momeni M, Zainodini N, Bidaki R, Hassanshahi G, Daneshvar H, Khaleghinia M, Ebrahim M, Karimi-Googheri M, Askari A, Arababadi MK. Decreased expression of toll like receptor signaling molecules in chronic HBV infected patients. Hum Immunol. 2014;75:15-19. [PubMed] [DOI] |
| 16. | Zou ZQ, Wang L, Wang K, Yu JG. Innate immune targets of hepatitis B virus infection. World J Hepatol. 2016;8:716-725. [PubMed] [DOI] |
| 17. | Yin JW, Ping Huang M, Zhong B. Intrahepatic Toll-Like Receptor 3 in Chronic HBV Infection Subjects: Asymptomatic Carriers, Active Chronic Hepatitis, Cirrhosis, and Hepatocellular Carcinoma. Hepat Mon. 2016;16:e34432. [PubMed] [DOI] |
| 19. | Shi H, Dong L, Dang X, Liu Y, Jiang J, Wang Y, Lu X, Guo X. Effect of chlorogenic acid on LPS-induced proinflammatory signaling in hepatic stellate cells. Inflamm Res. 2013;62:581-587. [PubMed] [DOI] |
| 20. | Geng D, Zheng L, Srivastava R, Asprodites N, Velasco-Gonzalez C, Davila E. When Toll-like receptor and T-cell receptor signals collide: a mechanism for enhanced CD8 T-cell effector function. Blood. 2010;116:3494-3504. [PubMed] [DOI] |
| 21. | 陈 煜, 时 红波, 张 帆, 丁 美, 赵 军, 刘 旭华, 段 钟平. TLR2、TLR4和TLR9在慢性重型肝炎患者及肝衰竭大鼠中的表达. 世界华人消化杂志. 2010;18:1320-1325. [DOI] |
| 22. | Ayoobi F, Hassanshahi G, Zainodini N, Khorramdelazad H, Arababadi MK, Kennedy D. Reduced expression of TRIF in chronic HBV infected Iranian patients. Clin Res Hepatol Gastroenterol. 2013;37:491-495. [PubMed] [DOI] |
| 23. | Yin JW, Huang MP, Zhong B. Intrahepatic Toll-Like Receptor 3 in Chronic HBV Infection Subjects: Asymptomatic Carriers, Active Chronic Hepatitis, Cirrhosis, and Hepatocellular Carcinoma. Hepat Mon. 2016;16:e34432. [DOI] |