修回日期: 2017-08-20
接受日期: 2017-08-30
在线出版日期: 2017-09-28
系统评价ω-3多不饱和脂肪酸(omega-3 polyunsaturated fatty acids, ω-3PUFA)治疗非酒精性脂肪性肝病(non-alcoholic fatty liver disease, NAFLD)的疗效和安全性.
电子检索Cochrane图书馆临床对照试验、PubMed、EMBASE、CNKI、VIP、万方期刊论文数据库等, 检索时限为建库至2017-01. 并手检相关会议论文集及查阅参考文献, 全面收集国内外关于ω-3PUFA治疗NAFLD的随机对照试验研究资料进行系统评价.
共纳入11个试验(743例)患者. Meta分析结果: (1)肝脏组织学改善有效率: ω-3PUFA组优于安慰剂或空白对照组(OR = 2.64, 95%CI: 1.36-5.14; P = 0.004); (2)肝脏生化学指标(谷丙转氨酶、谷草转氨酶、谷氨酰转肽酶): ω-3PUFA组优于安慰剂或空白对照[95%CI: -15.77-(-2.91); P = 0.004]、[95%CI: -14.79-(-1.94); P = 0.01]、[95%CI: -21.33-(-6.92); P = 0.0001]; (3)血脂指标(甘油三酯、总胆固醇、低密度脂蛋白): ω-3PUFA组优于安慰剂或空白对照组[95%CI: -2.38-(-0.21); P = 0.02]、[95%CI: -1.71-(-0.06); P = 0.04]、[95%CI: -0.53-(-0.23); P<0.00001].
ω-3PUFA治疗非酒精性脂肪性肝病可改善肝脏组织学和肝脏酶谱, 同时改善血脂, 是一种安全有效的辅助治疗方案. 但仍需高质量循证医学证据指导临床.
核心提要: 研究显示ω-3多不饱和脂肪酸(omega-3 polyunsaturated fatty acids, ω-3PUFA)可通过降低肝脂质蓄积、胰岛素抵抗、血清炎症标志物、氧化应激和凋亡标志物, 改善非酒精性脂肪性肝病(non-alcoholic fatty liver disease, NAFLD)患者的生化、血流动力学和超声特征. 近年来, ω-3PUFA辅助治疗NAFLD为临床应用提供了新思路. 国内外临床研究亦显示, ω-3PUFA辅助治疗NAFLD可能获益. 本研究关注ω-3PUFA辅助治疗NAFLD, 对世界范围内收集到的11个已完成的随机对照试验进行了系统评价, 结果显示, ω-3PUFA辅助治疗NAFLD能改善肝脏组织学和肝脏酶谱, 同时改善血脂, 是一种有效和安全的辅助治疗方案, 但尚需严格设计多中心、大样本临床随机对照试验的证据.
引文著录: 何继东, 朱毓江, 刘莉. ω-3多不饱和脂肪酸治疗非酒精性脂肪性肝病的Meta分析. 世界华人消化杂志 2017; 25(27): 2459-2468
Revised: August 20, 2017
Accepted: August 30, 2017
Published online: September 28, 2017
To assess the efficacy and safety of ω-3 polyunsaturated fatty acids (ω-3 PUFAs) for the treatment of non-alcoholic fatty liver disease.
We searched Cochrane Central Register of Controlled Trails (CENTRAL), PubMed, EMBASE, CNKI, VIP, Wanfang database before January 2017, and the relevant conference proceedings to retrieve randomized controlled trials that assessed the efficacy and safety of ω-3 PUFAs for the treatment of non-alcoholic fatty liver disease. The systematic review was conducted using the method recommended by the Cochrane Collaboration.
Eleven trials with a total of 743 patients were included in the systematic review. The meta- analysis showed that ω-3 PUFAs were superior to placebo/blank control in the improvement of fatty liver (OR = 2.64, 95%CI: 1.36-5.14; P = 0.004), plasma biochemical markers of liver function [ALT: 95%CI: -15.77-(-2.91), P = 0.004; AST: 95%CI: -14.79-(-1.94), P = 0.01; GGT: 95%CI: -21.33-(-6.92), P = 0.0001], and plasma biochemical markers of lipid metabolism [TG: 95%CI: -2.38-(-0.21), P = 0.02; TC: 95%CI: -1.71-(-0.06), P = 0.04; LDL: 95%CI: -0.53-(-0.23); P < 0.00001].
The current evidence shows that supplementation with ω-3 PUFAs is a practical and effective treatment for NAFLD with regard to improvement of fatty liver, plasma biochemical markers of liver function and lipid metabolism. However, more high-quality, large randomized controlled trials are needed to validate our findings.
- Citation: He JD, Zhu YJ, Liu L. ω-3 Polyunsaturated fatty acids for treatment of non-alcoholic fatty liver disease: A systematic review of randomized controlled trials. Shijie Huaren Xiaohua Zazhi 2017; 25(27): 2459-2468
- URL: https://www.wjgnet.com/1009-3079/full/v25/i27/2459.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v25.i27.2459
非酒精性脂肪性肝病(non-alcoholic fatty liver disease, NAFLD)是指除外酒精和其他明确的损肝因素所致的以弥漫性肝细胞大泡性脂肪变为主要特征的临床病理综合征. 包括单纯性脂肪肝(non-alcoholic fatty liver, NAFL)以及由其演变的脂肪性肝炎(non-alcoholic steatohepatitis, NASH)和NASH相关性肝硬化(脂肪性肝硬化)[1,2]. 随着肥胖和代谢综合征发病率的增高, NAFLD已经成为我国最常见的慢性肝病之一, 严重危害公众健康[3]. 但NAFLD治疗尚缺乏特效药物, 以个体化治疗为原则. 近年来报道ω-3多不饱和脂肪酸(omega-3 polyunsaturated fatty acids, ω-3PUFA)治疗非酒精性脂肪性NAFLD肝病取得较好疗效, 且安全性好. 我们关注NAFLD治疗的临床循证医学证据, 采用国际Cochrane协作网推荐的方法对ω-3PUFA治疗NAFLD进行系统评价, 以期为临床提供循证医学的参考.
1.1.1 纳入研究: 纳入ω-3PUFA治疗NAFLD的随机对照试验(randomized controlled trial, RCT)中英文文献, 全文及摘要均予纳入.
1.1.2 纳入与排除标准: 纳入标准: (1)年龄(18岁以上), 性别不限; (2)诊断标准参照NAFLD诊疗指南(2010年修订版); (3)包含ω-3PUFA治疗的随机对照试验. 排除标准: 有以下情况之一的患者: (1)酒精性脂肪性肝病、肝豆状核变性、自身免疫性肝病等特定性肝病; (2)胃肠外营养、甲状腺功能减退症、炎性肠病、库欣综合征等可导致脂肪肝的情况; (3)正在或近期内服用药物可导致肝功能损害的患者; (4)药物导致脂肪肝; (5)治疗药物过敏者.
1.1.3 干预措施: 试验组为ω-3PUFA治疗方案. 对照组为安慰剂或空白对照. 治疗的剂量、疗程、给药途径不限, 可同时接受相同剂量、疗程其他治疗.
1.1.4 疗效指标: 肝脏组织学改善有效率、不良反应发生率; 肝脏生化学指标[谷丙转氨酶(alanine transaminase, ALT)、谷草转氨酶(aspartate transaminase, AST)、谷氨酰转肽酶(glutamyl transferase, GGT)]、血脂指标[甘油三酯(triglyceride, TG)、总胆固醇(total cholesterol, TC)、低密度脂蛋白(low-density lipoprotein, LDL)].
计算机检索Cochrane图书馆临床对照试验、PubMed、EMBASE、CNKI、VIP、万方期刊论文数据库, 检索时限均为建库至2017-01. 英文检索词包括: fish oil、ω-3 Polyunsaturated fatty acids (ω-3PUFA)、eicosapentaenoic acid (EPA)、docosahexaenoic acid (DHA)、fatty liver、NAFLD、NASH、hepatic steatosis、steatohepatitis; 中文检索词包括: 鱼油、ω-3多不饱和脂肪酸、二十碳五烯酸、二十二碳六烯酸、脂肪肝、非酒精性脂肪性肝病、非酒精性脂肪性肝炎、肝脂肪变性、脂肪性肝炎. 手工检索世界胃肠病学会议美国消化疾病周会议论文; 查阅参考文献索引, 手检相关文献. 以PubMed为例, 检索策略如框1
框1 PubMed: 检索策略
#1 fish oil OR ω-3PUFA OR EPA OR DHA
#2 fatty liver OR NAFLD OR NASH OR hepatic steatosis OR steatohepatitis
#3 clinical trial
#4#1 AND #2 AND #3
由评价员(刘莉和朱毓江)独立进行方法学质量评价, 按设计表格提取资料并进行交叉核对, 采用偏倚风险评估工具评价偏倚风险[4]. 产生分歧通过讨论或根据(何继东)的意见处理.
统计学处理 采用Revman5.2软件. 各试验异质性检验采用χ2检验, 若无异质性(P>0.10), Meta分析选择固定效应模型, 否则在解释异质性原因后选择随机效应模型. 若有足够试验可除外质量低的研究进行敏感性分析. 计数资料计算OR值及其95%CI. 计量资料计算加权均数差值及其95%CI, 各个疗效判定指标的分析均采用ITT分析. 当有足够研究时, 漏斗图分析是否存在发表偏倚. 若提供的数据不能进行Meta分析, 则只对其进行描述性分析. 如存在明显的临床异质性采用亚组分析或敏感性分析等进行处理.
纳入的11篇试验, 6篇为国外研究. 样本量最大的RCT[7]包括134例患者, 样本量最小的RCT[8]仅包括11例患者. 所有试验均有明确的纳入及排除标准. 纳入的11篇试验均表明为随机分组, 其中3篇试验采用了随机数字表法, 1篇试验采用了计算机随机法.其余未具体描述随机分组的方法. 5篇试验对随机分配方案进行了充分的隐藏. 有3篇试验采用了双盲; 1篇试验采用单盲(表1, 2).
| 纳入研究 | 例数(T/C) | 地区 | 年龄(T/C) | 试验组 | 对照组 | 结局指标 | 随访(治疗)时间 |
| 陈榕等[5]2008 | 30/16 | 中国 | 46.5/46 | ω-3PUFA胶丸4 g/d或5 g/d | 安慰剂 | ①③④ | 24 wk |
| Spadaro等[6]2008 | 20/20 | 意大利 | 50.16±12.9/51.3±9.8 | ω-3PUFA 2 g/d | 空白对照 | ②③④ | 6 mo |
| Zhu等[7]2008 | 66/68 | 中国 | 45.00±10.91/44.03±11.30 | ω-3PUFA 2 g/d | 安慰剂 | ①②③④ | 24 wk |
| Sofi等[8]2010 | 6/5 | 意大利 | 55/54 | 橄榄油6.5 mL(包含ω-3PUFA 0.83 g/d) | 安慰剂 | ①②③④ | 12 mo |
| Scorletti等[9]2014 | 51/52 | 英国 | 48.6±11.1/54.0±9.6 | ω-3PUFA 4 g/d | 安慰剂 | ①②③④ | 15-18 mo |
| 李士坤[10]2015 | 36/36 | 中国 | 33.4±2.7 | ω-3PUFA 2.5 g/d | 空白对照 | ①②③④ | 20 wk |
| Dasarathy等[11]2015 | 18/19 | 美国 | 51.5±6.9/49.8±12.1 | ω-3PUFA 3.6 g/d | 空白对照 | ①②③④ | 48 wk |
| Li等[12]2015 | 39/39 | 中国 | 52.6±6.6/50.4±7.2 | ω-3PUFA 50 mL/d | 安慰剂 | ①②③④ | 6 mo |
| Argo等[13]2015 | 17/17 | 美国 | 46.4±12.1/47.2±12 | ω-3PUFA 3 g/d | 安慰剂 | ①②③④ | 12 mo |
| Nogueira等[14]2016 | 32/28 | 巴西 | 52.5±7.2/53.9±6.8 | ω-3PUFA 0.945 g/d | 安慰剂 | ①②③④ | 6 mo |
| 田真真[15]2016 | 64/64 | 中国 | 56.12±9.76 | ω-3PUFA 5 g/d | 空白对照 | ①②③④ | 3 mo |
| 纳入研究 | 随机方法 | 分配隐藏 | 盲法 | 数据完整性 | 选择性报告研究结果 | 其他偏倚 |
| 陈榕等[5]2008 | 不清楚 | 不清楚 | 双盲 | 是 | 是 | 不清楚 |
| Spadaro等[6]2008 | 随机数字表 | 是 | 否 | 是 | 是 | 不清楚 |
| Zhu等[7]2008 | 不清楚 | 否 | 否 | 是 | 是 | 不清楚 |
| Sofi等[8]2010 | 不清楚 | 是 | 否 | 是 | 是 | 不清楚 |
| Scorletti等[9]2014 | 不清楚 | 否 | 单盲 | 是 | 是 | 不清楚 |
| 李士坤[10]2015 | 不清楚 | 否 | 否 | 是 | 是 | 不清楚 |
| Dasarathy等[11]2015 | 随机数字表 | 是 | 双盲 | 是 | 是 | 不清楚 |
| Li等[12]2015 | 不清楚 | 否 | 否 | 是 | 是 | 不清楚 |
| Argo等[13]2015 | 随机处理列表 | 是 | 是 | 是 | 是 | 不清楚 |
| Nogueira等[14]2016 | 计算机随机 | 是 | 双盲 | 是 | 是 | 不清楚 |
| 田真真[15]2016 | 不清楚 | 否 | 否 | 是 | 是 | 不清楚 |
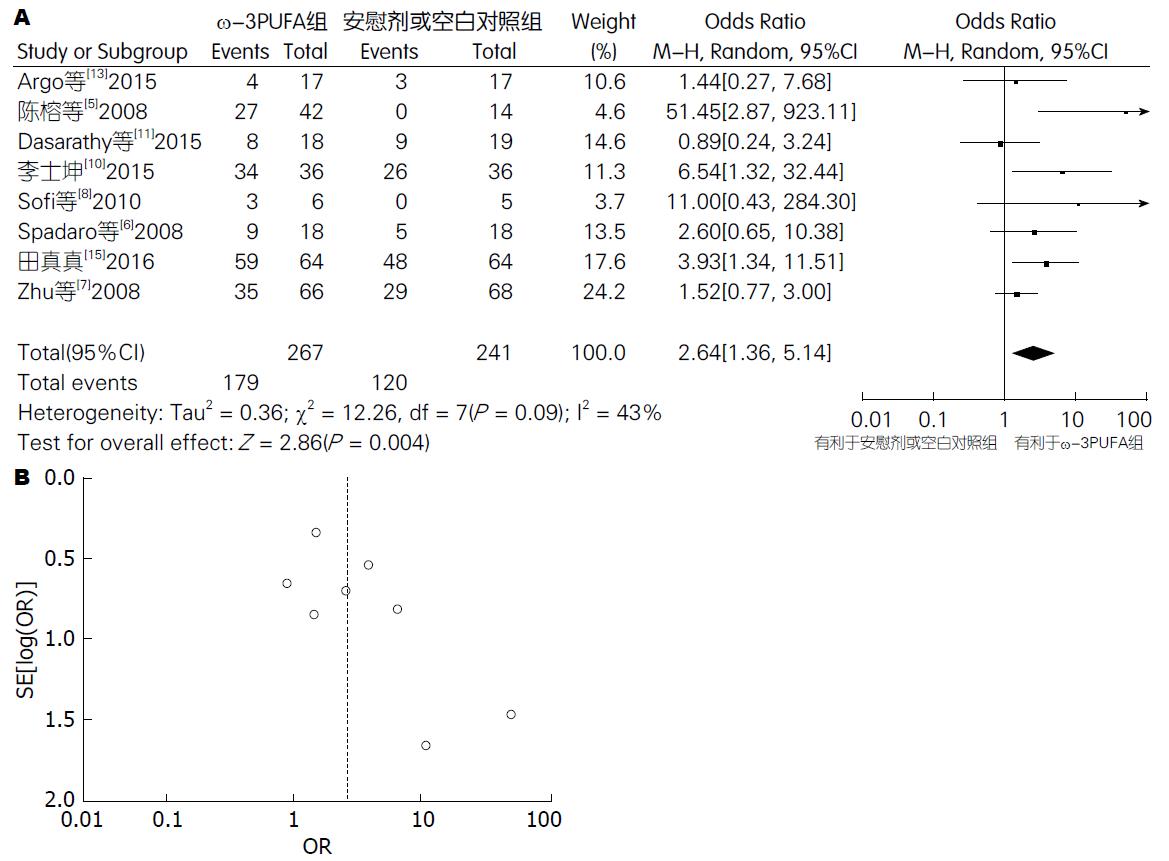
肝脏组织学改善有效率: 8篇试验[5-8,10,11,13,15](包括508例患者)提供了肝脏组织学改善有效率的数据. Meta分析结果显示: 各试验间有异质性 (P = 0.09, I2 = 43%), 采用随机效应模型. 试验组肝脏组织学改善有效率为67.04%, 对照组为49.79%, 两组间差异有统计学意义(OR = 2.64, 95%CI: 1.36-5.14; P = 0.004). 漏斗图分析提示不存在发表偏倚(图2).
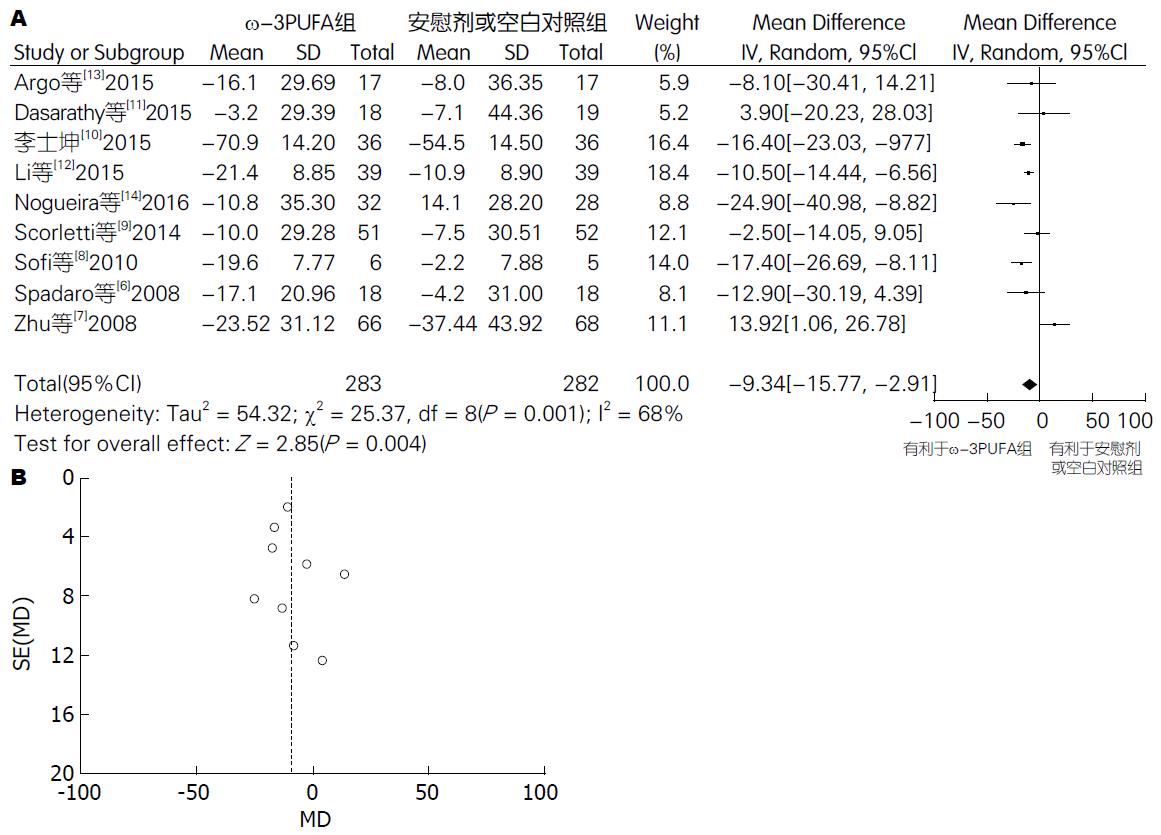
2.4.1 ALT: 有9篇试验[6-14](包括565例患者) 提供了ALT的数据. Meta分析结果显示: 各试验间有异质性(P = 0.0001, I2 = 68%) , 采用随机效应模型. 两组间差异有统计学意义[95%CI: -15.77-(-2.91); P = 0.004]. 漏斗图分析提示不存在发表偏倚(图3) .
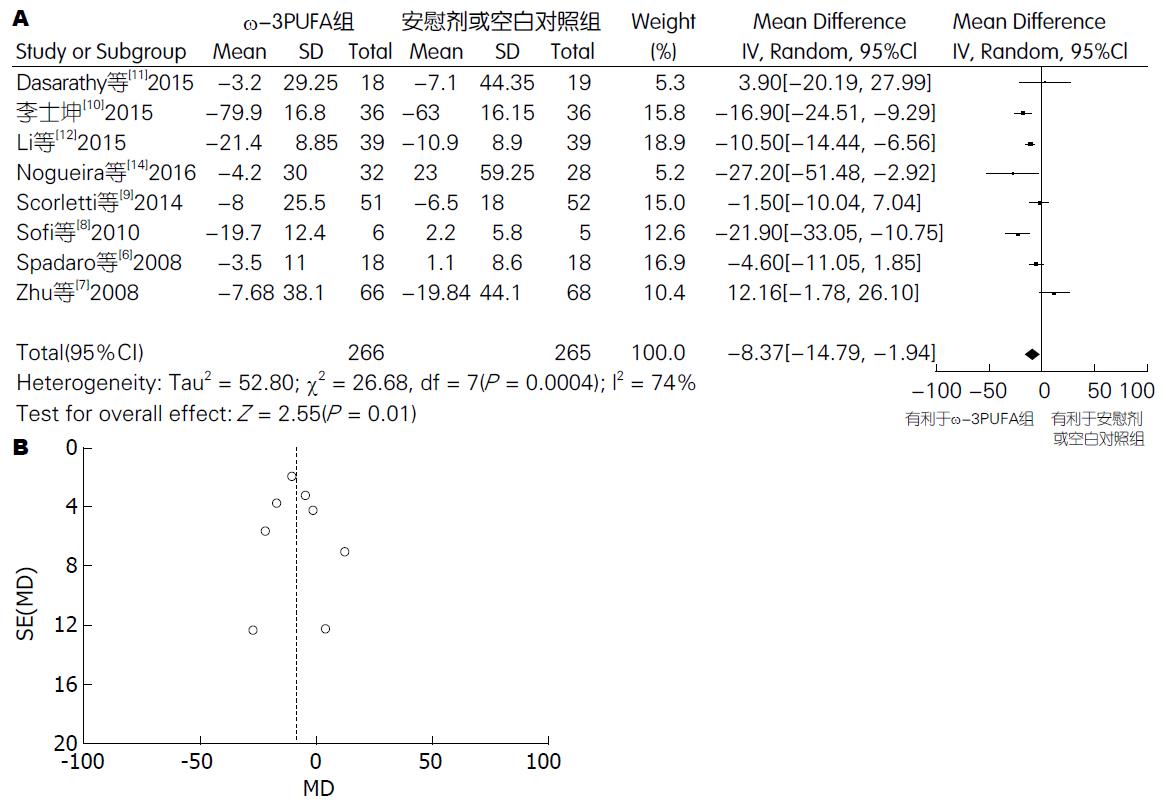
2.4.2 AST: 有8篇试验[6-12,14] (包括531例患者) 提供了AST的数据. Meta分析结果显示: 各试验间有异质性(P = 0.0004, I2 = 74%) , 采用随机效应模型. 两组间差异有统计学意义[95%CI: -14.79-(-1.94); P = 0.01]. 漏斗图分析提示不存在发表偏倚(图4).
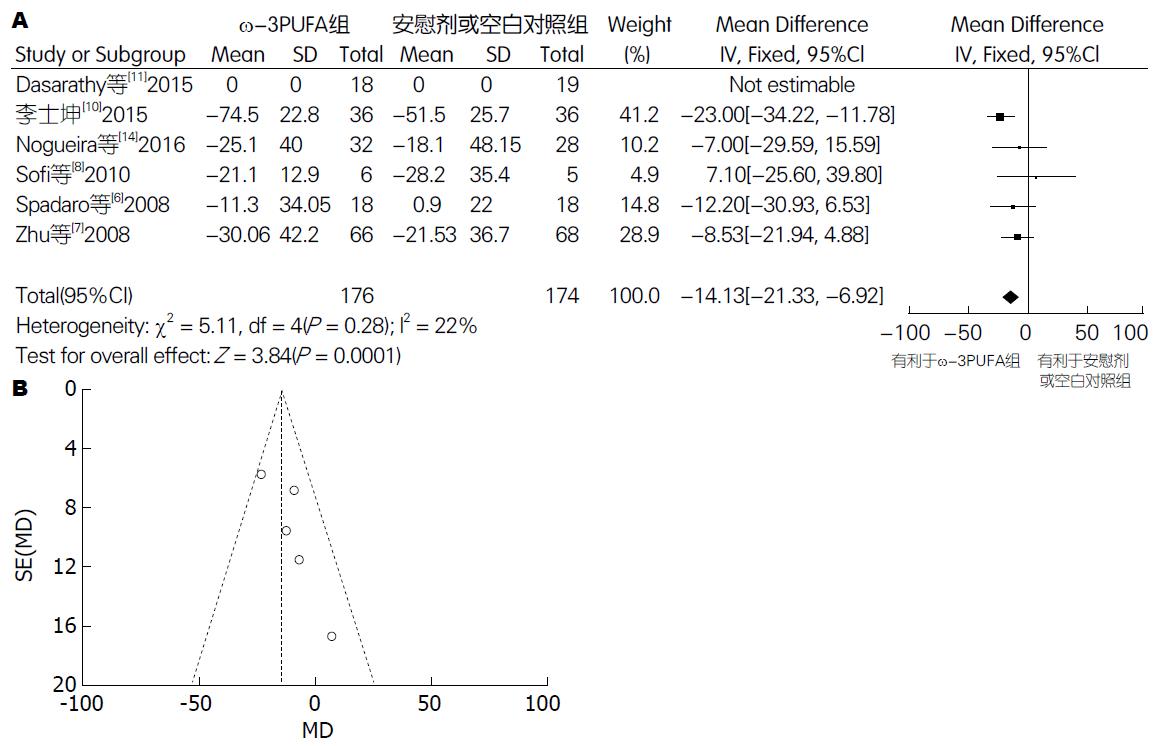
2.4.3 GGT: 有6篇试验[6-8,10,11,14](包括350例患者)提供了GGT的数据. Meta分析结果显示: 各试验间无异质性(P = 0.28, I2 = 22%), 采用固定效应模型. 两组间差异有统计学意义[95%CI: -21.33-(-6.92); P = 0.0001]. 漏斗图分析提示可能存在发表偏倚(图5).
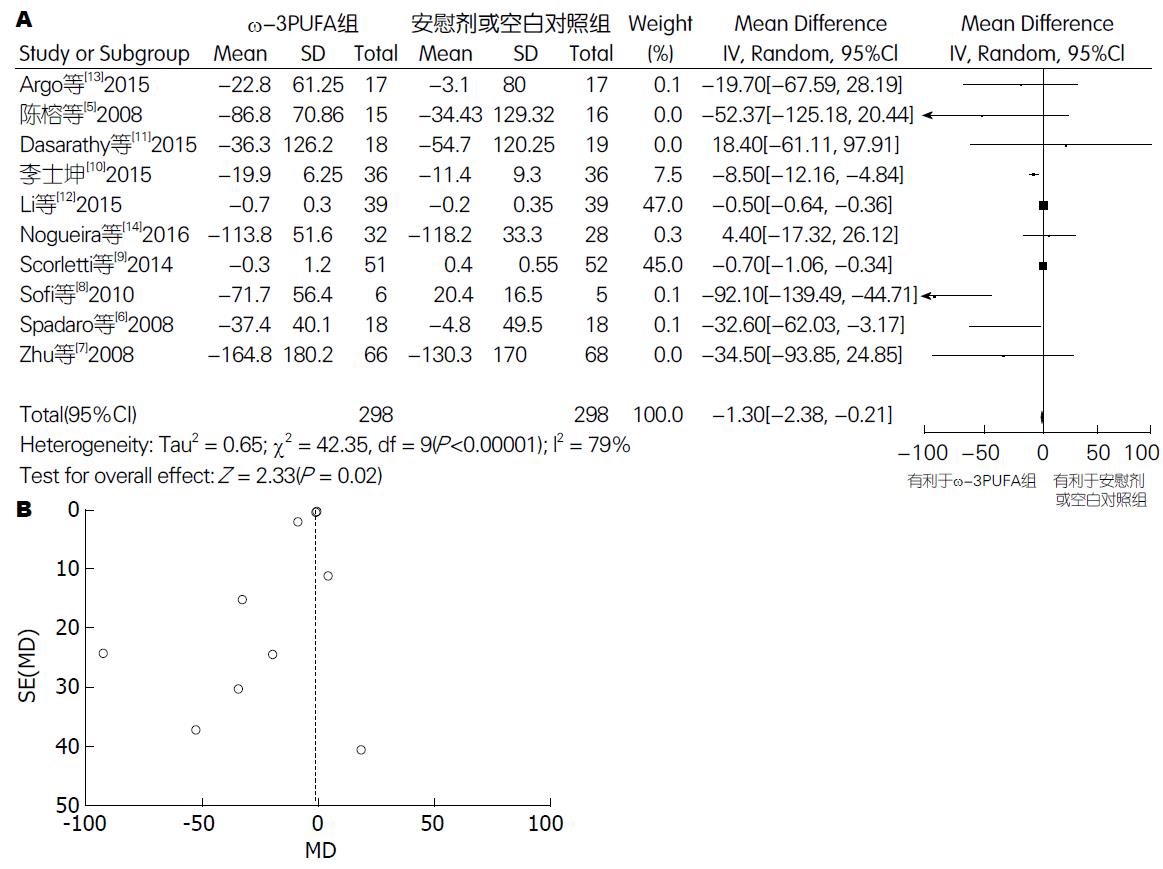
2.5.1 TG: 有10篇试验[5-14](包括596例患者)提供了TG的数据. Meta分析结果显示: 各试验间有异质性(P<0.00001, I2 = 79%), 采用随机效应模型. 两组间差异有统计学意义[95%CI: -2.38-(-0.21); P = 0.02]. 漏斗图分析提示可能存在发表偏倚(图6).
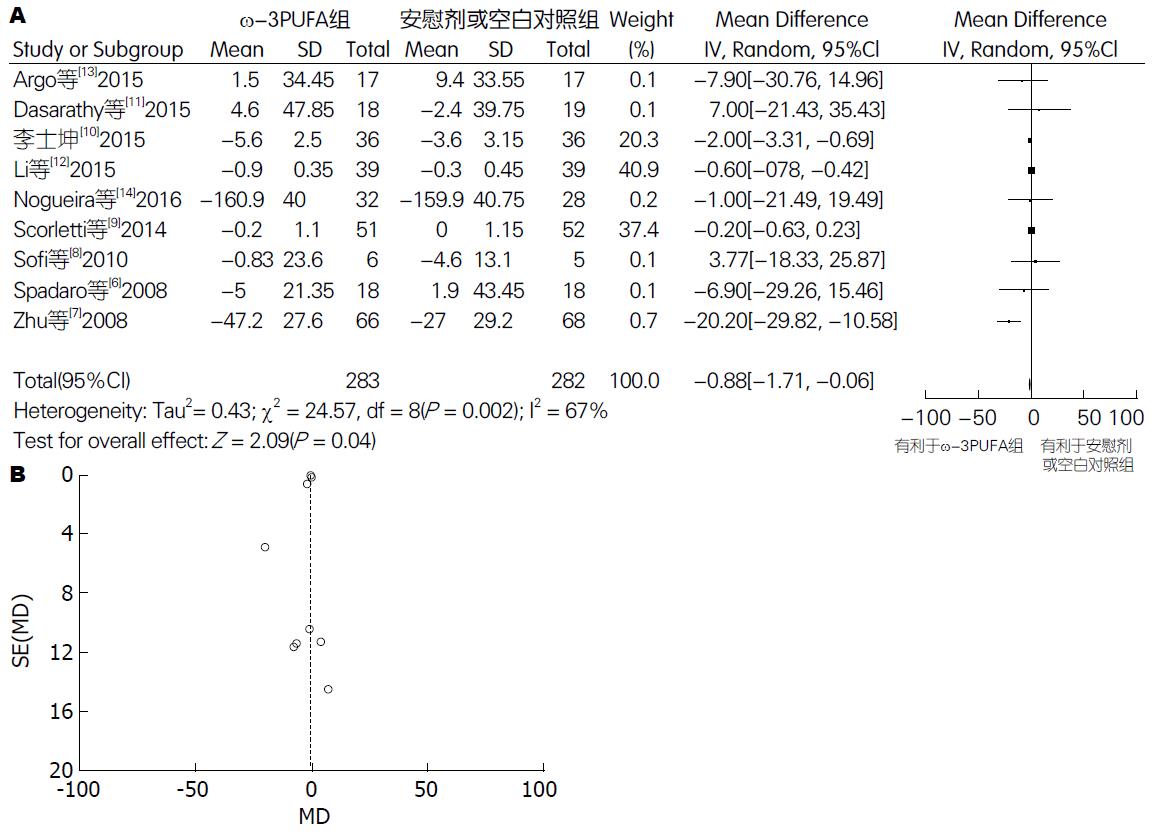
2.5.2 TC: 有9篇试验[6-14](包括565例患者)提供了TC的数据. Meta分析结果显示: 各试验间有异质性(P = 0.002, I2 = 67%), 采用随机效应模型. 两组间差异有统计学意义[95%CI: -1.71-(-0.06); P = 0.04]. 漏斗图分析提示可能存在发表偏倚(图7).
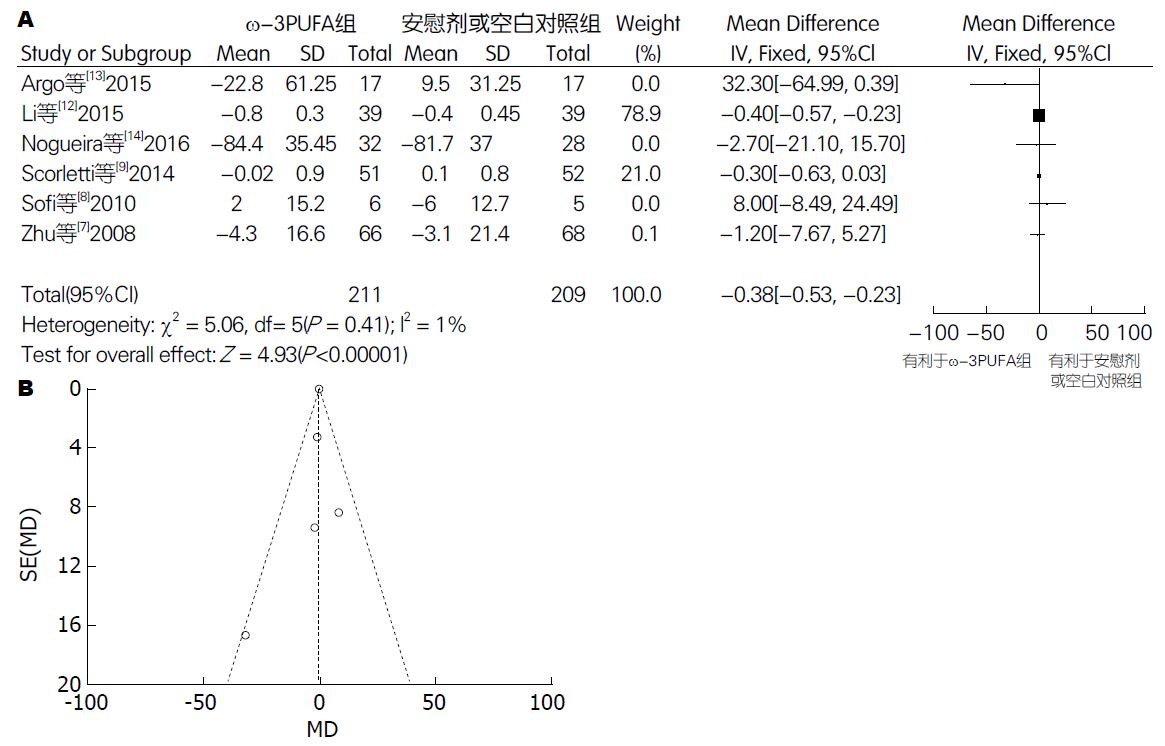
2.5.3 LDL: 有6篇试验[7-9,12-14](包括420例患者)提供了TC的数据. Meta分析结果显示: 各试验间无异质性(P = 0.41, I2 = 1%), 采用固定效应模型. 两组间差异有统计学意义[95%CI: -0.53-(-0.23); P<0.00001]. 漏斗图分析提示可能存在发表偏倚(图8).
ω-3PUFA主要包括a-亚麻酸、二十碳五烯酸和二十二碳六烯酸、二十二碳五烯酸. 研究显示其功能包括: 免疫作用、抗血小板聚集、抗动脉硬化、防止心血管事件、降压、抗炎、调节脂肪代谢、抗肿瘤、防治糖尿病[16-19]. 也有研究显示ω-3PUFA可以通过下调固醇调节元件结合蛋白-1c, 上调过氧化物酶体增殖物激活受体, 通过降低肝脂质蓄积、胰岛素抵抗、血清炎症标志物、氧化应激和凋亡标志物, 改善NAFLD患者的生化、血流动力学和超声特征[20]. 因此, ω-3PUFA已经广泛应用于临床. 近年来, ω-3PUFA辅助治疗NAFLD为临床应用提供了新思路. 国内外临床研究亦显示, ω-3PUFA辅助治疗NAFLD可能获益, 2012年Parker等[21]纳入9个RCT研究包括355例患者的Meta分析结果提示: ω-3PUFA辅助治疗NAFLD可降低AST, 有利于肝脂肪变性改善.
本研究关注ω-3PUFA辅助治疗NAFLD, 对世界范围内收集到的11个已完成的RCT进行了系统评价, 以期为临床应用提供最新的证据. 本系统评价中, 纳入8篇RCT的Meta分析结果显示, ω-3PUFA辅助治疗NAFLD可提高肝脏组织学改善, 尽管纳入研究仅5篇RCT为高质量研究, 但漏斗图分析提示无发表偏倚, 在排除低质量RCT研究后的Meta分析结果一致, 说明上述研究结果具有一定的稳定性和可靠性. 在肝脏生化指标改善上, Meta分析结果显示, ω-3PUFA辅助治疗NAFLD可降低ALT、AST、GGT, 但GGT漏斗图提示可能存在发表偏倚, 在排除低质量RCT研究后的Meta分析结果显示仅降低ALT, 说明结果存在一定局限性, 解释应慎重. 在血脂改善上, Meta分析结果显示, ω-3PUFA辅助治疗NAFLD可降低TG、TC、LDL, 漏斗图提示不存在发表偏倚, 在排除低质量RCT研究后的Meta分析结果显示仅降低TC、LDL, 说明结果存在一定局限性, 解释应慎重. 在不良反应发生率上, 纳入研究显示副作用较少, 较安全. 仅1篇文献报道不良反应为胃肠道反应, 表现为腹泻、大便频率增加等, 为轻度不良事件, 有研究显示大剂量ω-3PUFA有抗凝作用, 会致部分患者出现鼻衄, 对大剂量长期使用的安全性有待进一步研究. 同时, 本系统评价纳入试验还存在方法学缺陷可能影响Meta分析结果: (1)由于部分研究未采用盲法和对分配方案进行隐藏, 存在实施偏倚和测量偏倚的高度可能性, 也存在选择性偏倚的高度可能性, 个别研究样本含量小(仅11例), 使产生偏倚和误差的机会增加; (2)纳入研究在ω-3PUFA使用剂量和疗程上有差别, 且未能评估组分存在不同, 使用疗程存在不同. 今后的研究开展应注意选择ω-3PUFA组分, 剂量、使用时机、疗程及与何种治疗方案联合, 进一步的安全性评估等.
总之, 目前证据显示, ω-3PUFA辅助治疗NAFLD能改善肝脏组织学和肝脏酶谱, 同时改善血脂, 是一种有效和安全的辅助治疗方案, 但尚需严格设计多中心、大样本临床随机对照试验的证据.
随着肥胖和代谢综合征发病率的增高, 非酒精性脂肪性肝病(non-alcoholic fatty liver disease, NAFLD)已经成为我国最常见的慢性肝病之一, 严重危害公众健康. 目前尚缺乏治疗NAFLD的特效药物. 作者关注NAFLD治疗的临床循证医学证据, 采用国际Cochrane协作网推荐的方法对ω-3多不饱和脂肪酸(omega-3 polyunsaturated fatty acids, ω-3PUFA)治疗NAFLD进行系统评价, 以期为临床实践提供循证医学的参考.
研究显示ω-3PU-FA功能包括: 免疫作用、抗血小板聚集、抗动脉硬化、防止心血管事件、降压、抗炎、调节脂肪代谢、抗肿瘤、防治糖尿病. 但对NAFLD治疗的研究仍缺乏循证医学证据.
国内外临床研究亦显示, ω-3PUFA辅助治疗NAFLD可能获益, 2012年Parker等纳入9个随机对照试验(randomized controlled trial, RCT)研究包括355例患者的Meta分析结果提示: ω-3PUFA辅助治疗NAFLD可降低AST, 有利于肝脂肪变性改善.
采用循证医学的方法学, 全面收集世界范围内ω-3PUFA治疗NAFLD的RCT, 由2位研究者独立进行 文献筛选及质量评价, 对纳入研究进行Meta分析, 提供循证医学证据.
目前证据显示, ω-3PUFA治疗NAFLD可改善肝脏组织学和肝脏酶谱, 同时改善血脂, 是一种有效和安全的辅助治疗方案. 但仍需大量循证医学证据的进一步积累, 从而指导临床实践.
RCT的偏倚风险评估工具: Cochrane偏倚风险评估工具主要从选择(包括随机序列产生和分配隐藏)、实施(包括对研究者和受试者施盲)、测量(研究结局盲法评价)、随访(结局数据的完整性)、报告(选择性报告研究结果)及其他(其他偏倚来源) 这6个方面总计7个条目对偏倚风险进行评价.
池肇春, 教授, 青岛市市立医院消化内科; 丁浩, 博士, 南昌大学第二附属医院; 刘平, 教授, 上海中医药大学
本文对国内外关于ω-3PUFA治疗NAFLD的RCT研究资料(肝脏组织学、肝脏生化学指标及血脂指标)进行系统评价. 结果显示ω-3PUFA治疗NAFLD可改善肝脏组织学和肝脏酶谱, 同时改善血脂,是一种安全有效的辅助治疗方案. 研究对ω-3PUFA的临床应用有一定的指导意义.
手稿来源: 自由投稿
学科分类: 胃肠病学和肝病学
手稿来源地: 四川省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): C, C
D级 (一般): 0
E级 (差): 0
编辑: 马亚娟 电编:李瑞芳
| 1. | Lazo M, Clark JM. The epidemiology of nonalcoholic fatty liver disease: a global perspective. Semin Liver Dis. 2008;28:339-350. [PubMed] [DOI] |
| 2. | Neuschwander-Tetri BA, Caldwell SH. Nonalcoholic steatohepatitis: summary of an AASLD Single Topic Conference. Hepatology. 2003;37:1202-1219. [PubMed] [DOI] |
| 3. | Li L, Liu DW, Yan HY, Wang ZY, Zhao SH, Wang B. Obesity is an independent risk factor for non-alcoholic fatty liver disease: evidence from a meta-analysis of 21 cohort studies. Obes Rev. 2016;17:510-519. [PubMed] [DOI] |
| 4. | Cochrane Handbook for Systematic Reviews of Interventions Version.5.1.0 [updated March 2011]. Available from: http://www.cochrane-handbook.org. |
| 6. | Spadaro L, Magliocco O, Spampinato D, Piro S, Oliveri C, Alagona C, Papa G, Rabuazzo AM, Purrello F. Effects of n-3 polyunsaturated fatty acids in subjects with nonalcoholic fatty liver disease. Dig Liver Dis. 2008;40:194-199. [PubMed] [DOI] |
| 7. | Zhu FS, Liu S, Chen XM, Huang ZG, Zhang DW. Effects of n-3 polyunsaturated fatty acids from seal oils on nonalcoholic fatty liver disease associated with hyperlipidemia. World J Gastroenterol. 2008;14:6395-6400. [PubMed] [DOI] |
| 8. | Sofi F, Giangrandi I, Cesari F, Corsani I, Abbate R, Gensini GF, Casini A. Effects of a 1-year dietary intervention with n-3 polyunsaturated fatty acid-enriched olive oil on non-alcoholic fatty liver disease patients: a preliminary study. Int J Food Sci Nutr. 2010;61:792-802. [PubMed] [DOI] |
| 9. | Scorletti E, Bhatia L, McCormick KG, Clough GF, Nash K, Hodson L, Moyses HE, Calder PC, Byrne CD; WELCOME Study. Effects of purified eicosapentaenoic and docosahexaenoic acids in nonalcoholic fatty liver disease: results from the Welcome* study. Hepatology. 2014;60:1211-1221. [PubMed] [DOI] |
| 11. | Dasarathy S, Dasarathy J, Khiyami A, Yerian L, Hawkins C, Sargent R, McCullough AJ. Double-blind randomized placebo-controlled clinical trial of omega 3 fatty acids for the treatment of diabetic patients with nonalcoholic steatohepatitis. J Clin Gastroenterol. 2015;49:137-144. [PubMed] [DOI] |
| 12. | Li YH, Yang LH, Sha KH, Liu TG, Zhang LG, Liu XX. Efficacy of poly-unsaturated fatty acid therapy on patients with nonalcoholic steatohepatitis. World J Gastroenterol. 2015;21:7008-7013. [PubMed] [DOI] |
| 13. | Argo CK, Patrie JT, Lackner C, Henry TD, de Lange EE, Weltman AL, Shah NL, Al-Osaimi AM, Pramoonjago P, Jayakumar S. Effects of n-3 fish oil on metabolic and histological parameters in NASH: a double-blind, randomized, placebo-controlled trial. J Hepatol. 2015;62:190-197. [PubMed] [DOI] |
| 14. | Nogueira MA, Oliveira CP, Ferreira Alves VA, Stefano JT, Rodrigues LS, Torrinhas RS, Cogliati B, Barbeiro H, Carrilho FJ, Waitzberg DL. Omega-3 polyunsaturated fatty acids in treating non-alcoholic steatohepatitis: A randomized, double-blind, placebo-controlled trial. Clin Nutr. 2016;35:578-586. [PubMed] [DOI] |
| 16. | Simopoulos AP. Importance of the omega-6/omega-3 balance in health and disease: evolutionary aspects of diet. World Rev Nutr Diet. 2011;102:10-21. [PubMed] [DOI] |
| 17. | Kazemian P, Kazemi-Bajestani SM, Alherbish A, Steed J, Oudit GY. The use of ω-3 poly-unsaturated fatty acids in heart failure: a preferential role in patients with diabetes. Cardiovasc Drugs Ther. 2012;26:311-320. [PubMed] [DOI] |
| 18. | Ballestri S, Lonardo A, Bonapace S, Byrne CD, Loria P, Targher G. Risk of cardiovascular, cardiac and arrhythmic complications in patients with non-alcoholic fatty liver disease. World J Gastroenterol. 2014;20:1724-1745. [PubMed] [DOI] |
| 19. | Manickam P, Sudhakar R. Dyslipidemia and non-alcoholic fatty liver disease. Dig Dis Sci. 2013;58:1435. [PubMed] [DOI] |
| 20. | Pettinelli P, Del Pozo T, Araya J, Rodrigo R, Araya AV, Smok G, Csendes A, Gutierrez L, Rojas J, Korn O. Enhancement in liver SREBP-1c/PPAR-alpha ratio and steatosis in obese patients: correlations with insulin resistance and n-3 long-chain polyunsaturated fatty acid depletion. Biochim Biophys Acta. 2009;1792:1080-1086. [PubMed] [DOI] |